Галостахин
| |
| Имена | |
|---|---|
| Название ИЮПАК
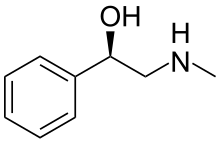
2-(Метиламино)-1-фенилэтанол
| |
| Другие имена
N -метилфенилэтаноламин; 1-гидрокси-1-фенил-2-метиламиноэтан; α-(Метиламинометил)бензиловый спирт; 2-Метиламино-1-фенилэтанол
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХЭМБЛ | |
| ХимическийПаук | |
| Номер ЕС |
|
| КЕГГ | |
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| C9H13NC9H13NO | |
| Молярная масса | 151.209 g·mol −1 |
| Появление | Бесцветное твердое вещество |
| Температура плавления | от 43 до 45 °C (от 109 до 113 °F; от 316 до 318 К) (R- или S-энантиомер); 75–76 °С (рацемат) |
| Опасности | |
| СГС Маркировка : | |

| |
| Предупреждение | |
| Х302 , Х332 | |
| P261 , P264 , P270 , P271 , P301+P312 , P304+P312 , P304+P340 , P312 , P330 , P501 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Галостахин (также известный как N -метилфенилэтаноламин ) — природный продукт , алкалоид, впервые выделенный из азиатского кустарника Halostachys caspica (синоним Halostachys belangeriana ), структурно β-гидроксифенэтиламин ( фенилэтаноламин ) , родственный его более известному «родителю». « биогенный амин , фенилэтаноламин , адренергическому препарату синефрину и алкалоид эфедрин . Фармакологические свойства галостахина имеют некоторое сходство со свойствами этих структурно родственных соединений, а экстракты Halostachys caspica были включены в состав некоторых безрецептурных пищевых добавок. [ 1 ] но галостахин никогда не разрабатывался как лекарство, отпускаемое по рецепту. Хотя галостахин встречается в природе в виде единственного стереоизомера , он чаще доступен в виде синтетического продукта в форме его рацемата (см. ниже). По внешнему виду это бесцветное твердое вещество.
возникновение
[ редактировать ]Встречающийся в природе галостахин был впервые обнаружен Сырневой в галофитном растении Halostachys caspica (теперь классифицируемом как Halostachys belangeriana) . [ 2 ] ) (семейство Амарантовые). [ 3 ] Ошибочная структура, первоначально предложенная для этого соединения, была впоследствии исправлена Меньшиковым и Рубинштейном. [ 4 ]
Галостахин также был выделен из райграса многолетнего Lolium perenne и овсяницы тростниковой Festuca arundinacea . [ 5 ] [ 6 ]
Присутствие N -метилфенилэтаноламина в мозге крыс было подтверждено экспериментами, описанными Сааведрой и Аксельродом. [ 7 ]
Химия
[ редактировать ]Синтез
[ редактировать ]несколько результатов синтеза рацемического N За прошедшие годы было опубликовано -метилфенилэтаноламина. Дёрден и его коллеги сообщили о синтезе с использованием «классической» методологии, начиная с ацетофенона . Метильную группу ацетофенона бромировали с α образованием -бромацетофенона , который затем подвергали взаимодействию с N -метилбензиламином с образованием аминокетона. Аминокетон восстанавливали алюмогидридом лития до соответствующего аминоспирта, а N -бензильную группу окончательно удаляли каталитическим гидрированием с использованием катализатора палладий на угле. [ 8 ]
Другой синтез, принадлежащий Нордландеру и его коллегам, начался с Фриделю-Крафтсу ацилирования бензола по N- (трифторацетил)глицилхлоридом в присутствии хлорида алюминия . Полученный N- (трифторацетил)-α-аминоацетофенон затем N- метилировали метилйодидом и карбонатом калия , и продукт окончательно превращался в рацемический N -метилфенилэтаноламин с помощью боргидрида натрия в этаноле . [ 9 ]
Об эффективном стереоспецифическом синтезе галостахина сообщили Зандберген и его коллеги: ( R )-(+)-α-гидроксибензолацетонитрил сначала был O -защитен с использованием 2-метоксипропена. Затем продукт обрабатывали DIBAL , а невыделенный имин затем последовательно обрабатывали бромидом аммония и метиламином для осуществления «трансиминации». Полученный N -метилимин превращали в ( R )-(-)-α-[(метиламино)метил]бензолметанол (т.е. ( R )-(-)-галостахин) с помощью боргидрида натрия . [ 10 ]
Характеристики
[ редактировать ]Химически N -метилфениэтаноламин представляет собой ароматическое соединение, амин и спирт . Аминогруппа делает это соединение слабым основанием , способным вступать в реакцию с кислотами с образованием солей.
Одной из обычных солей N -метилфенилэтаноламина является (рацемический) гидрохлорид C 9 H 13 NO.HCl, т.пл. 103-104°С. [ 8 ]
PK - a гидрохлорида N метилфенилэтаноламина при 25 °C и концентрации 10 мМ составляет 9,29. [ 11 ]
Наличие гидроксигруппы на бензильном С молекулы N -метилфенилэтаноламина создает хиральный центр , поэтому соединение существует в форме двух энантиомеров , d- и l- N -метилфенилэтаноламина, или в виде рацемической смеси , d, 1- N -метилфенилэтаноламин. Правовращающий конфигурации изомер соответствует S-конфигурации , а левовращающий - R- . [ 12 ] [ 13 ]
- Было обнаружено, что N метилфенилэтаноламин, выделенный из Halostachys caspica и получивший название алкалоида «галостахин», является левовращающим энантиомером.
Галостахин имеет температуру плавления 43-45°С и [α] D = - 47,03°; гидрохлоридная соль этого энантиомера имеет т.пл. 113-114°С и [α] D = - 52,21°. Разделение . рацемического N -метилфенилэтаноламина с помощью его тартратных солей дало энантиомеры с удельным вращением [α] D = - 52,46° и + 52,78° [ 4 ] [ 14 ]
Фармакология
[ редактировать ]Первое фармакологическое исследование синтетического рацемического N -метилфенилэтаноламина (называемого этими авторами «метилфенилэтаноламином») было проведено Баргером и Дейлом, которые обнаружили, что он является прессорным средством с силой действия, аналогичной силе фенилэтаноламина и β-фенилэтиламина. в препарате для кошек. [ 15 ] Впоследствии это соединение (все еще в форме рацемата) было более тщательно изучено Ченом и его коллегами, которые подтвердили его прессорную активность, но заметили, что оно было примерно вдвое менее эффективным, чем фенилэтаноламин, после внутривенного введения препарату для кошек. : общая доза 5 х 10 −6 М (или ~1 мг соли HCl) вызывал максимальное повышение артериального давления на 26 мм рт. ст. Дополнительные эксперименты, проведенные этими исследователями, показали, что рацемический N -метилфенилэтаноламин также вызывает мидриаз в глазу кролика (закапывание капли 0,05 М/л раствора вызывает расширение примерно в 5 раз больше, чем та же доза фенилэтаноламина), ингибирование выделенных полосок кишечника кролика. и сокращение изолированной матки морской свинки. Препарат также оказывает вяжущее действие на слизистую оболочку носа. [ 16 ]
У человека пероральная доза 50 мг не оказала влияния на кровяное давление, но это только по данным единственного исследования 1929 года. [ 16 ]
Более поздние исследования Лэндса и Гранта по влиянию рацемического N- метилфенилэтаноламина (идентифицированного кодами компании Sterling-Winthrop «WIN 5529» или «WIN 5529-2») на кровяное давление у интактных собак показали результаты, аналогичные тем, которые были получены Chen et al. др.: 0,41 мг/кг препарата при внутривенном введении вызывало повышение артериального давления на 38 мм рт. ст. длительностью 3–10 мин. Этот эффект был описан как ~ 1/200 х, вызванный той же дозой адреналина (или ~ 1/250 х при сравнении на молярной основе). [ 17 ] [ 18 ]
У овец галостахин вызывал лишь небольшой мидриаз в дозе 30 мг/кг внутривенно и «возбуждение» в дозе 100 мг/кг; у морских свинок дозы 30 мг/кг внутрибрюшинно вызывали беспокойство продолжительностью около получаса, а 100 мг/кг внутрибрюшинно вызывали возбуждение, мидриаз, слюнотечение, пилоэрекцию, мышечный тремор, а также учащенное сердцебиение и частоту дыхания, с возвращение к норме через 1/2–2 часа. [ 5 ]
Установлено, что внутривенное введение препарата собакам в дозах ~ 6 – 18 мг/кг вызывает значительный мидриаз (100% увеличение диаметра зрачка в результате дозы 17,5 мг/кг), причем эффект оказывается несколько большим ( ~ 1,3 х), чем при тех же дозах фенилэтаноламина. N -Метилфенилэтаноламин также вызывал снижение частоты сердечных сокращений, которое было обратно пропорционально дозе (т.е. постепенное увеличение дозы вызывало меньшую брадикардию ), и которое было количественно меньше, чем то, которое вызывалось теми же дозами фенилэтаноламина. Препарат вызывал падение температуры тела, которое также было обратно пропорционально дозе и было меньше, чем при тех же дозах фенилэтаноламина. Дополнительные симптомы, которые наблюдались, включали обильное слюнотечение и пилоэрекцию , хотя, в отличие от фенилэтаноламина, N -метилфенилэтаноламин не вызывал каких-либо стереотипных или быстрых движений глаз. Эти результаты позволили авторам предположить, что N -метилфенилэтаноламин действует как на α, так и на β. адренергические рецепторы . [ 19 ]
Используя препарат β2 - адренергических рецепторов , полученный из трансфицированных клеток HEK 293 , Лиаппакис и соавт. [ 20 ] обнаружили, что в дикого типа рецепторах рацемический N -метилфенилэтаноламин (называемый этими авторами «галостахином») имел ~ 1/120 сродство адреналина в конкурентных экспериментах с 3 [H] -CGP-12177 и поэтому был примерно в 3 раза более эффективным, чем сам фенилэтаноламин . [ 21 ] Измерения накопления цАМФ в интактных трансфицированных клетках HEK 293 после обработки EEDQ для инактивации 98-99% рецепторов показали, что «галостахин» был на ~ 19% столь же эффективен, как адреналин, в максимальной стимуляции накопления цАМФ у дикого типа. рецепторы. Таким образом, «галостахин» интерпретировали как обладающий частичным агонистическим действием на β2 - рецепторы. [ 20 ]
Фармакодинамика
[ редактировать ]Фармакокинетика N -метилфенилэтаноламина после внутривенного введения собакам была изучена Шенноном и его коллегами, которые обнаружили, что препарат соответствует «двухкамерной модели» с Т 1/2 (α) ≃ 9,7 минут и Т 1 /2 (β) ≃ 56,4 минуты; Таким образом, «период полувыведения из плазмы» N -метилфенилэтаноламина составлял около 1 часа. [ 19 ]
Биохимия
[ редактировать ]В тканях животных N -метилфенилэтаноламин образуется под действием фермента фенилэтаноламин -N-метилтрансферазы (ПНМТ), впервые выделенного из надпочечников обезьян Юлиусом Аксельродом , на фенилэтаноламин. [ 7 ] [ 22 ]
Действие моноаминоксидаз МАО-А и МАО-В мозга крысы из митохондрий на N -метилфенилэтаноламин было охарактеризовано Осаму и соавт., которые обнаружили, что в концентрации 10 мкМ это соединение (стереохимическая идентичность не указана) является специфическим субстратом. для МАО-Б, но при 100 мкМ и 1000 мкМ он стал субстратом как для МАО-А, так и для МАО-В. Кинетические константы, о которых сообщили эти исследователи, были следующими: K m = 27,7 мкМ; V max = 3,67 нМ/мг белка/30 мин (высокая аффинность) и K m = 143 мкМ; V max = 7,87 нМ/мг белка/30 минут (низкое сродство). [ 23 ]
Токсичность
[ редактировать ]Сообщается, что LD 50 N - метилфенилэтаноламина у мышей составляет 44 мг/кг при внутривенном введении и ~ 140 мг/кг при внутрибрюшинном введении (рацемическая соль HCl); [ 18 ] в более ранней статье того же года Лэндс отмечает приблизительную ЛД 50, равную 490 мг/кг (мышь, внутрибрюшинно) для якобы того же препарата, но с кодом «WIN 5529», а не «WIN 5529-2». [ 17 ]
Минимальная смертельная доза рацемата для кроликов внутривенно составляет 100 мг/кг. [ 16 ]
Исследования, проведенные с целью определить, может ли галостахин вызывать «пошатывание райграса» в Австралии, включали введение доз до 100 мг/кг внутривенно овцам и 100 мг/кг внутрибрюшинно морским свинкам без каких-либо показаний. летальности. Хотя очевидно, что адренергические эффекты были очевидны у морских свинок (см. «Фармакология» выше), исследователи пришли к выводу, что галостахин вряд ли может быть причиной синдрома «шатания». [ 5 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «База данных этикеток пищевых добавок» . Dietarysupplements.nlm.nih.gov . Архивировано из оригинала 17 февраля 2013 года . Проверено 2 февраля 2022 г.
- ^ «Halostachys caspica CAMey. — Список растений» .
- ^ Ю.И. Сырнева (1941). «Фармакология нового алкалоида галостахина». Фармакология и токсикология 4 45-51.
- ^ Jump up to: а б G. P. Menshikov and M. M. Rubinstein (1943). J. Gen. Chem. (USSR) 13 801.
- ^ Jump up to: а б с Эй Джей Осен, CCJ Калвенор, Э. П. Финни, А. В. Келлок и Л. В. Смит (1969). «Алкалоиды как возможная причина поражений райграса при выпасе скота». Ауст. Дж. Агрик. Рез. 20 71-86.
- ^ LP Буш и JAD Джеффрис (1975). «Выделение и разделение алкалоидов овсяницы тростниковой и райграса». Дж. Хром. 111 165-170.
- ^ Jump up to: а б Дж. М. Сааведра и Дж. Аксельрод (1973). «Демонстрация и распространение фенилэтаноламина в мозге и других тканях». Учеб. Натл. акад. наук. США 70 769-772.
- ^ Jump up to: а б Д. А. Дерден, А. В. Хуорио и Б. А. Дэвис (1980). «Тонкослойная хроматография и масс-спектрометрическое определение β-гидроксифенилэтиламинов в тканях в виде дансилацетильных производных». Анальный. хим. 52 1815-1820 гг.
- ^ Дж. Э. Нордландер, М. Дж. Пейн, Ф. Г. Ньороге, М. А. Балк, Г. Д. Лайкос и В. М. Вишванат (1984). «Ацилирование Фриделя-Крафтса хлорангидридами N-(трифторацетил)-α-аминокислот. Применение для получения β-арилалкиламинов и 3-замещенных 1,2,3,4-тетрагидроизохинолинов». Дж. Орг. хим. 49 4107–4111.
- ^ П. Зандберген, AMCH ван ден Нивендейк, Дж. Брусси, А. ван дер Ген и К.Г. Крузе (1992). «Синтез восстановления-трансиминирования-восстановления N-замещенных β-этаноламинов из циангидринов в одном горшке». Тетраэдр 48 3977-3982.
- ^ Дж. Армстронг и Р.Б. Барлоу (1976). «Ионизация фенольных аминов, включая апоморфин, дофамин и катехоламины, и оценка констант цвиттериона». Бр. Дж. Фармакол. 57 501–516.
- ^ Г. Г. Лайл (1960). «Исследования вращательной дисперсии. I. Аралкиламины и спирты». Дж. Орг. хим. 25 1779–1784 гг.
- ^ Р. Люкс, В. Динстбирова, Дж. Ковар и К. Блаха (1961). «О конфигурации азотсодержащих соединений. XII. Конфигурация (-)-галостахина». Колл. Чешский. хим. 26 466 .
- ^ G. P. Menshikov and G. M. Borodina (1947). J. Gen. Chem. (USSR) 17 1569.
- ^ Г. Баргер и Х. Х. Дейл (1910). «Химическая структура и симпатомиметическое действие аминов». Дж. Физиол. 41 19-59.
- ^ Jump up to: а б с К.К. Чен, К.-К. Ву и Э. Хенриксен (1929). «Связь между фармакологическим действием и химическим составом и конфигурацией оптических изомеров эфедрина и родственных соединений». Дж. Фармакол. Эксп. Там. 36 363-400.
- ^ Jump up to: а б А. М. Лендс (1952). «Сердечно-сосудистое действие 1-(3-аминофенил)-2-аминоэтанола и родственных соединений». Дж. Фармакол. Эксп. Там. 104 474-477.
- ^ Jump up to: а б А. М. Лэндс и Дж. И. Грант (1952). «Вазопрессорное действие и токсичность производных циклогексилэтиламина». Дж. Фармакол. Эксп. Там. 106 341-345.
- ^ Jump up to: а б Его Превосходительство Шеннон, Э.Дж. Коун и Д. Юсефнежад (1981). «Физиологические эффекты и кинетика фенилэтаноламина и его N-метилового гомолога в плазме у собак». Дж. Фармакол. Эксп. Там. 217 379-385.
- ^ Jump up to: а б Г. Лиапакис, В.К. Чан, М. Пападокостаки и Дж. А. Явич (2004). «Синергетический вклад функциональных групп адреналина в его сродство и эффективность в отношении β2 - адренергических рецепторов». Мол. Фармакол. 65 1181-1190.
- ^ Считается антагонистом рецепторов β 1 и β 2 и агонистом рецепторов β 3 .
- ^ Дж. Аксельрод (1962). «Очистка и свойства фенилэтаноламин-N-метилтрансферазы». Ж. Биол. хим. 237 1657-1660.
- ^ С. Осаму, О. Масакадзу и К. Ёсинао (1980). «Характеристика N-метилфенилэтиламина и N-метилфенилэтаноламина как субстратов моноаминоксидазы типа A и типа B». Биохим. Фармакол. 29 2663-2667.