Моноамин нейромедиатор

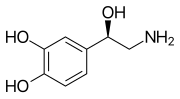
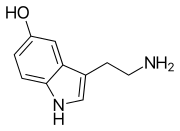
Моноаминовые нейротрансмиттеры — это нейромедиаторы и нейромодуляторы , которые содержат одну аминогруппу , соединенную с ароматическим кольцом двухуглеродной цепью (например, -СН 2 -СН 2 -). Примерами являются дофамин , норадреналин и серотонин .
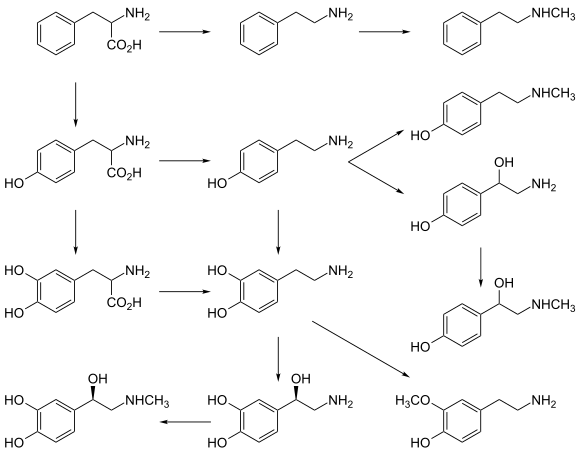
Все моноамины образуются из ароматических аминокислот, таких как фенилаланин , тирозин и триптофан , под действием декарбоксилазы ароматических аминокислот ферментов . В организме они деактивируются ферментами, известными как моноаминоксидазы, которые отщепляют аминогруппу.
Моноаминергические системы, т. е. сети нейронов, использующие моноаминовые нейротрансмиттеры, участвуют в регуляции таких процессов, как эмоции, возбуждение и некоторые виды памяти. Также было обнаружено, что моноаминовые нейротрансмиттеры играют важную роль в секреции и выработке нейротрофина-3 — химического вещества, которое поддерживает целостность нейронов и обеспечивает нейронам трофическую поддержку. астроцитами [1]
Препараты, повышающие или снижающие действие моноаминовых нейротрансмиттеров, применяются для лечения пациентов с психическими и неврологическими расстройствами, включая депрессию , тревогу , шизофрению и болезнь Паркинсона . [2]
Примеры
[ редактировать ]- Классические моноамины
- Имидазоламины :
- Катехоламины :
- Адреналин (Ad; Эпинефрин, Эпи)
- Дофамин (ДА)
- Noradrenaline (NAd; Norepinephrine, NE)
- Индоламины :
- Следовые амины
- Фенэтиламины (родственные катехоламинам ):
- Фенэтиламин [7] [8] [9] (МОЖЕТ БЫТЬ)
- N -метилфенэтиламин [10] [7] [9] (эндогенный изомер амфетамина )
- Фенилэтаноламин [11] [9]
- м -тирамин [7] [9]
- р -тирамин [7] [9]
- 3-Метокситирамин [10] [9]
- N -Метилтирамин [10] [7] [9]
- м -октопамин [7] [9]
- р -октопамин [7] [9]
- синефрин [10] [9]
- Триптамин [10] [8] [9]
Существуют специфические белки- переносчики, называемые переносчиками моноаминов , которые транспортируют моноамины в клетку или из нее. Это переносчик дофамина (DAT), переносчик серотонина (SERT) и переносчик норадреналина (NET) во внешней клеточной мембране и везикулярный переносчик моноаминов ( VMAT1 и VMAT2 ) в мембране внутриклеточных везикул . [ нужна ссылка ]
После высвобождения в синаптическую щель действие моноаминового нейромедиатора прекращается обратным захватом в пресинаптическое окончание. Там они могут быть переупакованы в синаптические пузырьки или расщеплены ферментом моноаминоксидазой ( МАО), который является мишенью ингибиторов моноаминоксидазы , класса антидепрессантов . [ нужна ссылка ]
Эволюция
[ редактировать ]
Системы моноаминовых нейротрансмиттеров встречаются практически у всех позвоночных, причем возможность развития этих систем способствовала адаптации видов позвоночных к различным средам. [12] [13]
Недавнее компьютерное исследование генетического происхождения показывает, что самое раннее появление моноаминов произошло 650 миллионов лет назад и что появление этих химических веществ, необходимых для активного или совместного осознания и взаимодействия с окружающей средой, совпадает с появлением билатерального или «зеркального» тела. в разгар (или, возможно, в каком-то смысле катализатор?) Кембрийского взрыва. [14]
См. также
[ редактировать ]- Ингибитор обратного захвата моноаминов
- Моноаминовый рецептор
- Моноаминоксидаза
- Транспортер моноаминов
- Моноаминная гипотеза
- Биогенный амин
- След амина
- Моноаминные ядра
- Биология депрессии
Ссылки
[ редактировать ]- ^ Меле Т, Чарман-Кржан М, Юрич ДМ (2010). «Регуляторная роль моноаминовых нейротрансмиттеров в синтезе астроцитов NT-3». Международный журнал нейробиологии развития . 28 (1): 13–9. дои : 10.1016/j.ijdevneu.2009.10.003 . ПМИД 19854260 . S2CID 25734591 .
- ^ Куриан М.А., Гиссен П., Смит М., Хилз С.Дж., Клейтон П.Т. (2011). «Нарушения моноаминовых нейротрансмиттеров: расширяющийся спектр неврологических синдромов». Ланцет Неврология . 10 (8): 721–33. дои : 10.1016/S1474-4422(11)70141-7 . ПМИД 21777827 . S2CID 32271477 .
- ^ Бродли К.Дж. (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакология и терапия . 125 (3): 363–375. doi : 10.1016/j.pharmthera.2009.11.005 . ПМИД 19948186 .
- ^ Линдеманн Л., Хонер MC (май 2005 г.). «Ренессанс следовых аминов, вдохновленный новым семейством GPCR». Тенденции в фармакологических науках . 26 (5): 274–281. дои : 10.1016/j.tips.2005.03.007 . ПМИД 15860375 .
- ^ Ван X, Ли Дж, Донг Дж, Юэ Дж (февраль 2014 г.). «Эндогенные субстраты CYP2D мозга». Европейский журнал фармакологии . 724 : 211–218. дои : 10.1016/j.ejphar.2013.12.025 . ПМИД 24374199 .
- ^ Ромеро-Кальдерон Р., Уленброк Г., Борич Дж., Саймон А.Ф., Григорук А., Йи С.К., Шайер А., Акерсон Л.К., Мейдмент Н.Т., Мейнерцхаген И.А., Ховеманн Б.Т., Кранц Д.Э. (ноябрь 2008 г.). «Глиальный вариант везикулярного переносчика моноаминов необходим для хранения гистамина в зрительной системе дрозофилы» . ПЛОС Генет . 4 (11): е1000245. дои : 10.1371/journal.pgen.1000245 . ПМК 2570955 . ПМИД 18989452 .
В отличие от других моноаминовых нейротрансмиттеров, механизм регуляции содержания гистамина в мозге остается неясным. У млекопитающих везикулярные переносчики моноаминов (VMAT) экспрессируются исключительно в нейронах и опосредуют хранение гистамина и других моноаминов.
- ^ Jump up to: а б с д и ж г Бродли К.Дж. (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакол. Там . 125 (3): 363–375. doi : 10.1016/j.pharmthera.2009.11.005 . ПМИД 19948186 .
Следовые амины метаболизируются в организме млекопитающих посредством моноаминоксидазы (МАО; EC 1.4.3.4) (Berry, 2004) (рис. 2)... Он дезаминирует первичные и вторичные амины, свободные в цитоплазме нейронов, но не связанные в запасные пузырьки симпатического нейрона... Точно так же β-ПЭА не будет дезаминироваться в кишечнике, поскольку он является селективным субстратом для МАО-В, который не обнаруживается в кишечнике...
Уровни эндогенных следовых аминов в мозге в несколько сотен раз ниже, чем у классических нейротрансмиттеров норадреналина, дофамина и серотонина, но скорость их синтеза эквивалентна скорости синтеза норадреналина и дофамина, и они имеют очень высокую скорость оборота (Berry, 2004). Уровни следовых аминов в эндогенных внеклеточных тканях, измеренные в головном мозге, находятся в низком наномолярном диапазоне. Такие низкие концентрации возникают из-за их очень короткого периода полураспада... - ^ Jump up to: а б Миллер GM (январь 2011 г.). «Новая роль рецептора 1, связанного с следами аминов, в функциональной регуляции переносчиков моноаминов и дофаминергической активности» . Дж. Нейрохем . 116 (2): 164–176. дои : 10.1111/j.1471-4159.2010.07109.x . ПМК 3005101 . ПМИД 21073468 .
- ^ Jump up to: а б с д и ж г час я дж к Хан М.З., Наваз В. (октябрь 2016 г.). «Новая роль следовых аминов человека и рецепторов, связанных с следовыми аминами человека (hTAAR), в центральной нервной системе». Биомед. Фармакотер . 83 : 439–449. дои : 10.1016/j.biopha.2016.07.002 . ПМИД 27424325 .
- ^ Jump up to: а б с д и Линдеманн Л., Хонер MC (май 2005 г.). «Ренессанс следовых аминов, вдохновленный новым семейством GPCR». Тренды Фармакол. Наука . 26 (5): 274–281. дои : 10.1016/j.tips.2005.03.007 . ПМИД 15860375 .
Помимо основного пути метаболизма, ТА также могут превращаться под действием неспецифической N-метилтрансферазы (NMT) [22] и фенилэтаноламин-N-метилтрансферазы (PNMT) [23] в соответствующие вторичные амины (например, синефрин [14], N-метилфенилэтиламин и N-метилтирамин [15]), которые проявляют аналогичную активность в отношении TAAR1 (TA1), что и их предшественники первичных аминов... И дофамин, и 3-метокситирамин, которые не подвергаются дальнейшему N-метилированию, являются частичными агонистами TAAR1 (TA1). . ...
Нарушение регуляции уровней ТА связано с несколькими заболеваниями, что делает соответствующих членов семейства TAAR потенциальными мишенями для разработки лекарств. В этой статье мы фокусируемся на значении ТА и их рецепторов для расстройств, связанных с нервной системой, а именно шизофрении и депрессии; однако ТА также связаны с другими заболеваниями, такими как мигрень, синдром дефицита внимания и гиперактивности, злоупотребление психоактивными веществами и расстройства пищевого поведения [7,8,36]. Клинические исследования сообщают о повышенных уровнях β-ПЭА в плазме у пациентов, страдающих острой шизофренией [37] и повышенной экскреции β-ПЭА с мочой у параноидальных шизофреников [38], что подтверждает роль ТА при шизофрении. В результате этих исследований β-ПЭА был назван «эндогенным амфетамином» организма [39]. - ^ Уэйнскотт Д.Б., Литтл С.П., Инь Т., Ту Ю., Рокко В.П., Хе Дж.К., Нельсон Д.Л. (январь 2007 г.). «Фармакологическая характеристика клонированного человеческого следового аминоассоциированного рецептора 1 (TAAR1) и доказательства видовых различий с крысиным TAAR1». Журнал фармакологии и экспериментальной терапии . 320 (1): 475–85. дои : 10.1124/jpet.106.112532 . ПМИД 17038507 . S2CID 10829497 .
- ^ Каллиер С., Снапян М., Ле Кром С., Пру Д., Винсент Дж.Д., Вернье П. (2003). «Эволюция и клеточная биология дофаминовых рецепторов у позвоночных» . Биология клетки . 95 (7): 489–502. дои : 10.1016/s0248-4900(03)00089-3 . ПМИД 14597267 . S2CID 18277786 .
Эта «эволюция» дофаминовых систем сыграла важную роль в адаптации видов позвоночных практически ко всем возможным средам обитания.
- ^ Винсент Дж.Д., Кардино Б., Вернье П. (1998). «[Эволюция моноаминовых рецепторов и происхождение мотивационных и эмоциональных систем у позвоночных]». Бюллетень Национальной медицинской академии (на французском языке). 182 (7): 1505–14, обсуждение 1515–6. ПМИД 9916344 .
Эти данные позволяют предположить, что дупликация гена D1/бета-рецептора была необходима для разработки новых катехоламиновых психомоторных адаптивных реакций и что норадренергическая система возникла именно в начале эволюции позвоночных.
- ^ Гулти М., Боттон-Амио Дж., Розато Э., Спречер С.Г., Феуда Р. (6 июня 2023 г.). «Моноаминергическая система — это двухсторонняя инновация» . Природные коммуникации . 14 (1): 3284. Бибкод : 2023NatCo..14.3284G . дои : 10.1038/s41467-023-39030-2 . ISSN 2041-1723 . ПМЦ 10244343 . ПМИД 37280201 .
Внешние ссылки
[ редактировать ]- Биогенные + моноамины в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)