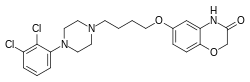
Брилароксазин
 | |
| Клинические данные | |
|---|---|
| Другие имена | РП5063; оксарипипразол [1] [2] |
| Маршруты администрация | Через рот |
| Класс препарата | Атипичный антипсихотик |
| Юридический статус | |
| Юридический статус | |
| Фармакокинетические данные | |
| Биодоступность | >80% [3] |
| Связывание с белками | >99% |
| Метаболизм | Печень (в основном через CYP3A4 (64%) и CYP2D6 (17%)) [4] |
| Период полувыведения | 55 часов [3] |
| Идентификаторы | |
| Номер CAS |
|
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| Химические и физические данные | |
| Формула | С 22 Н 25 Cl 2 Н 3 О 3 |
| Молярная масса | 450.36 g·mol −1 |
| 3D model ( JSmol ) | |
Брилароксазин (кодовое название разработки RP5063 ), также известный как оксарипипразол , [1] [2] — исследуемый атипичный антипсихотик , разрабатываемый Reviva Pharmaceuticals для лечения нервно-психических и воспалительных расстройств. [3] [5] [6] [7] В настоящее время завершено первое из двух III фазы клинических испытаний по лечению шизофрении . Reviva Pharmaceuticals также намерена исследовать брилароксазин для лечения биполярного расстройства , большого депрессивного расстройства , синдрома дефицита внимания и гиперактивности (СДВГ), раздражительности при аутизме , тиков , психоза / возбуждения, связанного с болезнью Альцгеймера , психоза при болезни Паркинсона , а также воспалительных расстройств. легочная артериальная гипертензия (ЛАГ), идиопатический фиброз легких (ИЛФ) и псориаз (гель для местного применения). [3] [8] FDA предоставило брилароксазину статус орфанного препарата для лечения ЛАГ и ИЛФ.
Брилароксазин является антипсихотиком третьего поколения и модулятором дофамин-серотониновой системы благодаря своему уникальному действию на дофаминовую и серотониновую нейротрансмиттерные системы по сравнению с другими антипсихотиками. [9] [10] [11] Клинические данные исследований фазы I , фазы II (NCT01490086) и фазы III (NCT05184335) позволяют предположить, что брилароксазин может иметь благоприятную эффективность и значительно улучшенный профиль побочных эффектов по сравнению с существующими препаратами второго и третьего поколения. [9] [12] [13]
Фармакология
[ редактировать ]Фармакодинамика
[ редактировать ]Брилароксазин действует как мощный частичный агонист рецепторов D 2 , D 3 , D 4 и 5-HT 1A и как 5 антагонист -HT 2A , 5-HT 2B , 5-HT 2C , 5-HT 6 и 5- HT7 - рецепторы. [9] [11] Брилароксазин проявляет высокое сродство к рецепторам D 2S , D 2L , D 3 , D 4.4 , 5-HT 1A , 5-HT 2A , 5-HT 2B и 5-HT 7 и умеренное сродство к D 1 , D 5 , 5. -HT 2C , 5-HT 3 , 5-HT 6 , H 1 и α 4 β 2 никотиновые рецепторы, переносчик серотонина и α 1B адренергический рецептор . [9] [11] Ему не хватает значительного сродства к 5-HT 1B , α 2 адренергическим и мускариновым рецепторам ацетилхолина , а также к переносчикам норадреналина и дофамина . [11]
| Сайт | К я (нМ) | Действие | |
|---|---|---|---|
| Д 1 | 100 | без даты | |
| DД2 | 0.40 | Частичный агонист | |
| Д 2Л | 0.45 | Частичный агонист | |
| Д 2С | 0.28 | Частичный агонист | |
| Д 3 | 3.7 | Частичный агонист | |
| Д 4 | 6.0 | Частичный агонист | |
| Д 5 | 200 | без даты | |
| 5-НТ 1А | 1.5 | Частичный агонист | |
| 5-НТ 2А | 2.5 | Слабый частичный агонист/ Антагонист | |
| 5-НТ 2Б | 0.19 | Антагонист | |
| 5-НТ 2С | 39 | Антагонист | |
| 5- HT3 | 78 | без даты | |
| 5-НТ 6 | 51 | Антагонист | |
| 5- HT7 | 2.7 | Антагонист | |
| α 4 β 2 никотиновый | 36.3 | без даты | |
| SERT | 107 | без даты | |
| Значения представляют собой K i (нМ). Чем меньше значение, тем сильнее лекарство связывается с участком. | |||
Химия
[ редактировать ]Брилароксазин идентичен арипипразолу по химической структуре, за исключением замены метиленовой группы арипипразола в хинолиноновой кольцевой системе атомом кислорода , в результате чего вместо этого образуется бензоксазиноновая кольцевая система. молекулы Это структурное изменение происходит во вторичном фармакофоре , который играет важную роль в модуляции его связывания и внутренней эффективности на рецепторах дофамина и серотонина. [14] [15] По структуре препарат также связан с брекспипразолом и карипразином .
Последние события
[ редактировать ]В октябре 2023 года Reviva Pharmaceuticals опубликовала основные результаты своего ключевого клинического исследования III фазы RECOVER (NCT05184335). Исследование RECOVER представляло собой 4-недельное рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование, в котором 411 пациентов получали брилароксазин в дозе 15 мг, 50 мг или плацебо один раз в день. Испытательная группа состояла из 60% пациентов из США, 34% из Индии и 6% из Болгарии со сбалансированной рандомизацией и разнообразной демографической репрезентацией во всех трех группах исследования. Первичной конечной точкой было изменение общего балла PANSS по сравнению с исходным уровнем по сравнению с плацебо на 4-й неделе. Вторичными конечными точками были положительные симптомы PANSS, отрицательные симптомы PANSS, отрицательный фактор Мардера PANSS, социальное познание PANSS, возбуждение/возбуждение PANSS, CGI-S , а также личная и социальная эффективность. Изменение показателя (PSP) по сравнению с исходным уровнем по сравнению с плацебо на 4-й неделе.
Брилароксазин в дозе 50 мг успешно достиг всех первичных и вторичных конечных точек со статистически значимыми и клинически значимыми улучшениями по сравнению с плацебо во всех основных областях симптомов. Изменение общего балла по первичной конечной точке по сравнению с исходным уровнем по PANSS составило -23,9 для брилароксазина в дозе 50 мг против -13,8 для плацебо на 4-й неделе, что привело к снижению на 10,1 балла по сравнению с плацебо (p < 0,001). В течение первой недели приема брилароксазин в дозе 50 мг уже достиг отделения от плацебо по первичной конечной точке и нескольким вторичным конечным точкам.
| Конечная точка | Снижение/улучшение очков | Размер эффекта Коэна d | P-значение |
|---|---|---|---|
| Общий балл PANSS | 10.1 | 0.6 | <0,001 |
| Положительные симптомы PANSS | 2.8 | 0.5 | <0,001 |
| PANSS-негативные симптомы | 2.0 | 0.4 | 0.003 |
| Отрицательный фактор Мардера по PANSS | 2.1 | 0.4 | 0.002 |
| PANSS Социальное познание | 1.6 | 0.5 | <0,001 |
| PANSS Волнение/Возбуждение | 2.1 | 0.5 | <0,001 |
| Личная и социальная эффективность (PSP) | 6.3 | 0.5 | <0,001 |
| CGI-S | >= 1 | 0.5 | <0,001 |
Более низкая доза брилароксазина (15 мг) достигла двух вторичных конечных точек на 4-й неделе: социального познания и личной и социальной активности по PANSS (PSP), а также продемонстрировала явную тенденцию к улучшению и увеличивающееся отделение от плацебо по первичной конечной точке: общий балл PANSS и балл положительных симптомов PANSS, начиная с 15 мг. на 3 неделе.
Брилароксазин очень хорошо переносился и был безопасен: общая частота возникновения нежелательных явлений при лечении (TEAE) составляла 34,5% для брилароксазина в дозе 15 мг, 35,5% для 50 мг и 30% для плацебо. Частота прекращения приема брилароксазина была ниже, чем при приеме плацебо, и составляла 19% для 15 мг брилароксазина, 16% для 50 мг и 22% для плацебо. Частота прекращения лечения из-за побочных эффектов препарата также была ниже для группы брилароксазина, чем для группы плацебо: 1% для группы брилароксазина в дозе 15 мг, 0% для группы 50 мг и 4% для группы плацебо. Распространенными TEAE (>5%) были головная боль (<6%) и сонливость (<=7,5%), но они были легкой или умеренной степени тяжести и, как правило, преходящего характера. Случаев суицидальных мыслей не было.
Не было отмечено >=7% средних изменений массы тела, уровня глюкозы в крови, липидов, пролактина или гормонов щитовидной железы по сравнению с плацебо. Процент пациентов, набравших вес во время исследования, составил 2,1% для 15 мг брилароксазина, 5,9% для 50 мг и 2,9% для плацебо. Это значительное улучшение по сравнению с назначаемыми в настоящее время антипсихотиками третьего поколения арипипразолом (Абилифай), брекспипразолом (Рексулти) и карипразином (Врайлар). В сопоставимых краткосрочных (4–6 недель) клинических исследованиях острой шизофрении процент пациентов, принимавших антипсихотик третьего поколения, у которых наблюдалось клинически значимое увеличение веса (прибавка >= 7%), составил 9,2% в группе арипипразола против 4,3% в группе плацебо. 10,4% для брекспипразола против 4,1% для плацебо и 9,2% для карипразина против 4,7% для плацебо. При приеме самой высокой дозы карипразин приводил к увеличению веса на 3% по сравнению с плацебо, что было эквивалентно увеличению веса при приеме брилароксазина. [16] [17]
Частота акатизии и экстрапирамидных симптомов (ЭПС) была очень низкой и составляла 0% для 15 мг брилароксазина, 0,7% для 50 мг и 0% для плацебо. Процент пациентов с повышенным уровнем холестерина ЛПВП по сравнению с исходным уровнем составил 0% для брилароксазина 15 и 50 мг по сравнению с 2,9% для плацебо, а процент пациентов с низким уровнем холестерина ЛПВП по сравнению с исходным уровнем составил 0,7% для брилароксазина 15 мг, 1,4% для 50 мг. мг и 1,4% для плацебо.
Reviva также проводит 52-недельное одногрупповое открытое расширенное исследование III фазы (OLE) у пациентов со стабильной шизофренией для дальнейшей оценки долгосрочной безопасности и переносимости брилароксазина в рамках программы RECOVER (NCT05184335). В этом исследовании пациенты, участвовавшие в 4-недельном двойном слепом исследовании RECOVER, а также пациенты со стабильной шизофренией de novo получали брилароксазин в гибком графике дозирования 15-30-50 мг. Завершение ожидается в четвертом квартале 2024 года. В первом квартале 2024 года Reviva планирует начать RECOVER-2 во втором квартале 2024 года. RECOVER-2 — это подтверждающее 4-недельное рандомизированное двойное слепое плацебо-контролируемое многоцентровое клиническое исследование III фазы с участием 450 больных острой шизофренией. пациентов, где пациенты будут получать брилароксазин 30 мг, 50 мг или плацебо один раз в день. Завершение ожидается во втором квартале 2025 года, а подача заявки на новый препарат брилароксазина в FDA ожидается в третьем квартале 2025 года. В случае успеха ожидается коммерческая доступность к 2026 году.
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Модика М.Н., Лачивита Э., Интальята С., Салерно Л., Ромео Дж., Питтала В., Леопольдо М. (октябрь 2018 г.). «Взаимосвязь структура-активность и терапевтические возможности лигандов рецептора 5-HT7: обновленная информация». J Med Chem . 61 (19): 8475–8503. doi : 10.1021/acs.jmedchem.7b01898 . hdl : 11586/218985 . ПМИД 29767995 .
- ^ Jump up to: а б Джордан, Австралия (14 сентября 2018 г.). Антидепрессанты: история, наука и проблемы . Абк-Клио. ISBN 9781440839276 .
- ^ Jump up to: а б с д «Корпоративная презентация Ревива» . Ревива Фармацевтика . Проверено 19 июля 2023 г.
- ^ Кантильон М., Ингс Р., Пракаш А., Бхат Л. (2018). «Популяционный фармакокинетический и фармакодинамический анализ данных исследования фазы 2 RP5063 у пациентов с шизофренией или шизоаффективным расстройством» . Европейский журнал метаболизма лекарств и фармакокинетики . 43 (5): 573–585. дои : 10.1007/s13318-018-0472-z . ПМК 6133081 . ПМИД 29619682 .
- ^ Разрабатываемые лекарства для психического здоровья (PDF) (Отчет). Фармацевтические исследования и производители Америки. 2014. с. 20 . Проверено 19 мая 2015 г.
- ^ Кестер Л.С., Карбон М., Коррелл К.У. (декабрь 2014 г.). «Новые лекарства от шизофрении: обновленная информация». Мнение экспертов о новых лекарствах . 19 (4): 511–31. дои : 10.1517/14728214.2014.958148 . ПМИД 25234340 . S2CID 42729570 .
- ^ «Разработка лекарств от шизофрении: резюме и таблица». Фармацевтическая медицина . 28 (5): 265–271. 2014. doi : 10.1007/s40290-014-0070-6 . ISSN 1178-2595 . S2CID 8513976 .
- ^ «Продуктовый конвейер Reviva» . Ревива Фармацевтика . Проверено 19 июля 2023 г.
- ^ Jump up to: а б с д и Кантильон М., Пракаш А., Александр А., Ингс Р., Свейцер Д., Бхат Л. (2017). «Стабилизатор дофамина-серотонина RP5063: рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование безопасности и эффективности при обострении шизофрении или шизоаффективного расстройства». Исследования шизофрении . 189 : 126–133. дои : 10.1016/j.schres.2017.01.043 . ПМИД 28215471 . S2CID 19499381 .
- ^ Jump up to: а б Раджагопал Л., Квон С., Хуанг М., Майкл Э., Бхат Л., Кантильон М., Мельцер Х.И. (2017). «RP5063, атипичный антипсихотический препарат с уникальным фармакологическим профилем, улучшает декларативную память и психоз на мышиных моделях шизофрении». Поведенческие исследования мозга . 332 : 180–199. дои : 10.1016/j.bbr.2017.02.036 . ПМИД 28373127 . S2CID 13047310 .
- ^ Jump up to: а б с д Марк Кантильон, доктор медицинских наук, Майк Ли, магистр наук, Сарат Канекал, доктор философии, DABT, RAC, Роберт М.Дж. Ингс, доктор философии, Грейс Тунг, RAC, Лакшминараян Бхат (2013). «Обновление: эффективность и безопасность RP5063 фазы 2 при шизофрении и шизоаффективном расстройстве» (PDF) . Американское общество клинической психофармакологии . Проверено 19 мая 2015 г.
{{cite web}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Кантильон М., Ингс Р., Бхат Л. (2018). «Начальный клинический опыт RP5063 после однократного введения нормальным здоровым добровольцам и многократного введения доз пациентам со стабильной шизофренией» . Клиническая и трансляционная наука . 11 (4): 387–396. дои : 10.1111/cts.12545 . ПМК 6039200 . ПМИД 29637739 .
- ^ «Основные результаты исследования Reviva RECOVER фазы III» (PDF) . Ревива Фармацевтика . Проверено 2 ноября 2023 г.
- ^ Кляйн Херенбринк С., Верма Р., Лим Х.Д., Копинатан А., Кин А., Шонберг Дж., Дрейпер-Джойс С.Дж., Скаммеллс П.Дж., Кристопулос А., Джавич Дж.А., Капуано Б., Ши Л., Лейн Дж.Р. (2019). «Молекулярные детерминанты внутренней эффективности антипсихотика арипипразола» . АКС Химическая биология . 14 (8): 1780–1792. doi : 10.1021/acschembio.9b00342 . ПМЦ 7365685 . ПМИД 31339684 .
- ^ Чен З, Фань Л, Ван Х, Ю Дж, Лу Д, Ци Дж, Не Ф, Ло З, Лю З, Ченг Дж, Ван С (2021). «Структурная разработка нового антипсихотического препарата третьего поколения с потенциальными антидепрессивными свойствами». Природа Нейронауки . 25 (1): 39–49. дои : 10.1038/s41593-021-00971-w . ПМИД 34887590 . S2CID 256840074 .
- ^ Вайс С., Вейллер Э., Бейкер Р.А., Даффи Р.А., Гвин К.К., Чжан П., Маккуэйд Р.Д. (2018). «Влияние брекспипразола и арипипразола на массу тела в качестве монотерапии у пациентов с шизофренией и в качестве дополнительного лечения у пациентов с большим депрессивным расстройством: анализ краткосрочных и долгосрочных исследований» . Инт Клин Психофармакол . 33 (5): 255–260. doi : 10.1097/YIC.0000000000000226 . ПМК 6078484 . ПМИД 29878915 .
- ^ Эрли В., Дургам С., Лу К., Ласловский И., Дебелль М., Кейн Дж.М. (2017). «Безопасность и переносимость карипразина у пациентов с острым обострением шизофрении: объединенный анализ четырех рандомизированных двойных слепых плацебо-контролируемых исследований фазы II/III» . Инт Клин Психофармакол . 32 (6): 319–328. doi : 10.1097/YIC.0000000000000187 . ПМК 5625952 . ПМИД 28692485 .
Внешние ссылки
[ редактировать ]- Агонисты D2-рецепторов
- Агонисты дофамина
- Агонисты 5-HT1A
- Агонисты 5-HT2A
- Антагонисты 5-HT2B
- Антагонисты 5-HT2C
- Антагонисты 5-НТ6
- Антагонисты 5-HT7
- Атипичные нейролептики
- Бензоксазины
- хлорарены
- Разработаны экспериментальные лекарства от шизофрении
- Пиперазины
- Ингибиторы обратного захвата серотонина
- Экспериментальные антидепрессанты