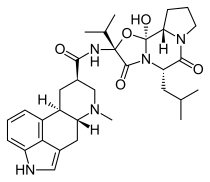
Дигидроэргокриптин
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Алмирид, Крипар |
| Другие имена | ДГЭК; 12'-Гидрокси-2'-(1-метилэтил)-5'α-(2-метилпропил)-9,10α-дигидроэрготаман-3',6',18-трион; (5'α,10α)-9,10-Дигидро-12'-гидрокси-2'-(1-метилэтил)-5'-(2-метилпропил)-эрготаман-3',6',18-трион |
| Беременность категория |
|
| Маршруты администрация | Оральный |
| код АТС | |
| Юридический статус | |
| Юридический статус |
|
| Фармакокинетические данные | |
| Период полувыведения | 12–16 часов |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.042.706 |
| Химические и физические данные | |
| Формула | С 32 Ч 43 Н 5 О 5 |
| Молярная масса | 577.726 g·mol −1 |
| 3D model ( JSmol ) | |
| (проверять) | |
Дигидроэргокриптин ( ДГЭК под торговыми марками Алмирид и Крипар ), продаваемый , среди прочего, , представляет собой агонист дофамина группы эрголина , который используется в качестве противопаркинсонического средства при лечении болезни Паркинсона . [1] Его принимают внутрь . [ нужна ссылка ]
Медицинское использование
[ редактировать ]болезнь Паркинсона
[ редактировать ]Было показано, что дигидроэргокриптин особенно эффективен в качестве монотерапии на ранних стадиях болезни Паркинсона . Начальная монотерапия агонистом дофамина (другие примеры включают перголид , прамипексол и ропинирол ) связана со снижением риска двигательных осложнений у пациентов с болезнью Паркинсона по сравнению с леводопой . [2] DHEC, как и другие агонисты дофамина, стремится имитировать эндогенный нейромедиатор и оказывать антипаркинсонический эффект. [3] Недавние данные также подтверждают, что агонисты дофаминовых рецепторов вместо леводопы могут замедлять или предотвращать прогрессирование болезни Паркинсона. [4]
Считается, что относительно длительный период полувыведения и отсутствие диетического влияния дигидроэргокриптина способствуют эффективности этого соединения при болезни Паркинсона, особенно потому, что оно обеспечивает более непрерывную стимуляцию дофаминергических рецепторов головного мозга, чем препараты короткого действия, такие как леводопа. [5] Также доказано, что DHEC безопасен и эффективен для улучшения симптомов у пациентов с болезнью Паркинсона. [6]
Улучшение моторики у пациентов с болезнью Паркинсона обычно наблюдается у пациентов, которые принимают по крайней мере среднюю суточную дозу около 40 мг. [7] Пациенты, получающие DHEC, демонстрируют более высокие баллы по шкале Вебстера, стандартизированной шкале оценки симптомов болезни Паркинсона, таких как параметры походки и дискинезия, по сравнению с пациентами, принимавшими леводопу. [5] [8] Другое клиническое исследование показало, что DHEC обладает превосходной эффективностью в снижении клинических и двигательных осложнений, связанных с длительным применением леводопы, а также в снижении частоты и тяжести побочных эффектов. [1]
Активация пресинаптических дофаминовых ауторецепторов дигидроэргокриптином приводит к снижению оборота дофаминовых рецепторов и непрямому антиоксидантному эффекту. В частности, предполагается, что дальнейшая активация внутриклеточных киназных систем под действием агонистов дофамина приведет к антиапоптотическим эффектам, которые также помогают остановить и замедлить прогрессирование заболевания. [2] Это также может способствовать предотвращению развития двигательных флуктуаций, хотя необходимы дополнительные исследования. [9]
Современные агонисты, такие как дигидроэргокриптин, обычно стоят в два-три раза дороже, чем терапия леводопой. Могут потребоваться дополнительные оценки экономики здравоохранения, чтобы определить, компенсируются ли первоначальные повышенные затраты на агонисты меньшим количеством пациентов, нуждающихся в хирургическом вмешательстве на более поздних стадиях заболевания. [10]
Другое использование
[ редактировать ]Дигидроэргокриптин также можно использовать для мигрени . профилактики [11] а также для лечения пониженного артериального давления у пожилых пациентов и нарушений периферических сосудов . [12] Чаще всего его используют в сочетании с двумя аналогичными соединениями: дигидроэргокорнином и дигидроэргокристином . Эту смесь называют эрголоидом или кодергокрином. [13]
Побочные эффекты
[ редактировать ]Было высказано предположение, что дигидроэргокриптин вызывает меньше побочных эффектов и имеет эффективность, аналогичную классическому агонисту дофамина, благодаря своему биохимическому профилю. [5] Влияния на метаболизм леводопы также не наблюдается. [10] Хотя DHEC может сопровождаться некоторыми острыми побочными эффектами, описанными ниже, DHEC в целом имеет хорошую переносимость практически без отмены или изменений в схеме приема. [7]
Острые побочные эффекты обычно сопровождают начало лечения, но имеют тенденцию к уменьшению по мере того, как у пациента развивается повышенная толерантность к препарату. [14] В рандомизированных двойных слепых исследованиях лица, принимавшие различные агонисты дофамина, включая дигидроэргокриптин, не различались по частоте прекращения лечения, связанной с нежелательными явлениями. [15] [16] Тем не менее, по-видимому, наблюдается более высокая частота дофаминергических побочных эффектов, таких как галлюцинации и желудочно-кишечные жалобы, которые, как правило, встречаются чаще. [6]
- Тошнота
- Рвота
- Беспокойство
- Сердечные аритмии
- Постуральная гипотония
- Сонливость
- Галлюцинации
- Расстройства контроля импульсивности
- Периферические отеки
Фармакология
[ редактировать ]Фармакодинамика
[ редактировать ]Несколько исследований in vitro и in vivo продемонстрировали, что дигидроэргокриптин является эффективным средством против болезни Паркинсона, скорее всего, проявляя свое действие как мощный агонист D2 - рецепторов. d K DHEC Обнаружено, что достоверным является вклад его частичной D1 активности агониста рецептора и D3 рецептора составляет около 5-8 нМ на рецепторах D2. Менее . DHEC имеет более низкое сродство к рецепторам D1 и D3 ( Kd составляет около 30 нМ для обоих), чем к рецепторам D2 . [3] Широко распространено мнение, что агонисты дофаминовых рецепторов демонстрируют свои антипаркинсонические эффекты, прежде всего, стимулируя рецепторы D2, но могут быть задействованы и другие рецепторы дофамина, такие как D1 и D3. [3]
Примечательно, что DHEC, как сообщается, незначительно взаимодействует с серотонинергическими и адренергическими рецепторами. [5]
Фармакокинетика
[ редактировать ]Дигидроэргокриптин имеет два основных фармакокинетических преимущества перед леводопой.
Первым фармакокинетическим преимуществом является период полувыведения от 12 до 16 часов. Считается, что этот относительно длительный период полувыведения способствует эффективности соединения при болезни Паркинсона, особенно потому, что оно обеспечивает более непрерывную стимуляцию дофаминергических рецепторов головного мозга, чем препараты короткого действия, такие как леводопа. Хотя точная причина неизвестна, считается, что постоянная стимуляция снижает риск двигательных осложнений. [2]
Вторым фармакокинетическим преимуществом является отсутствие влияния диеты на всасывание препарата. Эта характеристика также позволяет обеспечить более продолжительную стимуляцию дофаминовых рецепторов. [5]
DHEC можно принимать однократно перорально, он быстро всасывается. Пиковые концентрации в плазме наблюдаются через 30–120 минут после приема. Сильный метаболизм в печени при первом прохождении приводит к плохой биодоступности. Менее 5% исходной дозы достигает кровообращения. [5]
Химия
[ редактировать ]Дигидроэргокриптин представляет собой смесь двух очень похожих соединений, альфа- и бета -дигидроэргокриптина (эпикриптина) в соотношении 2:1. [12] Бета -форма отличается от альфа- формы только положением единственной метильной группы, что является следствием биосинтеза исходного соединения эргокриптина , в котором протеиногенная аминокислота лейцин заменена изолейцином . [17]
Дигидроэргокриптин представляет собой гидрогенизированное производное спорыньи , которое по своей структуре очень похоже на бромокриптин , еще один препарат, обладающий противопаркинсоническим действием. ДГЭЦ отличается тем, что он гидрирован по С9–С10 и лишен брома по С2. Фактически, все производные спорыньи являются уникальными или главным образом D 2 -подобных агонистами рецепторов . [5]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Баттистин Л., Бардин П.Г., Ферро-Милоне Ф., Равенна С., Тосо В., Реболди Г. (январь 1999 г.). «Альфа-дигидроэргокриптин при болезни Паркинсона: многоцентровое рандомизированное двойное слепое исследование в параллельных группах». Acta Neurologica Scandinavica . 99 (1): 36–42. дои : 10.1111/j.1600-0404.1999.tb00655.x . ПМИД 9925236 . S2CID 45192184 .
- ^ Перейти обратно: а б с Антонини А., Толоса Э., Мизуно Ю., Ямамото М., Пове В.Х. (октябрь 2009 г.). «Переоценка рисков и преимуществ агонистов дофамина при болезни Паркинсона». «Ланцет». Неврология . 8 (10): 929–37. дои : 10.1016/S1474-4422(09)70225-X . ПМИД 19709931 . S2CID 33649811 .
- ^ Перейти обратно: а б с Герлах М., Дабл К., Арцбергер Т., Леблхубер Ф., Татшнер Т., Ридерер П. (октябрь 2003 г.). «Агонисты дофаминовых рецепторов в современном клиническом использовании: сравнительные профили связывания дофаминовых рецепторов, определенные в полосатом теле человека». Журнал нейронной передачи . 110 (10): 1119–27. дои : 10.1007/s00702-003-0027-5 . ПМИД 14523624 . S2CID 10073899 .
- ^ Группа по изучению Паркинсона (апрель 2002 г.). «Визуализация головного мозга с помощью переносчика дофамина для оценки влияния прамипексола по сравнению с леводопой на прогрессирование болезни Паркинсона» . ДЖАМА . 287 (13): 1653–61. дои : 10.1001/jama.287.13.1653 . ПМИД 11926889 .
- ^ Перейти обратно: а б с д и ж г Альбанезе А., Колозимо С (май 2003 г.). «Дигидроэргокриптин при болезни Паркинсона: клиническая эффективность и сравнение с другими агонистами дофамина» . Acta Neurologica Scandinavica . 107 (5): 349–55. дои : 10.1034/j.1600-0404.2003.02049.x . ПМИД 12713527 . S2CID 18094044 .
- ^ Перейти обратно: а б Бергамаско Б, Фраттола Л, Мураторио А, Пикколи Ф, Майланд Ф, Парнетти Л (июнь 2000 г.). «Альфа-дигидроэргокриптин в лечении пациентов с паркинсонизмом de novo: результаты многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования». Acta Neurologica Scandinavica . 101 (6): 372–80. doi : 10.1034/j.1600-0404.2000.90295a.x . ПМИД 10877152 . S2CID 9859381 .
- ^ Перейти обратно: а б Мартиньони Э., Пакетти К., Сибилла Л., Бруджи П., Педевилья М., Наппи Дж. (февраль 1991 г.). «Дигидроэргокриптин в лечении болезни Паркинсона: шестимесячное двойное слепое клиническое исследование». Клиническая нейрофармакология . 14 (1): 78–83. дои : 10.1097/00002826-199102000-00006 . ПМИД 1903079 .
- ^ Рамакер С., Маринус Дж., Стиггельбаут А.М., Ван Хилтен Б.Дж. (сентябрь 2002 г.). «Систематическая оценка рейтинговых шкал нарушений и инвалидности при болезни Паркинсона». Двигательные расстройства . 17 (5): 867–76. дои : 10.1002/mds.10248 . ПМИД 12360535 . S2CID 2562332 .
- ^ Оланов CW (февраль 1992 г.). «Обоснование использования агонистов дофамина в качестве первичной терапии болезни Паркинсона» . Канадский журнал неврологических наук . 19 (1 приложение): 108–12. дои : 10.1017/S0317167100041469 . ПМИД 1349262 .
- ^ Перейти обратно: а б Кларк CE, Гуттман М (ноябрь 2002 г.). «Монотерапия агонистами дофамина при болезни Паркинсона». Ланцет . 360 (9347): 1767–9. дои : 10.1016/S0140-6736(02)11668-0 . ПМИД 12480442 . S2CID 25118777 .
- ^ Мичели Дж., Каваллини А., Маркеселли С., Майлланд Ф., Амбросоли Л., Наппи Дж. (апрель 2001 г.). «Альфа-дигидроэргокриптин и прогностические факторы профилактики мигрени». Международный журнал клинической фармакологии и терапии . 39 (4): 144–51. дои : 10.5414/cpp39144 . ПМИД 11332869 .
- ^ Перейти обратно: а б Хаберфельд, Х. (2007). Австрийский кодекс (на немецком языке) (изд. 2007/2008 г.). Вена: Издательство австрийского фармацевта. ISBN 978-3-85200-183-8 .
- ^ Drugs.com: Эрголоидные мезилаты
- ^ Ямамото М., Шапира А.Х. (апрель 2008 г.). «Агонисты дофамина при болезни Паркинсона». Экспертный обзор нейротерапии . 8 (4): 671–7. дои : 10.1586/14737175.8.4.671 . ПМИД 18416667 . S2CID 207194957 .
- ^ Раскол О., Гетц С., Коллер В., Пове В., Сампайо С. (май 2002 г.). «Лечебные мероприятия при болезни Паркинсона: оценка, основанная на фактических данных». Ланцет . 359 (9317): 1589–98. дои : 10.1016/S0140-6736(02)08520-3 . ПМИД 12047983 . S2CID 24426198 .
- ^ Гетц К.Г., Пове В., Раскол О., Сампайо К. (май 2005 г.). «Обновление научно-обоснованного медицинского обзора: фармакологическое и хирургическое лечение болезни Паркинсона: 2001–2004 гг.». Двигательные расстройства . 20 (5): 523–39. дои : 10.1002/mds.20464 . ПМИД 15818599 . S2CID 16260982 .
- ^ Штайнхильбер Д., Шуберт-Жсилавец М., Рот Х.Дж. (2005). Медицинская химия (на немецком языке). Штутгарт: Издательство немецкого фармацевта. п. 142. ИСБН 978-3-7692-3483-1 .