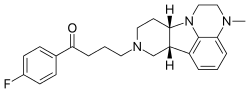
Люматеперон
 | |
| Клинические данные | |
|---|---|
| Произношение | / l uː m ə ˈ t ɛ p ə r ɑː n / loo-me- TE -pe-ron |
| Торговые названия | Каплита |
| Другие имена | ИТИ-007; ИТИ-722 |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а620014 |
| Данные лицензии |
|
| Маршруты администрация | Через рот |
| Класс препарата | Атипичный антипсихотик |
| код АТС | |
| Юридический статус | |
| Юридический статус |
|
| Фармакокинетические данные | |
| Биодоступность | 4.4% [2] |
| Связывание с белками | 97.4% [2] |
| Метаболизм | Несколько UGT , CYP450 и AKR ферментов [2] |
| Экскреция | <1% выводится с мочой в неизмененном виде [2] |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| Химические и физические данные | |
| Формула | С 24 Ч 28 Ф Н 3 О |
| Молярная масса | 393.506 g·mol −1 |
| 3D model ( JSmol ) | |
Луматеперон , продаваемый под торговой маркой Каплита , представляет собой атипичный антипсихотик класса бутирофенонов . Он одобрен для лечения шизофрении , а также биполярной депрессии как в качестве монотерапии, так и в качестве дополнительной терапии (с литием или вальпроатом ). [2] Он разработан компанией Intra-Cellular Therapies по лицензии Bristol-Myers Squibb . [3] Луматеперон был одобрен для медицинского применения в США в декабре 2019 года при первоначальном показании к шизофрении. [4] [5] и стал доступен в феврале 2020 года. [2] С тех пор он продемонстрировал эффективность при биполярной депрессии и получил одобрение FDA в декабре 2021 года для лечения депрессивных эпизодов, связанных как с биполярными расстройствами I, так и II типа.
Медицинское использование
[ редактировать ]Шизофрения
[ редактировать ]США 20 декабря 2019 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило луматеперон для лечения шизофрении у взрослых. [4] [5] [6]
Биполярная депрессия
[ редактировать ]В декабре 2021 года FDA одобрило луматеперон для лечения биполярной депрессии у взрослых в качестве монотерапии и в качестве дополнительной терапии с литием или вальпроатом . [2] [7] Число пациентов, нуждающихся в лечении (NNT) по поводу биполярной депрессии в дозе 42 мг в день, составляет 7 пациентов.
Побочные эффекты
[ редактировать ]Наиболее частыми побочными эффектами (≥5%) были сонливость и сухость во рту . [8]
Луматеперон связан с низким уровнем повышения аминотрансфераз в сыворотке крови во время терапии, но не связан со случаями клинически выраженного острого повреждения печени . [9]
Фармакология
[ редактировать ]| Сайт | К я (нМ) | |
|---|---|---|
| ЖЕСТКИЙ | 33 | |
| 5-НТ 2А | 0.54 | |
| 1А | <100 | |
| 1Б | <100 | |
| Д 1 | 41 | |
| DД2 | 32 | |
| Д 4 | <100 | |
Механизм действия
[ редактировать ]Луматеперон действует как антагонист рецептора 5 -НТ 2А и противодействует нескольким дофамина рецепторам ( D 1 , D 2 и D 4 ) с более низким сродством. Он обладает умеренным ингибированием обратного захвата переносчика серотонина . Он обладает дополнительным нецелевым антагонизмом к α1 - рецепторам заметных антимускариновых или антигистаминэргических свойств, что ограничивает побочные эффекты , без связанные с другими атипичными антипсихотиками. [2]
Фармакокинетика
[ редактировать ]После перорального приема люматеперон достигает максимальной концентрации в плазме в течение 1–2 часов, а конечный период полувыведения составляет 18 часов. [2] Луматеперон является субстратом для многочисленных метаболических ферментов, включая различные изоформы глюкуронозилтрансферазы (UGT) (UGT1A1, 1A4 и 2B15), изоформы альдокеторедуктазы (AKR) ( AKR1C1 , 1B10 и 1C4 ) и цитохрома P450 ферменты (CYP). CYP3A4 , 2C8 и 1A2 ). [2]
Луматеперон не вызывает заметного ингибирования каких-либо распространенных ферментов CYP450. Он не является субстратом для p-гликопротеина . [2]
История
[ редактировать ]FDA одобрило луматеперон на основании данных трех клинических исследований (Испытание 1/NCT01499563, Испытание 2/NCT02282761 и Испытание 3/NCT02469155), в которых приняли участие 818 взрослых участников с шизофренией. [4] Испытания проводились в 33 центрах в США. [4] В исследованиях 1 и 2 были представлены данные о пользе и побочных эффектах люматеперона, а в исследовании 3 — только данные о побочных эффектах. [4]
В трех исследованиях были получены данные для одобрения люматеперона. [4] В каждом исследовании госпитализированные участники с шизофренией были случайным образом распределены для приема люматеперона или препарата сравнения (плацебо или активного препарата сравнения) один раз в день в течение четырех недель (Испытания 1 и 2) или шести недель (Испытание 3). [4] Ни участники, ни поставщики медицинских услуг не знали, какое лечение им проводилось, пока испытания не были завершены. [4]
В исследованиях 1 и 2 были предоставлены данные для оценки преимуществ и побочных эффектов в течение четырех недель терапии. [4] Пользу оценивали путем измерения общего улучшения симптомов шизофрении. [4] В исследовании 3 были предоставлены данные для оценки побочных эффектов только в течение шести недель терапии. [4]
Были проведены и завершены два исследования III фазы монотерапии люматепероном для лечения биполярной депрессии: исследование 401 и исследование 404. [10] Третье исследование, Исследование 402, направлено на тестирование люматеперона в дополнение к литию или вальпроату . [11] [12] данные, относящиеся к этому исследованию, должны быть опубликованы в 2020 году. [13] [12]
Исследование 401 проводилось исключительно в США, а исследование 404 было глобальным и включало пациентов из США. [14] [15] Из всей популяции исследования 404 (381 пациент) две трети были из России и Колумбии. По завершении двух исследований фазы III монотерапии только исследование 404 достигло своей первичной конечной точки и одной из вторичных конечных точек. [16] [17] В исследовании 404 пациенты получали 42 мг люматеперона один раз в день или плацебо в течение шести недель. В исследовании 404 пациентов наблюдалось улучшение симптомов депрессии по сравнению с плацебо, о чем свидетельствует изменение общего балла MADRS на 4,6. [18]
Ссылки
[ редактировать ]- ^ «Список всех лекарств с предупреждениями о черном ящике, полученный FDA (используйте ссылки «Загрузить полные результаты» и «Просмотреть запрос»).» . nctr-crs.fda.gov . FDA . Проверено 22 октября 2023 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л м «Каплиталуматепероновая капсула» . DailyMed.nlm.nih.gov . США: Национальная медицинская библиотека, Национальные институты здравоохранения. 27 декабря 2019 года . Проверено 3 июля 2020 г.
- ^ Целанир С., Поли С., ред. (13 октября 2014 г.). Маломолекулярная терапия шизофрении . Спрингер. стр. 31–. ISBN 978-3-319-11502-3 .
- ^ Перейти обратно: а б с д и ж г час я дж к «Снимки испытаний наркотиков: Каплита» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 20 декабря 2019 года . Проверено 2 июля 2020 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Перейти обратно: а б «Пакет одобрения препарата: Каплита» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 21 января 2020 г. Проверено 1 июля 2020 г.
- ^ «FDA одобрило новый антипсихотический препарат для внутриклеточной терапии Каплита (луматеперон) для лечения шизофрении у взрослых» (пресс-релиз). Intra-Cellular Therapies Inc. 23 декабря 2019 г. Получено 1 июля 2020 г. - через GlobeNewswire.
- ^ «Intra-Cellular Therapies объявляет об одобрении FDA США препарата CAPLYTA® (луматеперон) для лечения биполярной депрессии у взрослых | Intra-Cellular Therapies Inc» .
- ^ Профессиональная информация о лекарствах FDA
- ^ «Луматеперон». LiverTox: клиническая и исследовательская информация о лекарственном повреждении печени . Национальный институт диабета, заболеваний органов пищеварения и почек. 2012. PMID 34648250 .
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Внутриклеточная терапия объявляет о положительных результатах исследования 3 фазы люматеперона у пациентов с биполярной депрессией» (пресс-релиз). Intra-Cellular Therapies Inc., 8 июля 2019 г. Проверено 6 ноября 2019 г. - через GlobeNewswire.
- ^ «Внутриклеточная терапия объявляет о положительных результатах исследования 3 фазы люматеперона у пациентов с биполярной депрессией» (пресс-релиз). Intra-Cellular Therapies Inc., 8 июля 2019 г. Проверено 6 ноября 2019 г. - через GlobeNewswire.
- ^ Перейти обратно: а б «Почему внутриклеточная терапия сегодня процветает» . Yahoo! Финансы . 8 июля 2019 года . Проверено 6 ноября 2019 г.
- ^ «Для внутриклеточного взаимодействия одного из двух недостаточно» . Оценивать . 8 июля 2019 года . Проверено 6 ноября 2019 г.
- ^ «Для внутриклеточного взаимодействия одного из двух недостаточно» . Оценивать . 8 июля 2019 года . Проверено 6 ноября 2019 г.
- ^ ДеАрмент А (8 июля 2019 г.). «Внутриклеточная терапия поражает одного и пропускает другого в программе III фазы биполярного расстройства» . Новости МедСити . Проверено 6 ноября 2019 г.
- ^ «Для внутриклеточного взаимодействия одного из двух недостаточно» . Оценивать . 8 июля 2019 года . Проверено 6 ноября 2019 г.
- ^ ДеАрмент А (8 июля 2019 г.). «Внутриклеточная терапия поражает одного и пропускает другого в программе III фазы биполярного расстройства» . Новости МедСити . Проверено 6 ноября 2019 г.
- ^ «Данные фазы 3 подтверждают эффективность люматеперона при биполярной депрессии» . Хелио . 8 июля 2019 года . Проверено 6 ноября 2019 г.
Внешние ссылки
[ редактировать ]- «Луматеперон» . Информационный портал о наркотиках . Национальная медицинская библиотека США.