Эргокриптин
 | |
| Идентификаторы | |
|---|---|
| Номер CAS | |
| ПабХим CID | |
| ИЮФАР/БПС | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| ХЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.007.384 |
| Химические и физические данные | |
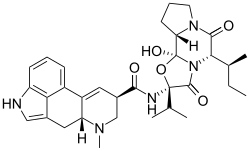
| Формула | С 32 Ч 41 Н 5 О 5 |
| Молярная масса | 575.710 g·mol −1 |
| 3D model ( JSmol ) | |
| | |
| |
| Имена | |
|---|---|
| Другие имена
(5'α S ) -втор -Бутил-12'-гидрокси-2'-изопропилэрготаман-3',6',18-трион
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| Информационная карта ECHA | 100.007.384 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 32 Ч 41 Н 5 О 5 | |
| Молярная масса | 575.710 g·mol −1 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Эргокриптин представляет собой эргопептин и один из эрголиновых алкалоидов . Его выделяют из спорыньи или ферментационного бульона и служат исходным материалом для производства бромокриптина . [ 1 ] Существуют два изомера эргокриптина: α-эргокриптин и β-эргокриптин . [ 2 ] Бета - отличается от альфа формы лишь положением единственной метильной группы, что является следствием биосинтеза, при котором протеиногенная аминокислота лейцин заменяется изолейцином . β-эргокриптин был впервые идентифицирован в 1967 году Альбертом Хофманном . [ 3 ] Спорынья из разных источников имеет разное соотношение двух изомеров. [ 4 ]
Биосинтез
[ редактировать ]Путь биосинтеза (DMAPP ) эргокриптина начинается с пренилирования L-триптофана по SN1-моду с помощью диметилаллилпирофосфата . DMAPP является производным мевалоновой кислоты . Эта реакция катализируется ферментом пренилтрансферазой (пренилтрансфераза 4-диметилаллилтриптофансинтаза), называемым FgaPT2 в Aspergillus fumigatus . [ 5 ] [ 6 ] образование аллильного Сообщалось о рентгеновской структуре пренилтрансферазы FgaPT2 и триптофана, которая использовалась для предположения трехэтапного механизма: (1) карбокатиона ; (2) нуклеофильная атака триптофана на карбокатион; (3) депротонирование для восстановления ароматичности и образования продукта — 4-диметилаллилтриптофана (DMAT). [ 6 ] Затем DMAT N-метилируется по аминогруппе триптофана с помощью фермента EasF, называемого FgaMT у A. fumigatus. S-аденозилметионин (SAM) является источником метила. [ 7 ]
 Следующим этапом биосинтеза эргокриптина является превращение 4-диметилаллил абрина в ханоклавин-I. Было показано, что ферменты EasE и EasC (FgaOx1 и FgaCat у A. fumigatus соответственно) необходимы для образования ханоклавина-I из 4-ДМА абрина. [ 8 ] Эксперименты по мутациям, изменяющие эти ферменты независимо, остановили путь прохождения абрина. Это указывает на необходимость сотрудничества между EasE и EasC.
Следующим этапом биосинтеза эргокриптина является превращение 4-диметилаллил абрина в ханоклавин-I. Было показано, что ферменты EasE и EasC (FgaOx1 и FgaCat у A. fumigatus соответственно) необходимы для образования ханоклавина-I из 4-ДМА абрина. [ 8 ] Эксперименты по мутациям, изменяющие эти ферменты независимо, остановили путь прохождения абрина. Это указывает на необходимость сотрудничества между EasE и EasC.

 Затем ханокальвин-I окисляется до альдегида ханоклавина-I с помощью НАД+-зависимого фермента EasD (FgaDH у A. fumigatus). Альдегид ханоклавина-I представляет собой точку разветвления, ведущую к различным алкалоидам спорыньи, в зависимости от конкретного гриба. У C. purpurea альдегид ханоклавина-I превращается в аргоклавин с помощью EasA, называемого старым желтым ферментом или FgaOx3. Этот процесс происходит посредством таутомеризации кето-енола, способствующей вращению вокруг углерод-углеродной связи, с последующей таутомеризацией обратно в альдегид и конденсацией с проксимальным вторичным амином. [ 6 ] [ 9 ] Образцы иминия, образующиеся в результате циклизации, затем восстанавливаются до третичного амина с образованием агроклавина.
Затем ханокальвин-I окисляется до альдегида ханоклавина-I с помощью НАД+-зависимого фермента EasD (FgaDH у A. fumigatus). Альдегид ханоклавина-I представляет собой точку разветвления, ведущую к различным алкалоидам спорыньи, в зависимости от конкретного гриба. У C. purpurea альдегид ханоклавина-I превращается в аргоклавин с помощью EasA, называемого старым желтым ферментом или FgaOx3. Этот процесс происходит посредством таутомеризации кето-енола, способствующей вращению вокруг углерод-углеродной связи, с последующей таутомеризацией обратно в альдегид и конденсацией с проксимальным вторичным амином. [ 6 ] [ 9 ] Образцы иминия, образующиеся в результате циклизации, затем восстанавливаются до третичного амина с образованием агроклавина.
Фермент монооксигеназа цитохрома Р-450 катализирует двухэлектронное окисление агроклавина до соответствующего первичного спирта - элимоклавина. [ 10 ] Затем элимоклавин окисляется четырьмя электронами монооксигеназой P450 с образованием паспаловой кислоты. Затем паспаловая кислота подвергается изомеризации двойной связи углерод-углерод, которая находится в сопряжении с кислотой, с образованием D-лизергиновой кислоты.
Лизергиновая кислота является точкой разветвления биосинтеза эргоамидов и эргопептинов. На пути к эргокриптину, эргопептину, трипептид устанавливается с помощью нерибосомальной пептидсинтазы (NRPS). Показано, что за соединение трипептида с лизергиновой кислотой ответственны два фермента — D-лизергилпептидсинтазы (ЛПС) 1 и 2. [ 11 ] Время окисления валина в спирт точно не известно. Однако предполагается, что окисление происходит при связывании NRPS LPS2. [ 12 ] Эргокриптин встречается в двух формах, различающихся аминокислотой, используемой NRPS. Альфа-форма содержит аминокислоту лейцин, а бета-форма — аминокислоту изолейцин. [ 6 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Крен В., Цвак Л. (1999). Спорынья: род Claviceps . Амстердам: Издательство Harwood Academic Publishers. стр. 399–401 . ISBN 9789057023750 .
- ^ Йейтс С.Г., Платтнер Р.Д., Гарнер ГБ (1985). «Обнаружение алкалоидов эргопептина в инфицированной эндофитами токсичной овсянице тростниковой Ky-31 методом масс-спектрометрии/масс-спектрометрии» (PDF) . Журнал сельскохозяйственной и пищевой химии . 33 (4): 719–722. дои : 10.1021/jf00064a038 . [ постоянная мертвая ссылка ]
- ^ Шлинц В., Бруннер Р., Рюггер А., Берде Б., Штюрмер Э., Хофман А. (декабрь 1967 г.). «Бета-эргокриптин, новый алкалоид группы эрготоксина». Эксперименты . 23 (12): 991–992. дои : 10.1007/BF02136400 . ПМИД 4965668 . S2CID 2328419 .
- ^ Шлинц В., Бруннер Р., Рюггер А., Берде Б., Штюрмер Э., Хофманн А. (1968). «Алкалоиды спорыньи. LXVII. β-эргокриптин, новый алкалоид ряда эрготоксинов». Фармацевтика Акта Гельвеция . 43 (8): 497–509.
- ^ Ли С.Л., Флосс Х.Г., Хайнштейн П. (ноябрь 1976 г.). «Очистка и свойства диметилаллилпирофосфата: триптофарм диметилаллилтрансферазы, первого фермента биосинтеза алкалоидов спорыньи у Claviceps. sp. SD 58». Архив биохимии и биофизики . 177 (1): 84–94. дои : 10.1016/0003-9861(76)90418-5 . ПМИД 999297 .
- ^ Jump up to: а б с д Герхардс Н., Нойбауэр Л., Тудзинский П., Ли С.М. (декабрь 2014 г.). «Пути биосинтеза алкалоидов спорыньи» . Токсины . 6 (12): 3281–3295. дои : 10.3390/toxins6123281 . ПМК 4280535 . ПМИД 25513893 .
- ^ Ригберс О, Ли С.М. (октябрь 2008 г.). «Биосинтез алкалоидов спорыньи в Aspergillus fumigatus. Перепроизводство и биохимическая характеристика 4-диметилаллилтриптофана N-метилтрансферазы» . Журнал биологической химии . 283 (40): 26859–26868. дои : 10.1074/jbc.M804979200 . ПМИД 18678866 .
- ^ Гетц К.Э., Койл С.М., Ченг Дж.З., О'Коннор С.Е., Панакчионе Д.Г. (июнь 2011 г.). «Каталаза, кодируемая кластером спорыньи, необходима для синтеза ханоклавина-I в Aspergillus fumigatus». Современная генетика . 57 (3): 201–211. дои : 10.1007/s00294-011-0336-4 . ПМИД 21409592 . S2CID 3031547 .
- ^ Койл С.М., Ченг Дж.З., О'Коннор С.Е., Панакчоне Д.Г. (июнь 2010 г.). «Старый ген желтого фермента контролирует точку ветвления между путями алкалоидов спорыньи Aspergillus fumigatus и Claviceps purpurea» . Прикладная и экологическая микробиология . 76 (12): 3898–3903. Бибкод : 2010ApEnM..76.3898C . дои : 10.1128/АЕМ.02914-09 . ПМК 2893504 . ПМИД 20435769 .
- ^ Хаарманн Т., Мачадо С., Люббе Й., Коррейя Т., Шардль К.Л., Панакчионе Д.Г., Тудзинский П. (июнь 2005 г.). «Кластер генов алкалоидов спорыньи у Claviceps purpurea: расширение последовательности кластера и внутривидовая эволюция». Фитохимия . 66 (11): 1312–1320. Бибкод : 2005PChem..66.1312H . doi : 10.1016/j.phytochem.2005.04.011 . ПМИД 15904941 .
- ^ Уолцель Б., Ридерер Б., Келлер Ю. (март 1997 г.). «Механизм синтеза алкалоидных циклопептидов у гриба спорыньи Claviceps purpurea» . Химия и биология . 4 (3): 223–230. дои : 10.1016/s1074-5521(97)90292-1 . ПМИД 9115414 .
- ^ Келлер У (1995). Генетика и биохимия производства антибиотиков . Бостон: Баттерворт-Хайнеманн.


