Никотин
 | |||
| |||
| Клинические данные | |||
|---|---|---|---|
| Торговые названия | Никоретте, Никотрол | ||
| AHFS / Drugs.com | Монография | ||
| Pregnancy категория |
| ||
| Dependence liability | Physical: Low–moderate[1] Psychological: High[2][3] | ||
| Addiction liability | Very high in susceptible individuals[4] | ||
| Routes of administration | Inhalation; insufflation; oral – buccal, sublingual, and ingestion; transdermal; rectal | ||
| ATC code | |||
| Legal status | |||
| Legal status |
| ||
| Pharmacokinetic data | |||
| Protein binding | <5% | ||
| Metabolism | Primarily hepatic: CYP2A6, CYP2B6, FMO3, others | ||
| Metabolites | Cotinine | ||
| Elimination half-life | 1–2 hours; 20 hours active metabolite | ||
| Excretion | Renal, urine pH-dependent;[8] 10–20% (gum), 30% (inhaled); 10–30% (intranasal) | ||
| Identifiers | |||
| CAS Number | |||
| PubChem CID | |||
| IUPHAR/BPS | |||
| DrugBank | |||
| ChemSpider | |||
| UNII | |||
| KEGG | |||
| ChEBI | |||
| ChEMBL | |||
| PDB ligand | |||
| CompTox Dashboard (EPA) | |||
| ECHA InfoCard | 100.000.177 | ||
| Chemical and physical data | |||
| Formula | C10H14N2 | ||
| Molar mass | 162.236 g·mol−1 | ||
| 3D model (JSmol) | |||
| Chirality | Chiral | ||
| Density | 1.01 g/cm3 | ||
| Melting point | −79 °C (−110 °F) | ||
| Boiling point | 247 °C (477 °F) | ||
| Part of a series on |
| Tobacco |
|---|
 |
Никотин — это природный алкалоид растений семейства пасленовых (преимущественно в табаке и Duboisia hopwoodii ). [9] и широко используется в рекреационных целях как стимулятор и анксиолитик . В качестве фармацевтического препарата он используется при прекращении курения для облегчения абстинентного синдрома . [10] [7] [11] [12] Никотин действует как агонист большинства никотиновых рецепторов ацетилхолина (нАХР), [13] [14] [15] за исключением двух субъединиц никотиновых рецепторов ( nAChRα9 и nAChRα10 ), где он действует как антагонист рецептора . [13]
Никотин составляет примерно 0,6–3,0% от сухой массы табака. [16] Никотин также присутствует в концентрациях ppb в съедобных растениях семейства пасленовых , включая картофель , помидоры и баклажаны . [17] хотя источники расходятся во мнениях относительно того, имеет ли это какое-либо биологическое значение для потребителей-людей. [17] Он действует как токсин против травоядных животных ; никотин широко использовался в качестве инсектицида , следовательно, в прошлом [18] [19] и неоникотиноиды (структурно подобные никотину), такие как имидаклоприд , являются одними из наиболее эффективных и широко используемых инсектицидов.
Nicotine is highly addictive.[20][21][22] Slow-release forms (gums and patches, when used correctly) can be less addictive and help in quitting.[23][24][25][26] Animal research suggests that monoamine oxidase inhibitors present in tobacco smoke may enhance nicotine's addictive properties.[27][28] An average cigarette yields about 2 mg of absorbed nicotine.[29]The estimated lower dose limit for fatal outcomes is 500–1,000 mg of ingested nicotine for an adult (6.5–13 mg/kg).[27][29] Nicotine addiction involves drug-reinforced behavior, compulsive use, and relapse following abstinence.[30] Nicotine dependence involves tolerance, sensitization,[31] physical dependence, psychological dependence,[32] and can cause distress.[33][34] Nicotine withdrawal symptoms include depressed mood, stress, anxiety, irritability, difficulty concentrating, and sleep disturbances.[2] Mild nicotine withdrawal symptoms are measurable in unrestricted smokers, who experience normal moods only as their blood nicotine levels peak, with each cigarette.[35] On quitting, withdrawal symptoms worsen sharply, then gradually improve to a normal state.[35]
Nicotine use as a tool for quitting smoking has a good safety history.[36] Animal studies suggest that nicotine may adversely affect cognitive development in adolescence, but the relevance of these findings to human brain development is disputed.[37][27] At low amounts, it has a mild analgesic effect.[38] According to the International Agency for Research on Cancer, "nicotine is not generally considered to be a carcinogen."[39][40]The Surgeon General of the United States indicates that evidence is inadequate to infer the presence or absence of a causal relationship between exposure to nicotine and risk for cancer.[41] Nicotine has been shown to produce birth defects in humans and is considered a teratogen.[42][43] The median lethal dose of nicotine in humans is unknown.[44] High doses are known to cause nicotine poisoning, organ failure, and death through paralysis of respiratory muscles,[41][45] though serious or fatal overdoses are rare.[46]
Uses
[edit]Medical
[edit]
The primary therapeutic use of nicotine is treating nicotine dependence to eliminate smoking and the damage it does to health. Controlled levels of nicotine are given to patients through gums, dermal patches, lozenges, inhalers, or nasal sprays to wean them off their dependence. A 2018 Cochrane Collaboration review found high-quality evidence that all current forms of nicotine replacement therapy (gum, patch, lozenges, inhaler, and nasal spray) increase the chances of successfully quitting smoking by 50–60%, regardless of setting.[47]
Combining nicotine patch use with a faster acting nicotine replacement, like gum or spray, improves the odds of treatment success.[48]
Nicotine is being researched in clinical trials for possible benefit in treating Parkinson's disease, dementia, ADHD, depression and sarcoma.[49]
In contrast to recreational nicotine products, which have been designed to maximize the likelihood of addiction, nicotine replacement products (NRTs) are designed to minimize addictiveness.[41]: 112 The more quickly a dose of nicotine is delivered and absorbed, the higher the addiction risk.[33]
Pesticide
[edit]Nicotine has been used as an insecticide since at least 1690, in the form of tobacco extracts[19][50][51] (although other components of tobacco also seem to have pesticide effects).[52] Nicotine pesticides have not been commercially available in the US since 2014,[53] homemade pesticides are banned on organic crops,[54] and caution is recommended for small gardeners.[55] Nicotine pesticides have been banned in the EU since 2009.[56] Foods are imported from countries in which nicotine pesticides are allowed, such as China, but foods may not exceed maximum nicotine levels.[56][57] Neonicotinoids, such as imidacloprid, which are derived from and structurally similar to nicotine, are widely used as agricultural and veterinary pesticides as of 2016.[58][50]
Performance
[edit]Nicotine-containing products are sometimes used for the performance-enhancing effects of nicotine on cognition.[59] A 2010 meta-analysis of 41 double-blind, placebo-controlled studies concluded that nicotine or smoking had significant positive effects on aspects of fine motor abilities, alerting and orienting attention, and episodic and working memory.[60] A 2015 review noted that stimulation of the α4β2 nicotinic receptor is responsible for certain improvements in attentional performance;[61] among the nicotinic receptor subtypes, nicotine has the highest binding affinity at the α4β2 receptor (ki=1 nM), which is also the biological target that mediates nicotine's addictive properties.[62] Nicotine has potential beneficial effects, but it also has paradoxical effects, which may be due to the inverted U-shape of the dose-response curve or pharmacokinetic features.[63]
Recreational
[edit]Nicotine is used as a recreational drug.[64] It is widely used, highly addictive and hard to discontinue.[22] Nicotine is often used compulsively,[65] and dependence can develop within days.[65][66] Recreational drug users commonly use nicotine for its mood-altering effects.[33] Recreational nicotine products include chewing tobacco, cigars,[67] cigarettes,[67] e-cigarettes,[68] snuff, pipe tobacco,[67] snus, and nicotine pouches.
Alcohol infused with nicotine is called nicotini.[69]
Contraindications
[edit]Nicotine use for tobacco cessation has few contraindications.[70]
It is not known whether nicotine replacement therapy is effective for smoking cessation in adolescents, as of 2014.[71] It is therefore not recommended to adolescents.[72] It is not safe to use nicotine during pregnancy or breastfeeding, although it is safer than smoking. The desirability of NRT use in pregnancy is therefore debated.[73][74][75]
Randomized trials and observational studies of nicotine replacement therapy in cardiovascular patients show no increase in adverse cardiovascular events compared to those treated with placebo.[76] Using nicotine products during cancer treatment may be contraindicated, as nicotine may promote tumour growth, but temporary use of NRTs to quit smoking may be advised for harm reduction.[77]
Nicotine gum is contraindicated in individuals with temporomandibular joint disease.[78] People with chronic nasal disorders and severe reactive airway disease require additional precautions when using nicotine nasal sprays.[72] Nicotine in any form is contraindicated in individuals with a known hypersensitivity to nicotine.[78][72]
Adverse effects
[edit]
Nicotine is classified as a poison.[80][81] However, at doses used by consumers, it presents little if any immediate hazard to the user.[82][83][84] A 2018 Cochrane Collaboration review lists nine main adverse events related to nicotine replacement therapy: headache, dizziness/light-headedness, nausea/vomiting, gastro-intestinal symptoms, sleep/dream problems, non-ischemic palpitations and chest pain, skin reactions, oral/nasal reactions and hiccups.[85] Many of these were also common in the placebo group without nicotine.[85] Palpitations and chest pain were deemed "rare" and there was no evidence of an increased number of serious cardiac problems compared to the placebo group, even in people with established cardiac disease.[47] The common side effects from nicotine exposure are listed in the table below. Serious adverse events due to the use of nicotine replacement therapy are extremely rare.[47] At low amounts, it has a mild analgesic effect.[38] At sufficiently high doses, nicotine may result in nausea, vomiting, diarrhea, salivation, bradyarrhythmia, and possibly seizures, hypoventilation, and death.[86]
| Route of administration | Dosage form | Associated side effects of nicotine | Sources |
|---|---|---|---|
| Buccal | Nicotine gum | Indigestion, nausea, hiccups, traumatic injury to oral mucosa or teeth, irritation or tingling of the mouth and throat, oral mucosal ulceration, jaw-muscle ache, burping, gum sticking to teeth, unpleasant taste, dizziness, lightheadedness, headache, and insomnia. | [47][78] |
| Lozenge | Nausea, dyspepsia, flatulence, headache, upper respiratory tract infections, irritation (i.e., a burning sensation), hiccups, sore throat, coughing, dry lips, and oral mucosal ulceration. | [47][78] | |
| Transdermal | Transdermal patch | Application site reactions (i.e., pruritus, burning, or erythema), diarrhea, dyspepsia, abdominal pain, dry mouth, nausea, dizziness, nervousness or restlessness, headache, vivid dreams or other sleep disturbances, and irritability. | [47][78][87] |
| Intranasal | Nasal spray | Runny nose, nasopharyngeal and ocular irritation, watery eyes, sneezing, and coughing. | [47][78][88] |
| Oral inhalation | Inhaler | Dyspepsia, oropharyngeal irritation (e.g., coughing, irritation of the mouth and throat), rhinitis, and headache. | [47][78][89] |
| All (nonspecific) | Peripheral vasoconstriction, tachycardia (i.e., fast heart rate), elevated blood pressure, increased alertness and cognitive performance. | [78][88] | |
Sleep
[edit]Nicotine reduces the amount of rapid eye movement (REM) sleep, slow-wave sleep (SWS), and total sleep time in healthy nonsmokers given nicotine via a transdermal patch, and the reduction is dose-dependent.[90] Acute nicotine intoxication has been found to significantly reduce total sleep time and increase REM latency, sleep onset latency, and non-rapid eye movement (NREM) stage 2 sleep time.[90][91] Depressive non-smokers experience mood and sleep improvements under nicotine administration; however, subsequent nicotine withdrawal has a negative effect on both mood and sleep.[92]
Cardiovascular system
[edit]This section needs expansion with: [78]"Cardiac adverse effects of nicotine replacement therapy". Prescrire International. 24 (166): 292–3. December 2015. PMID 26788573.. You can help by adding to it. (January 2019) |
A 2018 Cochrane review found that, in rare cases, nicotine replacement therapy can cause non-ischemic chest pain (i.e., chest pain that is unrelated to a heart attack) and heart palpitations, but does not increase the incidence of serious cardiac adverse events (i.e., myocardial infarction, stroke, and cardiac death) relative to controls.[47]
A 2016 review of the cardiovascular toxicity of nicotine concluded, "Based on current knowledge, we believe that the cardiovascular risks of nicotine from e-cigarette use in people without cardiovascular disease are quite low. We have concerns that nicotine from e-cigarettes could pose some risk for users with cardiovascular disease."[93]
Blood pressure
[edit]In the short term, nicotine causes a transient increase in blood pressure. Long term, epidemiological studies generally show increased blood pressure and hypertension among nicotine users.[93]
Reinforcement disorders
[edit]ΔFosB accumulation from excessive drug use Top: this depicts the initial effects of high dose exposure to an addictive drug on gene expression in the nucleus accumbens for various Fos family proteins (i.e., c-Fos, FosB, ΔFosB, Fra1, and Fra2). Bottom: this illustrates the progressive increase in ΔFosB expression in the nucleus accumbens following repeated twice daily drug binges, where these phosphorylated (35–37 kilodalton) ΔFosB isoforms persist in the D1-type medium spiny neurons of the nucleus accumbens for up to 2 months.[94][95] |
Nicotine is highly addictive but paradoxically has quite weak reinforcing property compared to other drugs of abuse in various animals.[21][22][96][97] Its addictiveness depends on how it is administered and also depends upon form in which nicotine is used.[25] Animal research suggests that monoamine oxidase inhibitors, acetaldehyde[97][98] and other constituents in tobacco smoke may enhance its addictiveness.[27][28] Nicotine dependence involves aspects of both psychological dependence and physical dependence, since discontinuation of extended use has been shown to produce both affective (e.g., anxiety, irritability, craving, anhedonia) and somatic (mild motor dysfunctions such as tremor) withdrawal symptoms.[2] Withdrawal symptoms peak in one to three days[99] and can persist for several weeks.[100] Some people experience symptoms for 6 months or longer.[101]
Normal between-cigarettes discontinuation, in unrestricted smokers, causes mild but measurable nicotine withdrawal symptoms.[35] These include mildly worse mood, stress, anxiety, cognition, and sleep, all of which briefly return to normal with the next cigarette.[35] Smokers have a worse mood than they typically would have if they were not nicotine-dependent; they experience normal moods only immediately after smoking.[35] Nicotine dependence is associated with poor sleep quality and shorter sleep duration among smokers.[102][103]
In dependent smokers, withdrawal causes impairments in memory and attention, and smoking during withdrawal returns these cognitive abilities to pre-withdrawal levels.[104] The temporarily increased cognitive levels of smokers after inhaling smoke are offset by periods of cognitive decline during nicotine withdrawal.[35] Therefore, the overall daily cognitive levels of smokers and non-smokers are roughly similar.[35]
Nicotine activates the mesolimbic pathway and induces long-term ΔFosB expression (i.e., produces phosphorylated ΔFosB isoforms) in the nucleus accumbens when inhaled or injected frequently or at high doses, but not necessarily when ingested.[105][106][107] Consequently, high daily exposure (possibly excluding oral route) to nicotine can cause ΔFosB overexpression in the nucleus accumbens, resulting in nicotine addiction.[105][106]
Cancer
[edit]This section needs more reliable medical references for verification or relies too heavily on primary sources, specifically: the second paragraph of this section includes citations to primary medical sources; these need to be replaced with reviews like this one. (January 2019) |  |
Contrary to popular belief, nicotine itself does not cause cancer in humans,[40][108] although it is unclear whether it functions as a tumor promoter as of 2012[update].[109] A 2018 report by the US National Academies of Sciences, Engineering, and Medicine concludes, "[w]hile it is biologically plausible that nicotine can act as a tumor promoter, the existing body of evidence indicates this is unlikely to translate into increased risk of human cancer."[110]
Low levels of nicotine stimulate cell proliferation,[111] while high levels are cytotoxic.[77] Nicotine increases cholinergic signaling and adrenergic signaling in colon cancer cells,[112] thereby impeding apoptosis (programmed cell death), promoting tumor growth, and activating growth factors and cellular mitogenic factors such as 5-lipoxygenase (5-LOX), and epidermal growth factor (EGF). Nicotine also promotes cancer growth by stimulating angiogenesis and neovascularization.[113][114] Nicotine promotes lung cancer development and accelerates its proliferation, angiogenesis, migration, invasion and epithelial–mesenchymal transition (EMT), via its influence on nAChRs receptors, whose presence has been confirmed in lung cancer cells.[115] In cancer cells, nicotine promotes the epithelial–mesenchymal transition which makes the cancer cells more resistant to drugs that treat cancer.[116]
Nicotine in tobacco can form carcinogenic tobacco-specific nitrosamines through a nitrosation reaction. This occurs mostly in the curing and processing of tobacco. However, nicotine in the mouth and stomach can react to form N-nitrosonornicotine,[117] a known type 1 carcinogen,[118] suggesting that consumption of non-tobacco forms of nicotine may still play a role in carcinogenesis.[119]
Genotoxicity
[edit]Nicotine causes DNA damage in several types of human cells as judged by assays for genotoxicity such as the comet assay, cytokinesis-block micronucleus test and chromosome aberrations test. In humans, this damage can happen in primary parotid gland cells,[120] lymphocytes,[121] and respiratory tract cells.[122]
Pregnancy and breastfeeding
[edit]Nicotine has been shown to produce birth defects in some animal species, but not others;[43] consequently, it is considered to be a possible teratogen in humans.[43] In animal studies that resulted in birth defects, researchers found that nicotine negatively affects fetal brain development and pregnancy outcomes;[43][41] the negative effects on early brain development are associated with abnormalities in brain metabolism and neurotransmitter system function.[123] Nicotine crosses the placenta and is found in the breast milk of mothers who smoke as well as mothers who inhale passive smoke.[124]
Nicotine exposure in utero is responsible for several complications of pregnancy and birth: pregnant women who smoke are at greater risk for both miscarriage and stillbirth and infants exposed to nicotine in utero tend to have lower birth weights.[125] A McMaster University research group observed in 2010 that rats exposed to nicotine in the womb (via parenteral infusion) later in life had conditions including type 2 diabetes, obesity, hypertension, neurobehavioral defects, respiratory dysfunction, and infertility.[126]
Overdose
[edit]It is unlikely that a person would overdose on nicotine through smoking alone. The US Food and Drug Administration (FDA) stated in 2013 that there are no significant safety concerns associated with the use of more than one form of over-the-counter (OTC) nicotine replacement therapy at the same time, or using OTC NRT at the same time as another nicotine-containing product, like cigarettes.[127] The median lethal dose of nicotine in humans is unknown.[44][29] Nevertheless, nicotine has a relatively high toxicity in comparison to many other alkaloids such as caffeine, which has an LD50 of 127 mg/kg when administered to mice.[128] At sufficiently high doses, it is associated with nicotine poisoning,[41] which, while common in children (in whom poisonous and lethal levels occur at lower doses per kilogram of body weight[38]) rarely results in significant morbidity or death.[43] The estimated lower dose limit for fatal outcomes is 500–1,000 mg of ingested nicotine for an adult (6.5–13 mg/kg).[27][29]
The initial symptoms of a nicotine overdose typically include nausea, vomiting, diarrhea, hypersalivation, abdominal pain, tachycardia (rapid heart rate), hypertension (high blood pressure), tachypnea (rapid breathing), headache, dizziness, pallor (pale skin), auditory or visual disturbances, and perspiration, followed shortly after by marked bradycardia (slow heart rate), bradypnea (slow breathing), and hypotension (low blood pressure).[43] An increased respiratory rate (i.e., tachypnea) is one of the primary signs of nicotine poisoning.[43] At sufficiently high doses, somnolence (sleepiness or drowsiness), confusion, syncope (loss of consciousness from fainting), shortness of breath, marked weakness, seizures, and coma may occur.[8][43] Lethal nicotine poisoning rapidly produces seizures, and death – which may occur within minutes – is believed to be due to respiratory paralysis.[43]
Toxicity
[edit]Today nicotine is less commonly used in agricultural insecticides, which was a main source of poisoning. More recent cases of poisoning typically appear to be in the form of Green Tobacco Sickness (GTS),[43] accidental ingestion of tobacco or tobacco products, or ingestion of nicotine-containing plants.[129][130][131] People who harvest or cultivate tobacco may experience GTS, a type of nicotine poisoning caused by dermal exposure to wet tobacco leaves. This occurs most commonly in young, inexperienced tobacco harvesters who do not consume tobacco.[129][132] People can be exposed to nicotine in the workplace by breathing it in, skin absorption, swallowing it, or eye contact. The Occupational Safety and Health Administration (OSHA) has set the legal limit (permissible exposure limit) for nicotine exposure in the workplace as 0.5 mg/m3 skin exposure over an 8-hour workday. The US National Institute for Occupational Safety and Health (NIOSH) has set a recommended exposure limit (REL) of 0.5 mg/m3 skin exposure over an 8-hour workday. At environmental levels of 5 mg/m3, nicotine is immediately dangerous to life and health.[133]
Drug interactions
[edit]Pharmacodynamic
[edit]- Potential interaction with sympathomimetic drugs (adrenergic agonists) and sympatholytic drugs (alpha-blockers and beta-blockers).[78]
Pharmacokinetic
[edit]Nicotine and cigarette smoke both induce the expression of liver enzymes (e.g., certain cytochrome P450 proteins) which metabolize drugs, leading to the potential for alterations in drug metabolism.[78]
- Smoking cessation may decrease the metabolism of acetaminophen, beta-blockers, caffeine, oxazepam, pentazocine, propoxyphene, theophylline, and tricyclic antidepressants, leading to higher plasma concentrations of these drugs.[78]
- Possible alteration of nicotine absorption through the skin from the transdermal nicotine patch by drugs that cause vasodilation or vasoconstriction.[78]
- Possible alteration of nicotine absorption through the nasal cavity from the nicotine nasal spray by nasal vasoconstrictors (e.g., xylometazoline).[78]
- Possible alteration of nicotine absorption through oral mucosa from nicotine gum and lozenges by food and drink that modify salivary pH.[78]
Pharmacology
[edit]Pharmacodynamics
[edit]Nicotine acts as a receptor agonist at most nicotinic acetylcholine receptors (nAChRs),[13][14] except at two nicotinic receptor subunits (nAChRα9 and nAChRα10) where it acts as a receptor antagonist.[13] Such antagonism results in mild analgesia.
Central nervous system
[edit]
By binding to nicotinic acetylcholine receptors in the brain, nicotine elicits its psychoactive effects and increases the levels of several neurotransmitters in various brain structures – acting as a sort of "volume control".[134][135] Nicotine has a higher affinity for nicotinic receptors in the brain than those in skeletal muscle, though at toxic doses it can induce contractions and respiratory paralysis.[136] Nicotine's selectivity is thought to be due to a particular amino acid difference on these receptor subtypes.[137] Nicotine is unusual in comparison to most drugs, as its profile changes from stimulant to sedative with increasing dosages, a phenomenon known as "Nesbitt's paradox" after the doctor who first described it in 1969.[138][139] At very high doses it dampens neuronal activity.[140] Nicotine induces both behavioral stimulation and anxiety in animals.[8] Research into nicotine's most predominant metabolite, cotinine, suggests that some of nicotine's psychoactive effects are mediated by cotinine.[141]
Nicotine activates nicotinic receptors (particularly α4β2 nicotinic receptors, but also α5 nAChRs) on neurons that innervate the ventral tegmental area and within the mesolimbic pathway where it appears to cause the release of dopamine.[142][143] This nicotine-induced dopamine release occurs at least partially through activation of the cholinergic–dopaminergic reward link in the ventral tegmental area.[143][144] Nicotine can modulate the firing rate of the ventral tegmental area neurons.[144] These actions are largely responsible for the strongly reinforcing effects of nicotine, which often occur in the absence of euphoria;[142] however, mild euphoria from nicotine use can occur in some individuals.[142] Chronic nicotine use inhibits class I and II histone deacetylases in the striatum, where this effect plays a role in nicotine addiction.[145][146]
Sympathetic nervous system
[edit]
Nicotine also activates the sympathetic nervous system,[147] acting via splanchnic nerves to the adrenal medulla, stimulating the release of epinephrine. Acetylcholine released by preganglionic sympathetic fibers of these nerves acts on nicotinic acetylcholine receptors, causing the release of epinephrine (and norepinephrine) into the bloodstream.
Adrenal medulla
[edit]By binding to ganglion type nicotinic receptors in the adrenal medulla, nicotine increases flow of adrenaline (epinephrine), a stimulating hormone and neurotransmitter. By binding to the receptors, it causes cell depolarization and an influx of calcium through voltage-gated calcium channels. Calcium triggers the exocytosis of chromaffin granules and thus the release of epinephrine (and norepinephrine) into the bloodstream. The release of epinephrine (adrenaline) causes an increase in heart rate, blood pressure and respiration, as well as higher blood glucose levels.[148]
Pharmacokinetics
[edit]
As nicotine enters the body, it is distributed quickly through the bloodstream and crosses the blood–brain barrier reaching the brain within 10–20 seconds after inhalation.[150] The elimination half-life of nicotine in the body is around two hours.[151][152] Nicotine is primarily excreted in urine and urinary concentrations vary depending upon urine flow rate and urine pH.[8]
The amount of nicotine absorbed by the body from smoking can depend on many factors, including the types of tobacco, whether the smoke is inhaled, and whether a filter is used. However, it has been found that the nicotine yield of individual products has only a small effect (4.4%) on the blood concentration of nicotine,[153] suggesting "the assumed health advantage of switching to lower-tar and lower-nicotine cigarettes may be largely offset by the tendency of smokers to compensate by increasing inhalation".
Nicotine has a half-life of 1–2 hours. Cotinine is an active metabolite of nicotine that remains in the blood with a half-life of 18–20 hours, making it easier to analyze.[154]
Nicotine is metabolized in the liver by cytochrome P450 enzymes (mostly CYP2A6, and also by CYP2B6) and FMO3, which selectively metabolizes (S)-nicotine. A major metabolite is cotinine. Other primary metabolites include nicotine N-oxide, nornicotine, nicotine isomethonium ion, 2-hydroxynicotine and nicotine glucuronide.[155] Under some conditions, other substances may be formed such as myosmine.[156][157]
Glucuronidation and oxidative metabolism of nicotine to cotinine are both inhibited by menthol, an additive to mentholated cigarettes, thus increasing the half-life of nicotine in vivo.[158]
Metabolism
[edit]Nicotine decreases hunger and as a consequence food consumption, alongside increasing energy expenditure.[159][160] The majority of research shows that nicotine reduces body weight, but some researchers have found that nicotine may result in weight gain under specific types of eating habits in animal models.[160] Nicotine effect on weight appears to result from nicotine's stimulation of α3β4 nAChR receptors located in the POMC neurons in the arcuate nucleus and subsequently the melanocortin system, especially the melanocortin-4 receptors on second-order neurons in the paraventricular nucleus of the hypothalamus, thus modulating feeding inhibition.[144][160] POMC neurons are a precursor of the melanocortin system, a critical regulator of body weight and peripheral tissue such as skin and hair.[160]
Chemistry
[edit]| NFPA 704 safety square | |
|---|---|
The fire diamond hazard sign for nicotine[161] |
Nicotine is a hygroscopic, colorless to yellow-brown, oily liquid, that is readily soluble in alcohol, ether or light petroleum. It is miscible with water in its neutral amine base form between 60 °C and 210 °C. It is a dibasic nitrogenous base, having Kb1=1×10−6, Kb2=1×10−11.[162] It readily forms ammonium salts with acids that are usually solid and water-soluble. Its flash point is 95 °C and its auto-ignition temperature is 244 °C.[163] Nicotine is readily volatile (vapor pressure 5.5 Pa at 25 °C)[162] On exposure to ultraviolet light or various oxidizing agents, nicotine is converted to nicotine oxide, nicotinic acid (niacin, vitamin B3), and methylamine.[164]
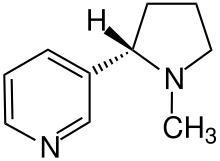
Nicotine is chiral and hence optically active, having two enantiomeric forms. The naturally occurring form of nicotine is levorotatory with a specific rotation of [α]D=–166.4° ((−)-nicotine). The dextrorotatory form, (+)-nicotine is physiologically less active than (−)-nicotine. (−)-nicotine is more toxic than (+)-nicotine.[165] The salts of (−)-nicotine are usually dextrorotatory; this conversion between levorotatory and dextrorotatory upon protonation is common among alkaloids.[164] The hydrochloride and sulfate salts become optically inactive if heated in a closed vessel above 180 °C.[164] Anabasine is a structural isomer of nicotine, as both compounds have the molecular formula C10H14N2.
Nicotine that is found in natural tobacco is primarily (99%) the S-enantiomer.[166] Conversely, the most common chemistry synthetic methods for generating nicotine yields a product that is approximately equal proportions of the S- and R-enantiomers.[167] This suggests that tobacco-derived and synthetic nicotine can be determined by measuring the ratio of the two different enantiomers, although means exist for adjusting the relative levels of the enantiomers or performing a synthesis that only leads to the S-enantiomer. There is limited data on the relative physiological effects of these two enantiomers, especially in people. However, the studies to date indicate that (S)-nicotine is more potent than (R)-nicotine and (S)-nicotine causes stronger sensations or irritation than (R)-nicotine. Studies have not been adequate to determine the relative addictiveness of the two enantiomers in people.
Pod mod electronic cigarettes use nicotine in the form of a protonated nicotine, rather than free-base nicotine found in earlier generations.[168]
Preparation
[edit]The first laboratory preparation of nicotine (as its racemate) was described in 1904.[169]
The starting material was an N-substituted pyrrole derivative, which was heated to convert it by a [1,5] sigmatropic shift to the isomer with a carbon bond between the pyrrole and pyridine rings, followed by methylation and selective reduction of the pyrrole ring using tin and hydrochloric acid.[169][170] Many other syntheses of nicotine, in both racemic and chiral forms have since been published.[171]
Biosynthesis
[edit]
The biosynthetic pathway of nicotine involves a coupling reaction between the two cyclic structures that comprise nicotine. Metabolic studies show that the pyridine ring of nicotine is derived from niacin (nicotinic acid) while the pyrrolidine is derived from N-methyl-Δ1-pyrrollidium cation.[172][173] Biosynthesis of the two component structures proceeds via two independent syntheses, the NAD pathway for niacin and the tropane pathway for N-methyl-Δ1-pyrrollidium cation.
The NAD pathway in the genus Nicotiana begins with the oxidation of aspartic acid into α-amino succinate by aspartate oxidase (AO). This is followed by a condensation with glyceraldehyde-3-phosphate and a cyclization catalyzed by quinolinate synthase (QS) to give quinolinic acid. Quinolinic acid then reacts with phosphoribosyl pyrophosphate catalyzed by quinolinic acid phosphoribosyl transferase (QPT) to form niacin mononucleotide (NaMN). The reaction now proceeds via the NAD salvage cycle to produce niacin via the conversion of nicotinamide by the enzyme nicotinamidase.[citation needed]
The N-methyl-Δ1-pyrrollidium cation used in the synthesis of nicotine is an intermediate in the synthesis of tropane-derived alkaloids. Biosynthesis begins with decarboxylation of ornithine by ornithine decarboxylase (ODC) to produce putrescine. Putrescine is then converted into N-methyl putrescine via methylation by SAM catalyzed by putrescine N-methyltransferase (PMT). N-methyl putrescine then undergoes deamination into 4-methylaminobutanal by the N-methyl putrescine oxidase (MPO) enzyme, 4-methylaminobutanal then spontaneously cyclize into N-methyl-Δ1-pyrrollidium cation.[citation needed]
The final step in the synthesis of nicotine is the coupling between N-methyl-Δ1-pyrrollidium cation and niacin. Although studies conclude some form of coupling between the two component structures, the definite process and mechanism remains undetermined. The current agreed theory involves the conversion of niacin into 2,5-dihydropyridine through 3,6-dihydronicotinic acid. The 2,5-dihydropyridine intermediate would then react with N-methyl-Δ1-pyrrollidium cation to form enantiomerically pure (−)-nicotine.[174]
Detection in body fluids
[edit]Nicotine can be quantified in blood, plasma, or urine to confirm a diagnosis of poisoning or to facilitate a medicolegal death investigation. Urinary or salivary cotinine concentrations are frequently measured for the purposes of pre-employment and health insurance medical screening programs. Careful interpretation of results is important, since passive exposure to cigarette smoke can result in significant accumulation of nicotine, followed by the appearance of its metabolites in various body fluids.[175][176] Nicotine use is not regulated in competitive sports programs.[177]
Methods for analysis of enantiomers
[edit]Methods for measuring the two enantiomers are straightforward and include normal-phase liquid chromatography,[166] liquid chromatography with a chiral column.[178] However, since methods can be used to alter the two enantiomers, it may not be possible to distinguish tobacco-derived from synthetic nicotine simply by measuring the levels of the two enantiomers. A new approach uses hydrogen and deuterium nuclear magnetic resonance to distinguish tobacco-derived and synthetic nicotine based on differences the substrates used in the natural synthetic pathway performed in the tobacco plant and the substrates most used in synthesis.[179] Another approach measures the carbon-14 content which also differs between natural and laboratory-based tobacco.[180] These methods remain to be fully evaluated and validated using a wide range of samples.
Natural occurrence
[edit]Nicotine is a secondary metabolite produced in a variety of plants in the family Solanaceae, most notably in tobacco Nicotiana tabacum, where it can be found at high concentrations of 0.5 to 7.5%.[181] Nicotine is also found in the leaves of other tobacco species, such as Nicotiana rustica (in amounts of 2–14%). Nicotine production is strongly induced in response to wounding as part of a jasmonate-dependent reaction.[182] Specialist insects on tobacco, such as the tobacco hornworm (Manduca sexta), have a number of adaptations to the detoxification and even adaptive re-purposing of nicotine.[183] Nicotine is also found at low concentrations in the nectar of tobacco plants, where it may promote outcrossing by affecting the behavior of hummingbird pollinators.[184]
Nicotine occurs in smaller amounts (varying from 2–7 μg/kg, or 20–70 millionths of a percent wet weight[17]) in other Solanaceaeous plants, including some crop species such as potatoes, tomatoes, eggplant, and peppers,[17][185] as well as non-crop species such as Duboisia hopwoodii.[162] The amounts of nicotine in tomatoes lowers substantially as the fruit ripens.[17] A 1999 report found "In some papers it is suggested that the contribution of dietary nicotine intake is significant when compared with exposure to ETS [environmental tobacco smoke] or by active smoking of small numbers of cigarettes. Others consider the dietary intake to be negligible unless inordinately large amounts of specific vegetables are consumed."[17] The amount of nicotine eaten per day is roughly around 1.4 and 2.25 μg/day at the 95th percentile.[17] These numbers may be low due to insufficient food intake data.[17] The concentrations of nicotine in vegetables are difficult to measure accurately, since they are very low (parts per billion range).[186]
History, society and culture
[edit]
Nicotine was originally isolated from the tobacco plant in 1828 by chemists Wilhelm Heinrich Posselt and Karl Ludwig Reimann from Germany, who believed it was a poison.[187][188] Its chemical empirical formula was described by Melsens in 1843,[189] its structure was discovered by Adolf Pinner and Richard Wolffenstein in 1893,[190][191][192][clarification needed] and it was first synthesized by Amé Pictet and A. Rotschy in 1904.[169][193]
Nicotine is named after the tobacco plant Nicotiana tabacum, which in turn is named after the French ambassador in Portugal, Jean Nicot de Villemain, who sent tobacco and seeds to Paris in 1560, presented to the French King,[194] and who promoted their medicinal use. Smoking was believed to protect against illness, particularly the plague.[194]
Tobacco was introduced to Europe in 1559, and by the late 17th century, it was used not only for smoking but also as an insecticide. After World War II, over 2,500 tons of nicotine insecticide were used worldwide, but by the 1980s the use of nicotine insecticide had declined below 200 tons. This was due to the availability of other insecticides that are cheaper and less harmful to mammals.[19]
The nicotine content of popular American-brand cigarettes has increased over time, and one study found that there was an average increase of 1.78% per year between the years of 1998 and 2005.[195]
Although methods of production of synthetic nicotine have existed for decades,[196] it was believed that the cost of making nicotine by laboratory synthesis was cost prohibitive compared to extracting nicotine from tobacco.[197] However, recently synthetic nicotine started to be found in different brands of e-cigarettes and oral pouches and marketed as "tobacco-free."[198]
The US FDA is tasked with reviewing tobacco products such as e-cigarettes and determining which can be authorized for sale. In response to the likelihood that FDA would not authorize many e-cigarettes to be marketed, e-cigarette companies began marketing products that they claimed to contain nicotine that were not made or derived from tobacco, but contained synthetic nicotine instead, and thus, would be outside FDA's tobacco regulatory authority.[199] Similarly, nicotine pouches that claimed to contain non-tobacco (synthetic) nicotine were also introduced. The cost of synthetic nicotine has decreased as the market for the product increased. In March 2022, the U.S. Congress passed a law (the Consolidated Appropriations Act, 2022) that expanded FDA's tobacco regulatory authority to include tobacco products containing nicotine from any source, thereby including products made with synthetic nicotine.
Legal status
[edit]В Соединенных Штатах никотиновые продукты и продукты никотинзаместительной терапии, такие как Никотрол, доступны только людям от 18 лет и старше; требуется подтверждение возраста; не для продажи в торговых автоматах или из любого источника, где невозможно подтвердить возраст. По состоянию на 2019 год минимальный возраст для покупки табака в США на федеральном уровне составляет 21 год. [200]
В Европейском Союзе минимальный возраст для покупки никотиновых продуктов составляет 18 лет. Однако минимального возраста для употребления табака или никотиновых продуктов не существует. [201]
В Соединенном Королевстве Постановления о табачных изделиях и сопутствующих продуктах 2016 года реализуют Европейскую директиву 2014/40/EU с поправками, внесенными Положениями о табачных изделиях и никотиновых продуктах для ингаляции (поправка и т. д.) (Выход из ЕС) 2019 года, а также Положениями о табачных изделиях и никотиновых продуктах для ингаляции ( Поправка) Регламент о выходе из ЕС 2020 г. Кроме того, другие правила ограничивают рекламу, продажу и демонстрацию табачных изделий и других продуктов, содержащих никотин, для потребления человеком. Правительство Сунака предложило запретить одноразовые вейпы, чтобы ограничить их привлекательность и доступность для детей.
В СМИ
[ редактировать ]| Внешний образ | |
|---|---|
В некоторой антитабачной литературе вред, наносимый табакокурением и никотиновой зависимостью, персонифицируется как Ник О'Тин , представленный в виде гуманоида с каким-либо аспектом сигареты или окурка вокруг него или его одежды и шляпы. [202] Ник О'Тин был злодеем, созданным для Совета по санитарному просвещению . Персонаж был показан в трех анимационных рекламных роликах, посвященных борьбе с курением , в которых он пытается привить детям зависимость от сигарет, прежде чем ему помешал DC Comics персонаж Супермен . [202]
Никотин часто сравнивали с кофеином в рекламе табачной промышленности в 1980-х годах, а позже, в 2010-х годах, в индустрии электронных сигарет, чтобы уменьшить стигматизацию и общественное восприятие рисков, связанных с употреблением никотина. [203]
Исследовать
[ редактировать ]Центральная нервная система
[ редактировать ]В то время как острый/начальный прием никотина вызывает активацию нейрональных никотиновых рецепторов, хроническое употребление низких доз никотина приводит к десенсибилизации этих рецепторов (из-за развития толерантности) и приводит к антидепрессивному эффекту. Ранние исследования показали, что никотиновые пластыри с низкими дозами могут быть полезны. эффективное лечение большого депрессивного расстройства у некурящих. [204]
Хотя курение табака связано с повышенным риском болезни Альцгеймера , [205] есть доказательства того, что никотин сам по себе может предотвращать и лечить болезнь Альцгеймера. [206]
Курение связано со снижением риска болезни Паркинсона; однако неизвестно, связано ли это с тем, что люди с более здоровыми дофаминергическими центрами вознаграждения в мозге (область мозга, пораженная болезнью Паркинсона) с большей вероятностью получают удовольствие от курения и, таким образом, приобретают привычку, никотин непосредственно действует как нейропротекторный агент, или другие причины соединения сигаретного дыма, действующие как нейропротекторы. [207]
Иммунная система
[ редактировать ]Иммунные клетки как врожденной иммунной системы , так и адаптивной иммунной системы часто экспрессируют субъединицы α2 , α5 , α6 , α7 , α9 и α10 никотиновых рецепторов ацетилхолина . [208] Данные свидетельствуют о том, что никотиновые рецепторы, содержащие эти субъединицы, участвуют в регуляции иммунной функции . [208]
Оптофармакология
[ редактировать ]форма фотоактивируемая никотина, которая высвобождает никотин при воздействии ультрафиолета при определенных условиях. Для изучения никотиновых ацетилхолиновых рецепторов в тканях головного мозга была разработана [209]
Здоровье полости рта
[ редактировать ]В нескольких исследованиях in vitro изучалось потенциальное воздействие никотина на ряд клеток полости рта. Недавний систематический обзор показал, что никотин вряд ли будет цитотоксичен для клеток полости рта in vitro в большинстве физиологических состояний, но необходимы дальнейшие исследования. [210] Понимание потенциальной роли никотина в здоровье полости рта становится все более важным, учитывая недавнее появление новых никотиновых продуктов и их потенциальную роль в помощи курильщикам бросить курить. [211]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Маклафлин И., Дэни Дж. А., Де Биаси М. (2015). «Никотиновая абстиненция». Нейрофармакология никотиновой зависимости . Актуальные темы поведенческой нейронауки. Том. 24. С. 99–123. дои : 10.1007/978-3-319-13482-6_4 . ISBN 978-3-319-13481-9 . ПМК 4542051 . ПМИД 25638335 .
- ^ Перейти обратно: а б с Д'Суза М.С., Марку А. (июль 2011 г.). «Нейрональные механизмы, лежащие в основе развития никотиновой зависимости: значение новых методов лечения отказа от курения» . Наука о зависимостях и клиническая практика . 6 (1): 4–16. ПМК 3188825 . ПМИД 22003417 .
Симптомы абстиненции после прекращения потребления никотина: Хроническое употребление никотина вызывает нейроадаптацию в системе вознаграждения мозга, что приводит к развитию никотиновой зависимости. Таким образом, никотинзависимые курильщики должны продолжать прием никотина, чтобы избежать соматических и аффективных симптомов абстиненции. У впервые воздержавшихся от курения наблюдаются такие симптомы, как депрессивное настроение, тревога, раздражительность, трудности с концентрацией внимания, тяга к курению, брадикардия, бессонница, желудочно-кишечный дискомфорт и увеличение веса (Shiffman and Jarvik, 1976; Hughes et al., 1991). У экспериментальных животных, таких как крысы и мыши, наблюдается синдром отмены никотина, который, как и синдром человека, включает как соматические признаки, так и негативное аффективное состояние (Watkins et al., 2000; Malin et al., 2006). К соматическим признакам отмены никотина относятся вставание на дыбы, прыжки, тряска, спазмы в животе, жевание, царапание и тремор лица. Негативное аффективное состояние отмены никотина характеризуется снижением реакции на ранее приносившие вознаграждение стимулы, состояние, называемое ангедонией.
- ^ Кошки Ф., Пистелли Ф., Лаццарини Н., Карроцци Л. (2011). «Никотиновая зависимость и психологический стресс: результаты и клинические последствия отказа от курения» . Психологические исследования и управление поведением . 4 : 119–28. дои : 10.2147/prbm.s14243 . ПМК 3218785 . ПМИД 22114542 .
- ^ Холлингер М.А. (19 октября 2007 г.). Введение в фармакологию (Третье изд.). Абингдон: CRC Press. стр. 222–223. ISBN 978-1-4200-4742-4 .
- ^ «Список всех лекарств с предупреждениями о черном ящике, полученный FDA (используйте ссылки «Загрузить полные результаты» и «Просмотреть запрос»).» . nctr-crs.fda.gov . FDA . Проверено 22 октября 2023 г.
- ^ «Приказ о внесении поправок 2001 года в лекарственные средства (продукты, кроме ветеринарных препаратов) (общий список продажи)» . законодательство.gov.uk . Проверено 2 августа 2022 г.
- ^ Перейти обратно: а б Никотин . База данных соединений PubChem. Национальная медицинская библиотека США – Национальный центр биотехнологической информации. 16 февраля 2019 года . Проверено 3 августа 2024 г.
- ^ Перейти обратно: а б с д Ландони Дж.Х. «Никотин (ПИМ)» . ИНЧЕМ . Международная программа по химической безопасности . Проверено 29 января 2019 г.
- ^ Фагерстрем К. (декабрь 2014 г.). «Никотин: фармакология, токсичность и терапевтическое применение» . Журнал отказа от курения . 9 (2): 53–59. дои : 10.1017/jsc.2014.27 .
- ^ Саджа Р.К., Рахман С., Кукулло Л. (март 2016 г.). «Злоупотребление наркотиками и эндотелиальная дисфункция гематоэнцефалического барьера: акцент на роли окислительного стресса» . Журнал церебрального кровотока и метаболизма . 36 (3): 539–54. дои : 10.1177/0271678X15616978 . ПМЦ 4794105 . ПМИД 26661236 .
- ^ «Никотин: Клинические данные» . Руководство IUPHAR/BPS по фармакологии . Международный союз фундаментальной и клинической фармакологии . Проверено 3 августа 2024 г.
Используется в качестве вспомогательного средства при отказе от курения и для облегчения симптомов отмены никотина.
- ^ Абу-Дония М (5 февраля 2015 г.). Токсикология млекопитающих . Джон Уайли и сыновья. стр. 587–. ISBN 978-1-118-68285-2 .
- ^ Перейти обратно: а б с д «Никотиновые ацетилхолиновые рецепторы: Введение» . База данных ИЮФАР . Международный союз фундаментальной и клинической фармакологии. Архивировано из оригинала 29 июня 2017 года . Проверено 1 сентября 2014 г.
- ^ Перейти обратно: а б Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). «Глава 9: Автономная нервная система». В Сидоре А., Брауне Р.Ю. (ред.). Молекулярная нейрофармакология: фонд клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. п. 234. ИСБН 978-0-07-148127-4 .
Никотин... является природным алкалоидом табачного растения. Лобелин – природный алкалоид индийского табака. Оба препарата являются агонистами никотиновых холинорецепторов...
- ^ Кишиока С., Кигучи Н., Кобаяши Ю., Сайка Ф. (2014). «Эффекты никотина и эндогенная опиоидная система» . Журнал фармакологических наук . 125 (2): 117–24. doi : 10.1254/jphs.14R03CP . ПМИД 24882143 .
- ^ «Монография № 9 по борьбе с курением и табакокурением» (PDF) . Архивировано (PDF) из оригинала 9 октября 2022 года . Проверено 19 декабря 2012 г.
- ^ Перейти обратно: а б с д и ж г час Зигмунд Б., Лейтнер Э., Пфаннхаузер В. (август 1999 г.). «Определение содержания никотина в различных съедобных пасленовых (Solanaceae) и продуктах из них и оценка связанного с ними потребления никотина с пищей». Журнал сельскохозяйственной и пищевой химии . 47 (8): 3113–20. дои : 10.1021/jf990089w . ПМИД 10552617 .
- ^ Родгман А., Перфетти Т.А. (2009). Химические компоненты табака и табачного дыма . Бока-Ратон, Флорида: CRC Press. ISBN 978-1-4200-7883-1 . LCCN 2008018913 . [ нужна страница ]
- ^ Перейти обратно: а б с Уйвари I (1999). «Никотин и другие инсектицидные алкалоиды». В Ямамото I, Касида Дж (ред.). Никотиноидные инсектициды и никотиновый рецептор ацетилхолина . Токио: Springer-Verlag. стр. 29–69.
- ^ Перкинс К.А., Карелиц Дж.Л. (август 2013 г.). «Усиление эффекта никотина посредством курения» . Психофармакология . 228 (3): 479–86. дои : 10.1007/s00213-013-3054-4 . ПМК 3707934 . ПМИД 23494236 .
- ^ Перейти обратно: а б Грана Р., Беновиц Н., Гланц С.А. (май 2014 г.). «Электронные сигареты: научный обзор» . Тираж . 129 (19): 1972–86. дои : 10.1161/circulationaha.114.007667 . ПМК 4018182 . ПМИД 24821826 .
- ^ Перейти обратно: а б с Сикейра LM (январь 2017 г.). «Никотин и табак как вещества, вызывающие злоупотребление детьми и подростками» . Педиатрия . 139 (1): e20163436. дои : 10.1542/пед.2016-3436 . ПМИД 27994114 .
- ^ Эттер Дж. Ф. (июль 2007 г.). «Пристрастие к никотиновой жевательной резинке у никогда не куривших» . BMC Общественное здравоохранение . 7 :159. дои : 10.1186/1471-2458-7-159 . ЧВК 1939993 . ПМИД 17640334 .
- ^ Олауссон П., Йентч Дж.Д., Тейлор Дж.Р. (январь 2004 г.). «Никотин усиливает реакцию с помощью условного подкрепления». Психофармакология . 171 (2): 173–178. дои : 10.1007/s00213-003-1575-y . ПМИД 13680077 . S2CID 11855403 .
- ^ Перейти обратно: а б «Обзор фактических данных по электронным сигаретам и нагретым табачным изделиям» (PDF) . Общественное здравоохранение Англии . 2018.
- ^ «Табак вызывает большее привыкание, чем никотин» . Архивировано из оригинала 20 апреля 2023 года.
- ^ Перейти обратно: а б с д и Королевский колледж врачей (28 апреля 2016 г.). «Никотин без дыма: снижение вреда от табака» . Проверено 16 сентября 2020 г.
- ^ Перейти обратно: а б Смит Т.Т., Рупрехт Л.Е., Квалина С.Н., Онимус М.Дж., Мерфи С.Е., Донни Э.К. и др. (август 2016 г.). «Влияние ингибирования моноаминоксидазы на усиливающие свойства низких доз никотина» . Нейропсихофармакология . 41 (9): 2335–2343. дои : 10.1038/нпп.2016.36 . ПМК 4946064 . ПМИД 26955970 .
- ^ Перейти обратно: а б с д Майер Б. (январь 2014 г.). «Сколько никотина убивает человека? Прослеживая общепринятую смертельную дозу до сомнительных экспериментов над собой в девятнадцатом веке» . Архив токсикологии . 88 (1): 5–7. дои : 10.1007/s00204-013-1127-0 . ПМЦ 3880486 . ПМИД 24091634 .
- ^ Капоннетто П., Кампанья Д., Папале Дж., Руссо К., Полоса Р. (февраль 2012 г.). «Новый феномен электронных сигарет». Экспертное обозрение респираторной медицины . 6 (1): 63–74. дои : 10.1586/ers.11.92 . ПМИД 22283580 . S2CID 207223131 .
- ^ Джайн Р., Мукерджи К., Балхара Ю.П. (апрель 2008 г.). «Роль антагонистов рецепторов NMDA в толерантности к никотину, сенсибилизации и физической зависимости: доклинический обзор» . Медицинский журнал Йонсей . 49 (2): 175–88. дои : 10.3349/ymj.2008.49.2.175 . ПМЦ 2615322 . ПМИД 18452252 .
- ^ Миясато К. (март 2013 г.). «[Психиатрические и психологические особенности никотиновой зависимости]». Нихон Ринсё. Японский журнал клинической медицины . 71 (3): 477–81. ПМИД 23631239 .
- ^ Перейти обратно: а б с Пэрротт AC (июль 2015 г.). «Почему все стимулирующие препараты вредны для рекреационных потребителей: эмпирический обзор и психобиологическое объяснение». Психофармакология человека . 30 (4): 213–24. дои : 10.1002/hup.2468 . ПМИД 26216554 . S2CID 7408200 .
- ^ Пэрротт AC (март 2006 г.). «Никотиновая психобиология: как проспективные исследования хронических доз могут пролить свет на некоторые теоретические проблемы исследований острых доз» (PDF) . Психофармакология . 184 (3–4): 567–76. дои : 10.1007/s00213-005-0294-y . ПМИД 16463194 . S2CID 11356233 .
- ^ Перейти обратно: а б с д и ж г Пэрротт AC (апрель 2003 г.). «Никотин, полученный из сигарет, не является лекарством». Всемирный журнал биологической психиатрии . 4 (2): 49–55. дои : 10.3109/15622970309167951 . ПМИД 12692774 . S2CID 26903942 .
- ^ Шрауфнагель Д.Э., Блази Ф., Драммонд М.Б., Лам Д.К., Латиф Э., Розен М.Дж. и др. (сентябрь 2014 г.). «Электронные сигареты. Заявление о позиции форума международных респираторных обществ» . Американский журнал респираторной медицины и медицины интенсивной терапии . 190 (6): 611–8. doi : 10.1164/rccm.201407-1198PP . ПМИД 25006874 . S2CID 43763340 .
- ^ «Употребление электронных сигарет среди молодежи и молодых людей. Отчет главного хирурга за 2016 год.lts» (PDF) . Surgerygeneral.gov . Архивировано (PDF) из оригинала 9 октября 2022 года.
- ^ Перейти обратно: а б с Шрауфнагель Д.Е. (март 2015 г.). «Электронные сигареты: уязвимость молодежи» . Детская аллергия, иммунология и пульмонология . 28 (1): 2–6. дои : 10.1089/пед.2015.0490 . ПМЦ 4359356 . ПМИД 25830075 .
- ^ Рабочая группа IARC по оценке канцерогенных рисков для человека. Личные привычки и возгорания в помещении. Лион (Франция): Международное агентство по исследованию рака; 2012. (Монографии МАИР по оценке канцерогенных рисков для человека, № 100E.) КУРЕНИЕ ТАБАКА. Доступно по адресу: https://www.ncbi.nlm.nih.gov/books/NBK304395/.
- ^ Перейти обратно: а б «Вызывает ли никотин рак?» . Европейский кодекс борьбы с раком . Всемирная организация здравоохранения – Международное агентство по изучению рака . Проверено 23 января 2019 г.
- ^ Перейти обратно: а б с д и Управление по охране здоровья от курения Национального центра профилактики хронических заболеваний (США) (2014 г.). Последствия курения для здоровья — 50 лет прогресса: доклад главного хирурга, глава 5 — Никотин . Главный хирург США . стр. 107–138. ПМИД 24455788 .
- ^ Кольмайер К.А. (июнь 2015 г.). «Никотин во время беременности: изменения, вызванные нейротрансмиссией, которые могут повысить склонность к наркозависимости и вызвать неадаптивный контроль внимания». Журнал истоков развития здоровья и болезней . 6 (3): 169–81. дои : 10.1017/S2040174414000531 . ПМИД 25385318 . S2CID 29298949 .
- ^ Перейти обратно: а б с д и ж г час я дж «Никотин» . Национальная медицинская библиотека США – Сеть токсикологических данных . Банк данных об опасных веществах. 20 августа 2009 г.
- ^ Перейти обратно: а б «Никотин» . Европейское химическое агентство: Комитет по оценке рисков. Сентябрь 2015 года . Проверено 23 января 2019 г.
- ^ Эффа Ф, Тайво Б, Бейнс Д, Бэйли А, Марсило Т (октябрь 2022 г.). «Легочные эффекты ароматизаторов жидкостей для электронных сигарет: систематический обзор» . Журнал токсикологии и гигиены окружающей среды, часть B: Критические обзоры . 25 (7): 343–371. Бибкод : 2022JTEHB..25..343E . дои : 10.1080/10937404.2022.2124563 . ПМК 9590402 . ПМИД 36154615 .
- ^ Лавуа Ф.В., Харрис Т.М. (1991). «Смертельное употребление никотина». Журнал неотложной медицины . 9 (3): 133–136. дои : 10.1016/0736-4679(91)90318-а . ПМИД 2050970 .
- ^ Перейти обратно: а б с д и ж г час я дж Хартманн-Бойс Дж., Чепкин С.С., Й.В., Буллен С., Ланкастер Т. (май 2018 г.). «Никотинзаместительная терапия против контроля над прекращением курения» . Кокрановская база данных систематических обзоров . 5 (5): CD000146. дои : 10.1002/14651858.CD000146.pub5 . ПМК 6353172 . ПМИД 29852054 .
Имеются убедительные доказательства того, что все лицензированные формы НЗТ (жевательная резинка, трансдермальный пластырь, назальный спрей, ингаляторы и сублингвальные таблетки/пастилки) могут помочь людям, которые пытаются бросить курить, повысить свои шансы на успешное прекращение курения. НЗТ увеличивают частоту отказа от курения на 50–60%, независимо от условий, и дальнейшие исследования вряд ли изменят нашу уверенность в оценке эффекта. Относительная эффективность НЗТ, по-видимому, в значительной степени не зависит от интенсивности дополнительной поддержки, оказываемой человеку.
Метаанализ побочных эффектов, связанных с НЗТ, включал 92 РКИ и 28 обсервационных исследований и рассматривал возможное увеличение случаев болей в груди и учащенного сердцебиения среди пользователей НЗТ по сравнению с группами плацебо (Mills 2010). Авторы сообщают об ОШ 2,06 (95% ДИ от 1,51 до 2,82) в 12 исследованиях. Мы повторили этот сбор данных и анализ там, где данные были доступны (включены и исключены) в этом обзоре, и обнаружили аналогичную, но немного более низкую оценку, OR 1,88 (95% ДИ от 1,37 до 2,57; 15 исследований; 11 074 участника; OR, а не RR). рассчитано для сравнения. Анализ 6.1). Боли в груди и учащенное сердцебиение были чрезвычайно редкими явлениями, встречавшимися с частотой 2,5% в группах НЗТ по сравнению с 1,4% в контрольных группах в 15 исследованиях, в которых о них вообще сообщалось. Недавний сетевой метаанализ сердечно-сосудистых событий, связанных с фармакотерапией для прекращения курения (Mills 2014), включающий 21 РКИ, сравнивающих НЗТ с плацебо, обнаружил статистически значимые доказательства того, что частота сердечно-сосудистых событий при приеме НЗТ была выше (ОР 2,29, 95% ДИ от 1,39 до 3,82). ). Однако, когда учитывались только серьезные неблагоприятные сердечные события (инфаркт миокарда, инсульт и сердечно-сосудистая смерть), результат не был статистически значимым (ОР 1,95 95% ДИ от 0,26 до 4,30). - ^ Теодулу А., Чепкин С.С., Й.В., Фэншоу Т.Р., Буллен С., Хартманн-Бойс Дж. и др. (июнь 2023 г.). «Различные дозы, продолжительность и способы проведения никотинзаместительной терапии для прекращения курения» . Кокрановская база данных систематических обзоров . 2023 (6): CD013308. дои : 10.1002/14651858.CD013308.pub2 . ПМЦ 10278922 . ПМИД 37335995 .
- ^ Исследование РАЗУМА. «Почему никотин?» . РАЗУМ . Проверено 6 декабря 2020 г.
- ^ Перейти обратно: а б Томизава М., Касида Дж.Э. (2005). «Токсикология неоникотиноидных инсектицидов: механизмы избирательного действия». Ежегодный обзор фармакологии и токсикологии . 45 : 247–68. doi : 10.1146/annurev.pharmtox.45.120403.095930 . ПМИД 15822177 .
- ^ Родгман А., Перфетти Т.А. (2009). Химические компоненты табака и табачного дыма . Бока-Ратон, Флорида: CRC Press. ISBN 978-1-4200-7883-1 . LCCN 2008018913 . [ нужна страница ]
- ^ «Табак и его злой родственник никотин хороши как пестициды – Американское химическое общество» . Американское химическое общество . Проверено 29 октября 2018 г.
- ^ USEPA (3 июня 2009 г.). «Никотин; Приказ об отмене продукта» . Федеральный реестр : 26695–26696 . Проверено 8 апреля 2012 г.
- ^ Кодекс федеральных правил США. 7 CFR 205.602 – Несинтетические вещества, запрещенные к использованию в органическом растениеводстве.
- ^ Тарп С. (5 сентября 2014 г.). «Безопасность домашних средств борьбы с вредителями» (PDF) . Бюллетень по пестицидам штата Монтана . Государственный университет Монтаны. Архивировано из оригинала (PDF) 5 сентября 2014 года . Проверено 21 сентября 2020 г.
- ^ Перейти обратно: а б Михальски Б., Херрманн М., Солецкий Р. (июль 2017 г.). «[Как остатки пестицидов превращаются в загрязнитель?]». Федеральный вестник здравоохранения – Исследования в области здравоохранения – Защита здоровья (на немецком языке). 60 (7): 768–773. дои : 10.1007/s00103-017-2556-3 . ПМИД 28508955 . S2CID 22662492 .
- ^ Европейское управление по безопасности пищевых продуктов (7 мая 2009 г.). «Потенциальные риски для здоровья населения из-за присутствия никотина в лесных грибах» . Журнал EFSA . 7 (5): 286р. дои : 10.2903/j.efsa.2009.286r .
- ^ Абреу-Вильяса Ю., Левин Э.Д. (февраль 2017 г.). «Эволюционная нейротоксичность последующих поколений инсектицидов» . Интернационал окружающей среды . 99 : 55–77. Бибкод : 2017EnInt..99...55A . дои : 10.1016/j.envint.2016.11.019 . ПМЦ 5285268 . ПМИД 27908457 .
- ^ Валентин Г., Софуоглу М. (май 2018 г.). «Когнитивные эффекты никотина: недавний прогресс» . Современная нейрофармакология . 16 (4). Издательство Bentham Science: 403–414. дои : 10.2174/1570159X15666171103152136 . ПМК 6018192 . ПМИД 29110618 .
- ^ Хейшман С.Дж., Клейкамп Б.А., Синглтон Э.Г. (июль 2010 г.). «Метаанализ острого воздействия никотина и курения на работоспособность человека» . Психофармакология . 210 (4): 453–69. дои : 10.1007/s00213-010-1848-1 . ПМК 3151730 . ПМИД 20414766 .
- ^ Сартер М. (август 2015 г.). «Поведенчески-когнитивные цели для улучшения холинергического действия» . Современное мнение в области поведенческих наук . 4 : 22–26. дои : 10.1016/j.cobeha.2015.01.004 . ПМК 5466806 . ПМИД 28607947 .
- ^ «Никотин: Биологическая активность» . Руководство IUPHAR/BPS по фармакологии . Международный союз фундаментальной и клинической фармакологии . Проверено 7 февраля 2016 г.
K заключается в следующем; α2β4=9900нМ [5], α3β2=14нМ [1], α3β4=187нМ [1], α4β2=1нМ [4,6]. Из-за гетерогенности каналов nACh мы не отметили первичную мишень препарата для никотина, хотя сообщается, что α4β2 является преобладающим подтипом с высоким сродством в мозге, который опосредует никотиновую зависимость.
- ^ Мажди А., Камари Ф., Вафаи М.С., Садиг-Этегад С. (октябрь 2017 г.). «Возврат к роли никотина в старении мозга и когнитивных нарушениях» (PDF) . Обзоры в области нейронаук . 28 (7): 767–781. дои : 10.1515/revneuro-2017-0008 . ПМИД 28586306 . S2CID 3758298 .
- ^ Убан К.А., Хортон М.К., Якобус Дж., Хейзер С., Томпсон В.К., Таперт С.Ф. и др. (август 2018 г.). «Биообразцы и исследование ABCD: обоснование, методы сбора, измерения и ранние данные» . Когнитивная нейробиология развития . 32 : 97–106. дои : 10.1016/j.dcn.2018.03.005 . ПМК 6487488 . ПМИД 29606560 .
- ^ Перейти обратно: а б Столерман И.П., Джарвис М.Дж. (январь 1995 г.). «Научное доказательство того, что никотин вызывает привыкание». Психофармакология . 117 (1): 2–10, обсуждение 14–20. дои : 10.1007/BF02245088 . ПМИД 7724697 . S2CID 8731555 .
- ^ Уайлдер Н., Дейли С., Шугармен Дж., Партридж Дж. (апрель 2016 г.). «Никотин без дыма: снижение вреда от табака» . Великобритания: Королевский колледж врачей. стр. 58, 125.
- ^ Перейти обратно: а б с Эль Сайед К.А., Сильвестр П.В. (июнь 2007 г.). «Биокаталитические и полусинтетические исследования противораковых кембраноидов табака». Экспертное заключение об исследуемых препаратах . 16 (6): 877–87. дои : 10.1517/13543784.16.6.877 . ПМИД 17501699 . S2CID 21302112 .
- ^ Рахман М.А., Ханн Н., Уилсон А., Уорролл-Картер Л. (2014). «Электронные сигареты: модели употребления, влияние на здоровье, использование при отказе от курения и вопросы регулирования» . Заболевания, вызванные табакокурением . 12 (1): 21. дои : 10.1186/1617-9625-12-21 . ПМК 4350653 . ПМИД 25745382 .
- ^ «2003: Третий ежегодный год идей; Никотини, The» . www.nytimes.com . Журнал «Нью-Йорк Таймс». Архивировано из оригинала 27 мая 2015 года . Проверено 28 марта 2024 г.
- ^ Литтл М.А., Эбберт Дж.О. (2016). «Безопасность лечения расстройств, связанных с употреблением табака». Экспертное заключение о безопасности лекарственных средств . 15 (3): 333–41. дои : 10.1517/14740338.2016.1131817 . ПМИД 26715118 . S2CID 12064318 .
- ^ Обен Х.Ю., Люкиенс А., Берлин I (февраль 2014 г.). «Фармакотерапия при отказе от курения: фармакологические принципы и клиническая практика» . Британский журнал клинической фармакологии . 77 (2): 324–36. дои : 10.1111/bcp.12116 . ПМК 4014023 . ПМИД 23488726 .
- ^ Перейти обратно: а б с Бэйли С.Р., Крю Э.Э., Риск Э.К., Аммерман С., Робинсон Т.Н., Киллен Дж.Д. (апрель 2012 г.). «Эффективность и переносимость фармакотерапии, помогающей бросить курить подросткам» . Педиатрические препараты . 14 (2): 91–108. дои : 10.2165/11594370-000000000-00000 . ПМК 3319092 . ПМИД 22248234 .
- ^ «Электронные сигареты. Каковы последствия употребления электронных сигарет для здоровья?» (PDF) . Центры по контролю и профилактике заболеваний. 22 февраля 2018 г. Архивировано (PDF) из оригинала 9 октября 2022 г.
Никотин представляет опасность для здоровья беременных женщин и их развивающихся детей.
- ^ Брюин Дж.Э., Герштейн ХК, Холлоуэй AC (август 2010 г.). «Долгосрочные последствия воздействия никотина на плод и новорожденного: критический обзор» . Токсикологические науки . 116 (2): 364–74. дои : 10.1093/toxsci/kfq103 . ПМК 2905398 . ПМИД 20363831 .
не существует безопасной дозы никотина во время беременности... Врачи сходятся во мнении, что необходимо больше информации о рисках применения НЗТ во время беременности, прежде чем можно будет дать беременным женщинам обоснованные окончательные рекомендации... В целом, доказательства представленные в этом обзоре, в подавляющем большинстве случаев указывают на то, что никотин больше не следует считать безопасным компонентом сигаретного дыма. Фактически, многие из неблагоприятных послеродовых последствий для здоровья, связанных с курением матери во время беременности, могут быть связаны, по крайней мере частично, только с никотином.
- ^ Форест С (1 марта 2010 г.). «Споры и данные о никотинзаместительной терапии во время беременности». MCN: Американский журнал по уходу за матерями и детьми . 35 (2): 89–95. дои : 10.1097/NMC.0b013e3181cafba4 . ПМИД 20215949 . S2CID 27085986 .
- ^ Баруа Р.С., Риготти Н.А., Беновиц Н.Л., Каммингс К.М., Джазайери М.А., Моррис П.Б. и др. (декабрь 2018 г.). «Путь принятия экспертного консенсуса ACC 2018 года по лечению отказа от табакокурения: отчет целевой группы Американского колледжа кардиологов о документах клинического экспертного консенсуса» . Журнал Американского колледжа кардиологов . 72 (25): 3332–3365. дои : 10.1016/j.jacc.2018.10.027 . ПМИД 30527452 .
- ^ Перейти обратно: а б Саннер Т., Гримсруд Т.К. (2015). «Никотин: канцерогенность и влияние на реакцию на лечение рака - обзор» . Границы онкологии . 5 : 196. doi : 10.3389/fonc.2015.00196 . ПМЦ 4553893 . ПМИД 26380225 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот «Никотин» . Наркотики.com . Американское общество фармацевтов систем здравоохранения . Проверено 24 января 2019 г.
- ^ Подробный список литературы расположен на отдельной странице с изображением .
- ^ Видж К (2014). Учебник судебной медицины и токсикологии: принципы и практика (5-е изд.). Elsevier Науки о здоровье. п. 525. ИСБН 978-81-312-3623-9 . Отрывок страницы 525
- ^ «НИКОТИН: Системный агент» . 8 июля 2021 г.
- ^ Королевский колледж врачей. «Никотин без дыма – снижение вреда от табака» . п. 125 . Проверено 30 сентября 2020 г.
Использование никотина в чистом виде в дозах, используемых курильщиками, практически не представляет опасности для потребителя.
- ^ Дуглас С.Э., Хенсон Р., Дропе Дж., Вендер Р.С. (июль 2018 г.). «Заявление общественного здравоохранения Американского онкологического общества об отказе от употребления горючего табака в Соединенных Штатах» . КА . 68 (4): 240–245. дои : 10.3322/caac.21455 . ПМИД 29889305 . S2CID 47016482 .
Именно дым горючих табачных изделий, а не никотин, ранит и убивает миллионы курильщиков.
- ^ Динакар С, О'Коннор GT (октябрь 2016 г.). «Влияние электронных сигарет на здоровье». Медицинский журнал Новой Англии . 375 (14): 1372–1381. дои : 10.1056/NEJMra1502466 . ПМИД 27705269 .
Помимо свойств, вызывающих привыкание, кратковременное или длительное воздействие никотина на взрослых не было признано опасным.
- ^ Перейти обратно: а б Хартманн-Бойс Дж., Чепкин С.С., Й.В., Буллен С., Ланкастер Т. (май 2018 г.). «Никотинзаместительная терапия против контроля над прекращением курения» . Кокрановская база данных систематических обзоров . 5 (5): CD000146. дои : 10.1002/14651858.CD000146.pub5 . ПМК 6353172 . ПМИД 29852054 .
- ^ Англия LJ, Bunnell RE, Pechacek TF, Tong VT, McAfee TA (август 2015 г.). «Никотин и развивающийся человек: забытый элемент в дебатах об электронных сигаретах» . Американский журнал профилактической медицины . 49 (2): 286–293. дои : 10.1016/j.amepre.2015.01.015 . ПМЦ 4594223 . ПМИД 25794473 .
- ^ «Никотиновый трансдермальный пластырь» (PDF) . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США . Проверено 24 января 2019 г.
- ^ Перейти обратно: а б «Никотрол НС» (PDF) . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США . Проверено 24 января 2019 г.
- ^ «Никотрол» (PDF) . Пфайзер . Проверено 24 января 2019 г.
- ^ Перейти обратно: а б Гарсия А.Н., Саллум И.М. (октябрь 2015 г.). «Полисомнографические нарушения сна при употреблении никотина, кофеина, алкоголя, кокаина, опиоидов и каннабиса: целенаправленный обзор». Американский журнал о зависимостях . 24 (7): 590–8. дои : 10.1111/ajad.12291 . ПМИД 26346395 . S2CID 22703103 .
- ^ Бутрел Б., Кооб Г.Ф. (сентябрь 2004 г.). «Что не дает нам уснуть: нейрофармакология стимуляторов и лекарств, способствующих бодрствованию» . Спать . 27 (6): 1181–94. дои : 10.1093/sleep/27.6.1181 . ПМИД 15532213 .
- ^ Йене А., Лёссл Б., Баркай З., Риман Д., Хорняк М. (октябрь 2009 г.). «Влияние никотина на сон во время употребления, отмены и заместительной терапии». Обзоры медицины сна (обзор). 13 (5): 363–77. дои : 10.1016/j.smrv.2008.12.003 . ПМИД 19345124 .
- ^ Перейти обратно: а б Беновиц Н.Л., Бербанк AD (август 2016 г.). «Сердечно-сосудистая токсичность никотина: последствия использования электронных сигарет» . Тенденции сердечно-сосудистой медицины . 26 (6): 515–23. дои : 10.1016/j.tcm.2016.03.001 . ПМЦ 4958544 . ПМИД 27079891 .
- ^ Нестлер Э.Дж., Баррот М., Селф Д.В. (сентябрь 2001 г.). «DeltaFosB: устойчивый молекулярный переключатель зависимости» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (20): 11042–6. Бибкод : 2001PNAS...9811042N . дои : 10.1073/pnas.191352698 . ПМК 58680 . ПМИД 11572966 .
Хотя сигнал ΔFosB относительно долговечен, он не является постоянным. ΔFosB постепенно деградирует и больше не может быть обнаружен в мозге через 1–2 месяца после отмены наркотиков. другие возмущения (не связанные с поражениями).
- ^ Нестлер Э.Дж. (декабрь 2012 г.). «Транскрипционные механизмы наркомании» . Клиническая психофармакология и неврология . 10 (3): 136–43. дои : 10.9758/cpn.2012.10.3.136 . ПМК 3569166 . ПМИД 23430970 .
Изоформы ΔFosB массой 35–37 кДа накапливаются при хроническом воздействии лекарств из-за их чрезвычайно длительного периода полураспада. ... Благодаря своей стабильности белок ΔFosB сохраняется в нейронах в течение как минимум нескольких недель после прекращения воздействия препарата. ... Сверхэкспрессия ΔFosB в прилежащем ядре индуцирует NFκB
- ^ Догерти Дж., Миллер Д., Тодд Дж., Костенбаудер Х.Б. (декабрь 1981 г.). «Усиление и другие поведенческие эффекты никотина». Неврологические и биоповеденческие обзоры . 5 (4): 487–495. дои : 10.1016/0149-7634(81)90019-1 . ПМИД 7322454 . S2CID 10076758 .
- ^ Перейти обратно: а б Беллуцци Джей Ди, Ван Р., Лесли FM (апрель 2005 г.). «Ацетальдегид способствует самостоятельному приему никотина у крыс-подростков». Нейропсихофармакология . 30 (4): 705–712. дои : 10.1038/sj.npp.1300586 . ПМИД 15496937 .
- ^ «Ацетальдегид | РИВМ» .
- ^ Дас С., Прочаска Джей Джей (октябрь 2017 г.). «Инновационные подходы к поддержке отказа от курения для людей с психическими заболеваниями и сопутствующими расстройствами, связанными с употреблением психоактивных веществ» . Экспертное обозрение респираторной медицины . 11 (10): 841–850. дои : 10.1080/17476348.2017.1361823 . ПМК 5790168 . ПМИД 28756728 .
- ^ Хейшман С.Дж., Клейкамп Б.А., Синглтон Э.Г. (июль 2010 г.). «Метаанализ острого воздействия никотина и курения на работоспособность человека» . Психофармакология . 210 (4): 453–69. дои : 10.1007/s00213-010-1848-1 . ПМК 3151730 . ПМИД 20414766 .
Значительное влияние никотина на двигательные способности, внимание и память, вероятно, представляет собой истинное улучшение работоспособности, поскольку оно не компенсируется облегчением абстиненции. Благоприятное когнитивное воздействие никотина влияет на начало курения и поддержание табачной зависимости.
- ^ Бараона Л.К., Лавлейс Д., Дэниелс Дж.Л., МакДэниел Л. (май 2017 г.). «Вред табака, никотиновая фармакология и фармакологические меры по прекращению употребления табака для женщин». Журнал акушерства и женского здоровья . 62 (3): 253–269. дои : 10.1111/jmwh.12616 . ПМИД 28556464 . S2CID 1267977 .
- ^ Дугас Э.Н., Сильвестр М.П., О'Локлин Е.К., Брюне Дж., Какинами Л., Константин Е. и др. (февраль 2017 г.). «Никотиновая зависимость и качество сна у молодых людей». Аддиктивное поведение . 65 : 154–160. дои : 10.1016/j.addbeh.2016.10.020 . ПМИД 27816041 .
- ^ Корс С., Роденбек А., Риман Д., Сагун Б., Джане А., Бринкмейер Дж. и др. (май 2014 г.). «Нарушение качества и продолжительности сна у курильщиков - результаты немецкого многоцентрового исследования никотиновой зависимости». Биология наркомании . 19 (3): 486–96. дои : 10.1111/j.1369-1600.2012.00487.x . hdl : 11858/00-001M-0000-0025-BD0C-B . ПМИД 22913370 . S2CID 1066283 .
- ^ Брейнзель А.В. (май 2012 г.). «Табачная зависимость и нарушение регуляции стрессовых систем мозга» . Неврологические и биоповеденческие обзоры . 36 (5): 1418–41. doi : 10.1016/j.neubiorev.2012.02.015 . ПМК 3340450 . ПМИД 22405889 .
Прекращение курения приводит к развитию негативных аффективных симптомов, таких как депрессивное настроение, повышенная тревожность, нарушение памяти и внимания... Отказ от курения приводит к относительно легкому соматическому абстинентному синдрому и тяжелому аффективному абстинентному синдрому, характеризующемуся снижением положительного аффекта, усиление негативного аффекта, тяга к табаку, раздражительность, тревожность, трудности с концентрацией внимания, гиперфагия, беспокойство, нарушение сна. Курение во время острой фазы абстиненции снижает тягу к сигаретам и возвращает когнитивные способности на уровень, существовавший до прекращения курения.
- ^ Перейти обратно: а б Нестлер Э.Дж. (декабрь 2013 г.). «Клеточная основа памяти при наркомании» . Диалоги в клинической неврологии . 15 (4): 431–43. doi : 10.31887/DCNS.2013.15.4/enestler . ПМЦ 3898681 . ПМИД 24459410 .
- ^ Перейти обратно: а б Раффл Дж.К. (ноябрь 2014 г.). «Молекулярная нейробиология зависимости: о чем вообще (Δ)FosB?». Американский журнал о злоупотреблении наркотиками и алкоголем . 40 (6): 428–37. дои : 10.3109/00952990.2014.933840 . ПМИД 25083822 . S2CID 19157711 .
Знание индукции ΔFosB при хроническом воздействии наркотиков обеспечивает новый метод оценки профиля зависимости от психоактивных веществ (т.е. того, насколько они вызывают привыкание). Сюн и др. использовали эту предпосылку для оценки потенциального аддиктивного профиля пропофола (119). Пропофол является общим анестетиком, однако зарегистрировано злоупотребление им в рекреационных целях (120). Используя контрольные препараты, вызывающие как индукцию ΔFosB, так и зависимость (этанол и никотин), ...
Выводы
ΔFosB является важным фактором транскрипции, участвующим в молекулярных и поведенческих путях развития зависимости после неоднократного воздействия наркотиков. Образование ΔFosB во многих областях мозга и молекулярный путь, ведущий к образованию комплексов AP-1, хорошо изучены. Установление функционального назначения ΔFosB позволило продолжить определение некоторых ключевых аспектов его молекулярных каскадов, включая такие эффекторы, как GluR2 (87,88), Cdk5 (93) и NFkB (100). Более того, многие из этих выявленных молекулярных изменений теперь напрямую связаны со структурными, физиологическими и поведенческими изменениями, наблюдаемыми после хронического воздействия наркотиков (60,95,97,102). Новые горизонты исследований по изучению молекулярной роли ΔFosB были открыты эпигенетическими исследованиями, а недавние достижения проиллюстрировали роль ΔFosB, действующего на ДНК и гистоны, действительно как молекулярный переключатель (34). Благодаря нашему лучшему пониманию ΔFosB при зависимости, стало возможным оценить потенциал привыкания современных лекарств (119), а также использовать его в качестве биомаркера для оценки эффективности терапевтических вмешательств (121,122,124). - ^ Марттила К., Рааттамаа Х., Ахти Л. (июль 2006 г.). «Влияние хронического введения никотина и его отмены на экспрессию FosB/DeltaFosB и c-Fos в полосатом теле у крыс и мышей». Нейрофармакология . 51 (1): 44–51. doi : 10.1016/j.neuropharm.2006.02.014 . ПМИД 16631212 . S2CID 8551216 .
- ^ Толентино Дж. (7 мая 2018 г.). «Обещание вейпинга и восхождение Юла» . Житель Нью-Йорка . Проверено 29 июня 2024 г.
- ^ Кардинале А, Наструччи С, Чезарио А, Руссо П (январь 2012 г.). «Никотин: специфическая роль в ангиогенезе, пролиферации и апоптозе». Критические обзоры по токсикологии . 42 (1): 68–89. дои : 10.3109/10408444.2011.623150 . ПМИД 22050423 . S2CID 11372110 .
- ^ Национальные академии наук, техники и медицины, Отдел здравоохранения и медицины, Совет по здоровью населения и Комитет практики общественного здравоохранения по обзору воздействия электронных систем доставки никотина на здоровье (2018). «Глава 4: Никотин» . В Eaton DL, Kwan LY, Stratton K (ред.). Последствия электронных сигарет для общественного здравоохранения . Пресса национальных академий. ISBN 978-0-309-46834-3 .
- ^ Дасгупта П., Ризвани В., Пиллаи С., Кинкейд Р., Ковач М., Растоги С. и др. (январь 2009 г.). «Никотин индуцирует пролиферацию клеток, инвазию и эпителиально-мезенхимальный переход в различных линиях раковых клеток человека» . Международный журнал рака . 124 (1). Журнал клинической эндокринологии и метаболизма: 36–45. дои : 10.1002/ijc.23894 . ПМК 2826200 . ПМИД 18844224 .
- ^ Вонг Х.П., Ю Л., Лам Е.К., Тай Е.К., Ву В.К., Чо Ч. (июнь 2007 г.). «Никотин способствует росту опухолей толстой кишки и ангиогенезу посредством бета-адренергической активации» . Токсикологические науки . 97 (2): 279–287. дои : 10.1093/toxsci/kfm060 . ПМИД 17369603 .
- ^ Натори Т., Сата М., Васида М., Хирата Ю., Нагай Р., Макуучи М. (октябрь 2003 г.). «Никотин усиливает неоваскуляризацию и способствует росту опухоли» . Молекулы и клетки . 16 (2): 143–146. дои : 10.1016/S1016-8478(23)13780-0 . ПМИД 14651253 .
- ^ Е Ю.Н., Лю Э.С., Шин В.Ю., Ву В.К., Луо Дж.К., Чо Ч. (январь 2004 г.). «Никотин способствует росту рака толстой кишки через рецептор эпидермального фактора роста, c-Src и сигнальный путь, опосредованный 5-липоксигеназой». Журнал фармакологии и экспериментальной терапии . 308 (1): 66–72. дои : 10.1124/jpet.103.058321 . ПМИД 14569062 . S2CID 9774853 .
- ^ Мерец-Садовска А., Ситарек П., Зелинска-Близневска Х., Малиновска К., Зайдел К., Законник Л. и др. (январь 2020 г.). «Краткий обзор исследований in vitro и in vivo, оценивающих влияние воздействия электронных сигарет на живые организмы и окружающую среду» . Международный журнал молекулярных наук . 21 (2): 652. doi : 10.3390/ijms21020652 . ПМК 7013895 . ПМИД 31963832 .
 В эту статью включен текст Мереч-Садовской А., Ситарека П., Зелинской-Близневской Х., Малиновской К., Зайделя К., Законника Л., Зайделя Р., доступный по лицензии CC BY 4.0 .
В эту статью включен текст Мереч-Садовской А., Ситарека П., Зелинской-Близневской Х., Малиновской К., Зайделя К., Законника Л., Зайделя Р., доступный по лицензии CC BY 4.0 . - ^ Котари А.Н., Ми З., Цапф М., Куо ПК (2014). «Новые клинические методы лечения, направленные на эпителиально-мезенхимальный переход» . Клиническая и трансляционная медицина . 3:35 . дои : 10.1186/s40169-014-0035-0 . ПМК 4198571 . ПМИД 25343018 .
- ^ Кнезевич А, Музик Дж, Хацуками Д.К., Хехт С.С., Степанов И. (февраль 2013 г.). «Нитрозирование норникотина в слюне и его связь с эндогенным синтезом N'-нитрозонорникотина у человека» . Исследования никотина и табака . 15 (2): 591–5. дои : 10.1093/ntr/nts172 . ПМК 3611998 . ПМИД 22923602 .
- ^ «Список классификаций – Монографии МАИР по выявлению канцерогенной опасности для человека» . monographs.iarc.fr . Проверено 22 июля 2020 г.
- ^ Саннер Т., Гримсруд Т.К. (31 августа 2015 г.). «Никотин: канцерогенность и влияние на реакцию на лечение рака - обзор» . Границы онкологии . 5 : 196. doi : 10.3389/fonc.2015.00196 . ПМЦ 4553893 . ПМИД 26380225 .
- ^ Гинзки С., Стеуслов Г., Келер С., Бургарц М., Шерцед А., Хакенберг С. и др. (август 2014 г.). «Генотоксические эффекты никотина в клетках первичных околоушных желез человека, оцененные in vitro с помощью кометного анализа, микроядерного теста с блокировкой цитокинеза и теста на хромосомные аберрации». Токсикология in vitro . 28 (5): 838–846. дои : 10.1016/j.tiv.2014.03.012 . ПМИД 24698733 .
- ^ Гинзки С., Фрис Г., Келер С., Хакенберг С., Хаген Р., Кляйнсассер Н.Х. (февраль 2013 г.). «Оценка никотин-индуцированного повреждения ДНК в батарее генотоксикологических тестов». Мутационные исследования . 751 (1): 34–39. doi : 10.1016/j.mrgentox.2012.11.004 . ПМИД 23200805 .
- ^ Гинзки С., Штюбер Т., Фрис Г., Келер С., Хакенберг С., Рихтер Э. и др. (январь 2012 г.). «Анализ никотин-индуцированных повреждений ДНК в клетках дыхательных путей человека». Письма по токсикологии . 208 (1): 23–29. дои : 10.1016/j.toxlet.2011.09.029 . ПМИД 22001448 .
- ^ Бенке М., Смит В.К. (март 2013 г.). «Пренатальная злоупотребление психоактивными веществами: краткосрочные и долгосрочные последствия для подвергшегося воздействию плода» . Педиатрия . 131 (3): e1009-24. дои : 10.1542/пед.2012-3931 . ПМК 8194464 . ПМИД 23439891 .
- ^ «Отчет государственного санитарного врача об электронных сигаретах: угроза здоровью населения» (PDF) . Департамент общественного здравоохранения Калифорнии. Январь 2015 г. Архивировано (PDF) из оригинала 9 октября 2022 г.
- ^ Холбрук Б.Д. (июнь 2016 г.). «Влияние никотина на развитие плода человека». Исследование врожденных дефектов. Часть C, Эмбрион сегодня . 108 (2): 181–192. дои : 10.1002/bdrc.21128 . ПМИД 27297020 .
- ^ Брюин Дж.Э., Герштейн ХК, Холлоуэй AC (август 2010 г.). «Долгосрочные последствия воздействия никотина на плод и новорожденного: критический обзор» . Токсикологические науки . 116 (2): 364–374. дои : 10.1093/toxsci/kfq103 . ПМК 2905398 . ПМИД 20363831 .
- ^ «Новости для потребителей: этикетки никотинзаместительной терапии могут измениться» . FDA. 1 апреля 2013 г.
- ^ Токсикология и прикладная фармакология . Том. 44, стр. 1, 1978.
- ^ Перейти обратно: а б Шеп Л.Дж., Слотер Р.Дж., Бизли Д.М. (сентябрь 2009 г.). «Никотиновое отравление растениями». Клиническая токсикология . 47 (8): 771–81. дои : 10.1080/15563650903252186 . ПМИД 19778187 . S2CID 28312730 .
- ^ Смолинске С.К., Сперке Д.Г., Спиллер С.К., Врук К.М., Кулиг К., Румак Б.Х. (январь 1988 г.). «Токсичность сигарет и никотиновой жевательной резинки у детей». Токсикология человека . 7 (1): 27–31. дои : 10.1177/096032718800700105 . ПМИД 3346035 . S2CID 27707333 .
- ^ Фурер В., Херш М., Сильвецки Н., Брейер Г.С., Зевин С. (март 2011 г.). «Отравление Nicotiana glauca (табачным деревом) — два случая в одной семье» . Журнал медицинской токсикологии . 7 (1): 47–51. дои : 10.1007/s13181-010-0102-x . ПМЦ 3614112 . ПМИД 20652661 .
- ^ Гельбах С.Х., Уильямс В.А., Перри Л.Д., Вудалл Дж.С. (сентябрь 1974 г.). «Зеленотабачная болезнь. Болезнь сборщиков табака». ДЖАМА . 229 (14): 1880–3. дои : 10.1001/jama.1974.03230520022024 . ПМИД 4479133 .
- ^ «CDC – Карманный справочник NIOSH по химическим опасностям – никотин» . www.cdc.gov . Проверено 20 ноября 2015 г.
- ^ Померло О.Ф., Померло К.С. (1984). «Нейрегуляторы и усиление курения: к биоповеденческому объяснению». Неврологические и биоповеденческие обзоры . 8 (4): 503–13. дои : 10.1016/0149-7634(84)90007-1 . ПМИД 6151160 . S2CID 23847303 .
- ^ Померло О.Ф., Роузкранс Дж. (1989). «Нейрорегуляторное действие никотина». Психонейроэндокринология . 14 (6): 407–23. дои : 10.1016/0306-4530(89)90040-1 . hdl : 2027.42/28190 . ПМИД 2560221 . S2CID 12080532 .
- ^ Кацунг Б.Г. (2006). Базовая и клиническая фармакология . Нью-Йорк: McGraw-Hill Medical. стр. 99–105.
- ^ Сю X, Пушкар Н.Л., Шаната Дж.А., Лестер Х.А., Догерти Д.А. (март 2009 г.). «Связывание никотина с рецепторами мозга требует сильного взаимодействия катион-пи» . Природа . 458 (7237): 534–7. Бибкод : 2009Natur.458..534X . дои : 10.1038/nature07768 . ПМЦ 2755585 . ПМИД 19252481 .
- ^ Несбитт П. (1969). Курение, физиологическое возбуждение и эмоциональная реакция. Неопубликованная докторская диссертация, Колумбийский университет.
- ^ Пэрротт AC (январь 1998 г.). «Парадокс Несбитта решен? Модуляция стресса и возбуждения во время курения сигарет». Зависимость . 93 (1): 27–39. CiteSeerX 10.1.1.465.2496 . дои : 10.1046/j.1360-0443.1998.931274.x . ПМИД 9624709 .
- ^ Вадгаве У., Нагеш Л. (июль 2016 г.). «Никотинзаместительная терапия: обзор» . Международный журнал медицинских наук . 10 (3): 425–35. дои : 10.12816/0048737 . ПМЦ 5003586 . ПМИД 27610066 .
- ^ Гриззелл Дж. А., Эчеверрия V (октябрь 2015 г.). «Новое понимание механизмов действия котинина и его отличий от никотина». Нейрохимические исследования . 40 (10): 2032–46. дои : 10.1007/s11064-014-1359-2 . ПМИД 24970109 . S2CID 9393548 .
- ^ Перейти обратно: а б с Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). Сидор А., Браун Р.Ю. (ред.). Молекулярная нейрофармакология: фонд клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. стр. 369, 372–373. ISBN 978-0-07-148127-4 .
- ^ Перейти обратно: а б Диксон С.Л., Эгечиоглу Э., Ландгрен С., Скибицка К.П., Энгель Дж.А., Йерлхаг Э. (июнь 2011 г.). «Роль центральной системы грелина в вознаграждении от пищевых продуктов и химических препаратов» (PDF) . Молекулярная и клеточная эндокринология . 340 (1): 80–7. дои : 10.1016/j.mce.2011.02.017 . hdl : 2077/26318 . ПМИД 21354264 . S2CID 206815322 . Архивировано из оригинала (PDF) 4 августа 2020 года . Проверено 23 сентября 2019 г.
Эта связь вознаграждения включает проекцию дофамина из вентральной покрышки (VTA) в прилежащее ядро вместе с холинергическим входом, возникающим в первую очередь из латеродорсальной покрышки.
- ^ Перейти обратно: а б с Пиччотто М.Р., Минёр Ю.С. (январь 2014 г.). «Молекулы и цепи, участвующие в никотиновой зависимости: многоликость курения» . Нейрофармакология (обзор). 76 (Часть Б): 545–53. doi : 10.1016/j.neuropharm.2013.04.028 . ПМЦ 3772953 . ПМИД 23632083 .
Исследования на крысах показали, что введение никотина может снизить потребление пищи и массу тела, причем больший эффект наблюдается у самок животных (Grunberg et al., 1987). Подобный никотиновый режим также снижает массу тела и жировую массу у мышей в результате β4* nAChR-опосредованной активации нейронов POMC и последующей активации рецепторов MC4 на нейронах второго порядка в паравентрикулярном ядре гипоталамуса (Mineur et al., 2011). ).
- ^ Левин А., Хуанг Ю., Дрисальди Б., Гриффин Е.А., Поллак Д.Д., Сюй С. и др. (ноябрь 2011 г.). «Молекулярный механизм шлюзового препарата: эпигенетические изменения, инициированные экспрессией гена никотина кокаином» . Наука трансляционной медицины . 3 (107): 107ра109. doi : 10.1126/scitranslmed.3003062 . ПМК 4042673 . ПМИД 22049069 .
- ^ Волков Н.Д. (ноябрь 2011 г.). «Эпигенетика никотина: еще один гвоздь в кашель» . Наука трансляционной медицины . 3 (107): 107пс43. doi : 10.1126/scitranslmed.3003278 . ПМЦ 3492949 . ПМИД 22049068 .
- ^ Ёсида Т., Сакане Н., Умекава Т., Кондо М. (январь 1994 г.). «Влияние никотина на активность симпатической нервной системы мышей, подвергшихся иммобилизационному стрессу». Физиология и поведение . 55 (1): 53–7. дои : 10.1016/0031-9384(94)90009-4 . ПМИД 8140174 . S2CID 37754794 .
- ^ Мариб Э.Н., Хён К. (2007). Анатомия и физиология человека (7-е изд.) . Пирсон. стр. ?. ISBN 978-0-8053-5909-1 . [ нужна страница ]
- ^ Хеннингфилд Дж. Э., Кальвенто Э., Погун С. (2009). Никотиновая психофармакология . Справочник по экспериментальной фармакологии. Том. 192. Спрингер. стр. 35, 37. doi : 10.1007/978-3-540-69248-5 . ISBN 978-3-540-69248-5 .
- ^ Ле Уэзек Ж (сентябрь 2003 г.). «Роль фармакокинетики никотина в никотиновой зависимости и никотинзаместительной терапии: обзор». Международный журнал туберкулеза и болезней легких . 7 (9): 811–9. ПМИД 12971663 .
- ^ Колли А.Р., Кальвино-Мартин Ф., Кучай А.К., Вонг Э.Т., Титц Б., Сян Ю. и др. (1 января 2023 г.). «Деконволюция системной фармакокинетики предсказывает дозиметрию никотина при вдыхании аэрозоля» . Европейский журнал фармацевтических наук . 180 : 106321. doi : 10.1016/j.ejps.2022.106321 . ISSN 0928-0987 .
- ^ Беновиц Н.Л., Джейкоб П., Джонс Р.Т., Розенберг Дж. (май 1982 г.). «Межиндивидуальная изменчивость метаболизма и сердечно-сосудистых эффектов никотина у человека». Журнал фармакологии и экспериментальной терапии . 221 (2): 368–72. ПМИД 7077531 .
- ^ Рассел М.А., Джарвис М., Айер Р., Фейерабенд К. (апрель 1980 г.). «Связь выхода никотина в сигаретах с концентрацией никотина в крови курильщиков» . Британский медицинский журнал . 280 (6219): 972–976. дои : 10.1136/bmj.280.6219.972 . ПМК 1601132 . ПМИД 7417765 .
- ^ Бхалала О (весна 2003 г.). «Обнаружение котинина в плазме крови методом ВЭЖХ-МС/МС» . Журнал исследований бакалавриата Массачусетского технологического института . 8 : 45–50. Архивировано из оригинала 24 декабря 2013 года.
- ^ Хукканен Дж., Джейкоб П., Беновиц Н.Л. (март 2005 г.). «Метаболизм и кинетика распределения никотина». Фармакологические обзоры . 57 (1): 79–115. дои : 10.1124/пр.57.1.3 . ПМИД 15734728 . S2CID 14374018 .
- ^ Петрик Л.М., Свидовский А., Дубовский Ю. (январь 2011 г.). «Третье курение: гетерогенное окисление никотина и образование вторичного аэрозоля в помещении». Экологические науки и технологии . 45 (1): 328–33. Бибкод : 2011EnST...45..328P . дои : 10.1021/es102060v . ПМИД 21141815 . S2CID 206939025 .
- ^ « Опасность курения из третьих рук: краткое изложение простым языком – Петрик и др., «Курение из третьих рук: гетерогенное окисление никотина и вторичное образование аэрозоля в помещении» в журнале «Экологическая наука и технология » . Колонна . Том. 7, нет. 3. Хроматография онлайн. 22 февраля 2011 г.
- ^ Беновиц Н.Л., Эррера Б., Джейкоб П. (сентябрь 2004 г.). «Курение сигарет с ментолом подавляет метаболизм никотина». Журнал фармакологии и экспериментальной терапии . 310 (3): 1208–15. дои : 10.1124/jpet.104.066902 . ПМИД 15084646 . S2CID 16044557 .
- ^ «Влияние никотина на энергетический баланс: друг или враг?». Фармакология и терапия . 219 . Март 2021.
- ^ Перейти обратно: а б с д Ху Т, Ян Цз, Ли, доктор медицинских наук (декабрь 2018 г.). «Фармакологические эффекты и механизмы регулирования воздействия табакокурения на потребление пищи и контроль веса». Журнал нейроиммунной фармакологии . 13 (4): 453–466. дои : 10.1007/s11481-018-9800-y . ПМИД 30054897 . S2CID 51727199 .
Влияние никотина на вес, по-видимому, является результатом стимуляции препаратом никотин-ацетилхолиновых рецепторов α3β4 (nAChR), которые расположены на нейронах проопиомеланокортина (POMC) в дугообразном ядре (ARC), что приводит к активации меланокортинового контура, который связан с массой тела. Кроме того, nAChR, содержащие α7 и α4β2, участвуют в контроле веса с помощью никотина.
- ^ «Информация о рейтинге опасности NFPA для обычных химических веществ» . Архивировано из оригинала 17 февраля 2015 года . Проверено 15 марта 2015 г.
- ^ Перейти обратно: а б с Меткалф Р.Л. (2007), «Борьба с насекомыми», Энциклопедия промышленной химии Ульмана (7-е изд.), Wiley, стр. 9
- ^ «Паспорт безопасности L-никотина» . Sciencelab.com, Inc.
- ^ Перейти обратно: а б с Томас Андерсон Генри (1949). Растительные алкалоиды (PDF) (4-е изд.). Филадельфия, Торонто: Компания Blakiston. стр. 36–43.
- ^ Гаузе Г.Ф. (1941). «Глава V: Анализ различных биологических процессов путем изучения дифференциального действия оптических изомеров» . В Лует Б.Дж. (ред.). Оптическая активность и живая материя . Серия монографий по общей физиологии. Том. 2. Нормандия, Миссури: Биодинамика.
- ^ Перейти обратно: а б Чжан Х., Пан Ю., Луо Ю., Ли Х., Чен Х., Хань С. и др. (июль 2018 г.). «Энантиомерный состав никотина в табачном листе, сигаретах, бездымном табаке и жидкости для электронных сигарет по данным нормально-фазовой высокоэффективной жидкостной хроматографии». Хиральность . 30 (7): 923–931. дои : 10.1002/чир.22866 . ПМИД 29722457 .
- ^ Хеллингхаузен Г., Ли Дж.Т., Weatherly CA, Лопес Д.А., Армстронг Д.В. (июнь 2017 г.). «Оценка никотина в безтабачных коммерческих продуктах». Тестирование и анализ наркотиков . 9 (6): 944–948. дои : 10.1002/dta.2145 . ПМИД 27943582 .
- ^ Йенссен Б.П., Бойкан Р. (февраль 2019 г.). «Электронные сигареты и молодежь в Соединенных Штатах: призыв к действию (на местном, национальном и глобальном уровнях)» . Дети . 6 (2): 30. дои : 10.3390/детей6020030 . ПМК 6406299 . ПМИД 30791645 .
 В эту статью включен текст Дженссена Б.П. и Бойкана Р., доступный по лицензии CC BY 4.0 .
В эту статью включен текст Дженссена Б.П. и Бойкана Р., доступный по лицензии CC BY 4.0 . - ^ Перейти обратно: а б с Пиктет А, Ротчи А (1904). «Синтез никотина» . Отчеты Немецкого химического общества (на немецком языке). 37 (2): 1225–1235. дои : 10.1002/cber.19040370206 .
- ^ Хо Т.Л., Кузаков Е.В. (2004). «Новый подход к никотину: учет симметрии при разработке синтеза». Helvetica Chimica Acta . 87 (10): 2712–2716. дои : 10.1002/hlca.200490241 .
- ^ Е X, Чжан Ю, Сун X, Лю Ц (2022). «Прогресс исследований фармакологического действия и синтеза никотина». ХимияВыбрать . 7 (12). дои : 10.1002/slct.202104425 . S2CID 247687372 .
- ^ Ламбертс Б.Л., Дьюи Л.Дж., Байеррам Р.У. (май 1959 г.). «Орнитин как предшественник пирролидинового кольца никотина». Биохимика и биофизика Acta . 33 (1): 22–6. дои : 10.1016/0006-3002(59)90492-5 . ПМИД 13651178 .
- ^ Доусон Р.Ф., Кристман Д.Р., д'Адамо А., Солт М.Л., Вольф А.П. (1960). «Биосинтез никотина из изотопно-меченных никотиновых кислот». Журнал Американского химического общества . 82 (10): 2628–2633. дои : 10.1021/ja01495a059 .
- ^ Ашихара Х., Крозье А., Комамине А., ред. (7 июня 2011 г.). Метаболизм растений и биотехнология . Кембридж: Уайли. ISBN 978-0-470-74703-2 . [ нужна страница ]
- ^ Беновиц Н.Л., Хукканен Дж., Джейкоб П. (1 января 2009 г.). «Химия никотина, метаболизм, кинетика и биомаркеры». Никотиновая психофармакология . Справочник по экспериментальной фармакологии. Том. 192. стр. 29–60. дои : 10.1007/978-3-540-69248-5_2 . ISBN 978-3-540-69246-1 . ПМЦ 2953858 . ПМИД 19184645 .
- ^ Базельт РЦ (2014). Утилизация токсичных лекарств и химических веществ в организме человека (10-е изд.). Биомедицинские публикации. стр. 1452–6. ISBN 978-0-9626523-9-4 .
- ^ Мюндель Т., Джонс Д.А. (июль 2006 г.). «Влияние трансдермального введения никотина на выносливость к физической нагрузке у мужчин» . Экспериментальная физиология . 91 (4): 705–13. doi : 10.1113/expphysicalol.2006.033373 . ПМИД 16627574 . S2CID 41954065 .
- ^ Хеллингхаузен Г., Рой Д., Ван Ю., Ли Дж.Т., Лопес Д.А., Weatherly CA и др. (май 2018 г.). «Комплексная методология хирального разделения 40 табачных алкалоидов и их канцерогенных E/Z-(R,S)-специфичных для табака метаболитов нитрозаминов». Таланта . 181 : 132–141. дои : 10.1016/j.talanta.2017.12.060 . ПМИД 29426492 .
- ^ Лю Б, Чен Ю, Ма Х, Ху К (сентябрь 2019 г.). «Коэффициент пиковой интенсивности для конкретного участка (SPIR) из 1D 2 ЧАС/ 1 Спектры H ЯМР для быстрого различения природного и синтетического никотина и обнаружения возможной фальсификации». Analytical and Bioanalytical Chemistry . 411 (24): 6427–6434. doi : /s00216-019-02023-6 . PMID 31321470. . S2CID 197593505 10.1007
- ^ Читам А.Г., Планкетт С., Кэмпбелл П., Хиллдруп Дж., Коффа Б.Г., Гиллиланд С. и др. (14 апреля 2022 г.). Гринлиф CM (ред.). «Анализ и дифференциация табачных и синтетических никотиновых продуктов: решение актуальной проблемы регулирования» . ПЛОС ОДИН . 17 (4): e0267049. Бибкод : 2022PLoSO..1767049C . дои : 10.1371/journal.pone.0267049 . ПМК 9009602 . ПМИД 35421170 .
- ^ «Табак (листовой табак)» . Служба транспортной информации.
- ^ Болдуин ИТ (декабрь 2001 г.). «Экологически мотивированный анализ взаимодействий растений и травоядных в местном табаке» . Физиология растений . 127 (4): 1449–1458. дои : 10.1104/стр.010762 . JSTOR 4280212 . ПМК 1540177 . ПМИД 11743088 .
- ^ Nd Исследование на основе РНКи, основанное на естественном анамнезе и опосредованное растениями, показывает роль CYP6B46 в опосредованной никотином защите травоядных от хищников | ПНАС.
- ^ Кесслер Д., Бхаттачарья С., Дизель С., Роте Е., Газ К., Шоттнер М. и др. (август 2012 г.). «Непредсказуемость никотина в нектаре способствует ауткроссингу колибри в Nicotiana attenuata». Заводской журнал . 71 (4): 529–538. дои : 10.1111/j.1365-313X.2012.05008.x . ПМИД 22448647 .
- ^ Домино Э.Ф., Хорнбах Э., Демана Т. (август 1993 г.). «Содержание никотина в обычных овощах» . Медицинский журнал Новой Англии . 329 (6): 437. doi : 10.1056/NEJM199308053290619 . ПМИД 8326992 .
- ^ Молдовяну СК, Скотт В.А., Лоусон Д.М. (апрель 2016 г.). «Анализ никотина в некоторых нетабачных растительных материалах» . Beiträge zur Tabakforschung International/Вклад в исследования табака . 27 (2): 54–59. дои : 10.1515/cttr-2016-0008 .
- ^ Хеннингфилд Дж. Э., Целлер М. (март 2006 г.). «Вклад исследований в области никотиновой психофармакологии в США и глобальное регулирование табакокурения: взгляд назад и взгляд вперед». Психофармакология . 184 (3–4): 286–91. дои : 10.1007/s00213-006-0308-4 . ПМИД 16463054 . S2CID 38290573 .
- ^ Поссельт В., Рейман Л. (1828). «Химическое исследование табака и получение характерно активного компонента этого растения» . Журнал аптеки (на немецком языке). 6 (24): 138–161.
- ^ Мельсенс Л.Х. (1843 г.). «Note sur la nicotin» [Заметка о никотине]. Annales de Chimie et de Physique . третья серия (на французском языке). 9 : 465–479, см. особенно стр. 470. [Примечание: эмпирическая формула, которую приводит Мелсенс, неверна, поскольку в то время химики использовали неправильную атомную массу углерода (6 вместо 12).]
- ^ Пиннер А., Вольфенштейн Р. (1891). «Уэбер Никотин» [О никотине]. Отчеты Немецкого химического общества (на немецком языке). 24 : 1373–1377. дои : 10.1002/cber.189102401242 .
- ^ Пиннер А (1893 г.). «О никотине: Конституция алкалоидов». Отчеты Немецкого химического общества (на немецком языке). 26 :292-305. дои : 10.1002/cber.18930260165 .
- ^ Пиннер А (1893 г.). «О никотине. I. Общение» . Архив аптеки . 231 (5–6): 378–448. дои : 10.1002/ardp.18932310508 . S2CID 83703998 .
- ^ Чжан С. «Электронные сигареты станут безтабачными с синтетическим никотином» . Проводной . ISSN 1059-1028 . Проверено 11 октября 2022 г.
- ^ Перейти обратно: а б Дейл М.М., Риттер Дж.М., Фаулер Р.Дж., Ранг Х.П. Фармакология Ранг и Дейла (6-е изд.). Черчилль Ливингстон. п. 598. ИСБН 978-0-8089-2354-1 .
- ^ Коннолли Дж.Н., Альперт Х.Р., Уэйн Г.Ф., Ко Х (октябрь 2007 г.). «Тенденции по выделению никотина в дыме и его взаимосвязь с конструктивными характеристиками среди популярных марок сигарет в США, 1997–2005 гг.» . Контроль над табаком . 16 (5): e5. дои : 10.1136/tc.2006.019695 . ПМЦ 2598548 . ПМИД 17897974 .
- ^ «Библиотека отраслевых документов» . www.industrydocuments.ucsf.edu . Проверено 11 октября 2022 г.
- ^ Джуэтт С. (8 марта 2022 г.). «Лазейка, которая способствует возвращению к подростковому вейпингу» . Нью-Йорк Таймс . ISSN 0362-4331 . Проверено 11 октября 2022 г.
- ^ Джуэтт С. (8 марта 2022 г.). «Лазейка, которая способствует возвращению к подростковому вейпингу» . Нью-Йорк Таймс . ISSN 0362-4331 . Проверено 11 октября 2022 г.
- ^ Йордт SE (сентябрь 2021 г.). «Прибыл синтетический никотин» . Контроль над табаком . 32 (e1): борьба против табака – 2021–056626. doi : 10.1136/tobaccocontrol-2021-056626 . ПМЦ 8898991 . ПМИД 34493630 .
- ^ Центр табачных изделий (26 сентября 2022 г.). «Табак 21» . FDA .
- ^ «21, 18 или 14 лет: взгляд на возраст, с которого разрешено курение во всем мире» . Стрейтс Таймс . 3 октября 2017 г. Проверено 1 марта 2019 г.
- ^ Перейти обратно: а б Джейкоб М. (1 марта 1985 г.). «Супермен против Ника О'Тина — детская кампания по борьбе с курением». Журнал санитарного просвещения . 44 (1): 15–18. дои : 10.1177/001789698504400104 . S2CID 71246970 .
- ^ Беккер Р. (26 апреля 2019 г.). «Почему Big Tobacco и Big Vape любят сравнивать никотин с кофеином» . Грань .
- ^ Минёр Ю.С., Пиччотто М.Р. (декабрь 2010 г.). «Никотиновые рецепторы и депрессия: пересмотр и пересмотр холинергической гипотезы» . Тенденции в фармакологических науках . 31 (12): 580–6. дои : 10.1016/j.tips.2010.09.004 . ПМЦ 2991594 . ПМИД 20965579 .
- ^ Питерс Р., Поултер Р., Уорнер Дж., Беккет Н., Берч Л., Булпитт С. (декабрь 2008 г.). «Курение, деменция и снижение когнитивных функций у пожилых людей, систематический обзор» . BMC Гериатрия . 8:36 . дои : 10.1186/1471-2318-8-36 . ПМЦ 2642819 . ПМИД 19105840 .
- ^ Хеннингфилд Дж. Э., Целлер М. (2009). «Никотиновая психофармакология: политика и регулирование». Никотиновая психофармакология . Справочник по экспериментальной фармакологии. Том. 192. стр. 511–34. дои : 10.1007/978-3-540-69248-5_18 . ISBN 978-3-540-69246-1 . ПМИД 19184661 .
- ^ Квик М., О'Лири К., Таннер С.М. (сентябрь 2008 г.). «Никотин и болезнь Паркинсона: значение для терапии» . Двигательные расстройства . 23 (12): 1641–52. дои : 10.1002/mds.21900 . ПМК 4430096 . ПМИД 18683238 .
- ^ Перейти обратно: а б Фуджи Т., Машимо М., Мориваки Ю., Мисава Х., Оно С., Хоригучи К. и др. (2017). «Экспрессия и функция холинергической системы в иммунных клетках» . Границы в иммунологии . 8 : 1085. дои : 10.3389/fimmu.2017.01085 . ПМЦ 5592202 . ПМИД 28932225 .
- ^ Банала С., Арвин М.К., Бэннон Н.М., Джин ХТ, Маклин Дж.Дж., Ван Ю. и др. (май 2018 г.). «Фотоактивируемые препараты никотиновой оптофармакологии» . Природные методы . 15 (5): 347–350. дои : 10.1038/nmeth.4637 . ПМЦ 5923430 . ПМИД 29578537 .
- ^ Холлидей Р.С., Кэмпбелл Дж., Прешоу П.М. (июль 2019 г.). «Влияние никотина на десны, периодонтальную связку и эпителиальные клетки полости рта человека. Систематический обзор литературы». Журнал стоматологии . 86 : 81–88. дои : 10.1016/j.jdent.2019.05.030 . ПМИД 31136818 . S2CID 169035502 .
- ^ Холлидей Р., Прешоу П.М., Райан В., Сниехотта Ф.Ф., Макдональд С., Баулд Л. и др. (4 июня 2019 г.). «Технико-экономическое обоснование со встроенным пилотным рандомизированным контролируемым исследованием и оценкой процесса использования электронных сигарет для прекращения курения у пациентов с пародонтитом» . Пилотные и технико-экономические исследования . 5 (1): 74. дои : 10.1186/s40814-019-0451-4 . ПМК 6547559 . ПМИД 31171977 .
Внешние ссылки
[ редактировать ]- Алкалоиды найдены в Erythroxylum coca.
- Алкалоиды обнаружены в Никотиане
- Аноректики
- Препараты, разработанные Pfizer
- Препараты, разработанные GSK plc.
- Анксиолитики
- Эйфорианты
- Никотиновые агонисты
- Никотиновые антагонисты
- Инсектициды растительного токсина
- Агонисты рецепторов прегнана X
- Пиридиновые алкалоиды
- Пирролидиновые алкалоиды
- Курение
- Стимуляторы
- тератогенный
- 3-пиридиловые соединения





