Экспрессия генов
| Часть серии о |
| Биохимия |
|---|
 |
Экспрессия гена — это процесс, посредством которого информация гена используется в синтезе функционального генного продукта , который позволяет ему производить конечные продукты, белки или некодирующую РНК , и в конечном итоге влиять на фенотип . Эти продукты часто являются белками , но в генах, не кодирующих белок, таких как транспортная РНК (тРНК) и малая ядерная РНК (мяРНК) , продуктом является функциональная некодирующая РНК .Процесс экспрессии генов используется всеми известными формами жизни — эукариотами (включая многоклеточные организмы ), прокариотами ( бактериями и архей ), а также вирусами — для создания макромолекулярного механизма жизни.
В генетике экспрессия генов является наиболее фундаментальным уровнем, на котором генотип порождает фенотип , то есть наблюдаемый признак. Генетическая информация, хранящаяся в ДНК, представляет собой генотип, тогда как фенотип является результатом «интерпретации» этой информации. Такие фенотипы часто проявляются в синтезе белков, которые контролируют структуру и развитие организма или действуют как ферменты, катализирующие определенные метаболические пути.
Все этапы процесса экспрессии генов можно модулировать (регулировать), включая транскрипцию , сплайсинг РНК , трансляцию и посттрансляционную модификацию белка. Регуляция экспрессии генов обеспечивает контроль над временем, местоположением и количеством данного генного продукта (белка или нкРНК), присутствующего в клетке, и может оказывать глубокое влияние на клеточную структуру и функцию. Регуляция экспрессии генов является основой клеточной дифференциации , развития , морфогенеза , а также универсальности и адаптивности любого организма . Таким образом, регуляция генов может служить субстратом для эволюционных изменений.
Механизм
[ редактировать ]Транскрипция
[ редактировать ]
Производство копии РНК из цепи ДНК называется транскрипцией и осуществляется РНК-полимеразами , которые добавляют по одному рибонуклеотиду за раз к растущей цепи РНК в соответствии с законом комплементарности нуклеотидных оснований. Эта РНК комплементарна матричной цепи ДНК 3' → 5', [1] за исключением тиминов замены (Т) на урацилы (U) в РНК и возможных ошибок.
У бактерий транскрипция осуществляется одним типом РНК-полимеразы, которой необходимо связать последовательность ДНК, называемую коробкой Прибнова, с помощью белка сигма-фактора (σ-фактора), чтобы начать транскрипцию. У эукариот транскрипция осуществляется в ядре тремя типами РНК-полимераз, каждому из которых для необходима особая последовательность ДНК, называемая промотором , и набор ДНК-связывающих белков — факторов транскрипции инициации процесса (см. регуляцию транскрипции ниже). . РНК-полимераза I отвечает за транскрипцию генов рибосомальной РНК (рРНК). РНК-полимераза II (Pol II) транскрибирует все гены, кодирующие белки, а также некоторые некодирующие РНК ( например , мяРНК, мяРНК или длинные некодирующие РНК ). РНК-полимераза III транскрибирует 5S рРНК , гены транспортных РНК (тРНК) и некоторые небольшие некодирующие РНК ( например , 7SK ). Транскрипция заканчивается, когда полимераза встречает последовательность, называемую терминатором .
обработка мРНК
[ редактировать ]В то время как транскрипция генов, кодирующих прокариотические белки, создает информационную РНК (мРНК), готовую к трансляции в белок, транскрипция эукариотических генов оставляет первичный транскрипт РНК (пре-РНК), который сначала должен претерпеть ряд модификаций, чтобы стать зрелая РНК. Типы и этапы процессов созревания различаются между кодирующими и некодирующими преРНК; т.е. даже несмотря на то, что молекулы преРНК как для мРНК, так и для тРНК подвергаются сплайсингу, этапы и задействованные механизмы различны. [2] Процессинг некодирующей РНК описан ниже (созревание некодирующей РНК).
Процессинг пре-мРНК включает в себя 5'- кэпирование , которое представляет собой набор ферментативных реакций, в ходе которых добавляется 7-метилгуанозин (м 7 G) к 5'-концу пре-мРНК и, таким образом, защищают РНК от деградации экзонуклеазами . [3] Их 7 Затем G-кэп связывается с гетеродимером кэп-связывающего комплекса (CBC20/CBC80), который способствует экспорту мРНК в цитоплазму, а также защищает РНК от декэпирования . [4]
Другой модификацией является 3'- расщепление и полиаденилирование . [5] Они возникают, если сигнальная последовательность полиаденилирования (5'-AAUAAA-3') присутствует в пре-мРНК, которая обычно находится между последовательностью, кодирующей белок, и терминатором. [6] Пре-мРНК сначала расщепляется, а затем добавляется серия из ~200 аденинов (А) с образованием поли(А)-хвоста, который защищает РНК от деградации. [7] Поли(А)-хвост связан с множеством поли(А)-связывающих белков (PABP), необходимых для экспорта мРНК и повторной инициации трансляции. [8] В обратном процессе деаденилирования хвосты поли(А) укорачиваются 3'-5' экзонуклеазой CCR4-Not , что часто приводит к полному распаду транскрипта. [9]
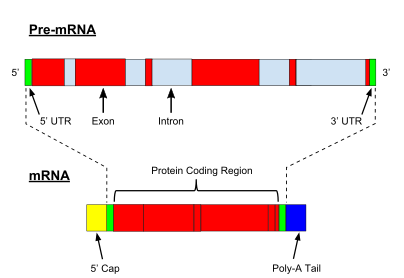
Очень важной модификацией пре-мРНК эукариот является сплайсинг РНК . Большинство эукариотических пре-мРНК состоят из чередующихся сегментов, называемых экзонами и интронами . [10] В процессе сплайсинга каталитический комплекс РНК-белок, известный как сплайсосома, катализирует две реакции переэтерификации , которые удаляют интрон и высвобождают его в форме лариатной структуры, а затем соединяют соседние экзоны вместе. [11] В определенных случаях некоторые интроны или экзоны могут быть удалены или сохранены в зрелой мРНК. [12] Этот так называемый альтернативный сплайсинг создает серию различных транскриптов, происходящих от одного гена. Поскольку эти транскрипты потенциально могут транслироваться в различные белки, сплайсинг увеличивает сложность экспрессии эукариотических генов и размер видового протеома . [13]
Обширный процессинг РНК может быть эволюционным преимуществом, которое стало возможным благодаря ядру эукариот. У прокариот транскрипция и трансляция происходят одновременно, тогда как у эукариот ядерная мембрана разделяет эти два процесса, давая время для процессинга РНК. [14]
Созревание некодирующей РНК
[ редактировать ]В большинстве организмов некодирующие гены (нкРНК) транскрибируются как предшественники, которые подвергаются дальнейшему процессингу. В случае рибосомальных РНК (рРНК) они часто транскрибируются как пре-рРНК, которая содержит одну или несколько рРНК. Пре-рРНК расщепляется и модифицируется ( 2'- О -метилирование и образование псевдоуридина ) в определенных сайтах примерно 150 различными небольшими видами РНК, ограниченными ядрышком, называемыми мякРНК. SnoRNAs связываются с белками, образуя snoRNP. В то время как часть мякРНК спаривается с целевой РНК и, таким образом, позиционирует модификацию в точном месте, белковая часть выполняет каталитическую реакцию. У эукариотов, в частности, мяРНП, называемая РНКазой, MRP расщепляет 45S пре-рРНК на 28S , 5,8S и 18S рРНК . Факторы процессинга рРНК и РНК образуют большие агрегаты, называемые ядрышками . [15]
Например, в случае транспортной РНК (тРНК) 5'-последовательность удаляется Р. РНКазой [16] тогда как 3'-конец удаляется ферментом Z тРНКаза [17] и нематрицированный 3'-CCA-хвост добавляется нуклеотидилтрансферазой . [18] В случае микроРНК (миРНК) микроРНК сначала транскрибируются как первичные транскрипты или при-миРНК с кепкой и поли-А-хвостом и процессируются в короткие 70-нуклеотидные структуры «стебель-петля», известные как пре-миРНК в ядре клетки. ферментами Дроша и Паша . После экспорта он затем обрабатывается для созревания микроРНК в цитоплазме путем взаимодействия с эндонуклеазой Dicer , которая также инициирует образование РНК-индуцированного комплекса молчания (RISC) , состоящего из белка Argonaute .
Даже мяРНК и сами мяРНК претерпевают ряд модификаций, прежде чем они станут частью функционального комплекса РНП. [19] Это делается либо в нуклеоплазме, либо в специализированных отсеках, называемых тельцами Кахаля . [20] Их основания метилированы или псевдоуридинилированы группой малых специфичных для тела Кахаля РНК (scaRNA) , которые структурно сходны с мякРНК. [21]
Экспорт РНК
[ редактировать ]У эукариот наиболее зрелая РНК должна экспортироваться в цитоплазму из ядра . Хотя некоторые РНК функционируют в ядре, многие РНК транспортируются через ядерные поры в цитозоль . [22] Экспорт РНК требует ассоциации со специфическими белками, известными как экспортины. За экспорт определенного типа РНК отвечают специфические молекулы экспортина. Транспорт мРНК также требует правильной ассоциации с комплексом экзонов (EJC), который гарантирует завершение правильной обработки мРНК перед экспортом. В некоторых случаях РНК дополнительно транспортируются в определенную часть цитоплазмы, например в синапс ; затем их буксируют моторные белки , которые связываются через линкерные белки со специфическими последовательностями (называемыми «зипкодами») на РНК. [23]
Перевод
[ редактировать ]Для некоторых некодирующих РНК зрелая РНК является конечным продуктом гена. [24] В случае информационной РНК (мРНК) РНК является носителем информации, кодирующим синтез одного или нескольких белков. мРНК, несущая одну белковую последовательность (часто встречающаяся у эукариот), является моноцистронной , тогда как мРНК, несущая несколько белковых последовательностей (распространенная у прокариот), известна как полицистронная .

Каждая мРНК состоит из трех частей: 5'-нетранслируемой области (5'-UTR), белково-кодирующей области или открытой рамки считывания (ORF) и 3'-нетранслируемой области (3'-UTR). Кодирующая область несет информацию для синтеза белка, закодированную генетическим кодом, с образованием триплетов. Каждый триплет нуклеотидов кодирующей области называется кодоном и соответствует участку связывания, комплементарному триплету антикодона в транспортной РНК. одинакового типа Транспортные РНК с одинаковой последовательностью антикодонов всегда несут аминокислоты . Затем аминокислоты соединяются рибосомой в соответствии с порядком триплетов в кодирующей области. Рибосома помогает транспортной РНК связываться с информационной РНК, забирает аминокислоту из каждой транспортной РНК и создает из нее бесструктурный белок. [25] [26] Каждая молекула мРНК транслируется во множество белковых молекул, в среднем около 2800 у млекопитающих. [27] [28]
У прокариот трансляция обычно происходит в точке транскрипции (котранскрипционно), часто с использованием информационной РНК, которая все еще находится в процессе создания. У эукариот трансляция может происходить в различных областях клетки в зависимости от того, где должен находиться записываемый белок. Основными местами локализации являются цитоплазма растворимых цитоплазматических белков и мембрана эндоплазматического ретикулума для белков, которые предназначены для экспорта из клетки или для встраивания в клеточную мембрану . Белки, которые, как предполагается, производятся в эндоплазматическом ретикулуме, распознаются на полпути процесса трансляции. Этим управляет частица распознавания сигнала — белок, который связывается с рибосомой и направляет ее в эндоплазматический ретикулум, когда обнаруживает сигнальный пептид на растущей (зарождающейся) аминокислотной цепи. [29]
Складной
[ редактировать ]
Каждый белок существует как развернутый полипептид или случайный клубок при трансляции из последовательности мРНК в линейную цепь аминокислот . У этого полипептида отсутствует развитая трехмерная структура (левая часть соседнего рисунка). Затем полипептид сворачивается в свою характерную и функциональную трехмерную структуру из случайного спираля . [30] Аминокислоты взаимодействуют друг с другом, образуя четко определенную трехмерную структуру — свернутый белок (правая часть рисунка), известный как нативное состояние . Получающаяся трехмерная структура определяется аминокислотной последовательностью ( догма Анфинсена ). [31]
Правильная трехмерная структура необходима для функционирования, хотя некоторые части функциональных белков могут оставаться развернутыми . [32] Неспособность свернуться в заданную форму обычно приводит к образованию неактивных белков с различными свойствами, включая токсичные прионы . Считается, что некоторые нейродегенеративные и другие заболевания возникают в результате накопления неправильно свернутых белков. [33] Многие аллергии вызваны сворачиванием белков, поскольку иммунная система не вырабатывает антитела к определенным белковым структурам. [34]
Ферменты, называемые шаперонами, помогают вновь образовавшемуся белку достичь ( свернуться ) трехмерной структуры, необходимой для его функционирования. [35] Точно так же шапероны РНК помогают РНК обрести свою функциональную форму. [36] Помощь в сворачивании белков — одна из основных функций эндоплазматической сети у эукариот.
Транслокация
[ редактировать ]Секреторные белки эукариот или прокариот должны быть транслоцированы, чтобы войти в секреторный путь. Вновь синтезированные белки направляются в эукариотический канал транслокации Sec61 или прокариотический SecYEG с помощью сигнальных пептидов . Эффективность секреции белка у эукариот во многом зависит от сигнального пептида . использованного [37]
Белковый транспорт
[ редактировать ]Многие белки предназначены для других частей клетки, помимо цитозоля, и широкий спектр сигнальных последовательностей или (сигнальных пептидов) используется для направления белков туда, где они должны быть. [38] [39] У прокариот это обычно простой процесс из-за ограниченной компартментализации клетки. [40] Однако у эукариот существует множество различных процессов нацеливания, обеспечивающих попадание белка в нужную органеллу. [41]
Не все белки остаются внутри клетки, а многие экспортируются, например, пищеварительные ферменты , гормоны и внеклеточного матрикса белки . У эукариот путь экспорта хорошо развит, и основным механизмом экспорта этих белков является транслокация в эндоплазматический ретикулум с последующим транспортом через аппарат Гольджи . [42] [43]
Регуляция экспрессии генов
[ редактировать ]
Регуляция экспрессии генов — это контроль количества и сроков появления функционального продукта гена. Контроль экспрессии жизненно важен для того, чтобы позволить клетке производить необходимые ей генные продукты тогда, когда они ей нужны; в свою очередь, это дает клеткам возможность адаптироваться к изменяющейся среде, внешним сигналам, повреждениям клетки и другим раздражителям. В более общем смысле, регуляция генов дает клетке контроль над всей структурой и функциями и является основой клеточной дифференциации , морфогенеза , а также универсальности и адаптивности любого организма.
Для описания типов генов используются многочисленные термины в зависимости от того, как они регулируются; к ним относятся:
- Конститутивный ген — это ген, который транскрибируется постоянно, в отличие от факультативного гена, который транскрибируется только при необходимости.
- Ген «домашнего хозяйства» — это ген, который необходим для поддержания основных клеточных функций и поэтому обычно экспрессируется во всех типах клеток организма. Примеры включают актин , GAPDH и убиквитин . Некоторые гены «домашнего хозяйства» транскрибируются с относительно постоянной скоростью, и эти гены можно использовать в качестве ориентира в экспериментах по измерению скорости экспрессии других генов.
- Факультативный ген — это ген, транскрибируемый только при необходимости, в отличие от конститутивного гена.
- Индуцибельный ген — это ген, экспрессия которого либо реагирует на изменения окружающей среды, либо зависит от положения в клеточном цикле.
Любой этап экспрессии гена можно модулировать, от этапа транскрипции ДНК-РНК до посттрансляционной модификации белка. Стабильность конечного продукта гена, будь то РНК или белок, также способствует уровню экспрессии гена: нестабильный продукт приводит к низкому уровню экспрессии. В целом экспрессия генов регулируется посредством изменений [44] в количестве и типе взаимодействий между молекулами [45] которые в совокупности влияют на транскрипцию ДНК [46] и трансляция РНК. [47]
Вот несколько простых примеров того, где важна экспрессия генов:
- Контроль экспрессии инсулина , чтобы он давал сигнал для регуляции уровня глюкозы в крови .
- Инактивация Х-хромосомы у самок млекопитающих для предотвращения «передозировки» содержащихся в ней генов.
- Уровни экспрессии циклина контролируют развитие эукариотического клеточного цикла .
Транскрипционная регуляция
[ редактировать ]
Регуляцию транскрипции можно разделить на три основных пути влияния; генетический (прямое взаимодействие фактора контроля с геном), модуляционное взаимодействие фактора контроля с аппаратом транскрипции и эпигенетический (непоследовательные изменения в структуре ДНК, влияющие на транскрипцию). [48] [49]

Прямое взаимодействие с ДНК — самый простой и прямой метод изменения уровня транскрипции белка. [50] Гены часто имеют несколько сайтов связывания белков вокруг кодирующей области со специфической функцией регулирования транскрипции. [51] Существует много классов регуляторных сайтов связывания ДНК, известных как энхансеры , инсуляторы и сайленсеры . [52] Механизмы регуляции транскрипции разнообразны: от блокирования ключевых сайтов связывания РНК-полимеразы на ДНК до действия в качестве активатора и стимулирования транскрипции, помогая связыванию РНК-полимеразы. [53]
Активность факторов транскрипции дополнительно модулируется внутриклеточными сигналами, вызывающими посттрансляционную модификацию белка, включая фосфорилирование , ацетилирование или гликозилирование . [54] Эти изменения влияют на способность фактора транскрипции прямо или косвенно связываться с промотором ДНК, рекрутировать РНК-полимеразу или способствовать удлинению вновь синтезированной молекулы РНК. [55]
Ядерная мембрана у эукариот позволяет осуществлять дальнейшую регуляцию факторов транскрипции за счет продолжительности их присутствия в ядре, что регулируется обратимыми изменениями их структуры и связыванием других белков. [56] Стимулы окружающей среды или эндокринные сигналы [57] может вызывать модификацию регуляторных белков [58] вызывая каскады внутриклеточных сигналов, [59] которые приводят к регуляции экспрессии генов.
Стало очевидным, что существует значительное влияние специфичных эффектов, не связанных с последовательностями ДНК, на транскрипцию. [60] Эти эффекты называются эпигенетическими и включают структуру ДНК более высокого порядка, ДНК-связывающие белки, не специфичные для последовательности, и химическую модификацию ДНК. [61] В целом эпигенетические эффекты изменяют доступность ДНК для белков и тем самым модулируют транскрипцию. [62]

У эукариот структура хроматина , контролируемая кодом гистонов , регулирует доступ к ДНК, оказывая значительное влияние на экспрессию генов в эухроматина и гетерохроматина . областях [63]
Энхансеры, факторы транскрипции, медиаторный комплекс и петли ДНК в транскрипции млекопитающих
[ редактировать ]
Экспрессия генов у млекопитающих регулируется многими цис-регуляторными элементами , включая коровые промоторы и проксимальные промоторные элементы , которые расположены рядом с сайтами начала транскрипции генов, выше по ДНК (по направлению к 5'-области смысловой цепи ). Другие важные цис-регуляторные модули локализованы в участках ДНК, удаленных от сайтов начала транскрипции. К ним относятся усилители , глушители , изоляторы и привязывающие элементы. [64] Энхансеры и связанные с ними факторы транскрипции играют ведущую роль в регуляции экспрессии генов. [65]
Энхансеры — это области генома, которые регулируют гены. Энхансеры контролируют программы экспрессии генов, специфичные для конкретного типа клеток, чаще всего преодолевая большие расстояния, чтобы оказаться в физической близости с промоторами своих генов-мишеней. [66] Множественные энхансеры, каждый из которых часто находится на расстоянии десятков или сотен тысяч нуклеотидов от генов-мишеней, соединяются с промоторами генов-мишеней и координируются друг с другом, чтобы контролировать экспрессию генов. [66]
На иллюстрации показан энхансер, вращающийся вокруг, чтобы приблизиться к промотору целевого гена. Петля стабилизируется димером соединительного белка (например, димером CTCF или YY1 ). Один член димера прикреплен к своему мотиву связывания на энхансере, а другой член прикреплен к своему мотиву связывания на промоторе (представлен красным зигзагом на иллюстрации). [67] Несколько факторов транскрипции, специфичных для клеточных функций (среди примерно 1600 факторов транскрипции в клетке человека) [68] обычно связываются со специфическими мотивами энхансера. [69] Небольшая комбинация этих связанных с энхансером факторов транскрипции, когда они приближаются к промотору с помощью петли ДНК, регулирует уровень транскрипции целевого гена. Медиатор (комплекс, обычно состоящий примерно из 26 белков во взаимодействующей структуре) передает регуляторные сигналы от энхансерных ДНК-связанных факторов транскрипции непосредственно ферменту РНК-полимеразы II (pol II), связанному с промотором. [70]
Энхансеры, когда они активны, обычно транскрибируются с обеих цепей ДНК с помощью РНК-полимераз, действующих в двух разных направлениях, образуя две эРНК, как показано на рисунке. [71] Неактивный энхансер может быть связан с неактивным фактором транскрипции. Фосфорилирование фактора транскрипции может активировать его, и этот активированный фактор транскрипции может затем активировать энхансер, с которым он связан (см. маленькую красную звездочку, обозначающую фосфорилирование фактора транскрипции, связанного с энхансером, на иллюстрации). [72] Активированный энхансер начинает транскрипцию своей РНК до активации транскрипции информационной РНК из своего гена-мишени. [73]
Метилирование и деметилирование ДНК в регуляции транскрипции
[ редактировать ]
Метилирование ДНК является широко распространенным механизмом эпигенетического влияния на экспрессию генов, наблюдается у бактерий и эукариот и играет роль в наследственном подавлении транскрипции и регуляции транскрипции. Метилирование чаще всего происходит на цитозине (см. рисунок). Метилирование цитозина в основном происходит в динуклеотидных последовательностях, где за цитозином следует гуанин, сайт CpG . Число CpG-сайтов в геноме человека составляет около 28 миллионов. [74] В зависимости от типа клетки около 70% CpG-сайтов содержат метилированный цитозин. [75]
Метилирование цитозина в ДНК играет важную роль в регуляции экспрессии генов. Метилирование CpG в промоторной области гена обычно подавляет транскрипцию гена. [76] в то время как метилирование CpG в теле гена увеличивает экспрессию. [77] Ферменты ТЕТ играют центральную роль в деметилировании метилированных цитозинов. Деметилирование CpG в промоторе гена под действием фермента TET увеличивает транскрипцию гена. [78]
Транскрипционная регуляция обучения и памяти
[ редактировать ]
Для крыс контекстуальное обусловливание страха (CFC) представляет собой болезненный опыт обучения. Всего лишь один эпизод ХФУ может привести к появлению страшных воспоминаний на всю жизнь. [79] После эпизода ХФК метилирование цитозина изменяется в промоторных областях примерно 9,17% всех генов в ДНК нейронов гиппокампа крысы. [80] Гиппокамп — это место, где изначально хранятся новые воспоминания. После CFC около 500 генов имеют повышенную транскрипцию (часто из-за деметилирования сайтов CpG в промоторной области) и около 1000 генов имеют пониженную транскрипцию (часто из-за новообразованного 5-метилцитозина в сайтах CpG в промоторной области). Паттерн индуцированных и репрессированных генов в нейронах, по-видимому, обеспечивает молекулярную основу для формирования первых временных воспоминаний об этом тренировочном событии в гиппокампе мозга крысы. [80]
некоторые специфические механизмы, управляющие новым метилированием ДНК и новым деметилированием ДНК в гиппокампе во время формирования памяти (см. Были установлены [81] для резюме). Один из механизмов включает в себя направление короткой изоформы TET1 фермента деметилирования ДНК , TET1, примерно в 600 мест генома. Управление осуществляется путем ассоциации TET1 с белком EGR1 , фактором транскрипции, важным для формирования памяти. Прибытие TET1 в эти места инициирует деметилирование ДНК в этих местах, активируя связанные гены. Второй механизм включает DNMT3A2, сплайс-изоформу ДНК-метилтрансферазы DNMT3A, которая добавляет метильные группы к цитозинам в ДНК. Эта изоформа индуцируется синаптической активностью, и место ее действия, по-видимому, определяется гистонов посттрансляционными модификациями ( гистоновый код ). Полученные новые матричные РНК затем транспортируются информационными частицами РНП (нейрональными гранулами) к синапсам нейронов, где они могут транслироваться в белки, влияющие на активность синапсов. [81]
В частности, ген нейротрофического фактора головного мозга ( BDNF ) известен как «ген обучения». [82] После CFC наблюдалась активация экспрессии гена BDNF , связанная со снижением метилирования CpG некоторых внутренних промоторов гена, и это коррелировало с обучением. [82]
Регуляция транскрипции при раке
[ редактировать ]Большинство промоторов генов содержат островок CpG с многочисленными сайтами CpG . [83] Когда многие сайты CpG промотора гена метилированы, ген замолкает. [84] Колоректальный рак обычно имеет от 3 до 6 мутаций водителя и от 33 до 66 мутаций автостопщика или пассажира. [85] Однако подавление транскрипции может иметь большее значение, чем мутация, в возникновении рака. Например, при колоректальном раке около 600–800 генов транскрипционно подавляются в результате метилирования CpG-островков (см. Регуляция транскрипции при раке ). Репрессия транскрипции при раке может также происходить за счет других эпигенетических механизмов, таких как изменение экспрессии микроРНК . [86] При раке молочной железы репрессия транскрипции BRCA1 может происходить чаще из-за чрезмерной транскрипции микроРНК-182, чем из-за гиперметилирования промотора BRCA1 (см. Низкая экспрессия BRCA1 при раке молочной железы и яичников ).
Посттранскрипционная регуляция
[ редактировать ]Считается, что у эукариот, где экспорт РНК необходим до того, как станет возможной трансляция, ядерный экспорт обеспечивает дополнительный контроль над экспрессией генов. Весь транспорт в ядро и из ядра осуществляется через ядерную пору , и транспорт контролируется широким спектром белков импортина и экспортина . [87]
Экспрессия гена, кодирующего белок, возможна только в том случае, если информационная РНК, несущая код, выживает достаточно долго для трансляции. [41] В типичной клетке молекула РНК стабильна только в том случае, если она специально защищена от деградации. [88] Деградация РНК имеет особое значение для регуляции экспрессии в эукариотических клетках, где мРНК должна преодолевать значительные расстояния, прежде чем транслироваться. [89] У эукариот РНК стабилизируется за счет определенных посттранскрипционных модификаций, в частности 5'-кэпа и полиаденилированного хвоста . [90]
Намеренная деградация мРНК используется не только как механизм защиты от чужеродной РНК (обычно от вирусов), но и как путь дестабилизации мРНК . [91] Если молекула мРНК имеет последовательность, комплементарную небольшой интерферирующей РНК , то она подвергается разрушению посредством пути РНК-интерференции . [92]
Три основных нетранслируемых региона и микроРНК
[ редактировать ]Три основных нетранслируемых участка (3'UTR) информационных РНК (мРНК) часто содержат регуляторные последовательности, которые посттранскрипционно влияют на экспрессию генов. Такие 3'-UTR часто содержат как сайты связывания микроРНК (миРНК), так и регуляторные белки. [93] Связываясь со специфическими сайтами внутри 3'-UTR, микроРНК могут снижать экспрессию генов различных мРНК, либо ингибируя трансляцию, либо непосредственно вызывая деградацию транскрипта. [94] 3'-UTR также может иметь участки сайленсера, которые связывают белки-репрессоры, ингибирующие экспрессию мРНК. [95]
3'-UTR часто содержит элементы ответа микроРНК (MRE) . MRE — это последовательности, с которыми связываются микроРНК. Это преобладающие мотивы в 3'-UTR. Среди всех регуляторных мотивов внутри 3'-UTR (например, включая сайленсеры), MRE составляют около половины мотивов. [96]
По состоянию на 2014 год miRBase веб-сайт [97] архив микроРНК последовательностей и аннотаций содержит 28 645 записей о 233 биологических видах. Из них 1881 микроРНК находились в аннотированных локусах микроРНК человека. Было предсказано, что микроРНК содержат в среднем около четырехсот целевых мРНК (влияющих на экспрессию нескольких сотен генов). [98] Фридман и др. [98] подсчитали, что> 45 000 целевых сайтов микроРНК в 3'UTR мРНК человека консервативны выше фоновых уровней, и> 60% генов, кодирующих белки человека, находились под селективным давлением для поддержания спаривания с микроРНК.
Прямые эксперименты показывают, что одна микроРНК может снизить стабильность сотен уникальных мРНК. [99] Другие эксперименты показывают, что одна микроРНК может подавлять продукцию сотен белков, но эта репрессия часто бывает относительно легкой (менее чем в 2 раза). [100] [101]
Эффекты нарушения регуляции экспрессии генов микроРНК, по-видимому, важны при раке. [102] Например, при раке желудочно-кишечного тракта девять микроРНК были идентифицированы как эпигенетически измененные и эффективные в подавлении ферментов репарации ДНК. [103]
Эффекты нарушения регуляции экспрессии генов микроРНК также кажутся важными при нервно-психических расстройствах, таких как шизофрения, биполярное расстройство, большая депрессия, болезнь Паркинсона, болезнь Альцгеймера и расстройства аутистического спектра. [104] [105]
Трансляционная регуляция
[ редактировать ]
Прямая регуляция трансляции менее распространена, чем контроль транскрипции или стабильности мРНК, но иногда используется. [106] Ингибирование трансляции белка является основной мишенью для токсинов и антибиотиков , поэтому они могут убить клетку, игнорируя ее нормальный контроль экспрессии генов. [107] Ингибиторы синтеза белка включают антибиотик неомицин и токсин рицин . [108]
Посттрансляционные модификации
[ редактировать ]Посттрансляционные модификации (ПТМ) представляют собой ковалентные модификации белков. Подобно сплайсингу РНК, они помогают значительно разнообразить протеом. Эти модификации обычно катализируются ферментами. Кроме того, такие процессы, как ковалентное присоединение к остаткам боковой цепи аминокислот, часто могут быть обращены вспять другими ферментами. Однако некоторые из них, например протеолитическое расщепление белкового остова, необратимы. [109]
ПТМ играют много важных ролей в клетке. [110] Например, фосфорилирование в первую очередь участвует в активации и деактивации белков, а также в сигнальных путях. [111] PTM участвуют в регуляции транскрипции: важной функцией ацетилирования и метилирования является модификация хвоста гистонов, которая изменяет доступность ДНК для транскрипции. [109] Их также можно увидеть в иммунной системе, где гликозилирование играет ключевую роль. [112] Один тип PTM может инициировать другой тип PTM, как можно видеть на примере того, как убиквитинирование помечает белки для деградации посредством протеолиза. [109] Протеолиз, помимо расщепления белков, также важен для их активации и деактивации, а также для регулирования биологических процессов, таких как транскрипция ДНК и гибель клеток. [113]
Измерение
[ редактировать ]
Измерение экспрессии генов является важной частью многих наук о жизни , поскольку возможность количественного определения уровня экспрессии определенного гена в клетке, ткани или организме может предоставить много ценной информации. Например, измерение экспрессии генов может:
- Определить вирусную инфекцию клетки ( экспрессия вирусного белка ).
- Определить предрасположенность человека к раку ( экспрессия онкогена ).
- Определите, устойчива ли бактерия к пенициллину ( экспрессия бета-лактамазы ).
- Профилирование экспрессии генов оценивает группу генов, чтобы помочь понять фундаментальный механизм клетки. Это все чаще используется в терапии рака для нацеливания на специфическую химиотерапию. ( Подробную информацию см . в разделах RNA-Seq и DNA_microarray .)
Точно так же анализ места экспрессии белка является мощным инструментом, и его можно проводить в организменном или клеточном масштабе. Исследование локализации особенно важно для изучения развития многоклеточных организмов и как индикатор функции белка в одиночных клетках. В идеале измерение экспрессии осуществляется путем обнаружения конечного продукта гена (для многих генов это белок); однако зачастую легче обнаружить один из предшественников, обычно мРНК , и сделать вывод об уровнях экспрессии генов на основе этих измерений.
количественное определение мРНК
[ редактировать ]Уровни мРНК можно количественно измерить с помощью нозерн-блоттинга , который предоставляет информацию о размере и последовательности молекул мРНК. [114] Образец РНК отделяют на агарозном геле и гибридизуют с радиоактивно меченным зондом РНК, который комплементарен целевой последовательности. [115] Радиомеченую РНК затем обнаруживают с помощью авторадиографа . [116] Поскольку использование радиоактивных реагентов делает процедуру трудоемкой и потенциально опасной, были разработаны альтернативные методы маркировки и обнаружения, такие как химический анализ дигоксигенина и биотина. [117] Предполагаемые недостатки нозерн-блоттинга заключаются в том, что требуются большие количества РНК и что количественный анализ может быть не совсем точным, поскольку он включает измерение силы полосы на изображении геля. [118] С другой стороны, дополнительная информация о размере мРНК, полученная при нозерн-блоттинге, позволяет распознавать поочередно сплайсированные транскрипты. [119] [120]
Другим подходом к измерению содержания мРНК является RT-qPCR. В этом методе за обратной транскрипцией следует количественная ПЦР . Обратная транскрипция сначала генерирует матрицу ДНК из мРНК; эта одноцепочечная матрица называется кДНК . Затем матрица кДНК амплифицируется на количественном этапе, во время которого флуоресценция, излучаемая мечеными зондами гибридизации или интеркалирующими красителями, меняется по мере продвижения процесса амплификации ДНК . [121] С помощью тщательно построенной стандартной кривой кПЦР может дать абсолютное измерение количества копий исходной мРНК, обычно в единицах копий на нанолитр гомогенизированной ткани или копий на клетку. [122] qPCR очень чувствителен (обнаружение одной молекулы мРНК теоретически возможно), но может быть дорогостоящим в зависимости от типа используемого репортера; флуоресцентно меченные олигонуклеотидные зонды стоят дороже, чем неспецифические интеркалирующие флуоресцентные красители. [123]
Для профилирования экспрессии или высокопроизводительного анализа многих генов в образце количественная ПЦР может выполняться для сотен генов одновременно в случае массивов с низкой плотностью. [124] Второй подход — гибридизация микрочипов . Один массив или «чип» может содержать зонды для определения уровней транскриптов для каждого известного гена в геноме одного или нескольких организмов. [125] технологии «на основе меток», такие как серийный анализ экспрессии генов (SAGE) и RNA-Seq , которые могут обеспечить относительную оценку клеточной концентрации различных мРНК. В качестве альтернативы можно использовать [126] Преимуществом методов на основе тегов является «открытая архитектура», позволяющая точно измерить любой транскрипт с известной или неизвестной последовательностью. [127] Секвенирование следующего поколения (NGS), такое как RNA-Seq , является еще одним подходом, позволяющим получить огромные объемы данных о последовательностях, которые можно сопоставить с эталонным геномом. Хотя NGS является сравнительно трудоемким, дорогим и ресурсоемким процессом, он может идентифицировать однонуклеотидные полиморфизмы , варианты сплайсинга и новые гены, а также может использоваться для профилирования экспрессии в организмах, для которых мало или вообще нет информации о последовательностях. . [128]
Профили РНК в Википедии
[ редактировать ]
Подобные профили встречаются почти для всех белков, перечисленных в Википедии. Их генерируют такие организации, как Институт геномики исследовательского фонда Novartis и Европейский институт биоинформатики . Дополнительную информацию можно найти, выполнив поиск по их базам данных (пример транспортера GLUT4, изображенного здесь, см. В цитате). [129] Эти профили указывают уровень экспрессии ДНК (и, следовательно, продуцируемой РНК) определенного белка в определенной ткани и имеют соответствующую цветовую кодировку на изображениях, расположенных в разделе «Белки» в правой части каждой страницы Википедии.
Количественное определение белка
[ редактировать ]Уровень экспрессии генов, кодирующих белки, можно напрямую оценить с помощью ряда методов, имеющих некоторые явные аналогии с методами количественного определения мРНК.
Одним из наиболее часто используемых методов является проведение вестерн-блоттинга интересующего белка. [130] Это дает информацию о размере белка в дополнение к его идентичности. Образец (часто клеточный лизат ) отделяют на полиакриламидном геле , переносят на мембрану и затем исследуют антителом к интересующему белку. Антитело можно конъюгировать либо с флуорофором , либо с пероксидазой хрена для визуализации и/или количественного определения. Гелевая природа этого анализа делает количественную оценку менее точной, но он имеет то преимущество, что позволяет идентифицировать более поздние модификации белка, например протеолиз или убиквитинирование, по изменениям размера.
корреляция мРНК-белок
[ редактировать ]Хотя транскрипция напрямую отражает экспрессию генов, количество копий молекул мРНК не коррелирует напрямую с количеством белковых молекул, транслируемых с мРНК. Количественное определение белка и мРНК позволяет коррелировать эти два уровня. Регулирование каждого этапа экспрессии генов может влиять на корреляцию, как показано на примере регуляции трансляции. [28] или стабильность белка. [131] Посттрансляционные факторы, такие как транспорт белков в высокополярных клетках, [132] также может влиять на измеренную корреляцию мРНК-белок.
Локализация
[ редактировать ]
Анализ экспрессии не ограничивается количественной оценкой; локализацию также можно определить. мРНК можно обнаружить с помощью соответственно меченной комплементарной цепи мРНК, а белок можно обнаружить с помощью меченых антител. Затем зондированный образец исследуют под микроскопом, чтобы определить, где находится мРНК или белок.

Заменив ген новой версией, слитой с маркером зеленого флуоресцентного белка или аналогичным, экспрессию можно напрямую определить количественно в живых клетках. Это делается путем визуализации с помощью флуоресцентного микроскопа . Очень сложно клонировать слитый с GFP белок в его нативное место в геноме, не влияя при этом на уровни экспрессии, поэтому этот метод часто нельзя использовать для измерения экспрессии эндогенных генов. Однако он широко используется для измерения экспрессии гена, искусственно введенного в клетку, например, с помощью вектора экспрессии . Путем слияния целевого белка с флуоресцентным репортером можно существенно изменить поведение белка, включая его клеточную локализацию и уровень экспрессии.
Иммуноферментный анализ основан на использовании антител, иммобилизованных на титрационном микропланшете, для захвата интересующих белков из образцов, добавленных в лунку. Используя детектирующее антитело, конъюгированное с ферментом или флуорофором, количество связанного белка можно точно измерить с помощью флуорометрического или колориметрического обнаружения. Процесс обнаружения очень похож на процесс вестерн-блоттинга, но, избегая этапов геля, можно добиться более точного количественного определения.
Система экспрессии
[ редактировать ]
Система экспрессии представляет собой систему, специально разработанную для производства выбранного генного продукта. Обычно это белок, хотя также может быть РНК, например тРНК или рибозим . Система экспрессии состоит из гена, обычно кодируемого ДНК , и молекулярного механизма, необходимого для транскрипции ДНК в мРНК и трансляции мРНК в белок с использованием предоставленных реагентов. В самом широком смысле это включает в себя каждую живую клетку, но этот термин чаще используется для обозначения экспрессии как лабораторного инструмента. Поэтому система экспрессии часто бывает в некотором роде искусственной. Однако системы экспрессии представляют собой фундаментально естественный процесс. Вирусы являются прекрасным примером того, как они реплицируются, используя клетку-хозяина в качестве системы экспрессии вирусных белков и генома.
Индуцибельное выражение
[ редактировать ]Доксициклин также используется в контролируемой тетрациклином активации транскрипции «Tet-on» и «Tet-off» для регуляции экспрессии трансгена в организмах и клеточных культурах .
На природе
[ редактировать ]В дополнение к этим биологическим инструментам, некоторые естественно наблюдаемые конфигурации ДНК (гены, промоторы, энхансеры, репрессоры) и связанные с ними механизмы сами называются системой экспрессии. Этот термин обычно используется в случае, когда ген или набор генов включаются при четко определенных условиях, например, простая система экспрессии переключения репрессора в фаге Lambda и система lac-операторов у бактерий. Некоторые естественные системы экспрессии непосредственно используются или модифицируются и используются для искусственных систем экспрессии, таких как системы экспрессии Tet-on и Tet-off .
Генные сети
[ редактировать ]Гены иногда рассматривают как узлы в сети, где входными данными являются белки, такие как факторы транскрипции , а выходными — уровень экспрессии генов. Сам узел выполняет функцию, и работа этих функций интерпретируется как своего рода обработка информации внутри клеток и определяет клеточное поведение.
Генные сети также могут быть построены без формулирования явной причинно-следственной модели. Это часто происходит при сборке сетей из больших наборов данных выражений. [133] Ковариация и корреляция экспрессии рассчитываются на основе большой выборки случаев и измерений (часто транскриптома или протеома данных ). Источник изменчивости может быть как экспериментальным, так и естественным (наблюдательным). Существует несколько способов построения сетей экспрессии генов, но один из распространенных подходов заключается в вычислении матрицы всех парных корреляций экспрессии между условиями, моментами времени или отдельными людьми и преобразованием этой матрицы (после порогового значения при некотором пороговом значении) в графическое представление, в котором узлы представляют гены, транскрипты или белки, а ребра, соединяющие эти узлы, представляют силу ассоциации (см. GeneNetwork GeneNetwork 2 ). [134]
Техники и инструменты
[ редактировать ]Следующие экспериментальные методы используются для измерения экспрессии генов и перечислены примерно в хронологическом порядке, начиная со старых и более устоявшихся технологий. Они разделены на две группы в зависимости от степени мультиплексности .
- Техники от низкого до среднего плекса:
- Техники высшего сплетения:
Базы данных экспрессии генов
[ редактировать ]- Омнибус экспрессии генов (GEO) в NCBI [140]
- Атлас выражений в EBI
- Бджи Бджи из Швейцарского института биоинформатики SIB
- мышиных База данных экспрессии генов в лаборатории Джексона
- CollecTF : база данных экспериментально подтвержденных сайтов связывания транскрипционных факторов у бактерий. [141]
- КОЛОМБОС: коллекция сборников бактериальных экспрессий. [142]
- База данных многих микробных микрочипов : микробные данные Affymetrix [143]
См. также
[ редактировать ]- Тестирование молекулярной экспрессии AlloMap
- Закладки
- EPIC-Seq
- Тег выраженной последовательности
- Атлас выражений
- Профилирование выражений
- Генная структура
- Генная инженерия
- Генетически модифицированный организм
- Список биологических баз данных
- Список генов человека
- Осциллирующий ген
- Парамутация
- Производство белка
- Очистка белка
- Рибономика
- Ридж
- Инструмент профилирования последовательностей
- Транскрипционный разрыв
- Транскрипционный шум
- Расшифровка неизвестной функции
Ссылки
[ редактировать ]- ^ Брюкнер Ф., Армаш К.Дж., Чунг А., Дамсма Г.Е., Кеттенбергер Х., Леманн Е. и др. (февраль 2009 г.). «Структурно-функциональные исследования комплекса элонгации РНК-полимеразы II» . Акта Кристаллографика. Раздел D. Биологическая кристаллография . 65 (Часть 2): 112–120. Бибкод : 2009AcCrD..65..112B . дои : 10.1107/S0907444908039875 . ПМЦ 2631633 . ПМИД 19171965 .
- ^ Кребс Дж. Э., Гольдштейн Э. С., Килпатрик С. Т. (2 марта 2017 г.). Гены Левина XII . Берлингтон, Массачусетс: Jones & Bartlett Learning. ISBN 978-1-284-10449-3 . OCLC 965781334 .
- ^ Раманатан А., Робб ГБ, Чан Ш. (сентябрь 2016 г.). «Кэпирование мРНК: биологические функции и применение» . Исследования нуклеиновых кислот . 44 (16): 7511–7526. дои : 10.1093/nar/gkw551 . ПМК 5027499 . ПМИД 27317694 .
- ^ Гонатопулос-Пурнацис Т., Коулинг В.Х. (январь 2014 г.). «Колпачно-связывающий комплекс (КБС)» . Биохимический журнал . 457 (2): 231–242. дои : 10.1042/BJ20131214 . ПМЦ 3901397 . ПМИД 24354960 .
- ^ Нив Дж., Патель Р., Ван З., Луи А., Фургер А.М. (июль 2017 г.). «Расщепление и полиаденилирование: прекращение сообщения расширяет регуляцию генов» . Биология РНК . 14 (7): 865–890. дои : 10.1080/15476286.2017.1306171 . ПМК 5546720 . ПМИД 28453393 .
- ^ Бородулина О.Р., Крамеров Д.А. (сентябрь 2008 г.). «Транскрипты, синтезированные РНК-полимеразой III, могут быть полиаденилированы AAAAA-зависимым способом» . РНК . 14 (9): 1865–1873. дои : 10.1261/rna.1006608 . ПМЦ 2525947 . ПМИД 18658125 .
- ^ Муньос-Телло П., Раджаппа Л., Кокиль С., Торе С. (2015). «Полиуридилирование у эукариот: модификация 3'-конца, регулирующая жизнь РНК» . БиоМед Исследования Интернэшнл . 2015 : 968127. doi : 10.1155/2015/968127 . ПМЦ 4442281 . ПМИД 26078976 .
- ^ Пассмор Л.А., Коллер Дж. (февраль 2022 г.). «Роль поли(А)-хвостов мРНК в регуляции экспрессии генов эукариот» . Обзоры природы. Молекулярно-клеточная биология . 23 (2): 93–106. дои : 10.1038/s41580-021-00417-y . ПМЦ 7614307 . ПМИД 34594027 .
- ^ Морозов И.Ю., Джонс М.Г., Разак А.А., Ригден DJ, Caddick MX (январь 2010 г.). «Модификация мРНК CUCU способствует декэпированию и деградации транскриптов у Aspergillus nidulans» . Молекулярная и клеточная биология . 30 (2): 460–469. дои : 10.1128/MCB.00997-09 . ПМЦ 2798463 . ПМИД 19901075 .
- ^ Дарнелл Дж. Э. (апрель 2013 г.). «Размышления об истории процессинга пре-мРНК и основные моменты современных знаний: единая картина» . РНК . 19 (4): 443–460. дои : 10.1261/rna.038596.113 . ПМЦ 3677254 . ПМИД 23440351 .
- ^ Чжан Л., Виэль А., Эспиноза С., Чжао Р. (май 2019 г.). «РНК в сплайсосоме: понимание криоЭМ-структур» . Междисциплинарные обзоры Wiley. РНК . 10 (3): e1523. дои : 10.1002/wrna.1523 . ПМК 6450755 . ПМИД 30729694 .
- ^ Хоссейн М.А., Родригес К.М., Джонсон Т.Л. (октябрь 2011 г.). «Ключевые особенности двухинтронного гена Saccharomyces cerevisiae SUS1 способствуют его альтернативному сплайсингу» . Исследования нуклеиновых кислот . 39 (19): 8612–8627. дои : 10.1093/nar/gkr497 . ПМК 3201863 . ПМИД 21749978 .
- ^ Баралле Ф.Е., Джудис Дж. (июль 2017 г.). «Альтернативный сплайсинг как регулятор развития и идентичности тканей» . Обзоры природы. Молекулярно-клеточная биология . 18 (7): 437–451. дои : 10.1038/номер.2017.27 . ПМЦ 6839889 . ПМИД 28488700 .
- ^ Баум Б., Спанг А. (декабрь 2023 г.). «О происхождении ядра: гипотеза» . Обзоры микробиологии и молекулярной биологии . 87 (4): e0018621. дои : 10.1128/mmbr.00186-21 . ПМЦ 10732040 . ПМИД 38018971 .
- ^ Сирри В., Уркуки-Инчима С., Руссель П., Эрнандес-Верден Д. (январь 2008 г.). «Ядрышко: удивительное ядерное тело» . Гистохимия и клеточная биология . 129 (1): 13–31. дои : 10.1007/s00418-007-0359-6 . ПМК 2137947 . ПМИД 18046571 .
- ^ Фрэнк Д.Н., Пейс Н.Р. (1998). «Рибонуклеаза P: единство и разнообразие рибозима, процессирующего тРНК» . Ежегодный обзор биохимии . 67 : 153–180. doi : 10.1146/annurev.biochem.67.1.153 . ПМИД 9759486 .
- ^ Себальос М., Виоке А. (2007). «тРНКаза Z». Буквы о белках и пептидах . 14 (2): 137–145. дои : 10.2174/092986607779816050 . PMID 17305600 .
- ^ Вайнер А.М. (октябрь 2004 г.). «Созревание тРНК: полимеризация РНК без матрицы нуклеиновой кислоты» . Современная биология . 14 (20): Р883–Р885. Бибкод : 2004CBio...14.R883W . дои : 10.1016/j.cub.2004.09.069 . ПМИД 15498478 .
- ^ Браткович Т., Божич Ю., Рогель Б. (февраль 2020 г.). «Функциональное разнообразие малых ядрышковых РНК» . Исследования нуклеиновых кислот . 48 (4): 1627–1651. дои : 10.1093/nar/gkz1140 . ПМК 7038934 . ПМИД 31828325 .
- ^ Низами З., Дерюшева С., Галл Дж.Г. (июль 2010 г.). «Тело Кахаля и тело гистонового локуса» . Перспективы Колд-Спринг-Харбор в биологии . 2 (7): а000653. doi : 10.1101/cshperspect.a000653 . ПМК 2890199 . ПМИД 20504965 .
- ^ Дарзак X, Жади Б.Е., Верхегген С., Кисс А.М., Бертран Э., Кисс Т. (июнь 2002 г.). «Малые ядерные РНК, специфичные для тела Кахаля: новый класс направляющих РНК 2'-O-метилирования и псевдоуридилирования» . Журнал ЭМБО . 21 (11): 2746–2756. дои : 10.1093/emboj/21.11.2746 . ПМК 126017 . ПМИД 12032087 .
- ^ Келер А., Хёрт Э. (октябрь 2007 г.). «Экспорт РНК из ядра в цитоплазму». Обзоры природы. Молекулярно-клеточная биология . 8 (10): 761–773. дои : 10.1038/nrm2255 . ПМИД 17786152 . S2CID 10836137 .
- ^ Джамбхекар А., Дериси Дж.Л. (май 2007 г.). «Цис-действующие детерминанты асимметричного цитоплазматического транспорта РНК» . РНК . 13 (5): 625–642. дои : 10.1261/rna.262607 . ПМЦ 1852811 . ПМИД 17449729 .
- ^ Амарал П.П., Дингер М.Э., Мерсер Т.Р., Мэттик Дж.С. (март 2008 г.). «Геном эукариот как машина РНК». Наука . 319 (5871): 1787–1789. Бибкод : 2008Sci...319.1787A . дои : 10.1126/science.1155472 . ПМИД 18369136 . S2CID 206511756 .
- ^ Хансен Т.М., Баранов П.В., Иванов И.П., Гестеланд Р.Ф., Аткинс Дж.Ф. (май 2003 г.). «Поддержание правильной открытой рамки считывания рибосомой» . Отчеты ЭМБО . 4 (5): 499–504. doi : 10.1038/sj.embor.embor825 . ПМК 1319180 . ПМИД 12717454 .
- ^ Берк В., Кейт Дж. Х. (июнь 2007 г.). «Взгляд на биосинтез белка из структур бактериальных рибосом». Современное мнение в области структурной биологии . 17 (3): 302–309. дои : 10.1016/j.sbi.2007.05.009 . ПМИД 17574829 .
- ^ Шванхойссер Б., Буссе Д., Ли Н., Диттмар Г., Шуххардт Дж., Вольф Дж. и др. (май 2011 г.). «Глобальная количественная оценка контроля экспрессии генов млекопитающих» (PDF) . Природа . 473 (7347): 337–342. Бибкод : 2011Natur.473..337S . дои : 10.1038/nature10098 . ПМИД 21593866 . S2CID 205224972 .
- ^ Jump up to: а б Шванхойссер Б., Буссе Д., Ли Н., Диттмар Г., Шуххардт Дж., Вольф Дж. и др. (март 2013 г.). «Исправление: глобальная количественная оценка контроля экспрессии генов млекопитающих» . Природа . 495 (7439): 126–127. Бибкод : 2013Natur.495..126S . дои : 10.1038/nature11848 . ПМИД 23407496 .
- ^ Хегде Р.С., Канг С.В. (июль 2008 г.). «Понятие транслокационной регуляции» . Журнал клеточной биологии . 182 (2): 225–232. дои : 10.1083/jcb.200804157 . ПМЦ 2483521 . ПМИД 18644895 .
- ^ Альбертс Б. , Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтерс П. (2002). «Форма и строение белков» . Молекулярная биология клетки (Четвертое изд.). Нью-Йорк и Лондон: Garland Science. ISBN 978-0-8153-3218-3 .
- ^ Анфинсен CB (июль 1972 г.). «Формирование и стабилизация структуры белка» . Биохимический журнал . 128 (4): 737–749. дои : 10.1042/bj1280737 . ПМЦ 1173893 . ПМИД 4565129 .
- ^ Берг Дж.М., Тимочко Дж.Л., Люберт Страйер ; Веб-контент Нила Д. Кларка (2002). «3. Структура и функция белка» . Биохимия . Сан-Франциско: WH Freeman. ISBN 978-0-7167-4684-3 .
- ^ Селькое DJ (декабрь 2003 г.). «Сворачивание белков фатальным образом». Природа . 426 (6968): 900–904. Бибкод : 2003Natur.426..900S . дои : 10.1038/nature02264 . ПМИД 14685251 . S2CID 6451881 .
- ^ Альбертс Б., Брэй Д., Хопкин К., Джонсон А., Льюис Дж., Рафф М. и др. (2010). «Структура и функция белка». Основная клеточная биология (3-е изд.). Нью-Йорк: Garland Science, Taylor and Francisco Group, LLC. стр. 120–170. ISBN 978-0-8153-4129-1 .
- ^ Хеберт Д.Н., Молинари М. (октябрь 2007 г.). «В отделении скорой помощи и из него: сворачивание белков, контроль качества, деградация и связанные с ними болезни человека» . Физиологические обзоры . 87 (4): 1377–1408. doi : 10.1152/physrev.00050.2006 . ПМИД 17928587 .
- ^ Рассел Р. (январь 2008 г.). «Неправильное сворачивание РНК и действие шаперонов» . Границы бионауки . 13 (13): 1–20. дои : 10.2741/2557 . ПМК 2610265 . ПМИД 17981525 .
- ^ Кобер Л., Зехе С., Боде Дж. (апрель 2013 г.). «Оптимизированные сигнальные пептиды для разработки линий клеток CHO с высокой экспрессией». Биотехнология и биоинженерия . 110 (4): 1164–1173. дои : 10.1002/бит.24776 . ПМИД 23124363 . S2CID 449870 .
- ^ Лу Дж., Ву Т., Чжан Б., Лю С., Сун В., Цяо Дж. и др. (май 2021 г.). «Типы сигналов ядерной локализации и механизмы импорта белка в ядро» . Сотовая связь и сигнализация . 19 (1): 60. дои : 10.1186/s12964-021-00741-y . ПМК 8140498 . ПМИД 34022911 .
- ^ Ланг С., Нгуен Д., Бхадра П., Юнг М., Хелмс В., Циммерманн Р. (11 июля 2022 г.). «Свойства сигнального пептида, определяющие субстратные особенности нацеливания и транслокации компонентов при импорте белка ER человека» . Границы в физиологии . 13 : 833540. doi : 10.3389/fphys.2022.833540 . ПМК 9309488 . ПМИД 35899032 .
- ^ Мурат Д., Бирн М., Комейли А. (октябрь 2010 г.). «Клеточная биология прокариотических органелл» . Перспективы Колд-Спринг-Харбор в биологии . 2 (10): а000422. doi : 10.1101/cshperspect.a000422 . ПМЦ 2944366 . ПМИД 20739411 .
- ^ Jump up to: а б Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002), «От РНК к белку» , Молекулярная биология клетки. 4-е издание , Garland Science , получено 10 июня 2024 г.
- ^ Моро П., Брандицци Ф., Хантон С., Чатр Л., Мельзер С., Хоуз С. и др. (2007). «Растительный интерфейс ЭР-Гольджи: высокоструктурированный и динамичный мембранный комплекс» . Журнал экспериментальной ботаники . 58 (1): 49–64. дои : 10.1093/jxb/erl135 . ПМИД 16990376 .
- ^ Прудовский И., Тарантини Ф., Ландрискина М., Нейвандт Д., Сольди Р., Киров А. и др. (апрель 2008 г.). «Секреция без Гольджи» . Журнал клеточной биохимии . 103 (5): 1327–1343. дои : 10.1002/jcb.21513 . ПМК 2613191 . ПМИД 17786931 .
- ^ Заиди С.К., Янг Д.В., Чой Дж.Ю., Пратап Дж., Джавед А., Монтечино М. и др. (октябрь 2004 г.). «Внутриядерный оборот: организация и формирование механизма регулирования комбинаторного биологического контроля» . Журнал биологической химии . 279 (42): 43363–43366. дои : 10.1074/jbc.R400020200 . ПМИД 15277516 .
- ^ Мэттик Дж.С., Амарал П.П., Дингер М.Э., Мерсер Т.Р., Мелер М.Ф. (январь 2009 г.). «РНК-регуляция эпигенетических процессов» . Биоэссе . 31 (1): 51–59. doi : 10.1002/bies.080099 . ПМИД 19154003 .
- ^ Мартинес, Нью-Джерси, Уолхаут, Эй-Джей (апрель 2009 г.). «Взаимодействие между факторами транскрипции и микроРНК в регуляторных сетях масштаба генома» . Биоэссе . 31 (4): 435–445. doi : 10.1002/bies.200800212 . ПМЦ 3118512 . ПМИД 19274664 .
- ^ Томилин Н.В. (апрель 2008 г.). «Регуляция экспрессии генов млекопитающих с помощью ретроэлементов и некодирующих тандемных повторов» . Биоэссе . 30 (4): 338–348. doi : 10.1002/bies.20741 . ПМИД 18348251 .
- ^ Ли Т.И., Янг РА (март 2013 г.). «Регуляция транскрипции и ее нарушение при заболеваниях» . Клетка . 152 (6): 1237–1251. дои : 10.1016/j.cell.2013.02.014 . ПМК 3640494 . ПМИД 23498934 .
- ^ О'Коннор Л., Гилмор Дж., Бонифер С. (декабрь 2016 г.). «Роль повсеместно экспрессируемого транскрипционного фактора Sp1 в тканеспецифической регуляции транскрипции и при заболеваниях» . Йельский журнал биологии и медицины . 89 (4): 513–525. ПМК 5168829 . ПМИД 28018142 .
- ^ Йесудхас Д., Батул М., Анвар М.А., Паннеерселвам С., Чой С. (август 2017 г.). «Белки, распознающие ДНК: структурная уникальность и универсальность ДНК-связывающих доменов в факторах транскрипции стволовых клеток» . Гены . 8 (8): 192. doi : 10.3390/genes8080192 . ПМК 5575656 . ПМИД 28763006 .
- ^ Ван Г, Ван Ф, Хуан Ц, Ли Ю, Лю Ю, Ван Ю (2015). «Понимание регуляции факторов транскрипции путем интеграции экспрессии генов и гиперчувствительных участков ДНКазы I» . БиоМед Исследования Интернэшнл . 2015 : 757530. doi : 10.1155/2015/757530 . ПМЦ 4573618 . ПМИД 26425553 .
- ^ Коловос П., Кнох Т.А., Гросвельд Ф.Г., Кук П.Р., Папантонис А. (январь 2012 г.). «Усилители и глушители: интегрированная и простая модель их функции» . Эпигенетика и хроматин . 5 (1): 1. дои : 10.1186/1756-8935-5-1 . ПМК 3281776 . ПМИД 22230046 .
- ^ Фуда, Нью-Джерси, Ардехали М.Б., Лис Дж.Т. (сентябрь 2009 г.). «Определение механизмов, регулирующих транскрипцию РНК-полимеразы II in vivo» . Природа . 461 (7261): 186–192. Бибкод : 2009Natur.461..186F . дои : 10.1038/nature08449 . ПМЦ 2833331 . ПМИД 19741698 .
- ^ Фильц Т.М., Фогель В.К., Лейд М. (февраль 2014 г.). «Регуляция активности транскрипционных факторов посредством взаимосвязанных посттрансляционных модификаций» . Тенденции в фармакологических науках . 35 (2): 76–85. дои : 10.1016/j.tips.2013.11.005 . ПМЦ 3954851 . ПМИД 24388790 .
- ^ Хэмпси М. (июнь 1998 г.). «Молекулярная генетика общего транскрипционного аппарата РНК-полимеразы II» . Обзоры микробиологии и молекулярной биологии . 62 (2): 465–503. дои : 10.1128/MMBR.62.2.465-503.1998 . ПМК 98922 . ПМИД 9618449 .
- ^ Вейтиа РА (ноябрь 2008 г.). «Тысяча и один способ создания функционально подобных усилителей транскрипции». Биоэссе . 30 (11–12): 1052–1057. doi : 10.1002/bies.20849 . ПМИД 18937349 .
- ^ Нгуен Т., Ниой П., Пикетт CB (май 2009 г.). «Сигнальный путь элемента Nrf2-антиоксидантного ответа и его активация окислительным стрессом» . Журнал биологической химии . 284 (20): 13291–13295. дои : 10.1074/jbc.R900010200 . ПМЦ 2679427 . ПМИД 19182219 .
- ^ Пол С. (ноябрь 2008 г.). «Дисфункция системы убиквитин-протеасома при множественных заболеваниях: терапевтические подходы». Биоэссе . 30 (11–12): 1172–1184. doi : 10.1002/bies.20852 . ПМИД 18937370 . S2CID 29422790 .
- ^ Лос М., Маддика С., Эрб Б., Шульце-Остхофф К. (май 2009 г.). «Переключение Акта: от сигнализации выживания к смертельному ответу» . Биоэссе . 31 (5): 492–495. doi : 10.1002/bies.200900005 . ПМК 2954189 . ПМИД 19319914 .
- ^ Афек А., Села И., Муса-Лемпель Н., Лукацкий Д.Б. (ноябрь 2011 г.). «Неспецифическое связывание транскрипционного фактора с ДНК влияет на заселенность нуклеосом у дрожжей» . Биофизический журнал . 101 (10): 2465–2475. arXiv : 1111.4779 . Бибкод : 2011BpJ...101.2465A . дои : 10.1016/j.bpj.2011.10.012 . ПМЦ 3218343 . ПМИД 22098745 .
- ^ Мусави А., Мотевализаде Ардекани А (ноябрь 2016 г.). «Роль эпигенетики в биологии и болезнях человека» . Иранский биомедицинский журнал . 20 (5): 246–258. дои : 10.22045/ibj.2016.01 . ПМК 5075137 . ПМИД 27377127 .
- ^ Аль Абуд Н.М., Таппер С., Джалал I (2024 г.). «Генетика, эпигенетический механизм» . СтатПерлс . Остров сокровищ (Флорида): StatPearls Publishing. ПМИД 30422591 . Проверено 12 июня 2024 г.
- ^ Миллер Дж.Л., Грант П.А. (2013). «Роль метилирования ДНК и модификаций гистонов в регуляции транскрипции у человека». Эпигенетика: развитие и болезни . Субклеточная биохимия. Том. 61. С. 289–317. дои : 10.1007/978-94-007-4525-4_13 . ISBN 978-94-007-4524-7 . ПМК 6611551 . ПМИД 23150256 .
- ^ Верхёль Т.С., ван Хейфте Л., Перенталер Э., Баракат Т.С. (2020). «Почему YY1: механизмы регуляции транскрипции Инь Ян 1» . Границы клеточной биологии и биологии развития . 8 : 592164. дои : 10.3389/fcell.2020.592164 . ПМЦ 7554316 . ПМИД 33102493 .
- ^ Шпиц Ф, Ферлонг Э.Э. (сентябрь 2012 г.). «Факторы транскрипции: от связывания энхансера к контролю развития». Обзоры природы. Генетика . 13 (9): 613–626. дои : 10.1038/nrg3207 . ПМИД 22868264 . S2CID 205485256 .
- ^ Jump up to: а б Шенфельдер С., Фрейзер П. (август 2019 г.). «Дальние контакты энхансер-промотор в контроле экспрессии генов». Обзоры природы. Генетика . 20 (8): 437–455. дои : 10.1038/s41576-019-0128-0 . ПМИД 31086298 . S2CID 152283312 .
- ^ Вайнтрауб А.С., Ли CH, Замудио А.В., Сигова А.А., Ханнетт Н.М., Дэй Д.С. и др. (декабрь 2017 г.). «YY1 является структурным регулятором петель энхансер-промотор» . Клетка . 171 (7): 1573–1588.e28. дои : 10.1016/j.cell.2017.11.008 . ПМЦ 5785279 . ПМИД 29224777 .
- ^ Ламберт С.А., Йолма А., Кампителли Л.Ф., Дас П.К., Инь Ю., Альбу М. и др. (февраль 2018 г.). «Факторы транскрипции человека» . Клетка . 172 (4): 650–665. дои : 10.1016/j.cell.2018.01.029 . ПМИД 29425488 .
- ^ Гроссман С.Р., Энгрейтц Дж., Рэй Дж.П., Нгуен Т.Х., Хакоэн Н., Ландер Э.С. (июль 2018 г.). «Позиционная специфичность различных классов транскрипционных факторов в энхансерах» . Труды Национальной академии наук Соединенных Штатов Америки . 115 (30): Е7222–Е7230. Бибкод : 2018PNAS..115E7222G . дои : 10.1073/pnas.1804663115 . ПМК 6065035 . ПМИД 29987030 .
- ^ Аллен Б.Л., Taatjes DJ (март 2015 г.). «Медиаторный комплекс: центральный интегратор транскрипции» . Обзоры природы. Молекулярно-клеточная биология . 16 (3): 155–166. дои : 10.1038/nrm3951 . ПМЦ 4963239 . ПМИД 25693131 .
- ^ Михайличенко О., Бондаренко В., Харнетт Д., Шор И.Е., Малес М., Виалес Р.Р. и др. (январь 2018 г.). «Степень активности энхансера или промотора отражается уровнями и направленностью транскрипции эРНК» . Гены и развитие . 32 (1): 42–57. дои : 10.1101/gad.308619.117 . ПМЦ 5828394 . ПМИД 29378788 .
- ^ Ли QJ, Ян Ш., Маэда Ю., Сладек Ф.М., Шаррокс А.Д., Мартинс-Грин М. (январь 2003 г.). «Зависимая от фосфорилирования MAP-киназы активация Elk-1 приводит к активации коактиватора p300» . Журнал ЭМБО . 22 (2): 281–291. дои : 10.1093/emboj/cdg028 . ПМК 140103 . ПМИД 12514134 .
- ^ Карулло Н.В., Филлипс III Р.А., Саймон Р.К., Сото С.А., Хиндс Дж.Э., Солсбери А.Дж. и др. (сентябрь 2020 г.). «Энхансерные РНК предсказывают регуляторные связи между энхансером и геном и имеют решающее значение для функции энхансера в нейрональных системах» . Исследования нуклеиновых кислот . 48 (17): 9550–9570. дои : 10.1093/nar/gkaa671 . ПМЦ 7515708 . ПМИД 32810208 .
- ^ Левквист С., Додд И.Б., Снеппен К., Хаертер Дж.О. (июнь 2016 г.). «Метилирование ДНК в эпигеномах человека зависит от локальной топологии сайтов CpG» . Исследования нуклеиновых кислот . 44 (11): 5123–5132. дои : 10.1093/нар/gkw124 . ПМЦ 4914085 . ПМИД 26932361 .
- ^ Джаббари К., Бернарди Дж. (май 2004 г.). «Метилирование цитозина и частоты CpG, TpG (CpA) и TpA». Джин . 333 : 143–149. дои : 10.1016/j.gene.2004.02.043 . ПМИД 15177689 .
- ^ Вебер М., Хеллманн И., Стадлер М.Б., Рамос Л., Паабо С., Ребхан М. и др. (апрель 2007 г.). «Распространение, потенциал молчания и эволюционное влияние метилирования ДНК промотора в геноме человека». Природная генетика . 39 (4): 457–466. дои : 10.1038/ng1990 . ПМИД 17334365 . S2CID 22446734 .
- ^ Ян X, Хан Х, Де Карвалью Д.Д., Лэй Ф.Д., Джонс П.А., Лян Г. (октябрь 2014 г.). «Метилирование тел генов может изменить экспрессию генов и является терапевтической мишенью при раке» . Раковая клетка . 26 (4): 577–590. дои : 10.1016/j.ccr.2014.07.028 . ПМК 4224113 . ПМИД 25263941 .
- ^ Маедер М.Л., Ангстман Дж.Ф., Ричардсон М.Е., Линдер С.Дж., Касио В.М., Цай С.К. и др. (декабрь 2013 г.). «Направленное деметилирование ДНК и активация эндогенных генов с использованием программируемых слитых белков TALE-TET1» . Природная биотехнология . 31 (12): 1137–1142. дои : 10.1038/nbt.2726 . ПМЦ 3858462 . ПМИД 24108092 .
- ^ Ким Джей-Джей, Юнг М.В. (2006). «Нейральные цепи и механизмы, участвующие в формировании павловского страха: критический обзор» . Неврологические и биоповеденческие обзоры . 30 (2): 188–202. doi : 10.1016/j.neubiorev.2005.06.005 . ПМЦ 4342048 . ПМИД 16120461 .
- ^ Jump up to: а б Дюк К.Г., Кеннеди А.Дж., Гэвин К.Ф., Дэй Дж.Дж., Суэтт Дж.Д. (июль 2017 г.). «Эпигеномная реорганизация в гиппокампе, зависящая от опыта» . Обучение и память . 24 (7): 278–288. дои : 10.1101/lm.045112.117 . ПМК 5473107 . ПМИД 28620075 .
- ^ Jump up to: а б Бернштейн С (2022). «Метилирование ДНК и установление памяти» . Эпигенетические выводы . 15 : 25168657211072499. дои : 10.1177/25168657211072499 . ПМЦ 8793415 . ПМИД 35098021 .
- ^ Jump up to: а б Кейфер Дж. (февраль 2017 г.). «Прайм-тайм для изучения генов» . Гены . 8 (2): 69. doi : 10.3390/genes8020069 . ПМК 5333058 . ПМИД 28208656 .
- ^ Саксонов С., Берг П., Брютлаг Д.Л. (январь 2006 г.). «Полногеномный анализ динуклеотидов CpG в геноме человека позволяет выделить два различных класса промоторов» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (5): 1412–1417. Бибкод : 2006PNAS..103.1412S . дои : 10.1073/pnas.0510310103 . ПМЦ 1345710 . ПМИД 16432200 .
- ^ Птица А (январь 2002 г.). «Схемы метилирования ДНК и эпигенетическая память» . Гены и развитие . 16 (1): 6–21. дои : 10.1101/gad.947102 . ПМИД 11782440 .
- ^ Фогельштейн Б., Пападопулос Н., Велкулеску В.Е., Чжоу С., Диас Л.А., Кинцлер К.В. (март 2013 г.). «Пейзажи генома рака» . Наука . 339 (6127): 1546–1558. Бибкод : 2013Sci...339.1546V . дои : 10.1126/science.1235122 . ПМК 3749880 . ПМИД 23539594 .
- ^ Тесситоре А., Чиччарелли Г., Дель Веккьо Ф., Гаджиано А., Верцелла Д., Фискьетти М. и др. (2014). «МикроРНК в сети повреждения/восстановления ДНК и раке» . Международный журнал геномики . 2014 : 820248. doi : 10.1155/2014/820248 . ПМЦ 3926391 . ПМИД 24616890 .
- ^ Де Магистрис П (октябрь 2021 г.). «Великий побег: экспорт мРНК через комплекс ядерных пор» . Международный журнал молекулярных наук . 22 (21): 11767. doi : 10.3390/ijms222111767 . ПМЦ 8583845 . ПМИД 34769195 .
- ^ Лю Х, Луо М, Вэнь Дж. К. (май 2014 г.). «стабильность мРНК в ядре» . Журнал Чжэцзянского университета. Наука. Б. 15 (5): 444–454. дои : 10.1631/jzus.B1400088 . ПМК 4076601 . ПМИД 24793762 .
- ^ Ян Л.Л., Захер Х.С. (октябрь 2019 г.). «Как клетки справляются с повреждением РНК и его последствиями?» . Журнал биологической химии . 294 (41): 15158–15171. дои : 10.1074/jbc.REV119.006513 . ПМК 6791314 . ПМИД 31439666 .
- ^ Пассмор Л.А., Коллер Дж. (февраль 2022 г.). «Роль поли(А)-хвостов мРНК в регуляции экспрессии генов эукариот» . Обзоры природы. Молекулярно-клеточная биология . 23 (2): 93–106. дои : 10.1038/s41580-021-00417-y . ПМЦ 7614307 . ПМИД 34594027 .
- ^ Шехата С.И., Уоткинс Дж.М., Берк Дж.М., Паркер Р. (февраль 2024 г.). «Механизмы и последствия дестабилизации мРНК при вирусных инфекциях» . Вирусологический журнал . 21 (1): 38. дои : 10.1186/s12985-024-02305-1 . ПМЦ 10848536 . ПМИД 38321453 .
- ^ Тан Л., Чен ХИ, Хао Н.Б., Тан Б., Го Х., Юн Икс и др. (октябрь 2017 г.). «Ингибиторы микроРНК: естественная и искусственная секвестрация микроРНК» . Письма о раке . 407 : 139–147. дои : 10.1016/B978-0-444-64046-8.00282-2 . ISBN 978-0-444-64047-5 . ПМЦ 7152241 . ПМИД 28602827 .
- ^ Майр С. (октябрь 2019 г.). «Что делают 3' UTR?» . Перспективы Колд-Спринг-Харбор в биологии . 11 (10): а034728. doi : 10.1101/cshperspect.a034728 . ПМК 6771366 . ПМИД 30181377 .
- ^ О'Брайен Дж., Хайдер Х., Заид Ю., Пэн С. (3 августа 2018 г.). «Обзор биогенеза микроРНК, механизмов действия и кровообращения» . Границы эндокринологии . 9 : 402. дои : 10.3389/fendo.2018.00402 . ПМК 6085463 . ПМИД 30123182 .
- ^ Майя В.К., Дюшен Т.Ф. (24 января 2019 г.). «Шифрование и палачи: как 3'-нетранслируемые области определяют судьбу информационных РНК» . Границы генетики . 10 :6. дои : 10.3389/fgene.2019.00006 . ПМК 6357968 . ПМИД 30740123 .
- ^ Наир А.А., Тан Х, Томпсон К.Дж., Веделл П.Т., Калари К.Р., Субраманиан С. (июнь 2020 г.). «Частота ответных элементов микроРНК определяет патологически значимые сигнальные пути при трижды негативном раке молочной железы» . iScience . 23 (6): 101249. Бибкод : 2020iSci...23j1249N . дои : 10.1016/j.isci.2020.101249 . ПМЦ 7322352 . ПМИД 32629614 .
- ^ miRBase.org
- ^ Jump up to: а б Фридман Р.К., Фарх К.К., Бердж CB, Бартель Д.П. (январь 2009 г.). «Большинство мРНК млекопитающих являются консервативными мишенями микроРНК» . Геномные исследования . 19 (1): 92–105. дои : 10.1101/гр.082701.108 . ПМЦ 2612969 . ПМИД 18955434 .
- ^ Лим Л.П., Лау Н.К., Гарретт-Энгеле П., Гримсон А., Шелтер Дж.М., Касл Дж. и др. (февраль 2005 г.). «Анализ микрочипов показывает, что некоторые микроРНК подавляют большое количество целевых мРНК». Природа . 433 (7027): 769–773. Бибкод : 2005Natur.433..769L . дои : 10.1038/nature03315 . ПМИД 15685193 . S2CID 4430576 .
- ^ Зельбах М., Шванхойссер Б., Тирфельдер Н., Фанг З., Ханин Р., Раевски Н. (сентябрь 2008 г.). «Широко распространенные изменения в синтезе белка, вызванные микроРНК». Природа . 455 (7209): 58–63. Бибкод : 2008Natur.455...58S . дои : 10.1038/nature07228 . ПМИД 18668040 . S2CID 4429008 .
- ^ Пэк Д., Виллен Дж., Шин С., Камарго Ф.Д., Гиги С.П., Бартель Д.П. (сентябрь 2008 г.). «Влияние микроРНК на выход белка» . Природа . 455 (7209): 64–71. Бибкод : 2008Natur.455...64B . дои : 10.1038/nature07242 . ПМК 2745094 . ПМИД 18668037 .
- ^ Палмеро Э.И., де Кампос С.Г., Кампос М., де Соуза Н.К., Геррейру И.Д., Карвалью А.Л. и др. (июль 2011 г.). «Механизмы и роль нарушения регуляции микроРНК в возникновении и прогрессировании рака» . Генетика и молекулярная биология . 34 (3): 363–370. дои : 10.1590/S1415-47572011000300001 . ПМК 3168173 . ПМИД 21931505 .
- ^ Бернштейн С., Бернштейн Х. (май 2015 г.). «Эпигенетическое снижение репарации ДНК при прогрессировании рака желудочно-кишечного тракта» . Всемирный журнал желудочно-кишечной онкологии . 7 (5): 30–46. дои : 10.4251/wjgo.v7.i5.30 . ПМЦ 4434036 . ПМИД 25987950 .
- ^ Меллиос Н., Сур М. (2012). «Новая роль микроРНК при шизофрении и расстройствах аутистического спектра» . Границы в психиатрии . 3 : 39. doi : 10.3389/fpsyt.2012.00039 . ПМК 3336189 . ПМИД 22539927 .
- ^ Гиган М., Кэрнс MJ (август 2015 г.). «МикроРНК и посттранскрипционная дисрегуляция в психиатрии» . Биологическая психиатрия . 78 (4): 231–239. doi : 10.1016/j.biopsych.2014.12.009 . hdl : 1959.13/1335073 . ПМИД 25636176 .
- ^ Зоненберг Н., Hinnebusch AG (февраль 2009 г.). «Регуляция инициации трансляции у эукариот: механизмы и биологические мишени» . Клетка . 136 (4): 731–745. дои : 10.1016/j.cell.2009.01.042 . ПМЦ 3610329 . ПМИД 19239892 .
- ^ Юренас Д., Ван Мельдерен Л. (17 апреля 2020 г.). «Разнообразие общей темы ингибирования трансляции системами токсин-антитоксин типа II» . Границы генетики . 11 : 262. дои : 10.3389/fgene.2020.00262 . ПМК 7180214 . ПМИД 32362907 .
- ^ Дмитриев С.Е., Владимиров Д.О., Лашкевич К.А. (ноябрь 2020 г.). «Краткое руководство по низкомолекулярным ингибиторам синтеза белка эукариот» . Биохимия. Биохимия . 85 (11): 1389–1421. дои : 10.1134/S0006297920110097 . ПМЦ 7689648 . ПМИД 33280581 .
- ^ Jump up to: а б с Уолш К.Т., Гарно-Цодикова С., Гатто Г.Дж. (декабрь 2005 г.). «Посттрансляционные модификации белков: химия диверсификации протеома». Ангеванде Хеми . 44 (45): 7342–7372. дои : 10.1002/anie.200501023 . ПМИД 16267872 . S2CID 32157563 .
- ^ Хури Г.А., Балибан Р.С., Флудас, Калифорния (сентябрь 2011 г.). «Статистика посттрансляционных модификаций всего протеома: частотный анализ и курирование базы данных Swiss-Prot» . Научные отчеты . 1 (90): 90. Бибкод : 2011НатСР...1Е..90К . дои : 10.1038/srep00090 . ПМК 3201773 . ПМИД 22034591 .
- ^ Манн М., Дженсен О.Н. (март 2003 г.). «Протеомный анализ посттрансляционных модификаций». Природная биотехнология . 21 (3): 255–261. дои : 10.1038/nbt0303-255 . ПМИД 12610572 . S2CID 205266061 .
- ^ Со Джей, Ли Кей Джей (январь 2004 г.). «Посттрансляционные модификации и их биологические функции: протеомный анализ и систематические подходы» . Журнал биохимии и молекулярной биологии . 37 (1): 35–44. дои : 10.5483/bmbrep.2004.37.1.035 . ПМИД 14761301 .
- ^ Роджерс Л.Д., общий управляющий директор (декабрь 2013 г.). «Протеолитическая посттрансляционная модификация белков: протеомные инструменты и методология» . Молекулярная и клеточная протеомика . 12 (12): 3532–3542. дои : 10.1074/mcp.M113.031310 . ПМЦ 3861706 . ПМИД 23887885 .
- ^ Ахмад В., Галл Б., Бэби Дж., Мустафа Ф. (июнь 2021 г.). «Комплексный анализ анализов северной и жидкой гибридизации мРНК, малых РНК и микроРНК с использованием подхода, не меченного радиоактивными изотопами» . Актуальные проблемы молекулярной биологии . 43 (2): 457–484. дои : 10.3390/cimb43020036 . ПМЦ 8929067 . ПМИД 34206608 .
- ^ Хой М.А. (2013). «Глава 6. Некоторые дополнительные инструменты для молекулярного биолога» . Молекулярная генетика насекомых (3-е изд.). Академическая пресса . стр. 215–249. дои : 10.1016/C2011-0-69839-4 . ISBN 978-0-12-415874-0 .
- ^ Петров А, Ца А, Пуглиси Дж. Д. (2013). «Анализ РНК методом аналитического электрофореза в полиакриламидном геле» . Лабораторные методы в энзимологии: РНК . Том. 530. стр. 301–313. дои : 10.1016/B978-0-12-420037-1.00016-6 . ISBN 978-0-12-420037-1 . ISSN 1557-7988 . ПМИД 24034328 .
- ^ Бойл А., Перри-О'Киф Х. (май 2001 г.). «Метки и колориметрическое обнаружение неизотопных зондов». Современные протоколы молекулярной биологии . 3 (Дополнение 20): Раздел 3.18. дои : 10.1002/0471142727.mb0318s20 . ПМИД 18265226 .
- ^ Куанг Дж., Ян X, Гендерс AJ, Граната С., Бишоп DJ (10 мая 2018 г.). «Обзор технических соображений при использовании количественного ПЦР-анализа экспрессии генов в реальном времени в исследованиях физических упражнений на людях» . ПЛОС ОДИН . 13 (5): e0196438. Бибкод : 2018PLoSO..1396438K . дои : 10.1371/journal.pone.0196438 . ПМЦ 5944930 . ПМИД 29746477 .
- ^ Ян Т., Чжан М., Чжан Н. (январь 2022 г.). «Модифицированный протокол нозерн-блоттинга для простого обнаружения мРНК в общей РНК с использованием радиоактивно меченных зондов» . БМК Геномика . 23 (1): 66. дои : 10.1186/s12864-021-08275-w . ПМЦ 8772191 . ПМИД 35057752 .
- ^ Весьерска-Гадек Дж., Ван ЗК, Шмид Г. (январь 1999 г.). «Снижение стабильности регулярно сплайсированного, но не альтернативно сплайсированного белка p53 в фибробластах мыши с дефицитом PARP» . Исследования рака . 59 (1): 28–34. ПМИД 9892179 .
- ^ Падхи Б.К., Сингх М., Розалес М., Пеллетье Дж., Чакмак С. (май 2018 г.). «Количественный анализ на основе ПЦР для оценки целостности мРНК в образцах крыс» . Биомолекулярное обнаружение и количественный анализ . 15 :18–23. дои : 10.1016/j.bdq.2018.02.001 . ПМК 6006387 . ПМИД 29922590 .
- ^ Квон Ю.М., Рике СК (22 марта 2011 г.). Высокопроизводительное секвенирование нового поколения . Методы молекулярной биологии. Том. 733 (1-е изд.). Springer Science+Business Media . дои : 10.1007/978-1-61779-089-8 . eISSN 1940-6029 . ISBN 978-1-61779-089-8 . ISSN 1064-3745 .
- ^ Рахмасари Р., Раекиансия М., Азаллеа С.Н., Нетания М., Билкисти Н., Розалиани А. и др. (ноябрь 2022 г.). «Недорогой анализ RT-qPCR на основе SYBR Green для обнаружения SARS-CoV-2 в условиях Индонезии с использованием праймеров, рекомендованных ВОЗ» . Гелион . 8 (11): е11130. Бибкод : 2022Heliy...811130R . дои : 10.1016/j.heliyon.2022.e11130 . ПМЦ 9617658 . ПМИД 36339747 .
- ^ Лян М., Коули А.В., Грин А.С. (январь 2004 г.). «Высокопроизводительное профилирование экспрессии генов: молекулярный подход к интегративной физиологии» . Журнал физиологии . 554 (Часть 1): 22–30. дои : 10.1113/jphysicalol.2003.049395 . ПМК 1664740 . ПМИД 14678487 .
- ^ Бамгарнер Р. (январь 2013 г.). «Обзор ДНК-микрочипов: типы, применение и их будущее» . Современные протоколы молекулярной биологии . Глава 22: Раздел 22.1. дои : 10.1002/0471142727.mb2201s101 . ПМК 4011503 . ПМИД 23288464 .
- ^ Байрон С.А., Ван Керен-Йенсен К.Р., Энгельталер Д.М., Карптен Дж.Д., Крейг Д.В. (май 2016 г.). «Перевод секвенирования РНК в клиническую диагностику: возможности и проблемы» . Обзоры природы. Генетика . 17 (5): 257–271. дои : 10.1038/nrg.2016.10 . ПМК 7097555 . ПМИД 26996076 .
- ^ Мейерс BC, Гэлбрейт Д.В., Нельсон Т., Агравал В. (июнь 2004 г.). «Методы транскрипционного профилирования у растений. Плодитесь и копируйтесь» . Физиология растений . 135 (2): 637–652. дои : 10.1104/стр.104.040840 . ПМК 514100 . ПМИД 15173570 .
- ^ Кукурба К.Р., Монтгомери С.Б. (апрель 2015 г.). «Секвенирование и анализ РНК» . Протоколы Колд-Спринг-Харбора . 2015 (11): 951–969. дои : 10.1101/pdb.top084970 . ПМЦ 4863231 . ПМИД 25870306 .
- ^ «Результаты поиска <Атлас выражений <EMBL-EBI» . www.ebi.ac.uk.
- ^ Мориц КП (февраль 2020 г.). «40 лет вестерн-блоттингу: тост за научный день рождения» . Журнал протеомики . 212 : 103575. doi : 10.1016/j.jprot.2019.103575 . ПМИД 31706026 .
- ^ Буркхарт Дж.М., Водель М., Гамбарян С., Радау С., Уолтер У., Мартенс Л. и др. (октябрь 2012 г.). «Первый комплексный и количественный анализ белкового состава тромбоцитов человека позволяет провести сравнительный анализ структурных и функциональных путей» . Кровь . 120 (15): е73–е82. doi : 10.1182/blood-2012-04-416594 . ПМИД 22869793 .
- ^ Мориц КП, Мюльхаус Т, Тенцер С, Шуленборг Т, Фриауф Э (июнь 2019 г.). «Плохая корреляция транскриптов и белков в мозге: отрицательно коррелирующие генные продукты показывают, что полярность нейронов является потенциальной причиной». Журнал нейрохимии . 149 (5): 582–604. дои : 10.1111/jnc.14664 . PMID 30664243 . S2CID 58667771 .
- ^ Банф М., Ри С.Ю. (январь 2017 г.). «Вычислительный вывод генных регуляторных сетей: подходы, ограничения и возможности» . Biochimica et Biophysica Acta (BBA) - Механизмы регуляции генов . 1860 (1): 41–52. дои : 10.1016/j.bbagrm.2016.09.003 . ПМИД 27641093 .
- ^ Чеслер Э.Дж., Лу Л., Ван Дж., Уильямс Р.В., Мэнли К.Ф. (май 2004 г.). «WebQTL: быстрый исследовательский анализ экспрессии генов и генетических сетей мозга и поведения». Природная неврология . 7 (5): 485–486. дои : 10.1038/nn0504-485 . ПМИД 15114364 . S2CID 20241963 .
- ^ Сун Ю, Ван В, Цюй Х, Сунь С (февраль 2009 г.). «Влияние индуцируемого гипоксией фактора-1альфа (HIF-1альфа) на рост и адгезию клеток плоскоклеточной карциномы языка». Индийский журнал медицинских исследований . 129 (2): 154–163. ПМИД 19293442 .
- ^ Ханриот Л., Кейме С., Гей Н., Фор С., Доссат С., Винкер П. и др. (сентябрь 2008 г.). «Комбинация LongSAGE и секвенирования Solexa хорошо подходит для изучения глубины и сложности транскриптома» . БМК Геномика . 9 : 418. дои : 10.1186/1471-2164-9-418 . ПМЦ 2562395 . ПМИД 18796152 .
- ^ Уилан С.Дж., Мартинес Мурильо Ф., Буке Дж.Д. (июль 2008 г.). «Невероятно сокращающийся мир ДНК-микрочипов» . Молекулярные биосистемы . 4 (7): 726–732. дои : 10.1039/b706237k . ПМЦ 2535915 . ПМИД 18563246 .
- ^ Миякоси М., Нисида Х., Синтани М., Ямане Х., Нодзири Х. (январь 2009 г.). «Картирование плазмидных транскриптомов в различных бактериях-хозяевах с высоким разрешением» . БМК Геномика . 10:12 . дои : 10.1186/1471-2164-10-12 . ПМЦ 2642839 . ПМИД 19134166 .
- ^ Деноэ Ф., Ори Дж.М., Да Силва С., Ноэль Б., Рожье О., Делледонн М. и др. (2008). «Аннотирование геномов с помощью масштабного секвенирования РНК» . Геномная биология . 9 (12): 175 рандов. дои : 10.1186/gb-2008-9-12-r175 . ПМЦ 2646279 . ПМИД 19087247 .
- ^ Клаф Э., Барретт Т. (2016). «Общая база данных экспрессии генов». Статистическая геномика . Методы молекулярной биологии. Том. 1418. стр. 93–110. дои : 10.1007/978-1-4939-3578-9_5 . ISBN 978-1-4939-3576-5 . ПМЦ 4944384 . ПМИД 27008011 .
- ^ Килич С., Уайт Э.Р., Сагитова Д.М., Корниш Дж.П., Эрилл И. (январь 2014 г.). «CollecTF: база данных экспериментально подтвержденных сайтов связывания факторов транскрипции у бактерий» . Исследования нуклеиновых кислот . 42 (Проблема с базой данных): D156–D160. дои : 10.1093/нар/gkt1123 . ПМК 3965012 . ПМИД 24234444 .
- ^ Моретто М., Сонего П., Диркксенс Н., Брилли М., Бьянко Л., Ледезма-Техейда Д. и др. (январь 2016 г.). «COLOMBOS v3.0: использование сборника экспрессии генов для межвидового анализа» . Исследования нуклеиновых кислот . 44 (Д1): Д620–Д623. дои : 10.1093/nar/gkv1251 . ПМК 4702885 . ПМИД 26586805 .
- ^ Фейт Дж.Дж., Дрисколл М.Э., Фусаро В.А., Косгроув Э.Дж., Хайете Б., Джун Ф.С. и др. (январь 2008 г.). «База данных многих микробных микрочипов: единообразно нормализованные сборники Affymetrix со структурированными экспериментальными метаданными» . Исследования нуклеиновых кислот . 36 (Проблема с базой данных): D866–D870. дои : 10.1093/нар/gkm815 . ПМК 2238822 . ПМИД 17932051 .