Транскрипционная регуляция
| Глоссарий регулирования транскрипции | |
|---|---|
|
В биологии и генетике молекулярной регуляция транскрипции — это средство, с помощью которого клетка регулирует преобразование ДНК в РНК ( транскрипцию ), тем самым управляя активностью генов . Одиночный ген можно регулировать разными способами: от изменения количества копий транскрибируемой РНК до временного контроля над моментом транскрипции гена. Этот контроль позволяет клетке или организму реагировать на различные внутри- и внеклеточные сигналы и, таким образом, вызывать ответ. Некоторые примеры этого включают производство мРНК, которая кодирует ферменты для адаптации к изменению источника пищи, производство генных продуктов, участвующих в специфической активности клеточного цикла, и производство генных продуктов, ответственных за клеточную дифференциацию у многоклеточных эукариот, как это изучалось в эволюционных исследованиях развития. биология .
Регуляция транскрипции является жизненно важным процессом во всех живых организмах. Он управляется транскрипционными факторами и другими белками, работающими совместно, чтобы точно регулировать количество РНК, вырабатываемой с помощью различных механизмов. Бактерии и эукариоты имеют совершенно разные стратегии осуществления контроля над транскрипцией, но некоторые важные особенности между ними сохраняются. Наиболее важной является идея комбинаторного контроля, которая заключается в том, что любой данный ген, вероятно, контролируется определенной комбинацией факторов, контролирующих транскрипцию. В гипотетическом примере факторы A и B могут регулировать отдельный набор генов из комбинации факторов A и C. Эта комбинаторная природа распространяется на комплексы, состоящие из гораздо более чем двух белков, и позволяет очень небольшому подмножеству (менее 10% ) генома для управления программой транскрипции всей клетки.
У бактерий
[ редактировать ]
Большая часть раннего понимания транскрипции пришла от бактерий, [2] хотя степень и сложность регуляции транскрипции выше у эукариот. Бактериальная транскрипция регулируется тремя основными элементами последовательности:
- Промоторы — это элементы ДНК, которые могут связывать РНК-полимеразу и другие белки для успешной инициации транскрипции непосредственно перед геном.
- Операторы распознают белки-репрессоры, которые связываются с участком ДНК и ингибируют транскрипцию гена.
- Элементы положительного контроля, которые связываются с ДНК и стимулируют более высокие уровни транскрипции. [3]
Хотя эти средства регуляции транскрипции существуют и у эукариот, ландшафт транскрипции значительно сложнее как из-за количества задействованных белков, так и из-за присутствия интронов и упаковки ДНК в гистоны .
Транскрипция основного бактериального гена зависит от силы его промотора и присутствия активаторов или репрессоров. В отсутствие других регуляторных элементов аффинность промотора к РНК-полимеразам на основе последовательности варьируется, что приводит к образованию разных количеств транскрипта. Переменная аффинность РНК-полимеразы к различным последовательностям промотора связана с областями консенсусной последовательности, расположенными выше сайта начала транскрипции. Чем больше нуклеотидов промотора соответствуют консенсусной последовательности, тем выше вероятное сродство промотора к РНК-полимеразе. [4]

В отсутствие других регуляторных элементов по умолчанию бактериальный транскрипт находится в конфигурации «включено», что приводит к образованию некоторого количества транскрипта. Это означает, что регуляция транскрипции с помощью белков-репрессоров и элементов положительного контроля может как увеличивать, так и уменьшать транскрипцию. Репрессоры часто физически занимают место промотора, препятствуя связыванию РНК-полимеразы. Альтернативно, репрессор и полимераза могут связываться с ДНК одновременно, при этом физическое взаимодействие между репрессорами предотвращает открытие ДНК для доступа к минус-цепи для транскрипции. Эта стратегия контроля отличается от эукариотической транскрипции, базальное состояние которой должно быть выключено и где кофакторы, необходимые для инициации транскрипции, сильно зависят от генов. [8]
Сигма-факторы представляют собой специализированные бактериальные белки, которые связываются с РНК-полимеразами и организуют инициацию транскрипции. Сигма-факторы действуют как медиаторы транскрипции, специфичной для последовательности, так что один сигма-фактор может использоваться для транскрипции всех генов домашнего хозяйства или набора генов, которые клетка желает экспрессировать в ответ на некоторые внешние стимулы, такие как стресс. [9]
Помимо процессов, регулирующих транскрипцию на этапе инициации, синтез мРНК контролируется также скоростью элонгации транскрипции. [10] Паузы РНК-полимеразы происходят часто и регулируются факторами транскрипции, такими как NusG и NusA, сопряжением транскрипции-трансляции и вторичной структурой мРНК. [11] [12]
У эукариотов
[ редактировать ]
Дополнительная сложность создания эукариотической клетки влечет за собой увеличение сложности регуляции транскрипции. Эукариоты имеют три РНК-полимеразы, известные как Pol I , Pol II и Pol III . Каждая полимераза имеет определенные цели и действия и регулируется независимыми механизмами. Существует ряд дополнительных механизмов, с помощью которых можно контролировать активность полимеразы. Эти механизмы можно в целом сгруппировать по трем основным направлениям:
- Контроль доступа полимеразы к гену. Это, пожалуй, самый широкий из трех механизмов контроля. Сюда входят функции ферментов ремоделирования гистонов , факторов транскрипции, энхансеров и репрессоров и многих других комплексов.
- Продуктивная элонгация транскрипта РНК. Как только полимераза связывается с промотором, ей требуется другой набор факторов, чтобы позволить ей выйти из промоторного комплекса и начать успешно транскрибировать РНК.
- Терминация полимеразы. Было обнаружено, что ряд факторов контролирует, как и когда происходит терминация, которые будут определять судьбу транскрипта РНК.
Все три системы работают согласованно, интегрируя сигналы клетки и соответствующим образом изменяя программу транскрипции.
В то время как в прокариотических системах базальное состояние транскрипции можно рассматривать как нерестриктивное (то есть «включенное» в отсутствие модифицирующих факторов), эукариоты имеют рестриктивное базальное состояние, которое требует привлечения других факторов для генерации транскриптов РНК. Это различие во многом связано с уплотнением эукариотического генома за счет намотки ДНК вокруг гистонов с образованием структур более высокого порядка. Это уплотнение делает промотор гена недоступным без помощи других факторов ядра, и, таким образом, структура хроматина является общим местом регуляции. Подобно сигма-факторам у прокариот, общие факторы транскрипции (GTF) представляют собой набор факторов у эукариот, которые необходимы для всех событий транскрипции. Эти факторы отвечают за стабилизацию связывающих взаимодействий и раскрытие спирали ДНК, позволяя РНК-полимеразе получить доступ к матрице, но обычно им не хватает специфичности для различных сайтов промотора. [13] Большая часть регуляции генов происходит посредством факторов транскрипции, которые либо рекрутируют, либо ингибируют связывание общего механизма транскрипции и/или полимеразы. Этого можно достичь посредством тесного взаимодействия с основными элементами промотора или с помощью элементов -энхансеров , находящихся на большом расстоянии .
Как только полимераза успешно связывается с матрицей ДНК, ей часто требуется помощь других белков, чтобы покинуть стабильный комплекс промотора и начать удлинение зарождающейся цепи РНК. Этот процесс называется уходом от промотора и является еще одним шагом, на котором регуляторные элементы могут действовать, ускоряя или замедляя процесс транскрипции. Аналогично, факторы белка и нуклеиновой кислоты могут связываться с комплексом элонгации и модулировать скорость, с которой полимераза движется вдоль матрицы ДНК.
На уровне состояния хроматина
[ редактировать ]У эукариот геномная ДНК сильно уплотнена, чтобы ее можно было разместить в ядре. Это достигается путем накручивания ДНК вокруг белковых октамеров, называемых гистонами , что влияет на физическую доступность частей генома в любой момент времени. Значительные части замалчиваются посредством модификаций гистонов и, таким образом, становятся недоступными для полимераз или их кофакторов. Высший уровень регуляции транскрипции происходит за счет перестройки гистонов с целью обнажения или секвестрации генов, поскольку эти процессы способны делать недоступными целые области хромосомы, как это происходит при импринтинге.
Перегруппировке гистонов способствуют посттрансляционные модификации хвостов основных гистонов. Широкий спектр модификаций может быть осуществлен с помощью таких ферментов, как гистон-ацетилтрансферазы (HAT) , гистон-метилтрансферазы (HMT) и гистон-деацетилазы (HDAC) , среди других. Эти ферменты могут добавлять или удалять ковалентные модификации, такие как метильные группы, ацетильные группы, фосфаты и убиквитин. Модификации гистонов служат для привлечения других белков, которые могут либо увеличивать уплотнение хроматина и изолировать промоторные элементы, либо увеличивать расстояние между гистонами и обеспечивать ассоциацию факторов транскрипции или полимеразы с открытой ДНК. [14] Например, триметилирование H3K27 полигребневидным комплексом PRC2 вызывает уплотнение хромосом и молчание генов. [15] Эти модификации гистонов могут быть созданы клеткой или унаследованы эпигенетически от родителя.
На уровне метилирования цитозина
[ редактировать ]
Регуляция транскрипции примерно на 60% промоторов контролируется метилированием цитозинов в динуклеотидах CpG (где за 5'-цитозином следует 3'-гуанин или сайты CpG ). 5-метилцитозин (5-mC) представляет собой метилированную форму ДНК основания цитозина (см. рисунок). 5-mC представляет собой эпигенетический маркер, обнаруживаемый преимущественно в сайтах CpG. В геноме человека встречается около 28 миллионов CpG-динуклеотидов. [16] В большинстве тканей млекопитающих в среднем от 70% до 80% цитозинов CpG метилированы (образуя 5-метилCpG или 5-mCpG). [17] Метилированные цитозины в 3'-последовательностях 5'цитозин-гуанин часто встречаются группами, называемыми CpG-островками . Около 60% последовательностей промоторов имеют островок CpG, тогда как только около 6% последовательностей энхансеров имеют островок CpG. [18] Островки CpG представляют собой регуляторные последовательности, поскольку если острова CpG метилированы в промоторе гена, это может уменьшить или заглушить транскрипцию гена. [19]
Метилирование ДНК регулирует транскрипцию генов посредством взаимодействия с белками метилсвязывающего домена (MBD) , такими как MeCP2 , MBD1 и MBD2 . Эти белки MBD наиболее прочно связываются с высоко метилированными CpG-островками . [20] Эти белки MBD имеют как метил-CpG-связывающий домен, так и домен репрессии транскрипции. [20] Они связываются с метилированной ДНК и направляют белковые комплексы, обладающие активностью ремоделирования хроматина и/или модификации гистонов, к метилированным CpG-островкам. Белки MBD обычно репрессируют локальный хроматин, например, катализируя введение репрессивных меток гистонов или создавая общую репрессивную среду хроматина посредством ремоделирования нуклеосом и реорганизации хроматина. [20]
Факторы транскрипции — это белки, которые связываются со специфическими последовательностями ДНК и регулируют экспрессию гена. Последовательность связывания фактора транскрипции в ДНК обычно имеет длину около 10 или 11 нуклеотидов. Как подытожили в 2009 году Vaquerizas et al. указали, что существует около 1400 различных факторов транскрипции, кодируемых в геноме человека генами, которые составляют около 6% всех генов, кодирующих человеческие белки. [21] Около 94% сайтов связывания транскрипционных факторов (TFBS), которые связаны с генами, чувствительными к сигналу, встречаются в энхансерах, тогда как только около 6% таких TFBS встречаются в промоторах. [22]
Белок EGR1 представляет собой особый фактор транскрипции, который важен для регуляции метилирования CpG-островков. Сайт связывания транскрипционного фактора EGR1 часто расположен в последовательностях энхансера или промотора. [23] В геноме млекопитающих имеется около 12 000 сайтов связывания EGR1, причем около половины сайтов связывания EGR1 расположены в промоторах, а половина - в энхансерах. [23] Связывание EGR1 с целевым участком связывания ДНК нечувствительно к метилированию цитозина в ДНК. [23]
Хотя в нестимулированных клетках обнаруживаются лишь небольшие количества белка транскрипционного фактора EGR1, трансляция гена EGR1 в белок через час после стимуляции резко увеличивается. [24] Экспрессия белков транскрипционного фактора EGR1 в различных типах клеток может стимулироваться факторами роста, нейротрансмиттерами, гормонами, стрессом и травмой. [24] В мозге, когда нейроны активируются, белки EGR1 активируются и связываются (рекрутируют) ранее существовавшие ферменты TET1 , которые высоко экспрессируются в нейронах. Ферменты ТЕТ могут катализировать деметилирование 5-метилцитозина. Когда факторы транскрипции EGR1 доставляют ферменты TET1 к сайтам связывания EGR1 в промоторах, ферменты TET могут деметилировать метилированные островки CpG на этих промоторах. После деметилирования эти промоторы могут затем инициировать транскрипцию своих генов-мишеней. Сотни генов в нейронах дифференциально экспрессируются после активации нейронов посредством рекрутирования EGR1 TET1 на метилированные регуляторные последовательности в их промоторах. [23]
Метилирование промоторов также изменяется в ответ на сигналы. Три метилтрансферазы ДНК млекопитающих (DNMT1, DNMT3A и DNMT3B) катализируют добавление метильных групп к цитозинам в ДНК. В то время как DNMT1 является «поддерживающей» метилтрансферазой, DNMT3A и DNMT3B могут осуществлять новые метилирования. Существуют также две сплайсингового изоформы белка, полученные из гена DNMT3A : белки ДНК-метилтрансферазы DNMT3A1 и DNMT3A2. [25]
Изоформа сплайсинга DNMT3A2 ведет себя как продукт классического гена немедленной ранней стадии и, например, она устойчиво и временно продуцируется после активации нейронов. [26] То, где изоформа ДНК-метилтрансферазы DNMT3A2 связывается и добавляет метильные группы к цитозинам, по-видимому, определяется посттрансляционными модификациями гистонов. [27] [28] [29]
С другой стороны, нервная активация вызывает деградацию DNMT3A1, сопровождающуюся снижением метилирования по крайней мере одного оцененного целевого промотора. [30]
Через транскрипционные факторы и энхансеры
[ редактировать ]Транскрипционные факторы
[ редактировать ]Факторы транскрипции — это белки, которые связываются со специфическими последовательностями ДНК, чтобы регулировать экспрессию данного гена. В геноме человека насчитывается около 1400 факторов транскрипции, и они составляют около 6% всех генов, кодирующих белки человека. [21] Сила транскрипционных факторов заключается в их способности активировать и/или подавлять широкий репертуар нижестоящих генов-мишеней. Тот факт, что эти факторы транскрипции работают комбинаторно, означает, что только небольшая часть генома организма кодирует факторы транскрипции.Факторы транскрипции действуют посредством широкого спектра механизмов. Согласно одному из механизмов, метилирование CpG влияет на связывание большинства факторов транскрипции с ДНК — в некоторых случаях отрицательно, а в других положительно. [31] Кроме того, часто они находятся в конце пути передачи сигнала , который изменяет что-то в факторе, например его субклеточную локализацию или его активность. Посттрансляционные модификации транскрипционных факторов, расположенных в цитозоле, могут привести к их перемещению в ядро , где они могут взаимодействовать с соответствующими энхансерами. Другие факторы транскрипции уже находятся в ядре и модифицируются, чтобы обеспечить взаимодействие с партнерскими факторами транскрипции. Некоторые посттрансляционные модификации, которые, как известно, регулируют функциональное состояние транскрипционных факторов, включают фосфорилирование , ацетилирование , SUMOилирование и убиквитилирование .Факторы транскрипции можно разделить на две основные категории: активаторы и репрессоры . В то время как активаторы могут прямо или косвенно взаимодействовать с основным механизмом транскрипции посредством связывания энхансера, репрессоры преимущественно рекрутируют ко-репрессорные комплексы, что приводит к репрессии транскрипции за счет конденсации хроматина областей энхансера. Также может случиться так, что репрессор может функционировать путем аллостерической конкуренции против определенного активатора, подавляя экспрессию генов: перекрывающиеся ДНК-связывающие мотивы как для активаторов, так и для репрессоров вызывают физическую конкуренцию за занятие места связывания. Если репрессор имеет более высокое сродство к своему мотиву, чем активатор, транскрипция будет эффективно блокироваться в присутствии репрессора.Жесткий регуляторный контроль достигается за счет высокодинамической природы транскрипционных факторов. Опять же, существует множество различных механизмов, контролирующих активность транскрипционного фактора. Эти механизмы включают контроль над локализацией белка или контроль над тем, может ли белок связываться с ДНК. [32] Примером этого является белок HSF1 , который остается связанным с Hsp70 в цитозоле и перемещается в ядро только при клеточном стрессе, таком как тепловой шок. Таким образом, гены, находящиеся под контролем этого транскрипционного фактора, останутся нетранскрибируемыми, пока клетка не подвергнется стрессу. [33]
Усилители
[ редактировать ]Энхансеры или цис-регуляторные модули/элементы (CRM/CRE) представляют собой некодирующие последовательности ДНК, содержащие множественные сайты связывания активатора и репрессора. Энхансеры имеют длину от 200 п.н. до 1 т.п.н. и могут располагаться как проксимально, в 5'-конце от промотора или внутри первого интрона регулируемого гена, так и дистально, в интронах соседних генов или межгенных областях, удаленных от локуса. Посредством образования петель ДНК активные энхансеры связываются с промотором в зависимости от специфичности промотора основного ДНК-связывающего мотива. [34] Дихотомия промотор-энхансер обеспечивает основу для функционального взаимодействия между факторами транскрипции и коровым механизмом транскрипции, запускающим выход РНК Pol II из промотора. Хотя можно было бы подумать, что соотношение энхансер-промотор составляет 1:1, исследования генома человека предсказывают, что активный промотор взаимодействует с 4-5 энхансерами. Точно так же энхансеры могут регулировать более одного гена без ограничения сцепления и, как говорят, «пропускают» соседние гены, чтобы регулировать более отдаленные. Хотя и нечасто, в регуляции транскрипции могут участвовать элементы, расположенные в хромосоме, отличной от той, где находится промотор. Проксимальные энхансеры или промоторы соседних генов могут служить платформами для рекрутирования более дистальных элементов. [35]
Активация и внедрение энхансера
[ редактировать ]Этот раздел может потребовать очистки Википедии , чтобы соответствовать стандартам качества . Конкретная проблема: Дублирование с помощью Enhancer (генетика) . Может быть {{main}} Сделаю?? ( сентябрь 2021 г. ) |
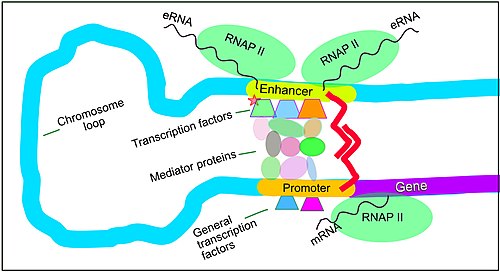
Повышенная экспрессия генов у млекопитающих может быть инициирована, когда сигналы передаются промоторам, связанным с генами. Цис-регуляторные последовательности ДНК , расположенные в участках ДНК, удаленных от промоторов генов, могут оказывать очень сильное влияние на экспрессию генов, при этом экспрессия некоторых генов увеличивается до 100 раз из-за такой цис-регуляторной последовательности. [36] Эти цис-регуляторные последовательности включают энхансеры , сайленсеры , инсуляторы и привязывающие элементы. [37] Среди этого созвездия последовательностей энхансеры и связанные с ними белки-факторы транскрипции играют ведущую роль в регуляции экспрессии генов. [38]
Энхансеры — это последовательности генома, являющиеся основными генно-регуляторными элементами. Энхансеры контролируют программы экспрессии генов, специфичные для определенного типа клеток, чаще всего путем прохождения больших расстояний, чтобы оказаться в физической близости с промоторами своих генов-мишеней. [39] При исследовании нейронов коры головного мозга было обнаружено 24 937 петель, подводящих энхансеры к промоторам. [36] Множественные энхансеры, каждый из которых часто находится на десятках или сотнях тысяч нуклеотидов, удаленных от генов-мишеней, соединяются с промоторами гена-мишени и координируются друг с другом, чтобы контролировать экспрессию общего гена-мишени. [39]
Схематическая иллюстрация в этом разделе показывает, как энхансер движется по кругу, чтобы вступить в тесную физическую близость к промотору целевого гена. Петля стабилизируется димером соединительного белка (например, димером CTCF или YY1 ), причем один член димера прикреплен к своему связывающему мотиву на энхансере, а другой член прикреплен к своему связывающему мотиву на промоторе (представленному красные зигзаги на иллюстрации). [40] Несколько белков-факторов транскрипции, специфичных для клеточных функций (в 2018 году Ламберт и др. указали, что в клетке человека имеется около 1600 факторов транскрипции). [41] ) обычно связываются с определенными мотивами энхансера [22] и небольшая комбинация этих связанных с энхансером факторов транскрипции, когда они приближаются к промотору с помощью петли ДНК, регулируют уровень транскрипции целевого гена. Медиатор (коактиватор) (комплекс, обычно состоящий примерно из 26 белков во взаимодействующей структуре) передает регуляторные сигналы от энхансерных ДНК-связанных факторов транскрипции непосредственно ферменту РНК-полимеразы II (РНКП II), связанному с промотором. [42]
Энхансеры, когда они активны, обычно транскрибируются с обеих цепей ДНК с помощью РНК-полимераз, действующих в двух разных направлениях, образуя две эРНК, как показано на рисунке. [43] Неактивный энхансер может быть связан с неактивным фактором транскрипции. Фосфорилирование фактора транскрипции может активировать его, и этот активированный фактор транскрипции может затем активировать энхансер, с которым он связан (см. маленькую красную звездочку, обозначающую фосфорилирование фактора транскрипции, связанного с энхансером, на иллюстрации). [44] Активированный энхансер начинает транскрипцию своей РНК перед активацией промотора, чтобы инициировать транскрипцию информационной РНК из его целевого гена. [45]
Нормативно-правовая база
[ редактировать ]Инициация, терминация и регуляция транскрипции опосредуются «петлей ДНК», которая объединяет промоторы, энхансеры, факторы транскрипции и факторы процессинга РНК для точной регуляции экспрессии генов. [46] Захват конформации хромосомы (3C) и, в последнее время, методы Hi-C предоставили доказательства того, что активные области хроматина «уплотняются» в ядерных доменах или тельцах, где регуляция транскрипции усилена. [47] Конфигурация генома важна для близости энхансера к промотору. Решения о судьбе клеток опосредуются высокодинамичными геномными реорганизациями в интерфазе, которые модульно включают или выключают целые сети регуляции генов посредством перестроек хроматина на короткие и длинные дистанции. [48] Связанные исследования показывают, что геномы многоклеточных животных разделены на структурные и функциональные единицы вокруг мегабазы, давно называемой топологическими ассоциативными доменами (TAD), содержащей десятки генов, регулируемых сотнями энхансеров, распределенных в больших геномных областях, содержащих только некодирующие последовательности. Функция TAD заключается в перегруппировке энхансеров и промоторов, взаимодействующих вместе в пределах одного большого функционального домена, вместо того, чтобы распространять их по разным TAD. [49] Однако исследования развития мышей указывают на то, что два соседних TAD могут регулировать один и тот же кластер генов. Наиболее актуальное исследование эволюции конечностей показывает, что TAD на 5'-конце кластера генов HoxD в геномах четвероногих стимулирует его экспрессию в эмбрионах дистальных зачатков конечностей, что дает начало руке, в то время как TAD, расположенный на 3'-стороне, делает это в проксимальный зачаток конечности, дающий начало руке. [50] Тем не менее, неизвестно, являются ли TAD адаптивной стратегией усиления регуляторных взаимодействий или эффектом ограничений на эти самые взаимодействия.Границы TAD часто состоят из генов домашнего хозяйства, тРНК, других высокоэкспрессируемых последовательностей и коротких вкраплений элементов (SINE). Хотя эти гены могут использовать свое пограничное положение для повсеместной экспрессии, они не связаны напрямую с формированием края TAD. Специфические молекулы, идентифицированные на границах TAD, называются инсуляторами или архитектурными белками, поскольку они не только блокируют утечку энхансера, но также обеспечивают точную компартментализацию цис-регуляторных входов к целевому промотору. Этими инсуляторами являются ДНК-связывающие белки, такие как CTCF и TFIIIC, которые помогают рекрутировать структурных партнеров, таких как когезины и конденсины. Локализация и связывание архитектурных белков с соответствующими сайтами связывания регулируются посттрансляционными модификациями. [51] ДНК-связывающие мотивы, распознаваемые архитектурными белками, имеют либо высокую заселенность и расположены примерно в мегабазе друг от друга, либо низкую заселенность и находятся внутри TAD. Сайты с высокой занятостью обычно консервативны и статичны, в то время как сайты внутри TAD являются динамическими в зависимости от состояния клетки, поэтому сами TAD разделены на субдомены, которые можно назвать субTAD длиной от нескольких килобайт до TAD (19). Когда архитектурные сайты связывания находятся на расстоянии менее 100 т.п.н. друг от друга, белки-медиаторы представляют собой архитектурные белки, взаимодействующие с когезином. Для субTAD размером более 100 т.п.н. и границ TAD типичным изолятором, взаимодействующим с когезией, является CTCF. [52]
О преинициационном комплексе и выходе промотора
[ редактировать ]У эукариот рибосомальная рРНК и тРНК, участвующие в трансляции, контролируются РНК-полимеразой I (Pol I) и РНК-полимеразой III (Pol III). РНК-полимераза II (Pol II) отвечает за производство информационной РНК (мРНК) внутри клетки. В частности, для Pol II большая часть регуляторных контрольных точек в процессе транскрипции происходит при сборке и выходе преинициаторного комплекса . Ген-специфическая комбинация факторов транскрипции привлечет TFIID и/или TFIIA к основному промотору с последующей ассоциацией TFIIB , создавая стабильный комплекс, на котором могут собраться остальные общие факторы транскрипции (GTF) . [53] Этот комплекс относительно стабилен и может подвергаться нескольким раундам инициации транскрипции. [54] После связывания TFIIB и TFIID, Pol II могут собраться остальные GTF. Эта сборка характеризуется посттрансляционной модификацией (обычно фосфорилированием) С-концевого домена (CTD) Pol II посредством ряда киназ. [55] CTD представляет собой большой неструктурированный домен, простирающийся от субъединицы RbpI Pol II и состоящий из множества повторов гептадной последовательности YSPTSPS. TFIIH , хеликаза, которая остается связанной с Pol II на протяжении всей транскрипции, также содержит субъединицу с киназной активностью, которая фосфорилирует серины 5 в гептадной последовательности. Аналогично, как CDK8 (субъединица массивного мультибелкового медиаторного комплекса), так и CDK9 (субъединица фактора элонгации p-TEFb ) обладают киназной активностью по отношению к другим остаткам на CTD. [56] Эти события фосфорилирования способствуют процессу транскрипции и служат местами рекрутирования механизмов процессинга мРНК. Все три из этих киназ реагируют на восходящие сигналы, и неспособность фосфорилировать CTD может привести к остановке полимеразы на промоторе.
При раке
[ редактировать ]У позвоночных большинство промоторов генов содержат островок CpG с многочисленными сайтами CpG . [57] Когда многие сайты CpG промотора гена метилированы, ген замолкает. [58] Колоректальный рак обычно имеет от 3 до 6 мутаций водителя и от 33 до 66 мутаций автостопщика или пассажира. [59] Однако подавление транскрипции может иметь большее значение, чем мутация, в возникновении рака. Например, при колоректальном раке около 600–800 генов транскрипционно подавляются в результате метилирования CpG-островков (см. Регуляция транскрипции при раке ). Репрессия транскрипции при раке может также происходить за счет других эпигенетических механизмов, таких как изменение экспрессии микроРНК . [60] При раке молочной железы репрессия транскрипции BRCA1 может происходить чаще из-за сверхэкспрессии микроРНК-182, чем из-за гиперметилирования промотора BRCA1 (см. Низкая экспрессия BRCA1 при раке молочной железы и яичников ).
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с Мэдиган, Майкл Т. Брок Биология микроорганизмов, 15e . Пирсон. п. 178. ИСБН 9780134602295 .
- ^ ДЖЕЙКОБ Ф., МОНОД Дж. (июнь 1961 г.). «Генетические регуляторные механизмы синтеза белков». Дж. Мол. Биол . 3 (3): 318–56. дои : 10.1016/s0022-2836(61)80072-7 . ПМИД 13718526 . S2CID 19804795 .
- ^ Энглсберг Э., Ирр Дж., Пауэр Дж., Ли Н. (октябрь 1965 г.). «Положительный контроль синтеза ферментов геном С в системе L-арабинозы» . Дж. Бактериол . 90 (4): 946–57. дои : 10.1128/JB.90.4.946-957.1965 . ПМК 315760 . ПМИД 5321403 .
- ^ Басби С., Эбрайт Р.Х. (декабрь 1994 г.). «Структура промотора, распознавание промотора и активация транскрипции у прокариот». Клетка . 79 (5): 743–6. дои : 10.1016/0092-8674(94)90063-9 . ПМИД 8001112 . S2CID 34940548 .
- ^ «malE - предшественник мальтозосвязывающего периплазматического белка - Escherichia coli (штамм K12) - ген и белок malE» . www.uniprot.org . Проверено 20 ноября 2017 г.
- ^ «malF - пермеазный белок мальтозной транспортной системы MalF - Escherichia coli (штамм K12) - ген и белок malF» . www.uniprot.org . Проверено 20 ноября 2017 г.
- ^ «malG - пермеазный белок мальтозной транспортной системы MalG - Escherichia coli (штамм K12) - ген и белок malG» . www.uniprot.org . Проверено 20 ноября 2017 г.
- ^ Паянкаулам С., Ли Л.М., Арности Д.Н. (сентябрь 2010 г.). «Транкрипционная репрессия: сохранившиеся и развитые особенности» . Курс. Биол . 20 (17): R764–71. дои : 10.1016/j.cub.2010.06.037 . ПМЦ 3033598 . ПМИД 20833321 .
- ^ Грубер Т.М., Гросс, Калифорния (2003). «Множественные сигма-субъединицы и разделение бактериального транскрипционного пространства». Анну. Преподобный Микробиол . 57 : 441–66. дои : 10.1146/annurev.micro.57.030502.090913 . ПМИД 14527287 .
- ^ Канг, Дж.; Мишанина, ТВ; Ландик Р. и Дарст С.А. (2019). «Механизмы транскрипционной паузы у бактерий» . Журнал молекулярной биологии . 431 (20): 4007–4029. дои : 10.1016/j.jmb.2019.07.017 . ПМЦ 6874753 . ПМИД 31310765 .
- ^ Чжан Дж. и Ландик Р. (2016). «Улица с двусторонним движением: регуляторное взаимодействие между РНК-полимеразой и зарождающейся структурой РНК» . Журнал молекулярной биологии . 41 (4): 293–310. дои : 10.1016/j.tibs.2015.12.009 . ПМЦ 4911296 . ПМИД 26822487 .
- ^ Арцимович, И. (2018). «Восстановление моста между транскрипцией и переводом» . Молекулярная микробиология . 108 (5): 467–472. дои : 10.1111/mmi.13964 . ПМК 5980768 . ПМИД 29608805 .
- ^ Струл К. (июль 1999 г.). «Принципиально разная логика регуляции генов у эукариот и прокариот» . Клетка . 98 (1): 1–4. дои : 10.1016/S0092-8674(00)80599-1 . ПМИД 10412974 . S2CID 12411218 .
- ^ Кало Э., Высоцка Дж. (март 2013 г.). «Модификация энхансерного хроматина: что, как и почему?» . Мол. Клетка . 49 (5): 825–37. doi : 10.1016/j.molcel.2013.01.038 . ПМЦ 3857148 . ПМИД 23473601 .
- ^ де Наполес М., Мермуд Дж.Э., Вакао Р., Тан Я.А., Эндо М., Аппана Р., Нестерова Т.Б., Силва Дж., Отте А.П., Видал М., Косеки Х., Брокдорф Н. (ноябрь 2004 г.). «Белки группы Polycomb Ring1A/B связывают убиквитилирование гистона H2A с наследственным молчанием генов и инактивацией X» . Дев. Клетка . 7 (5): 663–76. дои : 10.1016/j.devcel.2004.10.005 . ПМИД 15525528 .
- ^ Левквист С., Додд И.Б., Снеппен К., Хаертер Дж.О. (июнь 2016 г.). «Метилирование ДНК в эпигеномах человека зависит от локальной топологии сайтов CpG» . Нуклеиновые кислоты Рез . 44 (11): 5123–32. дои : 10.1093/нар/gkw124 . ПМЦ 4914085 . ПМИД 26932361 .
- ^ Джаббари К., Бернарди Дж. (май 2004 г.). «Метилирование цитозина и частоты CpG, TpG (CpA) и TpA». Джин . 333 : 143–9. дои : 10.1016/j.gene.2004.02.043 . ПМИД 15177689 .
- ^ Штайнхаус Р., Гонсалес Т., Зелов Д., Робинсон П.Н. (июнь 2020 г.). «Первазивные и CpG-зависимые промотороподобные характеристики транскрибируемых энхансеров» . Нуклеиновые кислоты Рез . 48 (10): 5306–5317. дои : 10.1093/nar/gkaa223 . ПМЦ 7261191 . ПМИД 32338759 .
- ^ Птица А (январь 2002 г.). «Схемы метилирования ДНК и эпигенетическая память» . Генс Дев . 16 (1): 6–21. дои : 10.1101/gad.947102 . ПМИД 11782440 .
- ^ Перейти обратно: а б с Ду Кью, Луу П.Л., Стирзакер С., Кларк С.Дж. (2015). «Белки метил-CpG-связывающего домена: читатели эпигенома» . Эпигеномика . 7 (6): 1051–73. дои : 10.2217/эпи.15.39 . ПМИД 25927341 .
- ^ Перейти обратно: а б Вакерисас Дж.М., Куммерфельд С.К., Тейхманн С.А., Ласкомб Н.М. (апрель 2009 г.). «Перепись факторов транскрипции человека: функции, экспрессия и эволюция». Нат. Преподобный Жене . 10 (4): 252–63. дои : 10.1038/nrg2538 . ПМИД 19274049 . S2CID 3207586 .
- ^ Перейти обратно: а б Гроссман С.Р., Энгрейтц Дж., Рэй Дж.П., Нгуен Т.Х., Хакоэн Н., Ландер Э.С. (июль 2018 г.). «Позиционная специфичность различных классов транскрипционных факторов в энхансерах» . Труды Национальной академии наук Соединенных Штатов Америки . 115 (30): Е7222–Е7230. Бибкод : 2018PNAS..115E7222G . дои : 10.1073/pnas.1804663115 . ПМК 6065035 . ПМИД 29987030 .
- ^ Перейти обратно: а б с д Сунь З, Сюй Х, Хэ Дж, Мюррей А, Сунь М.А., Вэй Х, Ван Х, Маккойг Е, Се Е, Цзян Икс, Ли Л, Чжу Дж, Чен Дж, Морозов А, Пикрелл А.М., Теус М.Х., Се Х (август 2019 г.). «EGR1 привлекает TET1 для формирования метилома мозга во время развития и при активности нейронов» . Нат Коммун . 10 (1): 3892. Бибкод : 2019NatCo..10.3892S . дои : 10.1038/s41467-019-11905-3 . ПМЦ 6715719 . ПМИД 31467272 .
- ^ Перейти обратно: а б Кубосаки А, Томару Ю, Тагами М, Арнер Э, Миура Х, Сузуки Т, Сузуки М, Сузуки Х, Хаяшизаки Ю (2009). «Полногеномное исследование сайтов связывания EGR-1 in vivo при моноцитарной дифференцировке» . Геном Биол . 10 (4): Р41. дои : 10.1186/gb-2009-10-4-r41 . ПМЦ 2688932 . ПМИД 19374776 .
- ^ Байрактар Г., Кройц М.Р. (апрель 2018 г.). «Нейрональные ДНК-метилтрансферазы: эпигенетические медиаторы между синаптической активностью и экспрессией генов?» . Нейробиолог . 24 (2): 171–185. дои : 10.1177/1073858417707457 . ПМЦ 5846851 . ПМИД 28513272 .
- ^ Оливейра А.М., Хемстедт Т.Дж., Бадинг Х. (июль 2012 г.). «Спасение связанного со старением снижения экспрессии Dnmt3a2 восстанавливает когнитивные способности». Нат Нейроски . 15 (8): 1111–3. дои : 10.1038/nn.3151 . ПМИД 22751036 . S2CID 10590208 .
- ^ Дхайалан А., Раджавелу А., Ратер П., Тамаш Р., Юрковска Р.З., Рагозин С., Елч А. (август 2010 г.). «Домен Dnmt3a PWWP считывает триметилирование гистона 3 лизина 36 и управляет метилированием ДНК» . J Биол Хим . 285 (34): 26114–20. дои : 10.1074/jbc.M109.089433 . ПМК 2924014 . ПМИД 20547484 .
- ^ Манзо М., Вирц Дж., Амбрози С., Вилласеньор Р., Рошицкий Б., Баубек Т. (декабрь 2017 г.). «Изоформ-специфическая локализация DNMT3A регулирует точность метилирования ДНК на двухвалентных CpG-островках» . ЭМБО Дж . 36 (23): 3421–3434. дои : 10.15252/embj.201797038 . ПМЦ 5709737 . ПМИД 29074627 .
- ^ Дукац М., Хольцер К., Чудалакис М., Эмперле М., Лунгу С., Баштрыков П., Елч А. (декабрь 2019 г.). «Связывание H3K36me2/3 и связывание ДНК домена PWWP ДНК-метилтрансферазы DNMT3A способствуют его взаимодействию с хроматином». Дж Мол Биол . 431 (24): 5063–5074. дои : 10.1016/j.jmb.2019.09.006 . ПМИД 31634469 . S2CID 204832601 .
- ^ Байрактар Г., Юаньсян П., Конфеттура А.Д., Гомес Г.М., Раза С.А., Сторк О., Тадзима С., Суэтаке И., Карпова А., Йылдирим Ф., Кройц М.Р. (ноябрь 2020 г.). «Синаптический контроль метилирования ДНК включает зависимую от активности деградацию DNMT3A1 в ядре» . Нейропсихофармакология . 45 (12): 2120–2130. дои : 10.1038/s41386-020-0780-2 . ПМК 7547096 . ПМИД 32726795 .
- ^ Инь Ю, Моргунова Е, Йолма А, Каасинен Е, Саху Б, Кхунд-Сайед С, Дас ПК, Кивиоджа Т, Дэйв К, Чжун Ф, Нитта КР, Тайпале М, Попов А, Джинно П.А., Домке С, Ян Дж, Шюбелер Д., Винсон С., Тайпале Дж. (май 2017 г.). «Влияние метилирования цитозина на специфичность связывания ДНК факторов транскрипции человека» . Наука . 356 (6337): eaaj2239. дои : 10.1126/science.aaj2239 . ПМК 8009048 . ПМИД 28473536 . S2CID 206653898 .
- ^ Уайтсайд С.Т., Гудборн С. (апрель 1993 г.). «Передача сигнала и ядерное нацеливание: регуляция активности транскрипционных факторов путем субклеточной локализации». Дж. Клеточная наука . 104 (Часть 4) (4): 949–55. дои : 10.1242/jcs.104.4.949 . ПМИД 8314906 .
- ^ Вихерваара А., Систонен Л. (январь 2014 г.). «HSF1 с первого взгляда» . Дж. Клеточная наука . 127 (Часть 2): 261–6. дои : 10.1242/jcs.132605 . ПМИД 24421309 .
- ^ Левин М. (сентябрь 2010 г.). «Усилители транскрипции в развитии и эволюции животных» . Курс. Биол . 20 (17): R754–63. дои : 10.1016/j.cub.2010.06.070 . ПМК 4280268 . ПМИД 20833320 .
- ^ ван Аренсберген Дж., ван Стинсел Б., Буссемейкер Х.Дж. (ноябрь 2014 г.). «В поисках факторов, определяющих специфичность взаимодействия энхансер-промотор» . Тенденции клеточной биологии . 24 (11): 695–702. дои : 10.1016/j.tcb.2014.07.004 . ПМЦ 4252644 . ПМИД 25160912 .
- ^ Перейти обратно: а б Биган Дж.А., Пастузин Э.Д., Фернандес Л.Р., Го М.Х., Фэн К., Титус КР и др. (июнь 2020 г.). «Трехмерная реструктуризация генома во временных рамках экспрессии генов нейронов, индуцированной активностью» . Природная неврология . 23 (6): 707–717. дои : 10.1038/s41593-020-0634-6 . ПМЦ 7558717 . ПМИД 32451484 .
- ^ Верхёль Т.С., ван Хейфте Л., Перенталер Э., Баракат Т.С. (2020). «Почему YY1: механизмы регуляции транскрипции Инь Ян 1» . Границы клеточной биологии и биологии развития . 8 : 592164. дои : 10.3389/fcell.2020.592164 . ПМЦ 7554316 . ПМИД 33102493 .
- ^ Шпиц Ф, Ферлонг Э.Э. (сентябрь 2012 г.). «Факторы транскрипции: от связывания энхансера к контролю развития». Обзоры природы. Генетика . 13 (9): 613–26. дои : 10.1038/nrg3207 . ПМИД 22868264 . S2CID 205485256 .
- ^ Перейти обратно: а б Шенфельдер С., Фрейзер П. (август 2019 г.). «Дальние контакты энхансер-промотор в контроле экспрессии генов». Обзоры природы. Генетика . 20 (8): 437–455. дои : 10.1038/s41576-019-0128-0 . ПМИД 31086298 . S2CID 152283312 .
- ^ Вайнтрауб А.С., Ли CH, Замудио А.В., Сигова А.А., Ханнетт Н.М., Дэй Д.С. и др. (декабрь 2017 г.). «YY1 является структурным регулятором петель энхансер-промотор» . Клетка . 171 (7): 1573–1588.e28. дои : 10.1016/j.cell.2017.11.008 . ПМЦ 5785279 . ПМИД 29224777 .
- ^ Ламберт С.А., Джолма А., Кампителли Л.Ф., Дас П.К., Инь Ю., Альбу М. и др. (февраль 2018 г.). «Факторы транскрипции человека» . Клетка . 172 (4): 650–665. дои : 10.1016/j.cell.2018.01.029 . ПМИД 29425488 .
- ^ Аллен Б.Л., Taatjes DJ (март 2015 г.). «Медиаторный комплекс: центральный интегратор транскрипции» . Обзоры природы. Молекулярно-клеточная биология . 16 (3): 155–66. дои : 10.1038/nrm3951 . ПМЦ 4963239 . ПМИД 25693131 .
- ^ Михайличенко О., Бондаренко В., Харнетт Д., Шор И.Е., Малес М., Виалес Р.Р., Ферлонг Э.Э. (январь 2018 г.). «Степень активности энхансера или промотора отражается уровнями и направленностью транскрипции эРНК» . Гены и развитие . 32 (1): 42–57. дои : 10.1101/gad.308619.117 . ПМЦ 5828394 . ПМИД 29378788 .
- ^ Ли QJ, Ян Ш., Маэда Ю., Сладек Ф.М., Шаррокс А.Д., Мартинс-Грин М. (январь 2003 г.). «Зависимая от фосфорилирования MAP-киназы активация Elk-1 приводит к активации коактиватора p300» . Журнал ЭМБО . 22 (2): 281–91. дои : 10.1093/emboj/cdg028 . ПМК 140103 . ПМИД 12514134 .
- ^ Карулло Н.В., Филлипс III Р.А., Саймон Р.К., Сото С.А., Хиндс Дж.Э., Солсбери А.Дж. и др. (сентябрь 2020 г.). «Энхансерные РНК предсказывают регуляторные связи между энхансером и геном и имеют решающее значение для функции энхансера в нейрональных системах» . Исследования нуклеиновых кислот . 48 (17): 9550–9570. дои : 10.1093/nar/gkaa671 . ПМЦ 7515708 . ПМИД 32810208 .
- ^ Мерсер Т.Р., Мэттик Дж.С. (июль 2013 г.). «Понимание регуляторной и транскрипционной сложности генома через структуру» . Геном Рез . 23 (7): 1081–8. дои : 10.1101/гр.156612.113 . ПМЦ 3698501 . ПМИД 23817049 .
- ^ Деккер Дж., Марти-Реном М.А., Мирный Л.А. (июнь 2013 г.). «Изучение трехмерной организации геномов: интерпретация данных о взаимодействии хроматина» . Нат. Преподобный Жене . 14 (6): 390–403. дои : 10.1038/nrg3454 . ПМЦ 3874835 . ПМИД 23657480 .
- ^ Гомес-Диас Э., Корсес В.Г. (ноябрь 2014 г.). «Архитектурные белки: регуляторы трехмерной организации генома в судьбах клеток» . Тенденции клеточной биологии . 24 (11): 703–11. дои : 10.1016/j.tcb.2014.08.003 . ПМЦ 4254322 . ПМИД 25218583 .
- ^ Смоллвуд А., Рен Б. (июнь 2013 г.). «Организация генома и долгосрочная регуляция экспрессии генов с помощью энхансеров» . Курс. Мнение. Клеточная Биол . 25 (3): 387–94. дои : 10.1016/j.ceb.2013.02.005 . ПМК 4180870 . ПМИД 23465541 .
- ^ Уолтеринг Дж. М., Нордермер Д., Леле М., Дюбул Д. (январь 2014 г.). «Сохранение и расхождение регуляторных стратегий Hox Loci и происхождение пальцев четвероногих» . ПЛОС Биол . 12 (1): e1001773. дои : 10.1371/journal.pbio.1001773 . ПМЦ 3897358 . ПМИД 24465181 .
- ^ Ван Х, Маурано МТ, Цюй Х, Варли К.Э., Герц Дж., Паули Ф., Ли К., Кэнфилд Т., Уивер М., Сандстром Р., Турман Р.Э., Каул Р., Майерс Р.М., Стаматояннопулос Дж.А. (сентябрь 2012 г.). «Широко распространенная пластичность заполнения CTCF, связанная с метилированием ДНК» . Геном Рез . 22 (9): 1680–8. дои : 10.1101/гр.136101.111 . ПМЦ 3431485 . ПМИД 22955980 .
- ^ Филлипс-Креминс Дж.Э., Саурия М.Е., Саньял А., Герасимова Т.И., Ладжуа Б.Р., Белл Дж.С. и др. (июнь 2013 г.). «Архитектурные подклассы белков формируют трехмерную организацию геномов во время передачи родословной» . Клетка . 153 (6): 1281–95. дои : 10.1016/j.cell.2013.04.053 . ПМЦ 3712340 . ПМИД 23706625 .
- ^ Томас MC, Чан CM (2006). «Общий механизм транскрипции и общие кофакторы». Крит. Преподобный Биохим. Мол. Биол . 41 (3): 105–78. CiteSeerX 10.1.1.376.5724 . дои : 10.1080/10409230600648736 . ПМИД 16858867 . S2CID 13073440 .
- ^ Воэт, Дональд Воэт, Джудит Г. (2011). Биохимия (4-е изд.). Хобокен, Нью-Джерси: John Wiley & Sons. ISBN 978-0470917459 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Наполитано Дж., Лания Л., Маджелло Б. (май 2014 г.). «Модификации CTD РНК-полимеразы II: сколько сказок из одного хвоста». Дж. Селл. Физиол . 229 (5): 538–44. дои : 10.1002/jcp.24483 . ПМИД 24122273 . S2CID 44613555 .
- ^ Чепмен Р.Д., Конрад М., Эйк Д. (сентябрь 2005 г.). «Роль несогласованных повторов С-концевого домена (CTD) РНК-полимеразы II млекопитающих в стабильности CTD и пролиферации клеток» . Мол. Клетка. Биол . 25 (17): 7665–74. дои : 10.1128/MCB.25.17.7665-7674.2005 . ПМК 1190292 . ПМИД 16107713 .
- ^ Саксонов С., Берг П., Брутлаг Д.Л. (2006). «Полногеномный анализ динуклеотидов CpG в геноме человека позволяет выделить два различных класса промоторов» . Учеб. Натл. акад. наук. США . 103 (5): 1412–7. Бибкод : 2006PNAS..103.1412S . дои : 10.1073/pnas.0510310103 . ПМЦ 1345710 . ПМИД 16432200 .
- ^ Птица А (2002). «Схемы метилирования ДНК и эпигенетическая память» . Генс Дев . 16 (1): 6–21. дои : 10.1101/gad.947102 . ПМИД 11782440 .
- ^ Фогельштейн Б., Пападопулос Н., Велкулеску В.Е., Чжоу С., Диас Л.А., Кинцлер К.В. (2013). «Пейзажи генома рака» . Наука . 339 (6127): 1546–58. Бибкод : 2013Sci...339.1546V . дои : 10.1126/science.1235122 . ПМК 3749880 . ПМИД 23539594 .
- ^ Тесситоре А, Чиччарелли Г, Дель Веккьо Ф, Гаджано А, Верцелла Д, Фискьетти М, Веккьотти Д, Капече Д, Заззерони Ф, Алессе Э (2014). «МикроРНК в сети повреждения/восстановления ДНК и раке» . Инт Джей Геном . 2014 : 1–10. дои : 10.1155/2014/820248 . ПМЦ 3926391 . ПМИД 24616890 .