РНК-полимераза II
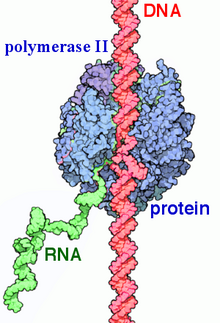
РНК-полимераза II ( РНКП II и Пол II ) представляет собой мультибелковый комплекс , который транскрибирует ДНК в предшественники информационной РНК (мРНК), а также большинства малых ядерных РНК (мяРНК) и микроРНК . [1] [2] Это один из трех РНКП ферментов , обнаруженных в ядре эукариотических клеток. [3] Комплекс РНКП II массой 550 кДа , состоящий из 12 субъединиц, является наиболее изученным типом РНК-полимеразы . широкий спектр транскрипционных факторов необходим Для того чтобы он связался с промоторами вышестоящих генов и начал транскрипцию, .
Открытие
[ редактировать ]
Ранние исследования предполагали наличие как минимум двух РНКП: одна, которая синтезирует рРНК в ядрышке , и другая, которая синтезирует другие РНК в нуклеоплазме , части ядра, но за пределами ядрышка. [5] В 1969 году биохимики Роберт Г. Рёдер и Уильям Раттер обнаружили, что существует всего три различных ядерных РНК-полимеразы , дополнительная РНКП, которая отвечает за транскрипцию определенного типа РНК в нуклеоплазме. [6] Открытие было получено с помощью ионообменной хроматографии на DEAE , покрытых шариках сефадекса . Методика разделяла ферменты по порядку соответствующих элюатов Ι,ΙΙ,ΙΙΙ путем увеличения концентрации сульфата аммония. Ферменты были названы в соответствии с порядком элюирования: РНКП I , РНКП II, РНКП II . [3] Это открытие продемонстрировало, что в нуклеоплазме присутствует дополнительный фермент, который позволяет дифференцировать РНКП II и РНКП III. [7]
РНК-полимераза II (РНКП2) подвергается регулируемой транскрипционной паузе во время ранней элонгации. Различные исследования показали, что нарушение элонгации транскрипции связано с раком , нейродегенерацией , латентным периодом ВИЧ и т. д. [8]
Субъединицы
[ редактировать ]
Эукариотическая коровая РНК - полимераза II была сначала очищена с помощью анализов транскрипции. [10] Очищенный фермент обычно имеет 10–12 субъединиц (12 у человека и дрожжей) и не способен распознавать специфический промотор. [11] Известны многие субъединичные взаимодействия. [12]
- Субъединица ДНК-ориентированной РНК-полимеразы II RPB1 – фермент , который у человека кодируется POLR2A геном , а у дрожжей – RPO21. RPB1 является крупнейшей субъединицей РНК-полимеразы II. Он содержит карбокси-концевой домен (CTD), состоящий из до 52 гептапептидных повторов (YSPTSPS), которые необходимы для активности полимеразы. [13] CTD был впервые обнаружен в лаборатории К. Дж. Инглеса в Университете Торонто и Дж. Л. Кордена в Университете Джонса Хопкинса . В сочетании с несколькими другими субъединицами полимеразы субъединица RPB1 образует ДНК-связывающий домен полимеразы — бороздку, в которой матрица ДНК транскрибируется в РНК. [14] Он сильно взаимодействует с RPB8. [12]
- RPB2 ( POLR2B ) – вторая по величине субъединица, которая в сочетании как минимум с двумя другими субъединицами полимеразы образует структуру внутри полимеразы, которая поддерживает контакт в активном сайте фермента между матрицей ДНК и вновь синтезированной РНК. [15]
- RPB3 ( POLR2C ) — третья по величине субъединица. Существует в виде гетеродимера с другой субъединицей полимеразы, POLR2J , образующей ядро. RPB3 сильно взаимодействует с RPB1-5, 7, 10–12. [12]
- Субъединица B4 РНК-полимеразы II (RPB4) - кодируется геном POLR2D. [16] является четвертой по величине субъединицей и может играть защитную роль от стресса.
- RPB5 – у человека кодируется геном POLR2E . Две молекулы этой субъединицы присутствуют в каждой РНК-полимеразе II. [17] RPB5 сильно взаимодействует с RPB1, RPB3 и RPB6. [12]
- RPB6 ( POLR2F ) – образует структуру как минимум с двумя другими субъединицами, которая стабилизирует транскрибирующую полимеразу на матрице ДНК. [18]
- RPB7 – кодируется POLR2G и может играть роль в регуляции функции полимеразы. [19] RPB7 сильно взаимодействует с RPB1 и RPB5. [12]
- RPB8 ( POLR2H ) – взаимодействует с субъединицами RPB1-3, 5 и 7. [12]
- RPB9 — бороздка, в которой матрица ДНК транскрибируется в РНК, состоит из RPB9 ( POLR2I ) и RPB1.
- RPB10 – продукт гена POLR2L . Он взаимодействует с RPB1-3 и 5 и сильно с RPB3. [12]
- RPB11 - субъединица RPB11 у человека состоит из трех субъединиц: POLR2J (RPB11-a), POLR2J2 (RPB11-b) и POLR2J3. [20] (РПБ11-в).
- RPB12 — с RPB3 также взаимодействует RPB12 ( POLR2K ). [12]
Сборка
[ редактировать ]RPB3 участвует в сборке РНК-полимеразы II. [21] Субкомплекс RPB2 и RPB3 появляется вскоре после синтеза субъединиц. [21] Этот комплекс впоследствии взаимодействует с RPB1. [21] RPB3, RPB5 и RPB7 взаимодействуют друг с другом с образованием гомодимеров, а RPB3 и RPB5 вместе способны связываться со всеми другими субъединицами RPB, кроме RPB9. [12] Только RPB1 прочно связывается с RPB5. [12] Субъединица RPB1 также контактирует с RPB7, RPB10 и более слабо, но наиболее эффективно с RPB8. [12] Как только RPB1 входит в комплекс, могут войти и другие субъединицы, такие как RPB5 и RPB7, где RPB5 связывается с RPB6 и RPB8, а RPB3 приводит к RPB10, RPB 11 и RPB12. [12] RPB4 и RPB9 могут появиться после того, как большая часть комплекса будет собрана. RPB4 образует комплекс с RPB7. [12]
Кинетика
[ редактировать ]Ферменты могут катализировать до нескольких миллионов реакций в секунду. Скорость ферментов зависит от условий раствора и концентрации субстрата. Как и другие ферменты, POLR2 имеет кривую насыщения и максимальную скорость ( V max ). Он имеет K m (концентрация субстрата, необходимая для половины V max ) и k cat (количество молекул субстрата, обрабатываемых одним активным центром в секунду). Константа специфичности определяется выражением k cat / K m . Теоретическим максимумом константы специфичности является диффузионный предел около 10 8 до 10 9 ( М −1 с −1 ), где каждое столкновение фермента с его субстратом приводит к катализу. У дрожжей мутация в домене триггерной петли самой большой субъединицы может изменить кинетику фермента. [22]
Бактериальная РНК-полимераза, родственница РНК-полимеразы II, переключается между инактивированным и активированным состояниями, перемещаясь вперед и назад по ДНК. [23] Концентрации [NTP] eq = 10 мкМ GTP, 10 мкМ UTP, 5 мкМ АТФ и 2,5 мкМ CTP дают среднюю скорость элонгации, число оборотов ~ 1 п.н. (NTP). −1 для бактериальной РНКП, родственника РНК-полимеразы II. [23]

РНК-полимераза II подвергается обширной котранскрипционной паузе во время элонгации транскрипции. [24] [25] Эта пауза особенно выражена в нуклеосомах и частично возникает из-за перехода полимеразы в транскрипционно некомпетентное состояние обратного отслеживания. [24] Продолжительность этих пауз варьируется от секунд до минут и более, а выходу из долговременных пауз могут способствовать факторы удлинения, такие как TFIIS. [26] В свою очередь, скорость транскрипции влияет на то, будут ли гистоны транскрибируемых нуклеосом вытесняться из хроматина или повторно вставляться позади транскрибирующей полимеразы. [27]
Альфа-Аманитин
[ редактировать ]РНК-полимераза II ингибируется α-аманитином. [28] и другие аматоксины . α-Аманитин — высокотоксичное вещество, содержащееся во многих грибах. [5] Грибной яд оказывает различное действие на каждую из РНК-полимераз: I, II, III. RNAP I совершенно не реагирует на это вещество и будет функционировать нормально, тогда как RNAP III имеет умеренную чувствительность. Однако РНКП II полностью ингибируется токсином. Альфа-аманитин ингибирует РНКП II за счет сильных взаимодействий в «воронке», «щели» фермента и ключевых участках «мостовой α-спирали » субъединицы RPB-1. [29]
Холофермент
[ редактировать ]Голофермент РНК-полимеразы II представляет собой форму эукариотической РНК-полимеразы II, которая рекрутируется в промоторы белок -кодирующих генов в живых клетках. [11] Он состоит из РНК-полимеразы II, подмножества общих факторов транскрипции , и регуляторных белков, известных как белки SRB.
Часть сборки голофермента называется преинициационным комплексом , поскольку его сборка происходит на гена промоторе до инициации транскрипции . Медиаторный комплекс действует как мост между РНК-полимеразой II и факторами транскрипции.
Контроль структуры хроматина
[ редактировать ]Это описание примерного механизма дрожжевых клеток, с помощью которого хроматина и гистонов посттрансляционная модификация помогают регулировать и регистрировать транскрипцию генов структура с помощью РНК-полимеразы II.
Этот путь дает примеры регуляции в этих точках транскрипции:
- Преинициация (продвижение Bre1, модификация гистонов)
- Инициация (продвижение с помощью TFIIH, модификация Pol II и продвижение с помощью COMPASS, модификация гистонов)
- Элонгация (продвижение Set2, модификация гистонов)
Это относится к различным этапам процесса как к этапам регулирования. Не доказано, что они используются для регулирования, но весьма вероятно, что так оно и есть.
Промоторы элонгации РНК Pol II можно разделить на 3 класса.
- Факторы, на которые влияет лекарство/последовательность (различные мешающие белки)
- Факторы, ориентированные на структуру хроматина (посттранскрипционные модификаторы гистонов, например, метилтрансферазы гистонов)
- Факторы, улучшающие катализ РНК Pol II (различные мешающие белки и кофакторы Pol II; см. РНК-полимераза II).
Механизмы транскрипции
[ редактировать ]- Факторы, ориентированные на структуру хроматина:
(HMT ( H -истон- М - этилтрансферазы )):
COMPASS§† – ( комплекс белков , AS et1) – Метилирует лизин 4 гистона H3 связанных с S : отвечает за репрессию/замалчивание транскрипции. Нормальная часть клеточного роста и регуляции транскрипции в рамках RNAP II. [30] - Set2 - Метилирует лизин 36 гистона H3: Set2 участвует в регуляции элонгации транскрипции посредством прямого контакта с CTD. [31]
(интересный нерелевантный пример: Dot1*‡ – метилирует лизин 79 гистона H3.) - Bre1 – убиквинирует (добавляет убиквитин ) лизин 123 гистона H2B. Связан с предварительной инициацией и возможностью связывания РНК Pol II.
С-концевой домен
[ редактировать ]С -конец RPB1 присоединяется, образуя С-концевой домен (CTD). Карбокси-концевой домен РНК-полимеразы II обычно состоит из до 52 повторов последовательности Tyr-Ser-Pro-Thr-Ser-Pro-Ser. [32] Домен простирается от ядра фермента RNAPII до выходного канала, такое размещение эффективно благодаря индукции «реакций процессинга РНК посредством прямых или непрямых взаимодействий с компонентами механизма процессинга РНК». [33] Домен CTD не существует в РНК-полимеразе I или РНК-полимеразе III. [3] РНК-полимераза CTD была впервые обнаружена в лаборатории Си. Дж. Инглеса в Университете Торонто, а также в лаборатории Дж. Кордена в Университете Джонса Хопкинса во время процессов секвенирования ДНК, кодирующей субъединицу RPB1 РНК-полимеразы из дрожжей и мышей соответственно. Другие белки часто связывают С-концевой домен РНК-полимеразы, чтобы активировать активность полимеразы. Это белковый домен, который участвует в инициации транскрипции, кэпировании транскрипта РНК и прикреплении к сплайсосоме для сплайсинга РНК . [13]
Фосфорилирование CTD
[ редактировать ]РНК-полимераза II существует в двух формах: нефосфорилированной и фосфорилированной: IIA и IIO соответственно. [5] [3] Переход между двумя формами облегчает выполнение различных функций транскрипции. Фосфорилирование . катализируется одним из шести основных факторов транскрипции , TFIIH CTD TFIIH служит двум целям: одна — раскручивать ДНК в месте начала транскрипции, а другая — фосфорилировать. Форма полимеразы IIA присоединяется к преинициационному комплексу, это предполагается, поскольку IIA связывается с более высоким сродством к TBP ( белку, связывающему ТАТА-бокс ), субъединице общего транскрипционного фактора TFIID , чем форма полимеразы IIO. Форма полимеразы IIO облегчает удлинение цепи РНК. [5] Метод инициации элонгации осуществляется путем фосфорилирования серина в положении 5 (Ser5) через TFIIH. Недавно фосфорилированный Ser5 привлекает ферменты для связывания 5'-конца вновь синтезированной РНК и «3'-факторов процессинга с сайтами поли(А) ». [33] Как только фосфорилируется второй серин, Ser2, элонгация активируется. Для прекращения элонгации должно произойти дефосфорилирование. Как только домен полностью дефосфорилируется, фермент RNAP II «перерабатывается» и катализирует тот же процесс с другим сайтом инициации. [33]
Рекомбинационная репарация, связанная с транскрипцией
[ редактировать ]Окислительное повреждение ДНК может блокировать транскрипцию РНК-полимеразы II и вызывать разрывы цепей. Описан процесс рекомбинации, связанной с транскрипцией на основе РНК, который может защитить от повреждения ДНК. [34] На стадиях клеточного цикла G1/G0 клетки демонстрируют сборку гомологичных факторов рекомбинации при двухцепочечных разрывах в активно транскрибируемых областях. Похоже, что транскрипция связана с восстановлением двухцепочечных разрывов ДНК посредством гомологичной рекомбинации с матрицей РНК. Этот процесс восстановления эффективно и точно воссоединяет двухцепочечные разрывы в генах , активно транскрибируемых РНК-полимеразой II.
См. также
[ редактировать ]- Эукариотическая транскрипция
- Посттранскрипционная модификация
- РНК-полимераза I
- РНК-полимераза II голофермент
- РНК-полимераза III
- Транскрипция (генетика)
Ссылки
[ редактировать ]- ^ Корнберг Р.Д. (декабрь 1999 г.). «Эукариотический контроль транскрипции» . Тенденции в клеточной биологии . 9 (12): М46–9. дои : 10.1016/S0962-8924(99)01679-7 . ПМИД 10611681 .
- ^ Симс Р.Дж., Мандал СС, Рейнберг Д. (июнь 2004 г.). «Недавние события транскрипции, опосредованной РНК-полимеразой II» . Современное мнение в области клеточной биологии . 16 (3): 263–71. дои : 10.1016/j.ceb.2004.04.004 . ПМИД 15145350 .
- ^ Jump up to: а б с д Янг, Ричард А. (28 ноября 2003 г.). «РНК-полимераза II». Ежегодный обзор биохимии . 60 (1): 689–715. дои : 10.1146/annurev.bi.60.070191.003353 . ПМИД 1883205 .
- ^ Мейер П.А., Йе П., Чжан М., Су М.Х., Фу Дж. (июнь 2006 г.). «Фазирование РНК-полимеразы II с использованием внутренне связанных атомов Zn: обновленная структурная модель» . Структура . 14 (6): 973–82. дои : 10.1016/j.str.2006.04.003 . ПМИД 16765890 .
- ^ Jump up to: а б с д Уивер, Роберт Франклин (1 января 2012 г.). Молекулярная биология . МакГроу-Хилл. ISBN 9780073525327 . OCLC 789601172 .
- ^ Редер Р.Г., Раттер В.Дж. (октябрь 1969 г.). «Множественные формы ДНК-зависимой РНК-полимеразы в эукариотических организмах». Природа . 224 (5216): 234–7. Бибкод : 1969Natur.224..234R . дои : 10.1038/224234a0 . ПМИД 5344598 . S2CID 4283528 .
- ^ Редер Р.Г., Раттер В.Дж. (октябрь 1969 г.). «Множественные формы ДНК-зависимой РНК-полимеразы в эукариотических организмах». Природа . 224 (5216): 234–7. Бибкод : 1969Natur.224..234R . дои : 10.1038/224234a0 . ПМИД 5344598 . S2CID 4283528 .
- ^ Чермакова, Катерина; Демельмейстер, Йонас; Люкс, Ванда; Недомова, Моника; Голдман, Сет Р.; Смит, Эрик А.; Срб, Павел; Хекснерова, Розали; Фабри, Милан; Мадликова, Марсела; Хорейси, Магдалена (26 ноября 2021 г.). «Повсеместный модуль неупорядоченного взаимодействия белков управляет элонгацией транскрипции» . Наука . 374 (6571): 1113–1121. Бибкод : 2021Sci...374.1113C . дои : 10.1126/science.abe2913 . ПМЦ 8943916 . ПМИД 34822292 . S2CID 244660781 .
- ^ Армаш, Карим-Жан; Миттервегер, Симона; Мейнхарт, Антон; Крамер, Патрик (2019). «Структуры полной РНК-полимеразы II и ее подкомплекса Rpb4/7» (PDF) . Журнал биологической химии . 280 (8): 7131–1734. doi : 10.2210/pdb1wcm/pdb . ПМИД 15591044 .
- ^ Савадого М., Сентенак А. (1990). «РНК-полимераза B (II) и общие факторы транскрипции». Ежегодный обзор биохимии . 59 : 711–54. дои : 10.1146/annurev.bi.59.070190.003431 . ПМИД 2197989 .
- ^ Jump up to: а б Майер В.Е., Янг Р.А. (октябрь 1998 г.). «РНК-полимераза II, голоферменты и субкомплексы» . Журнал биологической химии . 273 (43): 27757–60. дои : 10.1074/jbc.273.43.27757 . ПМИД 9774381 .
- ^ Jump up to: а б с д и ж г час я дж к л м Акер Дж., де Грааф М., Чейнель И., Хазак В., Кедингер С., Виньерон М. (июль 1997 г.). «Взаимодействие между субъединицами РНК-полимеразы II человека» . Журнал биологической химии . 272 (27): 16815–21. дои : 10.1074/jbc.272.27.16815 . ПМИД 9201987 .
- ^ Jump up to: а б Брики У.Дж., Гринлиф А.Л. (июнь 1995 г.). «Функциональные исследования карбокси-концевого повторяющегося домена РНК-полимеразы II дрозофилы in vivo» . Генетика . 140 (2): 599–613. дои : 10.1093/генетика/140.2.599 . ПМК 1206638 . ПМИД 7498740 .
- ^ «Ген Энтреза: полипептид А полимеразы (РНК) II (ДНК) POLR2A, 220 кДа» .
- ^ «Ген Энтреза: полипептид B полимеразы (РНК) II (ДНК) POLR2B, 140 кДа» .
- ^ Хазак В., Эстояк Дж., Чо Х., Мейджорс Дж., Сонода Дж., Теста Дж.Р., Големис Э.А. (апрель 1998 г.). «Анализ взаимодействия новой субъединицы РНК-полимеразы II (pol II) hsRPB4 с ее партнером hsRPB7 и с pol II» . Молекулярная и клеточная биология . 18 (4): 1935–45. дои : 10.1128/mcb.18.4.1935 . ПМЦ 121423 . ПМИД 9528765 .
- ^ «Ген Энтреза: полипептид Е полимеразы (РНК) II (ДНК) POLR2E, 25 кДа» .
- ^ «Ген Энтрез: полипептид F полимеразы (РНК) II (ДНК) POLR2F» .
- ^ «Ген Энтрез: полипептид G полимеразы (РНК) II (ДНК) POLR2G» .
- ^ «Полипептид J3 полимеразы (РНК) II (ДНК) POLR2J3» .
- ^ Jump up to: а б с Колодзей П.А., Молодой РА (сентябрь 1991 г.). «Мутации в трех крупнейших субъединицах дрожжевой РНК-полимеразы II, влияющие на сборку фермента» . Молекулярная и клеточная биология . 11 (9): 4669–78. дои : 10.1128/mcb.11.9.4669 . ПМЦ 361357 . ПМИД 1715023 .
- ^ Каплан С.Д., Джин Х., Чжан И.Л., Белянин А. (12 апреля 2012 г.). «Вскрытие функции триггерной петли Pol II и зависимый от активности Pol II контроль выбора стартового места in vivo» . ПЛОС Генетика . 8 (4): e1002627. дои : 10.1371/journal.pgen.1002627 . ПМК 3325174 . ПМИД 22511879 .
- ^ Jump up to: а б Аббонданциери Э.А., Гринлиф В.Дж., Шаевитц Дж.В., Ландик Р., Блок С.М. (ноябрь 2005 г.). «Прямое наблюдение шагания пары оснований с помощью РНК-полимеразы» . Природа . 438 (7067): 460–5. Бибкод : 2005Natur.438..460A . дои : 10.1038/nature04268 . ПМЦ 1356566 . ПМИД 16284617 .
- ^ Jump up to: а б Ходжес, Кортни; Бинту, Лакрамиоара; Лубковская, Люцина; Кашлев Михаил; Бустаманте, Карлос (31 июля 2009 г.). «Нуклеосомные флуктуации управляют динамикой транскрипции РНК-полимеразы II» . Наука . 325 (5940): 626–628. Бибкод : 2009Sci...325..626H . дои : 10.1126/science.1172926 . ISSN 1095-9203 . ПМЦ 2775800 . ПМИД 19644123 .
- ^ Черчман, Л. Стерлинг; Вайсман, Джонатан С. (20 января 2011 г.). «Секвенирование зарождающихся транскриптов визуализирует транскрипцию с разрешением нуклеотидов» . Природа . 469 (7330): 368–373. Бибкод : 2011Natur.469..368C . дои : 10.1038/nature09652 . ISSN 1476-4687 . ПМЦ 3880149 . ПМИД 21248844 .
- ^ Гэлбурт, Эрик А.; Гриль, Стефан В.; Видманн, Анна; Лубковская, Люцина; Чой, Джейсон; Ногалес, Ева; Кашлев Михаил; Бустаманте, Карлос (12 апреля 2007 г.). «Обратное отслеживание определяет чувствительность RNAP II к силе в зависимости от фактора». Природа . 446 (7137): 820–823. Бибкод : 2007Natur.446..820G . дои : 10.1038/nature05701 . ISSN 1476-4687 . ПМИД 17361130 . S2CID 4310108 .
- ^ Бинту, Лакрамиоара; Копачинская, Марта; Ходжес, Кортни; Лубковская, Люцина; Кашлев Михаил; Бустаманте, Карлос (13 ноября 2011 г.). «Скорость элонгации РНК-полимеразы определяет судьбу транскрибируемых нуклеосом» . Структурная и молекулярная биология природы . 18 (12): 1394–1399. дои : 10.1038/nsmb.2164 . ISSN 1545-9985 . ПМЦ 3279329 . ПМИД 22081017 .
- ^ Каплан К.Д., Ларссон К.М., Корнберг Р.Д. (июнь 2008 г.). «Триггерная петля РНК-полимеразы II участвует в выборе субстрата и непосредственно воздействует на альфа-аманитин» . Молекулярная клетка . 30 (5): 547–56. doi : 10.1016/j.molcel.2008.04.023 . ПМЦ 2475549 . ПМИД 18538653 .
- ^ Гун, Сюэ Ц.; Недяльков Юрий А.; Бертон, Закари Ф. (25 июня 2004 г.). «α-аманитин блокирует транслокацию РНК-полимеразой II человека» . Журнал биологической химии . 279 (26): 27422–27427. дои : 10.1074/jbc.M402163200 . ISSN 0021-9258 . ПМИД 15096519 .
- ^ Бриггс, Скотт Д.; Брик, Мэри; Страл, Брайан Д.; Чунг, Ван Л.; Дэви, Джудит К.; Дент, Шэрон Ю.Р.; Уинстон, Фред; Эллис, К. Дэвид (15 декабря 2001 г.). «Метилирование лизина 4 гистона H3 опосредовано Set1 и необходимо для роста клеток и подавления рДНК у Saccharomyces cerevisiae» . Гены и развитие . 15 (24): 3286–3295. дои : 10.1101/gad.940201 . ISSN 0890-9369 . ПМК 312847 . ПМИД 11751634 .
- ^ Ли, Бинг; Хау, Лиэнн; Андерсон, Скотт; Йейтс, Джон Р.; Уоркман, Джерри Л. (14 марта 2003 г.). «Функции метилтрансферазы гистона Set2 через фосфорилированный карбоксил-концевой домен РНК-полимеразы II» . Журнал биологической химии . 278 (11): 8897–8903. дои : 10.1074/jbc.M212134200 . ISSN 0021-9258 . ПМИД 12511561 .
- ^ Мейнхарт А., Крамер П. (июль 2004 г.). «Распознавание карбоксиконцевого домена РНК-полимеразы II факторами процессинга 3'-РНК» . Природа . 430 (6996): 223–6. Бибкод : 2004Natur.430..223M . дои : 10.1038/nature02679 . hdl : 11858/00-001M-0000-0015-8512-8 . ПМИД 15241417 . S2CID 4418258 .
- ^ Jump up to: а б с Эглофф, Сильвен; Мерфи, Шона (2008). «Взлом CTD-кода РНК-полимеразы II». Тенденции в генетике . 24 (6): 280–288. дои : 10.1016/j.tig.2008.03.008 . ПМИД 18457900 .
- ^ Вэй Л., Левин А.С., Лан Л. (2016). «Транскрипционная гомологичная рекомбинация после окислительного повреждения». Восстановление ДНК (Амст.) . 44 : 76–80. дои : 10.1016/j.dnarep.2016.05.009 . ПМИД 27233112 .
Внешние ссылки
[ редактировать ]- Дополнительная информация в Национальной лаборатории Беркли ( копия Wayback Machine )
- РНК + Полимераза + II в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)