Метаболизм жирных кислот
Метаболизм жирных кислот состоит из различных метаболических процессов, вовлекающих или тесно связанных с жирными кислотами , семейством молекул, отнесенных к категории липидных макронутриентов . Эти процессы в основном можно разделить на (1) катаболические процессы, которые генерируют энергию, и (2) анаболические процессы, в которых они служат строительными блоками для других соединений. [1]
При катаболизме жирные кислоты метаболизируются с получением энергии, главным образом в форме аденозинтрифосфата (АТФ). По сравнению с другими классами макронутриентов (углеводами и белками), жирные кислоты дают больше всего АТФ в расчете на грамм энергии, когда они полностью окисляются до CO 2 и воды посредством бета-окисления и цикла лимонной кислоты . [2] Таким образом, жирные кислоты (в основном в форме триглицеридов ) являются основной формой хранения топлива у большинства животных и, в меньшей степени, у растений.
В анаболизме интактные жирные кислоты являются важными предшественниками триглицеридов, фосфолипидов, вторичных мессенджеров, гормонов и кетоновых тел . Например, фосфолипиды образуют фосфолипидные бислои , из которых состоят все мембраны клетки из жирных кислот. Фосфолипиды составляют плазматическую мембрану и другие мембраны, которые окружают все органеллы внутри клеток, такие как ядро , митохондрии , эндоплазматический ретикулум и аппарат Гольджи . При другом типе анаболизма жирные кислоты модифицируются с образованием других соединений, таких как вторичные мессенджеры и местные гормоны . Простагландины , полученные из арахидоновой кислоты , хранящейся в клеточной мембране, вероятно, являются наиболее известными из этих местных гормонов.
Катаболизм жирных кислот
[ редактировать ]



Жирные кислоты хранятся в виде триглицеридов в жировых депо жировой ткани . Между приемами пищи они выделяются следующим образом:
- Липолиз , удаление цепей жирных кислот из глицерина, с которым они связаны в форме хранения в виде триглицеридов (или жиров), осуществляется липазами . Эти липазы активируются высокими уровнями адреналина и глюкагона в крови (или норадреналина, секретируемого симпатическими нервами в жировой ткани), вызванного снижением уровня глюкозы в крови после еды, что одновременно снижает уровень инсулина в крови. [1]
- Освободившись от глицерина , свободные жирные кислоты поступают в кровь, которая транспортирует их, прикрепленных к альбумину плазмы , по всему организму. [4]
- Длинноцепочечные свободные жирные кислоты проникают в метаболизирующиеся клетки (т.е. в большинство живых клеток организма, за исключением эритроцитов и нейронов центральной нервной системы ) через специфические транспортные белки , такие как SLC27 . транспортный белок жирных кислот семейства [5] [6] Эритроциты не содержат митохондрий и поэтому не способны метаболизировать жирные кислоты; ткани центральной нервной системы не могут использовать жирные кислоты, несмотря на наличие митохондрий, поскольку длинноцепочечные жирные кислоты (в отличие от жирных кислот со средней длиной цепи) [7] [8] ) не может преодолеть гематоэнцефалический барьер [9] в интерстициальную жидкость , омывающую эти клетки.
- Попав внутрь клетки, лигаза жирных кислот с длинной цепью — КоА катализирует реакцию между молекулой жирной кислоты с АТФ (которая расщепляется до АМФ и неорганического пирофосфата) с образованием ациладенилата жирных кислот, который затем реагирует со свободным коферментом. A, чтобы дать молекулу жирного ацил-КоА .
- Для проникновения ацил-КоА в митохондрии используется карнитиновый челнок: [10] [11] [12]
- Ацил-КоА переносится на гидроксильную группу карнитина карнитинпальмитоилтрансферазой I , расположенной на цитозольных поверхностях внешней и внутренней мембран митохондрий .
- Ацилкарнитин переносится внутрь с помощью карнитин-ацилкарнитинтранслоказы , тогда как карнитин переносится наружу.
- Ацил-карнитин превращается обратно в ацил-КоА под действием карнитинпальмитоилтрансферазы II , расположенной на внутренней поверхности внутренней митохондриальной мембраны . Высвобожденный карнитин возвращается в цитозоль, а ацил-КоА доставляется в митохондриальный матрикс.
- Бета-окисление в митохондриальном матриксе затем разрезает длинные углеродные цепи жирных кислот (в форме молекул ацил-КоА) на ряд двухуглеродных ( ацетатных ) единиц, которые в сочетании с коферментом А образуют молекулы ацетил-КоА , которые конденсируются с оксалоацетатом с образованием цитрата в «начале» цикла лимонной кислоты . [2] Удобно думать об этой реакции как о «начальной точке» цикла, так как это когда в цикл добавляется топливо — ацетил-КоА, которое будет рассеиваться в виде CO 2 и H 2 O с выделением значительное количество энергии захватывается в виде АТФ в ходе каждого цикла цикла и последующего окислительного фосфорилирования .
- Кратко этапы бета-окисления следующие: [2]
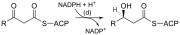
- Дегидрирование ацил-КоА-дегидрогеназой с образованием 1 FADH 2
- Гидратация еноил-КоА-гидратазой
- Дегидрирование 3-гидроксиацил-КоА-дегидрогеназой с образованием 1 НАДН + Н. +
- Расщепление тиолазой с образованием 1 ацетил-КоА и жирной кислоты, которая теперь укорочена на 2 атома углерода (образуя новый, укороченный ацил-КоА )
- Эта реакция бета-окисления повторяется до тех пор, пока жирная кислота не будет полностью восстановлена до ацетил-КоА или, в случае жирных кислот с нечетным числом атомов углерода, до ацетил-КоА и 1 молекулы пропионил-КоА на молекулу жирной кислоты. Каждый бета-окислительный разрез молекулы ацил-КоА в конечном итоге дает 5 молекул АТФ в результате окислительного фосфорилирования. [13] [14]
- Ацетил-КоА, образующийся в результате бета-окисления, входит в цикл лимонной кислоты в митохондриях, соединяясь с оксалоацетатом с образованием цитрата . В сочетании с окислительным фосфорилированием это приводит к полному сгоранию ацетил-КоА до CO 2 и воды. Энергия, выделяющаяся при этом процессе, улавливается в виде 1 молекулы ГТФ и 11 молекул АТФ на одну окисленную молекулу ацетил-КоА. [2] [10] Такова судьба ацетил-КоА везде, где происходит бета-окисление жирных кислот, за исключением определенных обстоятельств в печени .
- Пропионил-КоА позже преобразуется в сукцинил-КоА через биотин -зависимую пропионил-КоА-карбоксилазу (PCC) и витамин B12 - зависимую метилмалонил-КоА-мутазу (MCM) последовательно. [15] [16] Сукцинил-КоА сначала превращается в малат, а затем в пируват, откуда затем транспортируется в матрикс для участия в цикле лимонной кислоты.
В печени оксалоацетат может полностью или частично перенаправляться по глюконеогенному пути при голодании, голодании, низкоуглеводной диете, длительных физических нагрузках и при неконтролируемом сахарном диабете 1 типа . В этих условиях оксалоацетат гидрируется до малата , который затем удаляется из митохондрий клеток печени и превращается в глюкозу в цитоплазме клеток печени, откуда он высвобождается в кровь. [10] Таким образом, в печени оксалоацетат недоступен для конденсации с ацетил-КоА, когда значительный глюконеогенез стимулируется низким (или отсутствующим) уровнем инсулина и высокими концентрациями глюкагона в крови. В этих условиях ацетил-КоА направляется на образование ацетоацетата и бета-гидроксибутирата . [10] Ацетоацетат, бета-гидроксибутират и продукт их спонтанного распада, ацетон , часто, но сбивчиво, называют кетоновыми телами (поскольку они вообще не являются «телами», а являются водорастворимыми химическими веществами). Кетоны выбрасываются печенью в кровь. Все клетки с митохондриями могут поглощать кетоны из крови и превращать их в ацетил-КоА, который затем можно использовать в качестве топлива в циклах лимонной кислоты, поскольку никакая другая ткань не может направить свой оксалоацетат в глюконеогенный путь так, как это может произойти. происходят в печени. В отличие от свободных жирных кислот, кетоны могут преодолевать гематоэнцефалический барьер и поэтому доступны в качестве топлива для клеток центральной нервной системы , действуя как заменитель глюкозы, на которой эти клетки обычно выживают. [10] Возникновение высокого уровня кетонов в крови при голодании, низкоуглеводной диете, длительных тяжелых физических нагрузках или неконтролируемом сахарном диабете 1 типа известно как кетоз , а в его крайней форме - при вышедшем из-под контроля сахарном диабете 1 типа. , как кетоацидоз .
- Глицерин, высвобождаемый под действием липазы, фосфорилируется глицеринкиназой в глицерин - печени (единственной ткани, в которой может происходить эта реакция), и образующийся 3-фосфат окисляется до дигидроксиацетонфосфата . Гликолитический фермент триозофосфатизомераза превращает это соединение в глицеральдегид-3-фосфат , который окисляется посредством гликолиза или превращается в глюкозу посредством глюконеогенеза .
Жирные кислоты как источник энергии
[ редактировать ]
Жирные кислоты, хранящиеся в организме в виде триглицеридов, являются концентрированным источником энергии, поскольку содержат мало кислорода и безводны . Энергетическая ценность грамма жирных кислот составляет примерно 9 ккал (37 кДж), что намного выше, чем 4 ккал (17 кДж) углеводов. Поскольку углеводородная часть жирных кислот гидрофобна , эти молекулы могут храниться в относительно безводной (безводной) среде. Углеводы, с другой стороны, более гидратированы. Например, 1 г гликогена связывает примерно 2 г воды , что соответствует 1,33 ккал/г (4 ккал/3 г). Это означает, что жирные кислоты могут содержать в шесть раз больше энергии на единицу запасенной массы. Другими словами, если бы человеческое тело запасало энергию за счет углеводов, то человеку пришлось бы носить с собой 31 кг (67,5 фунтов ) гидратированного гликогена, чтобы иметь энергию, эквивалентную 4,6 кг (10 фунтов) жира . [10]
Животные, находящиеся в спячке, служат хорошим примером использования жировых запасов в качестве топлива. Например, медведи впадают в спячку около 7 месяцев, и весь этот период энергия добывается за счет расщепления жировых запасов. Перелетные птицы аналогичным образом накапливают большие запасы жира, прежде чем отправиться в межконтинентальное путешествие. [17]
Запасы жира у молодых взрослых людей составляют в среднем около 10–20 кг, но сильно различаются в зависимости от пола и индивидуального предрасположения. [18] Напротив, в человеческом организме хранится всего около 400 г гликогена , из которых 300 г заперты внутри скелетных мышц и недоступны для организма в целом. Примерно 100 г гликогена, хранящегося в печени, истощаются в течение одного дня голодания. [10] После этого глюкоза, которая выделяется в кровь печенью для общего использования тканями организма, должна синтезироваться из глюкогенных аминокислот и некоторых других глюконеогенных субстратов , которые не включают жирные кислоты. [1] Тем не менее, в результате липолиза высвобождается глицерин, который может вступить в путь глюконеогенеза.
Синтез углеводов из глицерина и жирных кислот.
[ редактировать ]Жирные кислоты расщепляются до ацетил-КоА посредством бета-окисления внутри митохондрий, тогда как жирные кислоты синтезируются из ацетил-КоА вне митохондрий, в цитозоле. Эти два пути различаются не только по месту их возникновения, но также по протекающим реакциям и используемым субстратам. Эти два пути взаимно ингибируют, предотвращая попадание ацетил-КоА, полученного в результате бета-окисления, в синтетический путь через реакцию ацетил-КоА-карбоксилазы . [1] Его также невозможно превратить в пируват , поскольку комплексная реакция пируватдегидрогеназы необратима. [10] Вместо этого ацетил-КоА, образующийся в результате бета-окисления жирных кислот, конденсируется с оксалоацетатом и вступает в цикл лимонной кислоты . Во время каждого витка цикла два атома углерода покидают цикл в виде CO 2 в реакциях декарбоксилирования, катализируемых изоцитратдегидрогеназой и альфа-кетоглутаратдегидрогеназой . Таким образом, каждый виток цикла лимонной кислоты окисляет единицу ацетил-КоА, одновременно регенерируя молекулу оксалоацетата, с которой ацетил-КоА первоначально соединился с образованием лимонной кислоты. Реакции декарбоксилирования происходят до образования малата в цикле. [1] Только растения обладают ферментами, превращающими ацетил-КоА в оксалоацетат, из которого может образовываться малат, который в конечном итоге превращается в глюкозу. [1]
Однако ацетил-КоА может превращаться в ацетоацетат, который может декарбоксилироваться в ацетон (либо спонтанно, либо катализируемо ацетоацетатдекарбоксилазой ). Затем он может метаболизироваться до изопропанола, который выводится с дыханием/мочой, или с помощью CYP2E1 в гидроксиацетон (ацетол). Ацетол можно превратить в пропиленгликоль . Он превращается в пируват (с помощью двух альтернативных ферментов), или пропиональдегид , или в L- лактальдегид , а затем в L -лактат (обычный изомер лактата). [19] [20] [21] Другой путь превращает ацетол в метилглиоксаль , затем в пируват или в D -лактальдегид (через SD -лактоилглутатион или иначе), а затем в D -лактат . [20] [22] [23] Метаболизм D-лактата (до глюкозы) у человека замедлен или нарушен, поэтому большая часть D-лактата выводится с мочой; таким образом, D -лактат, полученный из ацетона, может в значительной степени способствовать метаболическому ацидозу, связанному с кетозом или интоксикацией изопропанолом. [20] L -лактат может завершить чистое превращение жирных кислот в глюкозу. Первый эксперимент, показавший превращение ацетона в глюкозу, был проведен в 1951 году. В этом и последующих экспериментах использовалось мечение изотопами углерода . [21] До 11% глюкозы может быть получено из ацетона во время голодания у человека. [21]
Глицерин, попадающий в кровь во время липолиза триглицеридов в жировой ткани, может усваиваться только печенью. Здесь он превращается в глицерин-3-фосфат под действием глицеринкиназы, которая гидролизует одну молекулу АТФ на фосфорилированную молекулу глицерина. Затем глицерин-3-фосфат окисляется до дигидроксиацетонфосфата , который, в свою очередь, превращается в глицеральдегид-3-фосфат под действием фермента триозофосфат-изомеразы . Отсюда три атома углерода исходного глицерина могут быть окислены посредством гликолиза или превращены в глюкозу посредством глюконеогенеза . [10]
Другие функции и применение жирных кислот
[ редактировать ]Внутриклеточная передача сигналов
[ редактировать ]
Жирные кислоты являются неотъемлемой частью фосфолипидов, которые составляют основную часть плазматических мембран или клеточных мембран клеток. Эти фосфолипиды могут расщепляться на диацилглицерин (DAG) и инозитолтрифосфат (IP 3 ) посредством гидролиза фосфолипида, фосфатидилинозитол-4,5-бисфосфата (PIP 2 ), с помощью связанного с клеточной мембраной фермента фосфолипазы C (PLC). [24]
Эйкозаноидные паракринные гормоны
[ редактировать ]

Одним из продуктов метаболизма жирных кислот являются простагландины , соединения, оказывающие на животных разнообразные гормоноподобные эффекты. Простагландины обнаружены почти во всех тканях человека и других животных. Они ферментативно получены из арахидоновой кислоты, полиненасыщенной жирной кислоты с 20 атомами углерода. Таким образом, каждый простагландин содержит 20 атомов углерода , включая 5-углеродное кольцо . Они представляют собой подкласс эйкозаноидов и образуют класс простаноидов производных жирных кислот. [25]
Простагландины синтезируются в клеточной мембране путем отщепления арахидоната от фосфолипидов, составляющих мембрану. Это катализируется либо фосфолипазой А2 , действующей непосредственно на фосфолипид мембраны, либо липазой, действующей на ДАГ (диацилглицерин). Затем на арахидонат воздействует циклооксигеназный компонент простагландинсинтазы . Это образует циклопентановое кольцо примерно в середине цепи жирной кислоты. В результате реакции также добавляются 4 атома кислорода, полученные из двух молекул O 2 . Образующаяся молекула представляет собой простагландин G 2 , который под действием гидропероксидазного компонента ферментного комплекса превращается в простагландин H 2 . Это крайне нестабильное соединение быстро трансформируется в другие простагландины, простациклин и тромбоксаны. [25] Затем они высвобождаются в интерстициальную жидкость, окружающую клетки, вырабатывающие эйкозаноидный гормон.
Если на арахидонат действует липоксигеназа вместо циклооксигеназы, гидроксиэйкозатетраеновые кислоты и лейкотриены образуются . Они также действуют как местные гормоны.
Простагландины имеют два производных: простациклины и тромбоксаны . Простациклины являются мощными сосудорасширяющими средствами местного действия и ингибируют агрегацию тромбоцитов . Благодаря своей роли в расширении сосудов простациклины также участвуют в воспалении . Они синтезируются в стенках кровеносных сосудов и выполняют физиологическую функцию предотвращения ненужного образования тромбов, а также регулирования сокращения гладкой мышечной ткани. [26] И наоборот, тромбоксаны (продуцируемые клетками тромбоцитов) являются вазоконстрикторами и способствуют агрегации тромбоцитов. Их название происходит от их роли в образовании тромбов ( тромбозах ).
Диетические источники жирных кислот, их переваривание, всасывание, транспорт в крови и хранение.
[ редактировать ]


Значительная часть жирных кислот в организме поступает с пищей в форме триглицеридов животного или растительного происхождения. Жирные кислоты в жирах, полученных от наземных животных, обычно являются насыщенными, тогда как жирные кислоты в триглицеридах рыбы и растений часто являются полиненасыщенными и поэтому присутствуют в виде масел.
Эти триглицериды не могут всасываться в кишечнике . [27] Они расщепляются на моно- и диглицериды плюс свободные жирные кислоты (но не на свободный глицерин) под действием липазы поджелудочной железы , которая образует комплекс 1:1 с белком, называемым колипазой (также входящим в состав сока поджелудочной железы), который необходим для его деятельность. Активированный комплекс может работать только на границе вода-жир. Поэтому очень важно, чтобы жиры сначала эмульгировались солями желчных кислот для оптимальной активности этих ферментов. [28] Продукты пищеварения, состоящие из смеси три-, ди- и моноглицеридов и свободных жирных кислот, которые вместе с другими жирорастворимыми компонентами рациона (например, жирорастворимыми витаминами и холестерином) и солями желчных кислот образуют смешанные мицеллы . водянистое дуоденальное содержимое (см. схемы справа). [27] [29]
Содержимое этих мицелл (но не соли желчных кислот) поступает в энтероциты (эпителиальные клетки, выстилающие тонкий кишечник), где они повторно синтезируются в триглицериды и упаковываются в хиломикроны , которые высвобождаются в млечные клетки (капилляры лимфатической системы кишечника). ). [30] Эти млечные стекают в грудной проток , который впадает в венозную кровь в месте соединения левой яремной и левой подключичной вен в нижней левой части шеи. Это означает, что жирорастворимые продукты пищеварения выбрасываются непосредственно в общий кровоток, минуя предварительно печень, в отличие от всех других продуктов пищеварения. Причина этой особенности неизвестна. [31]

Хиломикроны циркулируют по всему телу, придавая плазме крови молочный или сливочный вид после жирной еды. [ нужна ссылка ] Липопротеинлипаза на эндотелиальных поверхностях капилляров, особенно в жировой ткани , но в меньшей степени и в других тканях, частично переваривает хиломикроны до свободных жирных кислот, глицерина и остатков хиломикронов. Жирные кислоты поглощаются адипоцитами. [ нужна ссылка ] , но остатки глицерина и хиломикронов остаются в плазме крови и в конечном итоге выводятся из кровообращения печенью. Свободные жирные кислоты, высвобождаемые при переваривании хиломикронов, поглощаются адипоцитами. [ нужна ссылка ] , где они повторно синтезируются в триглицериды с использованием глицерина, полученного из глюкозы гликолитическим путем. [ нужна ссылка ] . Эти триглицериды сохраняются до тех пор, пока они не потребуются для удовлетворения потребностей других тканей в топливе, в жировых каплях адипоцитов .
Печень поступающей поглощает часть глюкозы из крови в воротной вене, из кишечника. После того, как печень пополнила свои запасы гликогена (которые составляют всего около 100 г гликогена при полной нагрузке), большая часть остальной глюкозы превращается в жирные кислоты, как описано ниже. Эти жирные кислоты в сочетании с глицерином образуют триглицериды, которые упакованы в капли, очень похожие на хиломикроны, но известные как липопротеины очень низкой плотности (ЛПОНП). Эти капли ЛПОНП обрабатываются точно так же, как и хиломикроны, за исключением того, что остаток ЛПОНП известен как липопротеин промежуточной плотности (ЛПНП), который способен удалять холестерин из крови. При этом ЛНП преобразуются в липопротеины низкой плотности (ЛПНП), которые поглощаются клетками, которым требуется холестерин для включения в клеточные мембраны или для синтетических целей (например, для образования стероидных гормонов ). Остальная часть ЛПНП выводится печенью. [32]
Жировая ткань и лактирующие молочные железы также поглощают глюкозу из крови для преобразования в триглицериды. Это происходит так же, как и в печени, за исключением того, что эти ткани не выделяют в кровь триглицериды, образующиеся таким образом в виде ЛПОНП. Клетки жировой ткани хранят триглицериды в своих жировых каплях, чтобы в конечном итоге высвободить их снова в виде свободных жирных кислот и глицерина в кровь (как описано выше ), когда концентрация инсулина в плазме низкая, а концентрация глюкагона и/или адреналина высокая. . [33] Молочные железы выделяют жир (в виде капелек сливочного жира) в молоко, которое они производят под влиянием передней доли гипофиза гормона пролактина .
Всем клеткам организма необходимо производить и поддерживать свои мембраны и мембраны своих органелл. Неизвестно, полностью ли они полагаются на свободные жирные кислоты, всасываемые из крови, или способны синтезировать собственные жирные кислоты из глюкозы в крови. Клетки центральной нервной системы почти наверняка будут обладать способностью производить собственные жирные кислоты, поскольку эти молекулы не могут достичь их через гематоэнцефалический барьер . [34] Однако неизвестно, как к ним попадают незаменимые жирные кислоты , которые млекопитающие не могут синтезировать сами, но, тем не менее, являются важными компонентами клеточных мембран (и других функций, описанных выше).
Синтез жирных кислот
[ редактировать ]
Подобно бета-окислению , синтез жирных кислот с прямой цепью происходит посредством шести повторяющихся реакций, показанных ниже, до тех пор, пока не 16-углеродная пальмитиновая кислота . будет получена [35] [36]
На представленных схемах показано, как синтезируются жирные кислоты у микроорганизмов, и перечислены ферменты, обнаруженные в кишечной палочке . [35] Эти реакции выполняются синтазой жирных кислот II (FASII), которая обычно содержит несколько ферментов, действующих как один комплекс. FASII присутствует в прокариотах , растениях, грибах и паразитах, а также в митохондриях . [37]
У животных, а также у некоторых грибов, таких как дрожжи, те же самые реакции происходят с синтазой жирных кислот I (FASI), большим димерным белком, который обладает всей ферментативной активностью, необходимой для создания жирной кислоты. FASI менее эффективен, чем FASII; однако это позволяет образовывать больше молекул, включая жирные кислоты со «средней цепью», за счет раннего обрыва цепи. [37] Ферменты, ацилтрансферазы и трансацилазы, включают жирные кислоты в фосфолипиды, триацилглицерины и т. д. путем переноса жирных кислот между ацил-акцептором и донором. Их задача также заключается в синтезе биоактивных липидов, а также их молекул-предшественников. [38]
После образования жирной кислоты с соотношением углерода 16:0 она может претерпевать ряд модификаций, приводящих к десатурации и/или удлинению. Элонгация, начиная со стеарата (18:0), осуществляется преимущественно в эндоплазматическом ретикулуме несколькими мембраносвязанными ферментами. Ферментативные этапы, участвующие в процессе элонгации, в основном такие же, как и при синтезе жирных кислот , но четыре основных последовательных этапа элонгации выполняются отдельными белками, которые могут быть физически связаны. [39] [40]
| Шаг | Фермент | Реакция | Описание |
|---|---|---|---|
| (а) | Ацетил-КоА:АСР-трансацилаза | Активирует ацетил-КоА для реакции с малонил-АСР. | |
| (б) | Малонил-КоА: трансацилаза ACP | Активирует малонил-КоА для реакции с ацетил-АСР. | |
| (с) | 3-кетоацил-АСР-синтаза |  | Реагирует с ацильной цепью, связанной с ACP, с удлиняющим цепь малонил-ACP. |
| (г) | 3-кетоацил-АСР-редуктаза | Восстанавливает кетон углерода 3 до гидроксильной группы. | |
| (и) | 3-гидроксиацил-АПФ-дегидраза | Устраняет воду | |
| (е) | Эноил-АСР-редуктаза | Восстанавливает двойную связь C2-C3. |
Сокращения: АСР – ацил-переносящий белок , КоА – коэнзим А , НАДФ – никотинамидадениндинуклеотидфосфат .
Обратите внимание, что во время синтеза жиров восстановителем является НАДФН , тогда как НАД является окислителем при бета-окислении (распаде жирных кислот до ацетил-КоА). Это различие иллюстрирует общий принцип, согласно которому НАДФН расходуется во время реакций биосинтеза, тогда как НАДН генерируется в реакциях с выделением энергии. [34] (Таким образом, НАДФН также необходим для синтеза холестерина из ацетил-КоА; тогда как НАДН образуется во время гликолиза .) Источник НАДФН двоякий. Когда малат окислительно декарбоксилируется «НАДФ + связанный яблочный фермент пируват , CO 2 Образуются также и НАДФН. НАДФН также образуется по пентозофосфатному пути , который превращает глюкозу в рибозу, которая может использоваться в синтезе нуклеотидов и нуклеиновых кислот , или может катаболизироваться до пирувата. [34]
Конечные продукты гликолитического действия используются при превращении углеводов в жирные кислоты.
[ редактировать ]У человека жирные кислоты образуются из углеводов преимущественно в печени и жировой ткани , а также в молочных железах в период лактации. Пируват , образующийся в результате гликолиза, является важным посредником в превращении углеводов в жирные кислоты и холестерин. [34] Это происходит путем превращения пирувата в ацетил-КоА в митохондриях. Однако этот ацетил-КоА необходимо транспортировать в цитозоль, где происходит синтез жирных кислот и холестерина. Это не может произойти напрямую. Чтобы получить цитозольный ацетил-КоА, цитрат (полученный конденсацией ацетил-КоА с оксалоацетатом) удаляется из цикла лимонной кислоты и переносится через внутреннюю митохондриальную мембрану в цитозоль. [34] Там он расщепляется АТФ-цитратлиазой на ацетил-КоА и оксалоацетат. Оксалоацетат возвращается в митохондрии в виде малата (а затем превращается обратно в оксалоацетат для переноса большего количества ацетил-КоА из митохондрии). [41] Цитозольный ацетил-КоА карбоксилируется ацетил-КоА-карбоксилазой с образованием малонил-КоА , что является первой стадией синтеза жирных кислот. [41] [42]
Регуляция синтеза жирных кислот
[ редактировать ]Ацетил-КоА превращается в малонил-КоА под действием ацетил-КоА-карбоксилазы , после чего малонил-КоА предназначен для участия в пути синтеза жирных кислот. Ацетил-КоА-карбоксилаза является точкой регуляции синтеза насыщенных жирных кислот с прямой цепью и подлежит как фосфорилированию , так и аллостерическому регулированию . Регуляция посредством фосфорилирования происходит в основном у млекопитающих, тогда как аллостерическая регуляция происходит у большинства организмов. Аллостерический контроль осуществляется посредством ингибирования по принципу обратной связи пальмитоил-КоА и активации цитратом. При высоком уровне пальмитоил-КоА, конечного продукта синтеза насыщенных жирных кислот, он аллостерически инактивирует ацетил-КоА-карбоксилазу, предотвращая накопление жирных кислот в клетках. Цитрат активирует ацетил-КоА-карбоксилазу при высоких уровнях, поскольку высокие уровни указывают на то, что ацетил-КоА достаточно для участия в цикле Кребса и производства энергии. [43]
Высокие уровни инсулина в плазме крови (например, после еды) вызывают дефосфорилирование и активацию ацетил-КоА-карбоксилазы, способствуя тем самым образованию малонил-КоА из ацетил-КоА и, как следствие, превращению углеводов в жирные кислоты, тогда как адреналин и глюкагон (высвобождаемый в кровь во время голодания и физических упражнений) вызывают фосфорилирование этого фермента, подавляя липогенез в пользу окисления жирных кислот посредством бета-окисления . [34] [42]
расстройства
[ редактировать ]Нарушения обмена жирных кислот могут быть описаны, например, как гипертриглицеридемия (слишком высокий уровень триглицеридов ) или другие виды гиперлипидемии . Они могут быть семейными или приобретенными.
Семейные типы нарушений обмена жирных кислот обычно относят к врожденным нарушениям липидного обмена . Эти нарушения могут быть описаны как нарушения окисления жирных кислот или нарушения накопления липидов и представляют собой одно из нескольких врожденных нарушений метаболизма , возникающих в результате дефектов ферментов или транспортных белков, влияющих на способность организма окислять жирные кислоты для производства энергии. в мышцах, печени и других клеток типах . Когда нарушение окисления жирных кислот поражает мышцы, это метаболическая миопатия .
Более того, раковые клетки могут демонстрировать нерегулярный метаболизм жирных кислот в отношении синтеза жирных кислот. [44] и митохондриальное окисление жирных кислот (ФАО) [45] которые участвуют в различных аспектах онкогенеза и роста клеток.
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж Страйер, Люберт (1995). «Обмен жирных кислот». В: Биохимия (Четвертое изд.). Нью-Йорк: WH Freeman and Company. стр. 603–628. ISBN 0-7167-2009-4 .
- ^ Jump up to: а б с д Окисление жирных кислот
- ^ Цехнер Р., Штраус Дж.Г., Хеммерле Г., Ласс А., Циммерманн Р. (2005). «Липолиз: путь в разработке». Курс. Мнение. Липидол . 16 (3): 333–40. дои : 10.1097/01.мол.0000169354.20395.1c . ПМИД 15891395 . S2CID 35349649 .
- ^ Мобилизация и поглощение клетками накопленных жиров (триацилглицеринов) (с анимацией)
- ^ Шталь, Андреас (1 февраля 2004 г.). «Текущий обзор белков-переносчиков жирных кислот (SLC27)». Архив Pflügers: Европейский журнал физиологии . 447 (5): 722–727. дои : 10.1007/s00424-003-1106-z . ПМИД 12856180 . S2CID 2769738 .
- ^ Андерсон, Кортни М.; Шталь, Андреас (апрель 2013 г.). «Белки-переносчики жирных кислот SLC27» . Молекулярные аспекты медицины . 34 (2–3): 516–528. дои : 10.1016/j.mam.2012.07.010 . ПМЦ 3602789 . ПМИД 23506886 .
- ^ Эберт, Д.; Халлер, Р.Г.; Уолтон, Мэн. (июль 2003 г.). «Энергетический вклад октаноата в метаболизм интактного мозга крысы, измеренный с помощью 13 C-спектроскопия ядерного магнитного резонанса» . J Neurosci . 23 (13): 5928–35. : 10.1523 /JNEUROSCI.23-13-05928.2003 . PMC 6741266. . PMID 12843297 doi
- ^ Марин-Валенсия, И.; Хорошо, Л.Б.; Ма, Кью; Маллой, ЧР.; Паскуаль, Дж.М. (февраль 2013 г.). «Гептаноат как нервное топливо: энергетические предшественники нейромедиаторов в нормальном мозге и мозге с дефицитом транспортера глюкозы I (G1D)» . J Метаболия кровотока головного мозга . 33 (2): 175–82. дои : 10.1038/jcbfm.2012.151 . ПМК 3564188 . ПМИД 23072752 .
- ^ Страйер, Люберт (1995). «Обмен жирных кислот». В: Биохимия (Четвертое изд.). Нью-Йорк: WH Freeman and Company. стр. 770–771. ISBN 0-7167-2009-4 .
- ^ Jump up to: а б с д и ж г час я Страйер, Люберт (1995). Биохимия (Четвертое изд.). Нью-Йорк: WH Freeman and Company. стр. 510–515, 581–613, 775–778. ISBN 0-7167-2009-4 .
- ^ Активация и транспортировка жирных кислот в митохондрии посредством карнитинового челнока (с анимацией)
- ^ Виво, Дэррил С.; Бохан, Тимоти П.; Коултер, Дэвид Л.; Дрейфус, Фриц Э.; Гринвуд, Роберт С.; Нордли, Дуглас Р.; Шилдс, В. Дональд; Стафстром, Карл Э.; Тейн, Ингрид (1998). «Добавка l-карнитина при детской эпилепсии: современные перспективы» . Эпилепсия . 39 (11): 1216–1225. дои : 10.1111/j.1528-1157.1998.tb01315.x . ISSN 0013-9580 . ПМИД 9821988 . S2CID 28692799 .
- ^ Окисление жирных кислот с нечетной длиной углеродной цепи.
- ^ Окисление ненасыщенных жирных кислот
- ^ Вонгкиттихоте П., Ах Мью Н., Чепмен К.А. (декабрь 2017 г.). «Пропионил-КоА-карбоксилаза - обзор» . Молекулярная генетика и обмен веществ . 122 (4): 145–152. дои : 10.1016/j.ymgme.2017.10.002 . ПМЦ 5725275 . ПМИД 29033250 .
- ^ Халарнкар П.П., Бломквист Г.Дж. (1989). «Сравнительные аспекты метаболизма пропионата». Комп. Биохим. Физиол. Б. 92 (2): 227–31. дои : 10.1016/0305-0491(89)90270-8 . ПМИД 2647392 .
- ^ Страйер, Люберт (1995). Биохимия (Четвертое изд.). Нью-Йорк: WH Freeman and Company. п. 777. ИСБН 0-7167-2009-4 .
- ^ Слоан, AW; Коэслаг, Дж. Х.; Бределл, ГАГ (1973). «Состав тела, работоспособность и работоспособность активных и малоподвижных юношей». Европейский журнал прикладной физиологии . 32 : 17–24. дои : 10.1007/bf00422426 . S2CID 39812342 .
- ^ Раддик Дж. А. (1972). «Токсикология, метаболизм и биохимия 1,2-пропандиола». Токсикол Appl Pharmacol . 21 (1): 102–111. дои : 10.1016/0041-008X(72)90032-4 . ПМИД 4553872 .
- ^ Jump up to: а б с Глю, Роберт Х. «Вы можете добраться туда отсюда: ацетон, анионные кетоны и жирные кислоты с четным содержанием углерода могут обеспечить субстраты для глюконеогенеза» . Нигерийский журнал физиологических наук . 25 (1). Приглашенный обзор: 2–4. Архивировано из оригинала 26 сентября 2013 года . Проверено 7 августа 2016 г.
- ^ Jump up to: а б с Пак, Сун М.; Клапа, Мария И.; Сински, Энтони Дж.; Стефанопулос, Грегори (1999). «Баланс метаболитов и изотопомеров в анализе метаболических циклов: II. Приложения» (PDF) . Биотехнология и биоинженерия . 62 (4): 398. doi : 10.1002/(sici)1097-0290(19990220)62:4<392::aid-bit2>3.0.co;2-s . ISSN 0006-3592 . ПМИД 9921151 .
- ^ Миллер Д.Н., Баззано Дж.; Баццано (1965). «Метаболизм пропандиола и его связь с метаболизмом молочной кислоты». Энн, Нью-Йоркская академия наук . 119 (3): 957–973. Бибкод : 1965NYASA.119..957M . дои : 10.1111/j.1749-6632.1965.tb47455.x . ПМИД 4285478 . S2CID 37769342 .
- ^ Д.Л. Вандер Ягт; Б. Робинсон; К.К. Тейлор; Л.А. Хансакер (1992). «Восстановление триоз НАДФН-зависимыми альдокеторедуктазами. Альдозоредуктаза, метилглиоксаль и диабетические осложнения» . Журнал биологической химии . 267 (7): 4364–4369. дои : 10.1016/S0021-9258(18)42844-X . ПМИД 1537826 .
- ^ Страйер, Люберт (1995). «Каскады передачи сигналов». В: Биохимия (Четвертое изд.). Нью-Йорк: WH Freeman and Company. стр. 343–350. ISBN 0-7167-2009-4 .
- ^ Jump up to: а б Страйер, Люберт (1995). «Эйкозаноидные гормоны происходят из жирных кислот». В: Биохимия (Четвертое изд.). Нью-Йорк: WH Freeman and Company. стр. 624–627. ISBN 0-7167-2009-4 .
- ^ Нельсон, Рэнди Ф. (2005). Введение в поведенческую эндокринологию (3-е изд.). Сандерленд, Массачусетс: Sinauer Associates. п. 100. ИСБН 978-0-87893-617-5 .
- ^ Jump up to: а б Переваривание жиров (триацилглицеринов)
- ^ Хофманн А.Ф. (1963). «Функция желчных солей в всасывании жиров. Растворяющие свойства разбавленных мицеллярных растворов конъюгированных желчных солей» . Биохим. Дж . 89 (1): 57–68. дои : 10.1042/bj0890057 . ПМК 1202272 . ПМИД 14097367 .
- ^ Страйер, Люберт (1995). «Мембранные структуры и динамика». В: Биохимия (Четвертое изд.). Нью-Йорк: WH Freeman and Company. стр. 268–270. ISBN 0-7167-2009-4 .
- ^ Гроппер, Сарин С.; Смит, Джек Л. (2013). Расширенное питание и метаболизм человека (6-е изд.). Бельмонт, Калифорния: Уодсворт/Cengage Learning. ISBN 978-1133104056 .
- ^ Уильямс, Питер Л.; Уорик, Роджер; Дайсон, Мэри; Баннистер, Лоуренс Х. (1989). «Ангиология». В: Анатомия Грея (тридцать седьмое изд.). Эдинбург: Черчилль Ливингстон. стр. 841–843. ISBN 0443-041776 .
- ^ Страйер, Люберт (1995). «Биосинтез мембранных липидов и стероидов». В: Биохимия (Четвертое изд.). Нью-Йорк: WH Freeman and Company. стр. 697–700. ISBN 0-7167-2009-4 .
- ^ Стралфорс, Питер; Хонор, Руперт К. (1989). «Инсулин-индуцированное дефосфорилирование гормон-чувствительной липазы» . Европейский журнал биохимии . 182 (2): 379–385. дои : 10.1111/j.1432-1033.1989.tb14842.x . ПМИД 2661229 .
- ^ Jump up to: а б с д и ж Страйер, Люберт (1995). Биохимия (Четвертое изд.). Нью-Йорк: WH Freeman and Company. стр. 559–565, 614–623. ISBN 0-7167-2009-4 .
- ^ Jump up to: а б Дейкстра, Альберт Дж., Р. Дж. Гамильтон и Вольф Хэмм. «Биосинтез жирных кислот». Трансжирные кислоты. Оксфорд: Blackwell Pub., 2008. 12. Печать.
- ^ «Путь MetaCyc: суперпуть биосинтеза жирных кислот» . База данных метаболических путей MetaCyc . БиоЦик. ( Э. палочка ).
- ^ Jump up to: а б Кристи, Уильям В. (20 апреля 2011 г.). «Жирные кислоты: насыщенные с прямой цепью, структура, возникновение и биосинтез». В Американском обществе нефтехимиков (ред.). Липидная библиотека AOCS . Архивировано из оригинала 21 июля 2011 г. Проверено 2 мая 2011 г.
- ^ Ямасита, Ацуши; Хаяси, Ясухиро; Немото-Сасаки, Йоко; Ито, Макото; Ока, Саори; Таникава, Такаши; Ваку, Кейзо; Сугиура, Такаюки (01 января 2014 г.). «Ацилтрансферазы и трансацилазы, определяющие жирнокислотный состав глицеролипидов и метаболизм биоактивных липидных медиаторов в клетках млекопитающих и модельных организмах». Прогресс в исследованиях липидов . 53 : 18–81. дои : 10.1016/j.plipres.2013.10.001 . ISSN 0163-7827 . ПМИД 24125941 .
- ^ «Путь MetaCyc: биосинтез стеарата I (животные)» . База данных метаболических путей MetaCyc . БиоЦик.
- ^ «Путь MetaCyc: биосинтез очень длинноцепочечных жирных кислот II» . База данных метаболических путей MetaCyc . БиоЦик.
- ^ Jump up to: а б Ферре, П.; Ф. Фуфель (2007). «Фактор транскрипции SREBP-1c и липидный гомеостаз: клиническая перспектива» . Гормональные исследования . 68 (2): 72–82. дои : 10.1159/000100426 . ПМИД 17344645 . Проверено 30 августа 2010 г.
этот процесс графически представлен на стр. 73.
- ^ Jump up to: а б Воэт, Дональд; Джудит Г. Воэт; Шарлотта В. Пратт (2006). Основы биохимии, 2-е издание . John Wiley and Sons, Inc., стр. 547, 556 . ISBN 978-0-471-21495-3 .
- ^ Диван, Джойс Дж. «Синтез жирных кислот». Политехнический институт Ренсселера (RPI) :: Архитектура, Бизнес, Инженерия, ИТ, Гуманитарные науки, Наука. Веб. 30 апреля 2011 г. < «Синтез жирных кислот» . Архивировано из оригинала 7 июня 2011 г. Проверено 2 мая 2011 г. >.
- ^ Эззеддини Р., Тагихани М., Соми М.Х., Самади Н., Расаи, М.Дж. (май 2019 г.). «Клиническое значение FASN по отношению к HIF-1α и SREBP-1c при аденокарциноме желудка» . Науки о жизни . 224 : 169–176. дои : 10.1016/j.lfs.2019.03.056 . ПМИД 30914315 . S2CID 85532042 .
- ^ Эззеддини Р., Тагихани М., Салек Фаррохи А., Соми М.Х., Самади Н., Исфахани А., Расаи, MJ (май 2021 г.). «Подавление окисления жирных кислот за счет участия HIF-1α и PPARγ в аденокарциноме желудка человека и связанное с этим клиническое значение» . Журнал физиологии и биохимии . 77 (2): 249–260. дои : 10.1007/s13105-021-00791-3 . ISSN 1138-7548 . ПМИД 33730333 . S2CID 232300877 .