Фермент

| Часть серии о |
| Биохимия |
|---|
 |
Ферменты ( / ˈ ɛ n z aɪ m z / ) — это белки , которые действуют как биологические катализаторы , ускоряя химические реакции . Молекулы , на которые могут действовать ферменты, называются субстратами , и фермент превращает субстраты в различные молекулы, известные как продукты . Почти все метаболические процессы в клетке нуждаются в ферментативном катализе , чтобы протекать с достаточной скоростью для поддержания жизни. [ 1 ] : 8.1 Метаболические пути зависят от ферментов, катализирующих отдельные этапы. Изучение ферментов называется энзимологией , и в области анализа псевдоферментов признается, что в ходе эволюции некоторые ферменты утратили способность осуществлять биологический катализ, что часто отражается на их аминокислотных последовательностях и необычных «псевдокаталитических» свойствах. [ 2 ] [ 3 ]
Известно, что ферменты катализируют более 5000 типов биохимических реакций. [ 4 ]
Другими биокатализаторами являются каталитические молекулы РНК , также называемые рибозимами . Иногда их описывают как тип фермента, а не как фермент, но даже спустя десятилетия, прошедшие с момента открытия рибозимов в 1980–1982 годах, слово «фермент» само по себе часто означает конкретный тип белка (как используется в этой статье).
фермента Специфичность обусловлена его уникальной трехмерной структурой .

Как и все катализаторы, ферменты увеличивают скорость реакции за счет снижения ее энергии активации . Некоторые ферменты могут ускорять превращение субстрата в продукт во много миллионов раз. Крайним примером является оротидин-5'-фосфатдекарбоксилаза , которая позволяет реакции, которая в противном случае заняла бы миллионы лет, протекать за миллисекунды. [ 5 ] [ 6 ] С химической точки зрения ферменты подобны любому катализатору: они не расходуются в химических реакциях и не изменяют равновесие реакции. Ферменты отличаются от большинства других катализаторов гораздо более специфичностью. На активность фермента могут влиять другие молекулы: ингибиторы — это молекулы, которые снижают активность фермента, а активаторы — это молекулы, которые повышают активность. Многие терапевтические препараты и яды являются ингибиторами ферментов. Активность фермента заметно снижается за пределами оптимальной температуры и pH , и многие ферменты (постоянно) денатурируются при воздействии чрезмерного тепла, теряя свою структуру и каталитические свойства.
Некоторые ферменты используются в коммерческих целях, например, при синтезе антибиотиков . В некоторых предметах домашнего обихода используются ферменты для ускорения химических реакций: ферменты в биологических стиральных порошках расщепляют пятна белка, крахмала или жира на одежде, а ферменты в размягчителях мяса расщепляют белки на более мелкие молекулы, благодаря чему мясо легче пережевывать.
Этимология и история

К концу 17 - началу 18 веков переваривание мяса желудочными выделениями [ 7 ] и превращение крахмала в сахара растительными экстрактами и слюной было известно, но механизмы, посредством которых это происходило, не были идентифицированы. [ 8 ]
Французский химик Ансельм Пайен был первым, кто открыл фермент диастазу в 1833 году. [ 9 ] Несколько десятилетий спустя, изучая ферментацию сахара в спирт с помощью дрожжей , Луи Пастер пришел к выводу, что эта ферментация была вызвана жизненной силой, содержащейся в дрожжевых клетках, называемой «ферментами», которые, как считалось, функционировали только внутри живых организмов. Он писал, что «спиртовое брожение — это процесс, связанный с жизнью и организацией дрожжевых клеток, а не с гибелью или гниением клеток». [ 10 ]
В 1877 году немецкий физиолог Вильгельм Кюне (1837–1900) впервые использовал для описания этого процесса термин «фермент» , который происходит от древнегреческого ἔνζυμον (énzymon) « заквашенный в дрожжах». [ 11 ] Слово «фермент» позже использовалось для обозначения неживых веществ, таких как пепсин , а слово «фермент» использовалось для обозначения химической активности, производимой живыми организмами. [ 12 ]
Эдуард Бюхнер представил свою первую работу по изучению дрожжевых экстрактов в 1897 году. В серии экспериментов в Берлинском университете он обнаружил, что сахар сбраживается дрожжевыми экстрактами даже тогда, когда в смеси не было живых дрожжевых клеток. [ 13 ] Он назвал фермент, вызывающий ферментацию сахарозы, « зимазой ». [ 14 ] В 1907 году он получил Нобелевскую премию по химии «за открытие бесклеточного брожения». Следуя примеру Бюхнера, ферменты обычно называют в соответствии с проводимой ими реакцией: суффикс -аза сочетается с названием субстрата (например, лактаза — фермент, расщепляющий лактозу ) или с типом реакции (например, ДНК-полимераза) . образует полимеры ДНК). [ 15 ]
Биохимическая идентичность ферментов была еще неизвестна в начале 1900-х годов. Многие ученые отмечали, что ферментативная активность связана с белками, но другие (например, нобелевский лауреат Рихард Вильштеттер ) утверждали, что белки были просто носителями настоящих ферментов и что белки сами по себе неспособны к катализу. [ 16 ] В 1926 году Джеймс Б. Самнер показал, что фермент уреаза представляет собой чистый белок, и кристаллизовал его; он сделал то же самое для фермента каталазы в 1937 году. Вывод о том, что чистые белки могут быть ферментами, был окончательно продемонстрирован Джоном Говардом Нортропом и Уэнделлом Мередит Стэнли , которые работали над пищеварительными ферментами пепсином (1930), трипсином и химотрипсином . Эти трое учёных были удостоены Нобелевской премии по химии 1946 года. [ 17 ]
Открытие возможности кристаллизации ферментов в конечном итоге позволило определить их структуру с помощью рентгеновской кристаллографии . Впервые это было сделано для лизоцима , фермента, содержащегося в слезах, слюне и яичных белках , который расщепляет оболочки некоторых бактерий; структура была решена группой под руководством Дэвида Чилтона Филлипса и опубликована в 1965 году. [ 18 ] Эта структура лизоцима с высоким разрешением положила начало области структурной биологии и попыткам понять, как работают ферменты на атомном уровне детализации. [ 19 ]
Классификация и номенклатура
Ферменты можно классифицировать по двум основным критериям: сходству аминокислотных последовательностей (и, следовательно, эволюционному родству) или ферментативной активности.
Ферментативная активность . Название фермента часто происходит от его субстрата или химической реакции, которую он катализирует, причем слово заканчивается на -аза . [ 1 ] : 8.1.3 Примерами являются лактаза , алкогольдегидрогеназа и ДНК-полимераза . Различные ферменты, катализирующие одну и ту же химическую реакцию, называются изоферментами . [ 1 ] : 10.3
Международный союз биохимии и молекулярной биологии разработал номенклатуру ферментов, номера ЕС (от «Комиссия по ферментам») . Каждый фермент описывается буквой «EC», за которой следует последовательность из четырех чисел, которые представляют иерархию ферментативной активности (от очень общей до очень специфической). То есть первая цифра широко классифицирует фермент на основе его механизма, в то время как другие цифры добавляют все больше и больше специфичности. [ 20 ]
Классификация верхнего уровня:
- EC 1, Оксидоредуктазы : катализируют окисления /восстановления. реакции
- EC 2, Трансферазы : перенос функциональной группы ( например, метильной или фосфатной группы).
- EC 3, Гидролазы : катализируют гидролиз различных связей.
- EC 4, Лиазы : расщепляют различные связи способами, отличными от гидролиза и окисления.
- EC 5, Изомеразы : катализируют изомеризационные изменения внутри одной молекулы.
- EC 6, Лигазы : соединяют две молекулы ковалентными связями .
- EC 7, Транслоказы : катализируют движение ионов или молекул через мембраны или их разделение внутри мембран.
Эти разделы подразделяются по другим признакам, таким как субстрат, продукты и химический механизм . Фермент полностью определяется четырьмя цифровыми обозначениями. Например, гексокиназа (EC 2.7.1.1) представляет собой трансферазу (EC 2), которая присоединяет фосфатную группу (EC 2.7) к гексозному сахару, молекуле, содержащей спиртовую группу (EC 2.7.1). [ 21 ]
Сходство последовательности . Категории EC не отражают сходство последовательностей. Например, две лигазы с одинаковым номером ЕС, катализирующие одну и ту же реакцию, могут иметь совершенно разные последовательности. Независимо от своей функции ферменты, как и любые другие белки, по сходству последовательностей подразделяются на многочисленные семейства. Эти семейства были задокументированы в десятках баз данных различных белков и семейств белков, таких как Pfam . [ 22 ]
негомологичные изофункциональные ферменты . Неродственные ферменты, обладающие одинаковой ферментативной активностью, получили название негомологичных изофункциональных ферментов . [ 23 ] Горизонтальный перенос генов может распространить эти гены на несвязанные виды, особенно на бактерии, где они могут заменять эндогенные гены с той же функцией, что приводит к смещению гомологичных генов.
Структура

Ферменты обычно представляют собой глобулярные белки , действующие по отдельности или в более крупных комплексах . Последовательность аминокислот определяет структуру, которая, в свою очередь, определяет каталитическую активность фермента. [ 24 ] Хотя структура определяет функцию, новую ферментативную активность пока невозможно предсказать только на основании структуры. [ 25 ] Структуры ферментов разворачиваются ( денатурируют ) при нагревании или воздействии химических денатурантов, и это нарушение структуры обычно приводит к потере активности. [ 26 ] Денатурация фермента обычно связана с температурой выше нормального уровня для данного вида; в результате ферменты бактерий, живущих в вулканической среде, такой как горячие источники, ценятся промышленными пользователями за их способность функционировать при высоких температурах, что позволяет проводить реакции, катализируемые ферментами, с очень высокой скоростью.
Ферменты обычно намного крупнее своих субстратов. Размеры варьируются от 62 аминокислотных остатков, мономер 4 оксалокротонаттаутомеразы - . [ 27 ] до более чем 2500 остатков в синтазы жирных кислот животных . [ 28 ] Лишь небольшая часть их структуры (около 2–4 аминокислот) непосредственно участвует в катализе: каталитический центр. [ 29 ] Этот каталитический сайт расположен рядом с одним или несколькими сайтами связывания , где остатки ориентируют субстраты. фермента Каталитический сайт и сайт связывания вместе составляют активный центр . Оставшаяся большая часть структуры фермента служит для поддержания точной ориентации и динамики активного центра. [ 30 ]
В некоторых ферментах аминокислоты непосредственно не участвуют в катализе; вместо этого фермент содержит сайты для связывания и ориентации каталитических кофакторов . [ 30 ] Ферментные структуры также могут содержать аллостерические сайты , где связывание небольшой молекулы вызывает конформационные изменения , которые увеличивают или уменьшают активность. [ 31 ]
Существует небольшое количество биологических катализаторов на основе РНК , называемых рибозимами , которые также могут действовать отдельно или в комплексе с белками. Наиболее распространенной из них является рибосома , представляющая собой комплекс белков и каталитических компонентов РНК. [ 1 ] : 2.2
Механизм

Связывание подложки
Ферменты должны связать свои субстраты, прежде чем они смогут катализировать любую химическую реакцию. Ферменты обычно очень специфичны в отношении того, какие субстраты они связывают, а затем катализируют химическую реакцию. Специфичность достигается за счет связывания карманов с комплементарной формой, зарядом и гидрофильными / гидрофобными с субстратами характеристиками. Таким образом, ферменты могут различать очень похожие молекулы субстрата на хемоселективные , региоселективные и стереоспецифические . [ 32 ]
демонстрирующие наивысшую специфичность и точность, участвуют в копировании и экспрессии генома Некоторые из ферментов , . Некоторые из этих ферментов имеют механизмы « корректуры ». Здесь фермент, такой как ДНК-полимераза, катализирует реакцию на первом этапе, а затем проверяет правильность продукта на втором этапе. [ 33 ] Этот двухэтапный процесс приводит к тому, что средняя частота ошибок в высокоточных полимеразах млекопитающих составляет менее 1 ошибки на 100 миллионов реакций. [ 1 ] : 5.3.1 Подобные механизмы корректуры обнаружены и у РНК-полимеразы . [ 34 ] аминоацил-тРНК-синтетазы [ 35 ] и рибосомы . [ 36 ]
И наоборот, некоторые ферменты демонстрируют неразборчивость ферментов , обладают широкой специфичностью и действуют на ряд различных физиологически значимых субстратов. Многие ферменты обладают небольшой побочной активностью, которая возникла случайно (т.е. нейтрально ), что может стать отправной точкой для эволюционного отбора новой функции. [ 37 ] [ 38 ]

Модель «Замок и ключ».
Чтобы объяснить наблюдаемую специфичность ферментов, в 1894 году Эмиль Фишер предположил, что и фермент, и субстрат обладают определенными дополнительными геометрическими формами, которые точно соответствуют друг другу. [ 39 ] Эту модель часто называют моделью «замок и ключ». [ 1 ] : 8.3.2 Эта ранняя модель объясняет специфичность ферментов, но не может объяснить стабилизацию переходного состояния, которой достигают ферменты. [ 40 ]
Модель индуцированной подгонки
В 1958 году Дэниел Кошланд предложил модификацию модели замка и ключа: поскольку ферменты представляют собой довольно гибкие структуры, форма активного центра постоянно изменяется в результате взаимодействия с субстратом, когда субстрат взаимодействует с ферментом. [ 41 ] В результате субстрат не просто связывается с жестким активным центром; аминокислот Боковые цепи , составляющие активный центр, занимают точные положения, которые позволяют ферменту выполнять свою каталитическую функцию. В некоторых случаях, например, при гликозидазах субстрата , молекула также слегка меняет форму при входе в активный центр. [ 42 ] Активный центр продолжает меняться до тех пор, пока подложка не будет полностью связана, после чего определяется окончательная форма и распределение заряда. [ 43 ] Индуцированное соответствие может повысить точность молекулярного распознавания в присутствии конкуренции и шума посредством механизма конформационной корректуры . [ 44 ]
Катализ
Ферменты могут ускорять реакции несколькими способами, каждый из которых снижает энергию активации (ΔG ‡ , свободная энергия Гиббса ) [ 45 ]
- Стабилизируя переходное состояние:
- Создание среды с распределением заряда, дополнительным к распределению переходного состояния, для снижения его энергии. [ 46 ]
- Предоставляя альтернативный путь реакции:
- Временная реакция с субстратом с образованием ковалентного промежуточного соединения, обеспечивающего переходное состояние с более низкой энергией. [ 47 ]
- Путем дестабилизации основного состояния подложки:
- Искажение связанного субстрата(ов) в форму переходного состояния для уменьшения энергии, необходимой для достижения переходного состояния. [ 48 ]
- Ориентируя субстраты в продуктивное расположение, чтобы уменьшить энтропии реакции. изменение [ 49 ] (вклад этого механизма в катализ относительно невелик) [ 50 ]
Ферменты могут использовать несколько из этих механизмов одновременно. Например, протеазы, такие как трипсин, осуществляют ковалентный катализ с использованием каталитической триады , стабилизируют накопление заряда в переходных состояниях с помощью оксианионной дырки , осуществляют полный гидролиз с использованием ориентированного водного субстрата. [ 51 ]
Динамика
Ферменты не являются жесткими статическими структурами; вместо этого они имеют сложные внутренние динамические движения – то есть движения частей структуры фермента, таких как отдельные аминокислотные остатки, группы остатков, образующие белковую петлю или единицу вторичной структуры , или даже целый белковый домен . Эти движения порождают конформационный ансамбль несколько различных структур, которые в равновесии взаимопревращаются друг в друга . Различные состояния внутри этого ансамбля могут быть связаны с разными аспектами функции фермента. Например, различные конформации фермента дигидрофолатредуктазы связаны со стадиями связывания субстрата, катализа, высвобождения кофактора и высвобождения продукта каталитического цикла. [ 52 ] согласуется с теорией каталитического резонанса .
Презентация подложки
Этот раздел нуждается в дополнительных цитатах для проверки . ( Октябрь 2023 г. ) |
Презентация субстрата — это процесс, при котором фермент отделяется от субстрата. Ферменты могут быть секвестрированы на плазматической мембране вдали от субстрата в ядре или цитозоле. Или внутри мембраны фермент может быть изолирован в липидных плотах вдали от своего субстрата в неупорядоченной области. Когда фермент высвобождается, он смешивается со своим субстратом. Альтернативно, фермент можно изолировать рядом с его субстратом для активации фермента. Например, фермент может быть растворимым и при активации связываться с липидом плазматической мембраны, а затем действовать на молекулы плазматической мембраны.
Аллостерическая модуляция
Аллостерические сайты — это карманы фермента, отличные от активного центра, которые связываются с молекулами клеточной среды. Эти молекулы затем вызывают изменение конформации или динамики фермента, которое переносится в активный центр и, таким образом, влияет на скорость реакции фермента. [ 53 ] Таким образом, аллостерические взаимодействия могут либо ингибировать, либо активировать ферменты. Аллостерические взаимодействия с метаболитами выше или ниже метаболического пути фермента вызывают регуляцию по принципу обратной связи , изменяя активность фермента в соответствии с потоком через остальную часть пути. [ 54 ]
Кофакторы

Некоторым ферментам не нужны дополнительные компоненты для проявления полной активности. Другие требуют, чтобы небелковые молекулы, называемые кофакторами, были связаны для активности. [ 55 ] Кофакторы могут быть как неорганическими (например, ионы металлов и железо-серные кластеры ), так и органическими соединениями (например, флавин и гем ). Эти кофакторы служат многим целям; например, ионы металлов могут помочь в стабилизации нуклеофильных частиц внутри активного центра. [ 56 ] Органическими кофакторами могут быть либо коферменты , которые высвобождаются из активного центра фермента во время реакции, либо простетические группы , прочно связанные с ферментом. Органические простетические группы могут быть связаны ковалентно (например, биотин в таких ферментах, как пируваткарбоксилаза ). [ 57 ]
Примером фермента, содержащего кофактор, является карбоангидраза , которая использует кофактор цинка, связанный как часть его активного центра. [ 58 ] Эти прочно связанные ионы или молекулы обычно находятся в активном центре и участвуют в катализе. [ 1 ] : 8.1.1 Например, кофакторы флавина и гема часто участвуют в окислительно-восстановительных реакциях. [ 1 ] : 17
Ферменты, которым требуется кофактор, но не имеют с ним связи, называются апоферментами или апопротеинами . Фермент вместе с кофактором(ами), необходимым для активности, называется голоферментом (или галоферментом). Термин «холофермент» также можно применять к ферментам, которые содержат несколько белковых субъединиц, таким как ДНК-полимеразы ; здесь холофермент представляет собой полный комплекс, содержащий все субъединицы, необходимые для деятельности. [ 1 ] : 8.1.1
Коэнзимы
Коферменты – это небольшие органические молекулы, которые могут быть слабо или прочно связаны с ферментом. Коферменты переносят химические группы от одного фермента к другому. [ 59 ] Примеры включают НАДН , НАДФН и аденозинтрифосфат (АТФ). Некоторые коферменты, такие как флавинмононуклеотид (FMN), флавинадениндинуклеотид (FAD), тиаминпирофосфат (TPP) и тетрагидрофолат (THF), являются производными витаминов . Эти коферменты не могут синтезироваться организмом de novo , и близкородственные соединения (витамины) должны поступать с пищей. Перевозимые химические группы включают:
- гидрид - ион (H − ), переносимый НАД или НАДФ +
- фосфатная группа, переносимая аденозинтрифосфатом
- ацетильная группа, переносимая коферментом А
- формильные, метенильные или метильные группы, переносимые фолиевой кислотой и
- метильная группа, переносимая S-аденозилметионином [ 59 ]
Поскольку коферменты химически изменяются в результате действия ферментов, полезно рассматривать коферменты как особый класс субстратов или вторых субстратов, которые являются общими для многих различных ферментов. Например, известно около 1000 ферментов, использующих кофермент НАДН. [ 60 ]
Коэнзимы обычно постоянно регенерируются, и их концентрация внутри клетки поддерживается на постоянном уровне. Например, НАДФН регенерируется посредством пентозофосфатного пути , а S- аденозилметионин — с помощью метионин-аденозилтрансферазы . Эта непрерывная регенерация означает, что небольшие количества коферментов могут использоваться очень интенсивно. Например, человеческое тело каждый день превращает собственный вес в АТФ. [ 61 ]
Термодинамика

Как и все катализаторы, ферменты не изменяют положения химического равновесия реакции. В присутствии фермента реакция протекает в том же направлении, что и без фермента, только быстрее. [ 1 ] : 8.2.3 Например, карбоангидраза катализирует свою реакцию в любом направлении в зависимости от концентрации реагирующих веществ: [ 62 ]
| (в тканях ; высокая CO 2 ) концентрация | ( 1 ) |
| (в легких ; низкая CO 2 ) концентрация | ( 2 ) |
Скорость реакции зависит от энергии активации, необходимой для образования переходного состояния , которое затем распадается на продукты. Ферменты увеличивают скорость реакции за счет снижения энергии переходного состояния. Во-первых, связывание образует низкоэнергетический фермент-субстратный комплекс (ES). Во-вторых, фермент стабилизирует переходное состояние, так что для его достижения требуется меньше энергии по сравнению с некатализируемой реакцией (ES ‡ ). Наконец, комплекс фермент-продукт (ЭП) диссоциирует с высвобождением продуктов. [ 1 ] : 8.3
Ферменты могут связывать две или более реакции, так что термодинамически выгодная реакция может быть использована для «управления» термодинамически неблагоприятной реакцией, так что объединенная энергия продуктов будет ниже, чем у субстратов. Например, гидролиз АТФ часто используется для запуска других химических реакций. [ 63 ]
Кинетика
Кинетика ферментов — это исследование того, как ферменты связывают субстраты и превращают их в продукты. [ 64 ] Данные о скорости, используемые в кинетическом анализе, обычно получают с помощью ферментных анализов . В 1913 году Леонор Михаэлис и Мод Леонора Ментен предложили количественную теорию кинетики ферментов, которая получила название кинетики Михаэлиса-Ментен . [ 65 ] Основным вкладом Михаэлиса и Ментена было представление о двухстадийных ферментативных реакциях. В первом случае субстрат обратимо связывается с ферментом, образуя фермент-субстратный комплекс. В их честь иногда это называют комплексом Михаэлиса-Ментен. Затем фермент катализирует химическую стадию реакции и высвобождает продукт. Эта работа получила дальнейшее развитие Дж. Э. Бриггса и Дж. Б. С. Холдейна , которые вывели кинетические уравнения, которые до сих пор широко используются. [ 66 ]
Скорость ферментов зависит от условий раствора и концентрации субстрата . Чтобы найти максимальную скорость ферментативной реакции, концентрацию субстрата увеличивают до тех пор, пока не будет достигнута постоянная скорость образования продукта. Это показано на кривой насыщения справа. Насыщение происходит потому, что по мере увеличения концентрации субстрата все больше и больше свободного фермента превращается в связанный с субстратом комплекс ES. При максимальной скорости реакции ( V max ) фермента все активные центры фермента связаны с субстратом, и количество ES-комплекса равно общему количеству фермента. [ 1 ] : 8.4
V max является лишь одним из нескольких важных кинетических параметров. Также важно количество субстрата, необходимое для достижения заданной скорости реакции. Это определяется константой Михаэлиса-Ментена ( K m ), которая представляет собой концентрацию субстрата, необходимую для того, чтобы фермент достиг половины максимальной скорости реакции; как правило, каждый фермент имеет характеристику K M для данного субстрата. Другая полезная константа — k cat , также называемая числом оборота , которое представляет собой количество молекул субстрата, обрабатываемых одним активным центром в секунду. [ 1 ] : 8.4
фермента можно выразить kкат / через Км . Эффективность Ее также называют константой специфичности, и она включает константы скорости для всех стадий реакции, включая первую необратимую стадию. Поскольку константа специфичности отражает как сродство, так и каталитическую способность, она полезна для сравнения различных ферментов друг с другом или одного и того же фермента с разными субстратами. Теоретический максимум константы специфичности называется диффузионным пределом и составляет около 10 8 до 10 9 (М −1 с −1 ). В этот момент каждое столкновение фермента с его субстратом будет приводить к катализу, и скорость образования продукта ограничивается не скоростью реакции, а скоростью диффузии. Ферменты, обладающие этим свойством, называются каталитически совершенными или кинетически совершенными . Примерами таких ферментов являются триозофосфатизомераза , карбоангидраза , ацетилхолинэстераза , каталаза , фумараза , β-лактамаза и супероксиддисмутаза . [ 1 ] : 8.4.2 Скорость оборота таких ферментов может достигать нескольких миллионов реакций в секунду. [ 1 ] : 9.2 Но большинство ферментов далеки от совершенства: средние значения и около и , соответственно. [ 67 ]
Кинетика Михаэлиса-Ментен основана на законе действия масс , который выведен из предположений о свободной диффузии и термодинамически обусловленном случайном столкновении. Многие биохимические или клеточные процессы значительно отклоняются от этих условий из-за скученности макромолекул и ограниченного молекулярного движения. [ 68 ] Более поздние сложные расширения модели пытаются исправить эти эффекты. [ 69 ]
Торможение
Скорость ферментативной реакции можно снизить с помощью различных типов ингибиторов ферментов. [ 70 ] : 73–74
Виды торможения
Конкурентоспособный
и Конкурентный ингибитор субстрат не могут связываться с ферментом одновременно. [ 71 ] Часто конкурентные ингибиторы сильно напоминают реальный субстрат фермента. Например, препарат метотрексат является конкурентным ингибитором фермента дигидрофолатредуктазы , катализирующего восстановление дигидрофолата до тетрагидрофолата. [ 72 ] Сходство структур дигидрофолата и этого препарата показано на прилагаемом рисунке. Этот тип ингибирования можно преодолеть с помощью высокой концентрации субстрата. В некоторых случаях ингибитор может связываться с сайтом, отличным от сайта связывания обычного субстрата, и оказывать аллостерический эффект , изменяя форму обычного сайта связывания. [ 73 ]
Неконкурентный
связывается Неконкурентный ингибитор с сайтом, отличным от места связывания субстрата. Субстрат по-прежнему связывается с обычным сродством, и, следовательно, K m остается прежним. Однако ингибитор снижает каталитическую эффективность фермента, так что V max снижается. В отличие от конкурентного ингибирования, неконкурентное ингибирование невозможно преодолеть высокой концентрацией субстрата. [ 70 ] : 76–78
Неконкурентоспособный
Неконкурентный ингибитор не может связываться со свободным ферментом, а только с фермент-субстратным комплексом; следовательно, эти типы ингибиторов наиболее эффективны при высоких концентрациях субстрата. В присутствии ингибитора фермент-субстратный комплекс неактивен. [ 70 ] : 78 Этот тип торможения встречается редко. [ 74 ]
Смешанный
связывается Смешанный ингибитор с аллостерическим сайтом, и связывание субстрата и ингибитора влияют друг на друга. Функция фермента снижается, но не устраняется при связывании с ингибитором. Этот тип ингибитора не подчиняется уравнению Михаэлиса-Ментен. [ 70 ] : 76–78
необратимый
навсегда Необратимый ингибитор инактивирует фермент, обычно образуя ковалентную связь с белком. [ 75 ] Пенициллин [ 76 ] и аспирин [ 77 ] являются распространенными препаратами, которые действуют таким образом.
Функции ингибиторов
У многих организмов ингибиторы могут действовать как часть механизма обратной связи . Если фермент производит слишком много одного вещества в организме, это вещество может действовать как ингибитор фермента в начале пути его производства, вызывая замедление или остановку выработки этого вещества, когда его будет достаточно. Это форма отрицательной обратной связи . основных метаболических путях, таких как цикл лимонной кислоты . Этот механизм используется в [ 1 ] : 17.2.2
Поскольку ингибиторы модулируют функцию ферментов, их часто используют в качестве лекарств. Многие такие препараты являются обратимыми конкурентными ингибиторами, напоминающими нативный субстрат фермента, подобно метотрексату , указанному выше; другие хорошо известные примеры включают статины, используемые для лечения высокого уровня холестерина , [ 78 ] и ингибиторы протеазы, используемые для лечения ретровирусных инфекций, таких как ВИЧ . [ 79 ] Распространенным примером необратимого ингибитора, который используется в качестве лекарственного средства, является аспирин , который ингибирует ферменты ЦОГ-1 и ЦОГ-2 , которые производят воспаления посредник простагландин, . [ 77 ] Другие ингибиторы ферментов являются ядами. Например, яд цианид является необратимым ингибитором ферментов, который соединяется с медью и железом в активном центре фермента цитохром-с-оксидазы и блокирует клеточное дыхание . [ 80 ]
Факторы, влияющие на активность ферментов
Поскольку ферменты состоят из белков, их действие чувствительно к изменению многих физико-химических факторов, таких как pH, температура, концентрация субстрата и т. д.
В следующей таблице показаны оптимальные значения pH для различных ферментов. [ 81 ]
| Фермент | Оптимальный pH | описание рН |
|---|---|---|
| Пепсин | 1.5–1.6 | Сильно кислый |
| Инвертаза | 4.5 | Кислый |
| Липаза (желудок) | 4.0–5.0 | Кислый |
| Липаза (касторовое масло) | 4.7 | Кислый |
| Липаза (поджелудочная железа) | 8.0 | Щелочной |
| Амилаза (солод) | 4.6–5.2 | Кислый |
| Амилаза (поджелудочная железа) | 6.7–7.0 | Кислотно-нейтральный |
| Целлобиаза | 5.0 | Кислый |
| Мальтаза | 6.1–6.8 | Кислый |
| Сахарный тростник | 6.2 | Кислый |
| Каталаза | 7.0 | Нейтральный |
| Уреаза | 7.0 | Нейтральный |
| холинэстераза | 7.0 | Нейтральный |
| Рибонуклеаза | 7.0–7.5 | Нейтральный |
| Фумараза | 7.8 | Щелочной |
| Трипсин | 7.8–8.7 | Щелочной |
| Аденозинтрифосфат | 9.0 | Щелочной |
| Аргиназа | 10.0 | Сильнощелочная |
Биологическая функция
Ферменты выполняют широкий спектр функций внутри живых организмов. Они незаменимы для передачи сигналов и регуляции клеток, часто посредством киназ и фосфатаз . [ 82 ] Они также генерируют движение, при этом миозин гидролизует аденозинтрифосфат (АТФ), вызывая сокращение мышц , а также транспортируют грузы по клетке как часть цитоскелета . [ 83 ] Другие АТФазы клеточной мембраны представляют собой ионные насосы, участвующие в активном транспорте . Ферменты также участвуют в более экзотических функциях, таких как люцифераза, генерирующая свет у светлячков . [ 84 ] Вирусы также могут содержать ферменты для заражения клеток, такие как интеграза ВИЧ и обратная транскриптаза , или для высвобождения вируса из клеток, такие как гриппа вируса нейраминидаза . [ 85 ]
Важная функция ферментов заключается в пищеварительной системе животных. Ферменты, такие как амилазы и протеазы, расщепляют крупные молекулы ( крахмал или белки соответственно) на более мелкие, чтобы они могли всасываться в кишечнике. Молекулы крахмала, например, слишком велики, чтобы всасываться из кишечника, но ферменты гидролизуют цепи крахмала на более мелкие молекулы, такие как мальтоза и, в конечном итоге, на глюкозу , которые затем могут всасываться. Разные ферменты переваривают разные пищевые вещества. У жвачных животных , питающихся травоядными животными , микроорганизмы в кишечнике вырабатывают другой фермент, целлюлазу , разрушающую целлюлозные клеточные стенки растительной клетчатки. [ 86 ]
Метаболизм
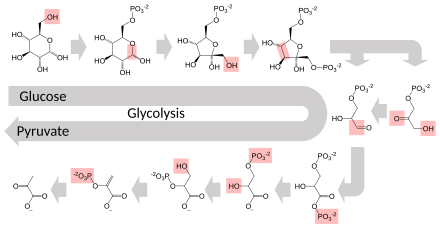
Несколько ферментов могут работать вместе в определенном порядке, создавая метаболические пути . [ 1 ] : 30.1 В метаболическом пути один фермент использует продукт другого фермента в качестве субстрата. После каталитической реакции продукт передается другому ферменту. Иногда одну и ту же реакцию могут катализировать несколько ферментов параллельно; это может обеспечить более сложную регуляцию: например, с низкой постоянной активностью, обеспечиваемой одним ферментом, но индуцируемой высокой активностью со стороны второго фермента. [ 87 ]
Ферменты определяют, какие этапы происходят на этих путях. Без ферментов метаболизм не мог бы проходить одни и те же этапы и не мог бы регулироваться для удовлетворения потребностей клетки. Большинство центральных метаболических путей регулируются в несколько ключевых этапов, обычно с помощью ферментов, активность которых включает гидролиз АТФ. Поскольку эта реакция высвобождает очень много энергии, другие термодинамически неблагоприятные реакции могут быть связаны с гидролизом АТФ, запуская общую серию связанных метаболических реакций. [ 1 ] : 30.1
Контроль деятельности
Существует пять основных способов контроля активности ферментов в клетке. [ 1 ] : 30.1.1
Регулирование
Ферменты могут быть активированы или ингибированы другими молекулами. Например, конечный продукт(ы) метаболического пути часто являются ингибиторами одного из первых ферментов этого пути (обычно первого необратимого этапа, называемого фиксированным этапом), регулируя таким образом количество конечного продукта, вырабатываемого этими путями. Такой механизм регулирования называется механизмом отрицательной обратной связи , поскольку количество вырабатываемого конечного продукта регулируется его собственной концентрацией. [ 88 ] : 141–48 Механизм отрицательной обратной связи позволяет эффективно регулировать скорость синтеза промежуточных метаболитов в соответствии с потребностями клеток. Это помогает эффективно распределять материалы и экономить энергию, а также предотвращает избыточное производство конечной продукции. Как и другие гомеостатические устройства , контроль ферментативного действия помогает поддерживать стабильную внутреннюю среду живых организмов. [ 88 ] : 141
Посттрансляционная модификация
Примеры посттрансляционной модификации включают фосфорилирование , миристоилирование и гликозилирование . [ 88 ] : 149–69 Например, в ответ на инсулин фосфорилирование сахара нескольких ферментов, включая гликогенсинтазу , помогает контролировать синтез или распад гликогена и позволяет клетке реагировать на изменения уровня в крови . [ 89 ] Другим примером посттрансляционной модификации является расщепление полипептидной цепи. Химотрипсин , пищеварительная протеаза, вырабатывается в неактивной форме в виде химотрипсиногена в поджелудочной железе и транспортируется в этой форме в желудок , где активируется. Это мешает ферменту переваривать поджелудочную железу или другие ткани до того, как он попадет в кишечник. Этот тип неактивного предшественника фермента известен как зимоген . [ 88 ] : 149–53 или профермент.
Количество
Производство ферментов ( транскрипция и трансляция генов ферментов) может увеличиваться или уменьшаться клеткой в ответ на изменения в клеточной среде. Эта форма регуляции генов называется индукцией ферментов . Например, бактерии могут стать устойчивыми к антибиотикам, таким как пенициллин ферменты, называемые бета-лактамазами , потому что индуцируются , которые гидролизуют важнейшее бета-лактамное кольцо в молекуле пенициллина. [ 90 ] Другой пример – ферменты печени , называемые цитохромоксидазами P450 , которые играют важную роль в метаболизме лекарств . Индукция или ингибирование этих ферментов может вызвать лекарственное взаимодействие . [ 91 ] Уровни ферментов также можно регулировать, изменяя скорость ферментативной деградации . [ 1 ] : 30.1.1 Противоположностью индукции ферментов является их репрессия .
Субклеточное распределение
Ферменты могут быть разделены на компартменты, при этом в разных клеточных компартментах происходят разные метаболические пути . Например, жирные кислоты синтезируются одним набором ферментов в цитозоле , эндоплазматическом ретикулуме и аппарате Гольджи и используются другим набором ферментов в качестве источника энергии в митохондриях посредством β-окисления . [ 92 ] Кроме того, перемещение фермента в разные компартменты может изменить степень протонирования (например, нейтральная цитоплазма и кислая лизосома ) или окислительного состояния (например, окисление периплазмы или восстановление цитоплазмы ), что, в свою очередь, влияет на активность фермента. [ 93 ] В отличие от разделения на мембраносвязанные органеллы, субклеточная локализация ферментов также может быть изменена за счет полимеризации ферментов в макромолекулярные цитоплазматические нити. [ 94 ] [ 95 ]
Органная специализация
У многоклеточных эукариот клетки в разных органах и тканях имеют разные модели экспрессии генов и, следовательно, имеют разные наборы ферментов (известных как изоферменты ), доступных для метаболических реакций. Это обеспечивает механизм регуляции общего метаболизма организма. Например, гексокиназа , первый фермент пути гликолиза , имеет специализированную форму, называемую глюкокиназой, экспрессируемую в печени и поджелудочной железе, которая имеет более низкое сродство к глюкозе, но более чувствительна к концентрации глюкозы. [ 96 ] Этот фермент участвует в определении уровня сахара в крови и регуляции выработки инсулина. [ 97 ]
Участие в болезни


Поскольку жесткий контроль активности ферментов необходим для гомеостаза , любой сбой (мутация, перепроизводство, недостаточное производство или удаление) одного критического фермента может привести к генетическому заболеванию. Нарушение работы хотя бы одного типа ферментов из тысяч, присутствующих в организме человека, может привести к летальному исходу. Примером смертельного генетического заболевания, вызванного недостаточностью фермента, является болезнь Тея-Сакса , при которой у пациентов отсутствует фермент гексозаминидаза . [ 98 ] [ 99 ]
Одним из примеров дефицита ферментов является наиболее распространенный тип фенилкетонурии . Множество различных мутаций отдельных аминокислот в ферменте фенилаланингидроксилазе , который катализирует первый этап деградации фенилаланина , приводят к накоплению фенилаланина и связанных с ним продуктов. Некоторые мутации происходят в активном центре, непосредственно нарушая связывание и катализ, но многие из них находятся далеко от активного центра и снижают активность, дестабилизируя структуру белка или влияя на правильную олигомеризацию. [ 100 ] [ 101 ] Это может привести к умственной отсталости, если заболевание не лечить. [ 102 ] Другим примером является дефицит псевдохолинэстеразы , при котором нарушается способность организма расщеплять препараты эфиров холина. [ 103 ] Пероральное введение ферментов можно использовать для лечения некоторых функциональных дефицитов ферментов, таких как недостаточность поджелудочной железы. [ 104 ] и непереносимость лактозы . [ 105 ]
Другой способ, которым сбои в работе ферментов могут вызвать заболевание, связан с мутациями зародышевой линии в генах, кодирующих ферменты репарации ДНК . Дефекты этих ферментов вызывают рак, поскольку клетки менее способны восстанавливать мутации в своих геномах . Это вызывает медленное накопление мутаций и приводит к развитию рака . Примером такого наследственного ракового синдрома является пигментная ксеродермия , вызывающая развитие рака кожи в ответ даже на минимальное воздействие ультрафиолета . [ 106 ] [ 107 ]
Эволюция
Как и любой другой белок, ферменты со временем изменяются в результате мутаций и дивергенции последовательностей. Учитывая их центральную роль в метаболизме , эволюция ферментов играет решающую роль в адаптации . Поэтому ключевой вопрос заключается в том, могут ли ферменты и каким образом одновременно изменять свою ферментативную активность. Принято считать, что многие новые активности ферментов возникли в результате дупликации генов и мутации дубликатов, хотя эволюция может происходить и без дупликации. Одним из примеров фермента, изменившего свою активность, является предок метиониламинопептидазы (MAP) и креатинаминогидролазы ( креатиназы ), которые явно гомологичны, но катализируют совершенно разные реакции (MAP удаляет аминоконцевой метионин в новых белках, в то время как креатиназа гидролизует креатин до саркозин и мочевина ). Кроме того, MAP зависит от ионов металлов, а кретиназа — нет, поэтому это свойство также со временем утрачивается. [ 108 ] Среди ферментов чрезвычайно распространены небольшие изменения ферментативной активности. В частности, специфичность связывания субстрата (см. выше) может легко и быстро меняться при изменении отдельных аминокислот в карманах связывания субстрата. Это часто наблюдается в основных классах ферментов, таких как киназы . [ 109 ]
Искусственная (in vitro) эволюция в настоящее время широко используется для изменения активности или специфичности ферментов в промышленных целях (см. ниже).
Промышленное применение
Ферменты используются в химической промышленности и других отраслях промышленности, когда требуются чрезвычайно специфические катализаторы. Ферменты в целом ограничены в количестве реакций, которые они способны катализировать, а также из-за их недостаточной стабильности в органических растворителях и при высоких температурах. Как следствие, белковая инженерия является активной областью исследований и включает в себя попытки создать новые ферменты с новыми свойствами либо посредством рационального проектирования, либо посредством эволюции in vitro . [ 110 ] [ 111 ] Эти усилия начали приносить успех, и теперь «с нуля» созданы несколько ферментов, катализирующих реакции, не встречающиеся в природе. [ 112 ]
См. также
Базы данных ферментов
Ссылки
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т в Страйер Л., Берг Дж.М., Тимочко Дж.Л. (2002). Биохимия (5-е изд.). Сан-Франциско: WH Freeman. ISBN 0-7167-4955-6 .

- ^ Мерфи Дж. М., Фархан Х., Эйерс, Пенсильвания (апрель 2017 г.). «Био-зомби: появление псевдоферментов в биологии». Труды Биохимического общества . 45 (2): 537–544. дои : 10.1042/bst20160400 . ПМИД 28408493 .
- ^ Мерфи Дж.М., Чжан К., Янг С.Н., Риз М.Л., Бэйли Ф.П., Эйерс П.А. и др. (январь 2014 г.). «Надежная методология субклассификации псевдокиназ на основе их свойств связывания нуклеотидов» . Биохимический журнал . 457 (2): 323–334. дои : 10.1042/BJ20131174 . ПМЦ 5679212 . ПМИД 24107129 .
- ^ Шомбург И., Чанг А., Плачек С., Зонген С., Ротер М., Ланг М. и др. (январь 2013 г.). «БРЕНДА в 2013 году: интегрированные реакции, кинетические данные, данные о функциях ферментов, улучшенная классификация болезней: новые возможности и содержание в БРЕНДА» . Исследования нуклеиновых кислот . 41 (Проблема с базой данных): D764–D772. дои : 10.1093/nar/gks1049 . ПМЦ 3531171 . ПМИД 23203881 .
- ^ Радзичка А., Вулфенден Р. (январь 1995 г.). «Опытный фермент». Наука . 267 (5194): 90–93. Бибкод : 1995Sci...267...90R . дои : 10.1126/science.7809611 . ПМИД 7809611 . S2CID 8145198 .
- ^ Каллахан Б.П., Миллер Б.Г. (декабрь 2007 г.). «OMP-декарбоксилаза - загадка остается». Биоорганическая химия . 35 (6): 465–469. дои : 10.1016/j.bioorg.2007.07.004 . ПМИД 17889251 .
- ^ Реомюра Р.А. (1752 г.). «Наблюдения за пищеварением птиц». История Королевской академии наук . 1752 : 266, 461.
- ^ Уильямс Х.С. (1904). История науки: в пяти томах . Том IV: Современное развитие химических и биологических наук . Харпер и братья.
- ^ Пайен А, Персоз Дж. Ф. (1833). «Мемуары о диастазе, основных продуктах ее реакций и их применении в промышленном искусстве» . Анналы химии и физики . 2-й (на французском языке). 53 :73–92.
- ^ Манчестер КЛ (декабрь 1995 г.). «Луи Пастер (1822–1895) - случай и подготовленный ум». Тенденции в биотехнологии . 13 (12): 511–515. дои : 10.1016/S0167-7799(00)89014-9 . ПМИД 8595136 .
- ^ Кюне ввел слово «фермент» в: Кюне В. (1877). «О поведении различных организованных и так называемых неоформленных ферментов» . Переговоры Ассоциации естествознания и медицины в Гейдельберге . новая серия (на немецком языке). 1 (3): 190–193. Соответствующий отрывок на стр. 190: «Во избежание недоразумений и во избежание надоедливых пересказов оратор предлагает называть неоформленные ферментами или неорганизованные ферменты, действие которых может совершаться без присутствия организмов и вне их». (Перевод: Во избежание недоразумений и во избежание громоздких перифраз [автор, преподаватель университета] предлагает обозначать «ферментами» неоформленные или неорганизованные ферменты, действие которых может происходить без присутствия организмов и вне их.)
- ^ Холмс, Флорида (2003). «Ферменты» . В Хейльброне Дж.Л. (ред.). Оксфордский справочник по истории современной науки . Оксфорд: Издательство Оксфордского университета. п. 270. ИСБН 9780199743766 .
- ^ «Эдуард Бюхнер» . Биография нобелевского лауреата . Нобелевская премия . Проверено 23 февраля 2015 г.
- ^ «Эдуард Бюхнер – Нобелевская лекция: Бесклеточная ферментация» . Нобелевская премия . 1907 год . Проверено 23 февраля 2015 г.
- ^ Названия ферментов путем добавления суффикса «-аза» к субстрату, на который действует фермент, были прослежены французским ученым Эмилем Дюкло (1840–1904), который намеревался почтить память первооткрывателей диастазы - первого фермента, который был открыт. изолированно – представив эту практику в своей книге Дюкло Э (1899). Трактат по микробиологии: диастазы, токсины и яды [ Трактат по микробиологии: диастазы, токсины и яды ] (на французском языке). Париж, Франция: Masson and Co. См. главу 1, особенно стр. 9.
- ^ Вильштеттер Р. (1927). «Фарадеевская лекция. Проблемы и методы исследования ферментов». Журнал Химического общества (возобновленный) : 1359–1381. дои : 10.1039/JR9270001359 . цитируется в Удар D (апрель 2000 г.). «Так мы понимаем, как работают ферменты?» . Структура . 8 (4): С77–Р81. дои : 10.1016/S0969-2126(00)00125-8 . ПМИД 10801479 .
- ^ «Нобелевские премии и лауреаты: Нобелевская премия по химии 1946 года» . Нобелевская премия . Проверено 23 февраля 2015 г.
- ^ Блейк CC, Кениг Д.Ф., Майр Г.А., Норт AC, Филлипс, округ Колумбия, Сарма В.Р. (май 1965 г.). «Структура лизоцима куриного яичного белка. Трехмерный синтез Фурье с разрешением 2 Ангстрем». Природа . 206 (4986): 757–761. Бибкод : 1965Natur.206..757B . дои : 10.1038/206757a0 . ПМИД 5891407 . S2CID 4161467 .
- ^ Джонсон Л.Н., Пецко Г.А. (июль 1999 г.). «Дэвид Филлипс и происхождение структурной энзимологии». Тенденции биохимических наук . 24 (7): 287–289. дои : 10.1016/S0968-0004(99)01423-1 . ПМИД 10390620 .
- ^ Мосс ГП. «Рекомендации Номенклатурного комитета Международного союза биохимии и молекулярной биологии по номенклатуре и классификации ферментов по реакциям, которые они катализируют» . Международный союз биохимии и молекулярной биологии . Проверено 28 августа 2021 г.
- ^ Номенклатурный комитет. «ЭК 2.7.1.1» . Международный союз биохимии и молекулярной биологии (NC-IUBMB) . Школа биологических и химических наук Королевы Марии, Лондонский университет. Архивировано из оригинала 1 декабря 2014 года . Проверено 6 марта 2015 г.
- ^ Малдер, Нью-Джерси (28 сентября 2007 г.). «Базы данных по семействам белков». ЭЛС . Чичестер, Великобритания: John Wiley & Sons, Ltd., стр. a0003058.pub2. дои : 10.1002/9780470015902.a0003058.pub2 . ISBN 978-0-470-01617-6 .
- ^ Омельченко М.В., Гальперин М.Ю., Вольф Ю.И., Кунин Е.В. (апрель 2010). «Номологичные изофункциональные ферменты: систематический анализ альтернативных решений в эволюции ферментов» . Биология Директ . 5 (1): 31. дои : 10.1186/1745-6150-5-31 . ПМК 2876114 . ПМИД 20433725 .
- ^ Анфинсен CB (июль 1973 г.). «Принципы, управляющие сворачиванием белковых цепей». Наука . 181 (4096): 223–230. Бибкод : 1973Sci...181..223A . дои : 10.1126/science.181.4096.223 . ПМИД 4124164 .
- ^ Данауэй-Мариано Д. (ноябрь 2008 г.). «Открытие функции фермента» . Структура . 16 (11): 1599–1600. дои : 10.1016/j.str.2008.10.001 . ПМИД 19000810 .
- ^ Пецко Г.А., Ринге Д (2003). «Глава 1: От последовательности к структуре» . Структура и функции белка . Лондон: Новая наука. п. 27. ISBN 978-1405119221 .
- ^ Чен Л.Х., Кеньон Г.Л., Кертин Ф., Хараяма С., Бембенек М.Е., Хаджипур Г., Уитмен К.П. (сентябрь 1992 г.). «4-оксалокротонаттаутомераза, фермент, состоящий из 62 аминокислотных остатков на мономер» . Журнал биологической химии . 267 (25): 17716–17721. дои : 10.1016/S0021-9258(19)37101-7 . ПМИД 1339435 .
- ^ Смит С. (декабрь 1994 г.). «Синтаза жирных кислот животных: один ген, один полипептид, семь ферментов» . Журнал ФАСЭБ . 8 (15): 1248–1259. дои : 10.1096/fasebj.8.15.8001737 . ПМИД 8001737 . S2CID 22853095 .
- ^ «Атлас каталитических сайтов» . Европейский институт биоинформатики. Архивировано из оригинала 27 сентября 2018 года . Проверено 4 апреля 2007 г.
- ^ Перейти обратно: а б Сузуки Х (2015). «Глава 7: Активная структура сайта». Как работают ферменты: от структуры к функции . Бока-Ратон, Флорида: CRC Press. стр. 117–140. ISBN 978-981-4463-92-8 .
- ^ Краусс Г. (2003). «Регламент активности ферментов» . Биохимия передачи и регуляции сигналов (3-е изд.). Вайнхайм: Wiley-VCH. стр. 89–114. ISBN 9783527605767 .
- ^ Джагер К.Е., Эггерт Т. (август 2004 г.). «Энантиоселективный биокатализ, оптимизированный путем направленной эволюции». Современное мнение в области биотехнологии . 15 (4): 305–313. doi : 10.1016/j.copbio.2004.06.007 . ПМИД 15358000 .
- ^ Шевелев И.В., Хюбшер У (май 2002 г.). «3'5'-экзонуклеазы». Обзоры природы. Молекулярно-клеточная биология . 3 (5): 364–376. дои : 10.1038/nrm804 . ПМИД 11988770 . S2CID 31605786 .
- ^ Зенкин Н., Юзенкова Ю., Северинов К. (июль 2006 г.). «Транскриптивная корректура». Наука . 313 (5786): 518–520. Бибкод : 2006Sci...313..518Z . дои : 10.1126/science.1127422 . ПМИД 16873663 . S2CID 40772789 .
- ^ Ибба М., Солл Д. (2000). «Синтез аминоацил-тРНК». Ежегодный обзор биохимии . 69 : 617–650. doi : 10.1146/annurev.biochem.69.1.617 . ПМИД 10966471 .
- ^ Роднина М.В., Винтермейер В. (2001). «Правильность выбора аминоацил-тРНК на рибосоме: кинетические и структурные механизмы». Ежегодный обзор биохимии . 70 : 415–435. doi : 10.1146/annurev.biochem.70.1.415 . ПМИД 11395413 .
- ^ Херсонский О., Тауфик Д.С. (2010). «Ферментная распущенность: механистическая и эволюционная перспектива». Ежегодный обзор биохимии . 79 : 471–505. doi : 10.1146/annurev-biochem-030409-143718 . ПМИД 20235827 .
- ^ О'Брайен П.Дж., Хершлаг Д. (апрель 1999 г.). «Каталитическая распущенность и эволюция новых ферментативных активностей» . Химия и биология . 6 (4): Р91–Р105. дои : 10.1016/S1074-5521(99)80033-7 . ПМИД 10099128 .
- ^ Фишер Э (1894). «Влияние конфигурации на действие ферментов» . Отчеты Немецкого химического общества в Берлине (на немецком языке). 27 (3): 2985–93. дои : 10.1002/cber.18940270364 . Со страницы 2992: «Используя метафору, я хочу сказать, что фермент и глюкозид должны подходить друг другу, как замок и ключ, чтобы оказывать друг на друга химическое воздействие». (Используя образ, я скажу, что фермент и глюкозид [т. е. производное глюкозы] должны подходить друг другу как замок и ключ, чтобы иметь возможность оказывать друг на друга химическое воздействие.)
- ^ Купер GM (2000). «Глава 2.2: Центральная роль ферментов как биологических катализаторов» . Клетка: молекулярный подход (2-е изд.). Вашингтон (округ Колумбия): ASM Press. ISBN 0-87893-106-6 .
- ^ Кошланд Д.Э. (февраль 1958 г.). «Применение теории специфичности ферментов к синтезу белка» . Труды Национальной академии наук Соединенных Штатов Америки . 44 (2): 98–104. Бибкод : 1958ПНАС...44...98К . дои : 10.1073/pnas.44.2.98 . ПМЦ 335371 . ПМИД 16590179 .
- ^ Васелла А., Дэвис Г.Дж., Бём М. (октябрь 2002 г.). «Гликозидазные механизмы». Современное мнение в области химической биологии . 6 (5): 619–629. дои : 10.1016/S1367-5931(02)00380-0 . ПМИД 12413546 .
- ^ Бойер Р. (2002). «Глава 6: Ферменты I, реакции, кинетика и ингибирование». Концепции биохимии (2-е изд.). Нью-Йорк, Чичестер, Вайнхайм, Брисбен, Сингапур, Торонто: John Wiley & Sons, Inc., стр. 137–8. ISBN 0-470-00379-0 . OCLC 51720783 .
- ^ Савир Ю., Тлусти Т. (май 2007 г.). Скалас Э (ред.). «Конформационная корректура: влияние конформационных изменений на специфику молекулярного распознавания» . ПЛОС ОДИН . 2 (5): е468. Бибкод : 2007PLoSO...2..468S . дои : 10.1371/journal.pone.0000468 . ПМЦ 1868595 . ПМИД 17520027 .
- ^ Фершт А (1985). Структура и механизм фермента . Сан-Франциско: WH Freeman. стр. 50–2. ISBN 978-0-7167-1615-0 .
- ^ Варшел А., Шарма П.К., Като М., Сян Ю., Лю Х., Олссон М.Х. (август 2006 г.). «Электростатические основы ферментативного катализа». Химические обзоры . 106 (8): 3210–3235. дои : 10.1021/cr0503106 . ПМИД 16895325 .
- ^ Кокс М.М., Нельсон Д.Л. (2013). «Глава 6.2: Как работают ферменты». Ленингерские принципы биохимии (6-е изд.). Нью-Йорк, штат Нью-Йорк: WH Freeman. п. 195. ИСБН 978-1464109621 .
- ^ Бенкович С.Дж., Хаммес-Шиффер С. (август 2003 г.). «Взгляд на ферментативный катализ». Наука . 301 (5637): 1196–1202. Бибкод : 2003Sci...301.1196B . дои : 10.1126/science.1085515 . ПМИД 12947189 . S2CID 7899320 .
- ^ Дженкс В.П. (1987). Катализ в химии и энзимологии . Минеола, Нью-Йорк: Дувр. ISBN 978-0-486-65460-7 .
- ^ Вилла Дж., Страйбл М., Гленнон Т.М., Шам Ю.И., Чу З.Т., Варшел А. (октябрь 2000 г.). «Насколько важен энтропийный вклад в ферментативный катализ?» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (22): 11899–11904. Бибкод : 2000PNAS...9711899V . дои : 10.1073/pnas.97.22.11899 . ПМК 17266 . ПМИД 11050223 .
- ^ Полгар Л. (октябрь 2005 г.). «Каталитическая триада сериновых пептидаз» . Клеточные и молекулярные науки о жизни . 62 (19–20): 2161–2172. дои : 10.1007/s00018-005-5160-x . ПМЦ 11139141 . ПМИД 16003488 . S2CID 3343824 .
- ^ Раманатан А., Савол А., Бургер В., Ченнубхотла К.С., Агарвал П.К. (январь 2014 г.). «Конформационные популяции белков и функционально значимые подсостояния». Отчеты о химических исследованиях . 47 (1): 149–156. дои : 10.1021/ar400084s . ОСТИ 1565147 . ПМИД 23988159 .
- ^ Цай С.Дж., Дель Соль А., Нусинов Р. (март 2009 г.). «Аллостерия белков, передача сигналов и динамика: схема классификации аллостерических механизмов» . Молекулярные биосистемы . 5 (3): 207–216. дои : 10.1039/b819720b . ПМК 2898650 . ПМИД 19225609 .
- ^ Changeux JP, Edelstein SJ (июнь 2005 г.). «Аллостерические механизмы передачи сигнала». Наука . 308 (5727): 1424–1428. Бибкод : 2005Sci...308.1424C . дои : 10.1126/science.1108595 . ПМИД 15933191 . S2CID 10621930 .
- ^ де Больстер М.В. (1997). «Словарь терминов, используемых в бионеорганической химии: кофактор» . Международный союз теоретической и прикладной химии. Архивировано из оригинала 21 января 2017 года . Проверено 30 октября 2007 г.
- ^ Воет Д., Воет Дж., Пратт С. (2016). Основы биохимии . Хобокен, Нью-Джерси: John Wiley & Sons, Inc., с. 336. ИСБН 978-1-118-91840-1 .
- ^ Чепмен-Смит А., Кронан Дж. Э. (сентябрь 1999 г.). «Ферментативное биотинилирование белков: посттрансляционная модификация исключительной специфичности». Тенденции биохимических наук . 24 (9): 359–363. дои : 10.1016/s0968-0004(99)01438-3 . ПМИД 10470036 .
- ^ Фишер З., Эрнандес Прада Х.А., Ту С., Дуда Д., Йошиока С., Ан Х. и др. (февраль 2005 г.). «Структурная и кинетическая характеристика гистидина активного центра как переносчика протонов в катализе карбоангидразой II человека». Биохимия . 44 (4): 1097–1105. дои : 10.1021/bi0480279 . ПМИД 15667203 .
- ^ Перейти обратно: а б Вагнер А.Л. (1975). Витамины и коферменты . Кригер Паб Ко. ISBN 0-88275-258-8 .
- ^ «БРЕНДА Комплексная информационная система по ферментам» . Технический университет Брауншвейга . Проверено 23 февраля 2015 г.
- ^ Торнрот-Хорсфилд С., Нойце Р. (декабрь 2008 г.). «Открытие и закрытие метаболитных ворот» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (50): 19565–19566. Бибкод : 2008PNAS..10519565T . дои : 10.1073/pnas.0810654106 . ПМК 2604989 . ПМИД 19073922 .
- ^ Макардл В.Д., Кэтч Ф., Кэтч В.Л. (2006). «Глава 9: Легочная система и упражнения» . Основы физиологии физических упражнений (3-е изд.). Балтимор, Мэриленд: Липпинкотт Уильямс и Уилкинс. стр. 312–3. ISBN 978-0781749916 .
- ^ Фергюсон С.Дж., Николлс Д., Фергюсон С. (2002). Биоэнергетика 3 (3-е изд.). Сан-Диего: Академик. ISBN 0-12-518121-3 .
- ^ Биссвангер Х (2017). Кинетика ферментов: принципы и методы (Третье, расширенное и улучшенное изд.). Вайнхайм, Германия: Wiley-VCH. ISBN 9783527806461 . OCLC 992976641 .
- ^ Михаэлис Л., Ментен М. (1913). «Die Kinetik der Invertinwirkung» [Кинетика действия инвертазы]. Биохим. З. (на немецком языке). 49 : 333–369. ; Михаэлис Л., Ментен М.Л., Джонсон К.А., Гуди Р.С. (октябрь 2011 г.). «Оригинальная константа Михаэлиса: перевод статьи Михаэлиса-Ментен 1913 года» . Биохимия . 50 (39): 8264–8269. дои : 10.1021/bi201284u . ПМЦ 3381512 . ПМИД 21888353 .
- ^ Бриггс Дж.Е., Холдейн Дж.Б. (1925). «Заметки о кинетике действия ферментов» . Биохимический журнал . 19 (2): 338–339. дои : 10.1042/bj0190338 . ПМК 1259181 . ПМИД 16743508 .
- ^ Бар-Эвен А., Нур Э., Савир Ю., Либермейстер В., Давиди Д., Тауфик Д.С., Майло Р. (май 2011 г.). «Умеренно эффективный фермент: эволюционные и физико-химические тенденции, определяющие параметры фермента». Биохимия . 50 (21): 4402–4410. дои : 10.1021/bi2002289 . ПМИД 21506553 .
- ^ Эллис Р.Дж. (октябрь 2001 г.). «Макромолекулярная скученность: очевидна, но недооценена». Тенденции биохимических наук . 26 (10): 597–604. дои : 10.1016/S0968-0004(01)01938-7 . ПМИД 11590012 .
- ^ Копельман Р. (сентябрь 1988 г.). «Кинетика фрактальных реакций». Наука . 241 (4873): 1620–1626. Бибкод : 1988Sci...241.1620K . дои : 10.1126/science.241.4873.1620 . ПМИД 17820893 . S2CID 23465446 .
- ^ Перейти обратно: а б с д Корниш-Боуден А (2004). Основы кинетики ферментов (3-е изд.). Лондон: Портленд Пресс. ISBN 1-85578-158-1 .
- ^ Прайс, Северная Каролина (1979). «Что подразумевается под «конкурентным торможением»?». Тенденции биохимических наук . 4 (11): Н272–Н273. дои : 10.1016/0968-0004(79)90205-6 .
- ^ Гудселл DS (1 августа 1999 г.). «Молекулярная перспектива: метотрексат» . Онколог . 4 (4): 340–341. doi : 10.1634/теонколог.4-4-340 . ПМИД 10476546 .
- ^ Ву П., Клаузен М.Х., Нильсен Т.Е. (декабрь 2015 г.). «Аллостерические ингибиторы низкомолекулярных киназ» (PDF) . Фармакология и терапия . 156 : 59–68. doi : 10.1016/j.pharmthera.2015.10.002 . ПМИД 26478442 . S2CID 1550698 .
- ^ Корниш-Боуден А (июль 1986 г.). «Почему неконкурентное ингибирование так редко? Возможное объяснение, имеющее последствия для разработки лекарств и пестицидов». Письма ФЭБС . 203 (1): 3–6. дои : 10.1016/0014-5793(86)81424-7 . ПМИД 3720956 . S2CID 45356060 .
- ^ Стрелов Дж. М. (январь 2017 г.). «Взгляд на кинетику ковалентного и необратимого торможения» . СЛАС Дискавери . 22 (1): 3–20. дои : 10.1177/1087057116671509 . ПМИД 27703080 .
- ^ Фишер Дж. Ф., Меруэ С. О., Мобашери С. (февраль 2005 г.). «Бактериальная устойчивость к бета-лактамным антибиотикам: убедительный оппортунизм, убедительная возможность». Химические обзоры . 105 (2): 395–424. дои : 10.1021/cr030102i . ПМИД 15700950 .
- ^ Перейти обратно: а б Джонсон Д.С., Вирапана Э., Краватт Б.Ф. (июнь 2010 г.). «Стратегии обнаружения и снижения риска ковалентных необратимых ингибиторов ферментов» . Будущая медицинская химия . 2 (6): 949–964. дои : 10.4155/fmc.10.21 . ПМК 2904065 . ПМИД 20640225 .
- ^ Эндо А (ноябрь 1992 г.). «Открытие и разработка ингибиторов ГМГ-КоА-редуктазы» . Журнал исследований липидов . 33 (11): 1569–1582. дои : 10.1016/S0022-2275(20)41379-3 . ПМИД 1464741 .
- ^ Влодавер А, Вондрасек Дж (1998). «Ингибиторы протеазы ВИЧ-1: большой успех разработки структурно-ориентированных лекарств». Ежегодный обзор биофизики и биомолекулярной структуры . 27 : 249–284. doi : 10.1146/annurev.biophys.27.1.249 . ПМИД 9646869 . S2CID 10205781 .
- ^ Ёсикава С., Коги В.С. (май 1990 г.). «Инфракрасные доказательства связывания цианида с участками железа и меди в цитохром-с-оксидазе бычьего сердца. Значение снижения кислорода» . Журнал биологической химии . 265 (14): 7945–7958. дои : 10.1016/S0021-9258(19)39023-4 . ПМИД 2159465 .
- ^ Джайн Дж.Л. (май 1999 г.). Основы биохимии . Нью-Дели: ISBN С. Чанда и Ко. 8121903432 . OCLC 818809626 .
- ^ Хантер Т. (январь 1995 г.). «Протеинкиназы и фосфатазы: инь и ян фосфорилирования белков и передачи сигналов» . Клетка . 80 (2): 225–236. дои : 10.1016/0092-8674(95)90405-0 . ПМИД 7834742 . S2CID 13999125 .
- ^ Берг Дж.С., Пауэлл Б.К., Чейни Р.Э. (апрель 2001 г.). «Тысячелетняя перепись миозина» . Молекулярная биология клетки . 12 (4): 780–794. дои : 10.1091/mbc.12.4.780 . ПМК 32266 . ПМИД 11294886 .
- ^ Мейген Э.А. (март 1991 г.). «Молекулярная биология бактериальной биолюминесценции» . Микробиологические обзоры . 55 (1): 123–142. дои : 10.1128/MMBR.55.1.123-142.1991 . ПМЦ 372803 . ПМИД 2030669 .
- ^ Де Клерк Э. (апрель 2002 г.). «Основные моменты разработки новых противовирусных средств». Мини-обзоры по медицинской химии . 2 (2): 163–175. дои : 10.2174/1389557024605474 . ПМИД 12370077 .
- ^ Маки Р.И., Уайт, бакалавр искусств (октябрь 1990 г.). «Последние достижения в области микробной экологии и метаболизма рубца: потенциальное влияние на выработку питательных веществ» . Журнал молочной науки . 73 (10): 2971–2995. doi : 10.3168/jds.S0022-0302(90)78986-2 . ПМИД 2178174 .
- ^ Рузер Калифорния, Марнетт LJ (апрель 2009 г.). «Циклооксигеназы: структурные и функциональные идеи» . Журнал исследований липидов . 50 (Дополнение): S29–S34. doi : 10.1194/jlr.R800042-JLR200 . ПМЦ 2674713 . ПМИД 18952571 .
- ^ Перейти обратно: а б с д Сузуки Х (2015). «Глава 8: Контроль активности ферментов». Как работают ферменты: от структуры к функции . Бока-Ратон, Флорида: CRC Press. стр. 141–69. ISBN 978-981-4463-92-8 .
- ^ Добл Б.В., Вуджетт-младший (апрель 2003 г.). «GSK-3: хитрости для многозадачной киназы» . Журнал клеточной науки . 116 (Часть 7): 1175–1186. дои : 10.1242/jcs.00384 . ПМК 3006448 . ПМИД 12615961 .
- ^ Беннетт П.М., Чопра I (февраль 1993 г.). «Молекулярные основы индукции бета-лактамаз у бактерий» . Антимикробные средства и химиотерапия . 37 (2): 153–158. дои : 10.1128/aac.37.2.153 . ПМК 187630 . ПМИД 8452343 .
- ^ Скетт П., Гибсон Г.Г. (2001). «Глава 3: Индукция и ингибирование метаболизма лекарств». Введение в метаболизм лекарств (3-е изд.). Челтнем, Великобритания: Издательство Nelson Thornes. стр. 87–118. ISBN 978-0748760114 .
- ^ Фагерман, штат Нью-Джерси, Кнудсен Дж. (апрель 1997 г.). «Роль длинноцепочечных эфиров ацил-КоА в регуляции метаболизма и передаче сигналов в клетках» . Биохимический журнал . 323 (Часть 1) (Часть 1): 1–12. дои : 10.1042/bj3230001 . ПМЦ 1218279 . ПМИД 9173866 .
- ^ Сузуки Х (2015). «Глава 4: Влияние pH, температуры и высокого давления на ферментативную активность». Как работают ферменты: от структуры к функции . Бока-Ратон, Флорида: CRC Press. стр. 53–74. ISBN 978-981-4463-92-8 .
- ^ Нори С., Сато Б.К., Бройер Р.М., Вильгельм Дж.Э. (август 2010 г.). «Идентификация новых белков, образующих филаменты, у Saccharomyces cerevisiae и Drosophila melanogaster» . Журнал клеточной биологии . 190 (4): 541–551. дои : 10.1083/jcb.201003001 . ПМК 2928026 . ПМИД 20713603 .
- ^ Оги Дж.Н., Лю Дж.Л. (2015). «Метаболическая регуляция посредством филаментации ферментов» . Критические обзоры по биохимии и молекулярной биологии . 51 (4): 282–293. дои : 10.3109/10409238.2016.1172555 . ПМЦ 4915340 . ПМИД 27098510 .
- ^ Камата К., Мицуя М., Нисимура Т., Эйки Дж., Нагата Ю. (март 2004 г.). «Структурные основы аллостерической регуляции мономерного аллостерического фермента глюкокиназы человека» . Структура . 12 (3): 429–438. дои : 10.1016/j.str.2004.02.005 . ПМИД 15016359 .
- ^ Фрогель П., Зуали Х., Вионнет Н., Вельо Г., Ваксиллер М., Сан Ф. и др. (март 1993 г.). «Семейная гипергликемия вследствие мутаций глюкокиназы. Определение подтипа сахарного диабета» . Медицинский журнал Новой Англии . 328 (10): 697–702. дои : 10.1056/NEJM199303113281005 . ПМИД 8433729 .
- ^ Окада С., О'Брайен Дж. С. (август 1969 г.). «Болезнь Тея-Сакса: генерализованное отсутствие компонента бета-ДН-ацетилгексозаминидазы». Наука . 165 (3894): 698–700. Бибкод : 1969Sci...165..698O . дои : 10.1126/science.165.3894.698 . ПМИД 5793973 . S2CID 8473726 .
- ^ «Знакомство с болезнью Тея-Сакса» . Национальный институт исследования генома человека США . Проверено 1 марта 2015 г.
- ^ Эрландсен Х., Стивенс Р.К. (октябрь 1999 г.). «Структурная основа фенилкетонурии». Молекулярная генетика и обмен веществ . 68 (2): 103–125. дои : 10.1006/mgme.1999.2922 . ПМИД 10527663 .
- ^ Флэтмарк Т., Стивенс Р.К. (август 1999 г.). «Структурное понимание гидроксилаз ароматических аминокислот и их мутантных форм, связанных с заболеваниями». Химические обзоры . 99 (8): 2137–2160. дои : 10.1021/cr980450y . ПМИД 11849022 .
- ^ «Фенилкетонурия» . Гены и болезни [Интернет] . Бетесда (Мэриленд): Национальный центр биотехнологической информации (США). 1998–2015 гг.
- ^ «Дефицит псевдохолинэстеразы» . Национальная медицинская библиотека США . Проверено 5 сентября 2013 г.
- ^ Фикер А., Филпотт Дж., Арманд М. (2011). «Ферментозаместительная терапия недостаточности поджелудочной железы: настоящее и будущее» . Клиническая и экспериментальная гастроэнтерология . 4 : 55–73. дои : 10.2147/CEG.S17634 . ПМК 3132852 . ПМИД 21753892 .
- ^ Миссельвиц Б., Пол Д., Фрюхауф Х., Фрид М., Ваврика С.Р., Фокс М. (июнь 2013 г.). «Мальабсорбция и непереносимость лактозы: патогенез, диагностика и лечение» . Объединенный европейский гастроэнтерологический журнал . 1 (3): 151–159. дои : 10.1177/2050640613484463 . ПМК 4040760 . ПМИД 24917953 .
- ^ Кливер Дж. Э. (май 1968 г.). «Дефектная репарационная репликация ДНК при пигментной ксеродерме». Природа . 218 (5142): 652–656. Бибкод : 1968Natur.218..652C . дои : 10.1038/218652a0 . ПМИД 5655953 . S2CID 4171859 .
- ^ Джеймс В.Д., Элстон Д., Бергер Т.Г. (2011). Кожные заболевания Эндрюса: клиническая дерматология (11-е изд.). Лондон: Сондерс/Эльзевир. п. 567. ИСБН 978-1437703146 .
- ^ Мурзин А.Г. (ноябрь 1993 г.). «Могут ли гомологичные белки проявлять различную ферментативную активность?». Тенденции биохимических наук . 18 (11): 403–405. дои : 10.1016/0968-0004(93)90132-7 . ПМИД 8291080 .
- ^ Очоа Д., Брэдли Д., Бельтрао П. (февраль 2018 г.). «Эволюция, динамика и нарушение регуляции передачи сигналов киназы». Современное мнение в области структурной биологии . 48 : 133–140. дои : 10.1016/j.sbi.2017.12.008 . ПМИД 29316484 .
- ^ Ренугопалакришнан В., Гардуньо-Хуарес Р., Нарасимхан Г., Верма К.С., Вэй Х., Ли П. (ноябрь 2005 г.). «Рациональный дизайн термостабильных белков: актуальность для бионанотехнологии». Журнал нанонауки и нанотехнологий . 5 (11): 1759–1767. дои : 10.1166/jnn.2005.441 . ПМИД 16433409 .
- ^ Хульт К., Берглунд П. (август 2003 г.). «Инженерные ферменты для улучшения органического синтеза». Современное мнение в области биотехнологии . 14 (4): 395–400. дои : 10.1016/S0958-1669(03)00095-8 . ПМИД 12943848 .
- ^ Цзян Л., Альтхофф Э.А., Клементе Ф.Р., Дойл Л., Ретлисбергер Д., Зангеллини А. и др. (март 2008 г.). «Вычислительный дизайн ретро-альдольных ферментов de novo» . Наука . 319 (5868): 1387–1391. Бибкод : 2008Sci...319.1387J . дои : 10.1126/science.1152692 . ПМК 3431203 . ПМИД 18323453 .
- ^ Перейти обратно: а б Сунь Ю, Ченг Дж (май 2002 г.). «Гидролиз лигноцеллюлозных материалов для производства этанола: обзор». Биоресурсные технологии . 83 (1): 1–11. Бибкод : 2002BiTec..83....1S . дои : 10.1016/S0960-8524(01)00212-7 . ПМИД 12058826 .
- ^ Перейти обратно: а б Кирк О, Borchert TV, Fuglsang CC (август 2002 г.). «Промышленное применение ферментов». Современное мнение в области биотехнологии . 13 (4): 345–351. дои : 10.1016/S0958-1669(02)00328-2 . ПМИД 12323357 .
- ^ Перейти обратно: а б с Бриггс Д.Э. (1998). Солод и соложение (1-е изд.). Лондон: Блэки Академик. ISBN 978-0412298004 .
- ^ Дюлье С., Молл М., Буран Дж., Понселе Д. (2000). «Улучшение производительности и контроля ферментации пива с использованием инкапсулированной альфа-ацетолактатдекарбоксилазы и моделирования» . Биотехнологический прогресс . 16 (6): 958–965. дои : 10.1021/bp000128k . ПМИД 11101321 . S2CID 25674881 .
- ^ Тарте Р. (2008). Свойства, функциональность и применение ингредиентов в мясных продуктах . Нью-Йорк: Спрингер. п. 177. ИСБН 978-0-387-71327-4 .
- ^ «Химозин – база данных ГМО» . ГМО Компас . Евросоюз. 10 июля 2010 года. Архивировано из оригинала 26 марта 2015 года . Проверено 1 марта 2015 г.
- ^ Молимард П., Спиннлер Х.Э. (февраль 1996 г.). «Обзор: Соединения, влияющие на вкус сыров, созревших с поверхностной плесенью: происхождение и свойства» . Журнал молочной науки . 79 (2): 169–184. doi : 10.3168/jds.S0022-0302(96)76348-8 .
- ^ Гусман-Мальдонадо Х., Паредес-Лопес О (сентябрь 1995 г.). «Амилолитические ферменты и продукты, полученные из крахмала: обзор». Критические обзоры в области пищевой науки и питания . 35 (5): 373–403. дои : 10.1080/10408399509527706 . ПМИД 8573280 .
- ^ Перейти обратно: а б «Протеаза – база данных ГМО» . ГМО Компас . Евросоюз. 10 июля 2010 г. Архивировано из оригинала 24 февраля 2015 г. Проверено 28 февраля 2015 г.
- ^ Алькорта I, Гарбису К, Ллама М.Дж., Серра Дж.Л. (январь 1998 г.). «Промышленное применение пектиновых ферментов: обзор». Процесс биохимии . 33 (1): 21–28. дои : 10.1016/S0032-9592(97)00046-0 .
- ^ Баджпай П. (март 1999 г.). «Применение ферментов в целлюлозно-бумажной промышленности». Биотехнологический прогресс . 15 (2): 147–157. дои : 10.1021/bp990013k . ПМИД 10194388 . S2CID 26080240 .
- ^ Бегли К.Г., Парагина С., Спорн А. (март 1990 г.). «Анализ ферментных очистителей контактных линз». Журнал Американской оптометрической ассоциации . 61 (3): 190–194. ПМИД 2186082 .
- ^ Фаррис П.Л. (2009). «Экономический рост и организация крахмальной промышленности США». В BeMiller JN, Whistler RL (ред.). Химия и технология крахмала (3-е изд.). Лондон: Академик. ISBN 9780080926551 .
Дальнейшее чтение
|
|
Внешние ссылки
 СМИ, связанные с ферментами, на Викискладе?
СМИ, связанные с ферментами, на Викискладе?
![{\displaystyle {\ce {CO2{}+H2O->[{\text{Карбоангидраза}}]H2CO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb4c8837b26e96fe552c17d863f93e0618cd998b)
![{\displaystyle {\ce {CO2{}+H2O<-[{\text{Карбоновая ангидраза}}]H2CO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/618e95485aa1c3c44a29c557ac448ae5b544ff07)







