Миристоилирование

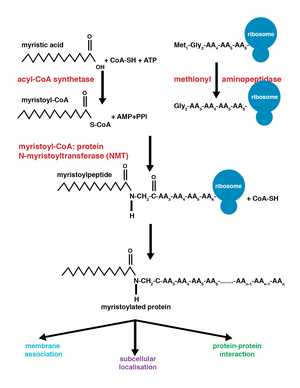
Миристоилирование — это модификация липидирования, при которой миристоильная группа , полученная из миристиновой кислоты , ковалентно присоединена амидной связью к альфа-аминогруппе N -концевого остатка глицина . [1] Миристиновая кислота представляет собой насыщенную жирную кислоту с 14 атомами углерода (14:0) с систематическим названием н- тетрадекановая кислота. Эта модификация может быть добавлена как котрансляционно, так и посттрансляционно . N -миристоилтрансфераза (NMT) катализирует реакцию присоединения миристиновой кислоты в цитоплазме клеток. [2] Это событие липидирования является наиболее распространенным типом жирного ацилирования. [3] и присутствует во многих организмах, включая животных , растения , грибы , простейшие. [4] и вирусы . Миристоилирование обеспечивает слабые белок-белковые и белок-липидные взаимодействия. [5] и играет важную роль в нацеливании на мембраны, белок-белковых взаимодействиях и широко участвует в различных путях передачи сигнала .
Открытие
[ редактировать ]В 1982 году лаборатория Коити Титани идентифицировала « N -концевую блокирующую группу» каталитической субъединицы циклической АМФ-зависимой протеинкиназы у коров как н -тетрадеканоил. [6] Почти одновременно в лаборатории Клода Б. Клее эта же группа, блокирующая N -конец, была дополнительно охарактеризована как миристиновая кислота. [7] Обе лаборатории сделали это открытие, используя схожие методы: масс-спектрометрию и газовую хроматографию . [6] [7]
N -миристоилтрансфераза
[ редактировать ]
Фермент N -миристоилтрансфераза (NMT) или глицилпептид N -тетрадеканоилтрансфераза отвечает за необратимое присоединение миристоильной группы к N -концевым или внутренним глициновым остаткам белков. Эта модификация может происходить котрансляционно или посттрансляционно . У позвоночных эта модификация осуществляется двумя NMT, NMT1 и NMT2 , оба из которых являются членами суперсемейства ацетилтрансфераз GCN5 . [8]
Структура
[ редактировать ]Кристаллическая структура NMT состоит из двух идентичных субъединиц, каждая из которых имеет собственный сайт связывания миристоил-КоА. седловидной формы, Каждая субъединица состоит из большого β-листа окруженного α-спиралями . Симметрия складки псевдодвойная. [ нужны разъяснения ] Миристоил-КоА связывается с N -концевой частью, тогда как С -концевой конец связывает белок. [9]
Механизм
[ редактировать ]Присоединение миристоильной группы происходит посредством реакции нуклеофильного присоединения-отщепления . Во-первых, миристоил- коэнзим А (КоА) располагается в связывающем кармане NMT так, что карбонил обращен к двум аминокислотным остаткам: фенилаланину 170 и лейцину 171. [9] Это поляризует карбонил так, что на углероде образуется положительный заряд, что делает его восприимчивым к нуклеофильной атаке со стороны остатка глицина модифицируемого белка. Когда миристоил-КоА связывается, NMT переориентируется, обеспечивая связывание пептида. С - конец NMT затем действует как общая основа для депротонирования NH 3 + , активируя аминогруппу для атаки карбонильной группы миристоил-КоА. Образующийся тетраэдрический интермедиат стабилизируется за счет взаимодействия между положительно заряженной оксианионной дыркой и отрицательно заряженным алкоксид- анионом. Затем высвобождается свободный КоА, вызывая конформационные изменения фермента, которые позволяют высвободить миристоилированный пептид. [2]

Котрансляционное и посттрансляционное добавление
[ редактировать ]Котрансляционные и посттрансляционные ковалентные модификации позволяют белкам достигать более высоких уровней сложности клеточных функций, дополнительно добавляя разнообразие протеому . [10] Добавление миристоил-КоА к белку может происходить во время трансляции белка или после нее. Во время котрансляционного добавления миристоильной группы N -концевой глицин модифицируется после отщепления N -концевого остатка метионина во вновь образующемся растущем полипептиде . [1] Посттрансляционное миристоилирование обычно происходит после расщепления каспазы , что приводит к обнажению внутреннего остатка глицина, который затем становится доступным для добавления миристиновой кислоты. [8]
Функции
[ редактировать ]Миристоилированные белки
[ редактировать ]| Белок | Физиологическая роль | Функция миристоилирования |
|---|---|---|
| Актин | цитоскелета Структурный белок | Посттрансляционное миристоилирование во время апоптоза [8] |
| Делать ставку | Белок, способствующий апоптозу | Посттрансляционное миристоилирование после расщепления каспаз направляет белок на митохондриальную мембрану. [8] |
| МАРКИ | перекрестное сшивание актина при фосфорилировании протеинкиназой C | Котрансляционное миристоилирование способствует ассоциации плазматических мембран |
| G-белок | Сигнальная ГТФаза | Котрансляционное миристоилирование способствует ассоциации плазматических мембран [11] |
| Гельсолин | Белок, разрезающий актиновые нити | Посттрансляционное миристоилирование усиливает антиапоптотические свойства [8] |
| ПАК2 | Серин/треониновая киназа, рост клеток, подвижность, стимулятор выживания | Посттрансляционное миристоилирование усиливает апоптотические свойства и индуцирует на плазматической мембране. локализацию [8] |
| Арф | регуляция везикулярного транспорта и ремоделирования актина | N -концевое миристоилирование способствует ассоциации мембран. |
| Гиппокальцин | Нейрональный датчик кальция | Содержит Ca 2+ /миристоиловый переключатель |
| ФСП1 | Фактор, индуцирующий апоптоз, ассоциированный с митохондриями 2 ( AIFM2 ) | Облегчает ассоциацию FSP1 с липидным бислоем, что обеспечивает устойчивость к ферроптозу. [12] |
Молекулярный переключатель миристоилирования
[ редактировать ]Миристоилирование не только разнообразит функцию белка, но и добавляет к ней уровни регуляции. Одной из наиболее распространенных функций миристоильной группы является мембранная ассоциация и клеточная локализация модифицированного белка. Хотя миристоильная группа добавляется к концу белка, в некоторых случаях она изолируется в гидрофобных областях белка, а не подвергается воздействию растворителя. [5] Регулируя ориентацию миристоильной группы, эти процессы можно хорошо скоординировать и тщательно контролировать. Таким образом, миристоилирование является формой « молекулярного переключения ». [13]
Как гидрофобные миристоильные группы, так и «основные участки» (высоко положительные участки белка) характеризуют миристоил-электростатические переключатели. Базовый пластырь обеспечивает благоприятных электростатических взаимодействий возникновение между отрицательно заряженными фосфолипидными головками мембраны и положительной поверхностью ассоциированного белка. Это обеспечивает более тесную ассоциацию и направленную локализацию белков. [5]
Миристоил-конформационные переключатели могут иметь несколько форм. Связывание лиганда с миристоилированным белком с изолированной миристоильной группой может вызвать конформационные изменения в белке, приводящие к обнажению миристоильной группы. Аналогичным образом, некоторые миристоилированные белки активируются не указанным лигандом, а путем обмена GDP на GTP факторами обмена гуаниновых нуклеотидов в клетке. Как только GTP связывается с миристоилированным белком, он активируется, обнажая миристоильную группу. Эти конформационные переключатели могут быть использованы в качестве сигнала для клеточной локализации, мембранно-белковых и белок-белковых взаимодействий . [5] [13] [14]
Двойные модификации миристоилированных белков
[ редактировать ]Дальнейшие модификации N -миристоилированных белков могут добавить еще один уровень регуляции миристоилированного белка. Двойное ацилирование может способствовать более жестко регулируемой локализации белков, в частности, нацеливая белки на липидные рафты на мембранах. [15] или обеспечение диссоциации миристоилированных белков от мембран.
Миристоилирование и пальмитоилирование обычно являются совмещенными модификациями. Само по себе миристоилирование может способствовать временным мембранным взаимодействиям. [5] которые позволяют белкам закрепляться на мембранах, но легко диссоциируют. Дальнейшее пальмитоилирование обеспечивает более прочное закрепление и более медленную диссоциацию от мембран, когда это требуется клетке. Эта специфическая двойная модификация важна для путей рецептора, связанного с G-белком , и называется двойным переключателем жирного ацилирования. [5] [8]
Миристоилирование часто сопровождается фосфорилированием близлежащих остатков. Дополнительное фосфорилирование того же белка может снизить электростатическое сродство миристоилированного белка к мембране, вызывая транслокацию этого белка в цитоплазму после диссоциации от мембраны. [5]
Преобразование сигнала
[ редактировать ]Миристоилирование играет жизненно важную роль в нацеливании на мембрану и передаче сигнала. [16] в реакции растений на экологический стресс. Кроме того, при передаче сигнала через G-белок пальмитоилирование субъединицы α, пренилирование субъединицы γ и миристоилирование участвуют в прикреплении G-белка к внутренней поверхности плазматической мембраны, чтобы G-белок мог взаимодействовать со своим рецептором. [17]
Апоптоз
[ редактировать ]Миристоилирование является неотъемлемой частью апоптоза или запрограммированной гибели клеток. Апоптоз необходим для клеточного гомеостаза и происходит, когда клетки находятся в состоянии стресса, такого как гипоксия или повреждение ДНК . Апоптоз может происходить путем активации, опосредованной либо митохондриями, либо рецепторами. При рецептор-опосредованном апоптозе пути апоптоза запускаются, когда клетка связывает рецептор смерти. В одном из таких случаев связывание рецептора смерти инициирует образование индуцирующего смерть сигнального комплекса , комплекса, состоящего из многочисленных белков, включающих несколько каспаз, включая каспазу 3 . Каспаза 3 расщепляет ряд белков, которые впоследствии миристоилируются NMT. Агонист гибели домена, взаимодействующего с проапоптозом BH3 (Bid), является одним из таких белков, который после миристоилирования перемещается в митохондрии , где вызывает высвобождение цитохрома c, что приводит к гибели клеток. [8] Актин , гельсолин и p21-активируемая киназа 2 PAK2 представляют собой три других белка, которые миристоилируются после расщепления каспазой 3 , что приводит либо к усилению, либо к подавлению апоптоза. [8]
Влияние на здоровье человека
[ редактировать ]Рак
[ редактировать ]c-Src представляет собой ген, который кодирует протоонкогенную тирозин-протеинкиназу Src, белок, важный для нормального митотического цикла . Он фосфорилируется и дефосфорилируется, включая и выключая передачу сигналов. Протоонкогенная тирозин-протеинкиназа Src должна быть локализована на плазматической мембране , чтобы фосфорилировать другие нижестоящие мишени; отвечает миристоилирование За это событие , направленное на мембрану, . Повышенное миристоилирование c-Src может привести к усилению пролиферации клеток и быть ответственным за трансформацию нормальных клеток в раковые . [5] [14] [18] Активация c-Src может привести к так называемым « признакам рака », среди которых активация ангиогенеза , пролиферации и инвазии . [19]
Вирусная инфекционность
[ редактировать ]
ВИЧ-1 — это ретровирус , который использует миристоилирование одного из своих структурных белков для успешной упаковки своего генома, сборки и созревания в новую инфекционную частицу. Белок вирусного матрикса , самый N -концевой домен полипротеина gag , миристоилирован. [20] Эта модификация миристоилирования нацеливает кляп на мембрану клетки-хозяина. Используя миристоил-электростатический переключатель, [13] включая базовый участок матричного белка, gag может собираться на липидных плотах плазматической мембраны для сборки вируса , почкования и дальнейшего созревания. [18] Чтобы предотвратить вирусную инфекционность, миристоилирование матриксного белка может стать хорошей мишенью для лекарств.
Прокариотические и эукариотические инфекции
[ редактировать ]Некоторые НМТ являются терапевтическими мишенями для разработки лекарств против бактериальных инфекций . Было показано, что миристоилирование необходимо для выживания ряда болезнетворных грибов , в том числе C. albicans и C. neoformans . Помимо прокариотических идентифицированы НМТ многочисленных болезнетворных эукариотических были бактерий, в качестве мишеней для лекарств также организмов. Правильное функционирование NMT у простейших Leishmania major и Leishmania donovani ( лейшманиоз ), Trypanosoma brucei ( африканская сонная болезнь ) и P. falciparum ( малярия ) необходимо для выживания паразитов. Ингибиторы этих микроорганизмов в настоящее время исследуются. T. brucei , конкурируя Идентифицирован ингибитор пиразолсульфонамида, который избирательно связывает за сайт связывания пептида , ингибируя таким образом ферментативную активность и устраняя паразита из кровотока мышей с африканской сонной болезнью . [8]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б Кокс, Дэвид Л. Нельсон, Майкл М. (2005). Ленингерские принципы биохимии (4-е изд.). Нью-Йорк: WH Freeman. ISBN 978-0716743392 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Jump up to: а б Таманои, Фуюхико; Сигман, Дэвид С., ред. (2001). Липидирование белков . Том. 21 (3-е изд.). Сан-Диего, Калифорния: Academic Press. ISBN 978-0-12-122722-7 .
- ^ Мохаммадзаде, Фатима; Хоссейни, Вахид; Мехдизаде, Амир; Дэни, Кристиан; Дараби, Масуд (30 ноября 2018 г.). «Метод валового анализа глобального ацилирования белков методом газожидкостной хроматографии» . ИУБМБ Жизнь . 71 (3): 340–346. дои : 10.1002/юб.1975 . ISSN 1521-6543 . ПМИД 30501005 .
- ^ Кара, Украина; Стензель, диджей; Ингрэм, Лейтенант; Бушелл, Греция; Лопес, Дж.А.; Кидсон, К. (апрель 1988 г.). «Ингибирующее моноклональное антитело против (миристилированного) низкомолекулярного антигена Plasmodium falciparum, связанного с мембраной паразитофорной вакуоли» . Инфекция и иммунитет . 56 (4): 903–9. дои : 10.1128/IAI.56.4.903-909.1988 . ПМК 259388 . ПМИД 3278984 .
- ^ Jump up to: а б с д и ж г час Фарази, Т.А. (29 августа 2001 г.). «Биология и энзимология N -миристоилирования белка» . Журнал биологической химии . 276 (43): 39501–39504. дои : 10.1074/jbc.R100042200 . ПМИД 11527981 .
- ^ Jump up to: а б Карр, ЮАР; Биманн, К; Сёдзи, С; Пармели, округ Колумбия; Титани, К. (октябрь 1982 г.). « N -Тетрадеканоил представляет собой NH 2 -концевую блокирующую группу каталитической субъединицы циклической АМФ-зависимой протеинкиназы из бычьей сердечной мышцы» . Труды Национальной академии наук Соединенных Штатов Америки . 79 (20): 6128–31. Бибкод : 1982PNAS...79.6128C . дои : 10.1073/pnas.79.20.6128 . ПМК 347072 . ПМИД 6959104 .
- ^ Jump up to: а б Эйткен, А; Коэн, П; Сантикарн, С; Уильямс, Д.Х.; Колдер, АГ; Смит, А; Клее, CB (27 декабря 1982 г.). «Идентификация NH 2 -концевой блокирующей группы кальциневрина B как миристиновой кислоты» . Письма ФЭБС . 150 (2): 314–8. дои : 10.1016/0014-5793(82)80759-x . ПМИД 7160476 . S2CID 40889752 .
- ^ Jump up to: а б с д и ж г час я дж Мартин, Дейл Д.О.; Бошан, Эрван; Бертьям, Люк Г. (январь 2011 г.). «Посттрансляционное миристоилирование: жир имеет значение в клеточной жизни и смерти». Биохимия . 93 (1): 18–31. дои : 10.1016/j.biochi.2010.10.018 . ПМИД 21056615 .
- ^ Jump up to: а б Бхатнагар, РС; Фюттерер, К; Ваксман, Г; Гордон, JI (23 ноября 1999 г.). «Структура миристоил-КоА: белок N -миристоилтрансфераза». Biochimica et Biophysical Acta (BBA) - Молекулярная и клеточная биология липидов . 1441 (2–3): 162–72. дои : 10.1016/s1388-1981(99)00155-9 . ПМИД 10570244 .
- ^ Снайдер, Джаред. «Обзор посттрансляционных модификаций (PTM)» . Термо Сайентифик.
- ^ Чен, Кэтрин А.; Мэннинг, Дэвид Р. (2001). «Регуляция G-белков путем ковалентной модификации» . Онкоген . 20 (13): 1643–1652. дои : 10.1038/sj.onc.1204185 . ПМИД 11313912 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Кукла, Себастьян; Фрейтас, Флоренсио Порту; Шах, Рон; Альдрованди, Маселер; да Силва, Милен Коста; Ингольд, Ирина; Гойя Грочин, Андреа; Ксавье да Силва, Тамара Нисида; Панзилиус, Елена; Шил, Кристина Х.; Мурао, Андре (ноябрь 2019 г.). «FSP1 представляет собой глутатион-независимый супрессор ферроптоза» . Природа . 575 (7784): 693–698. Бибкод : 2019Natur.575..693D . дои : 10.1038/s41586-019-1707-0 . hdl : 10044/1/75345 . ISSN 1476-4687 . PMID 31634899 . S2CID 204833583 .
- ^ Jump up to: а б с Маклафлин, Стюарт; Адерем, Алан (июль 1995 г.). «Миристоил-электростатический переключатель: модулятор обратимых белок-мембранных взаимодействий». Тенденции биохимических наук . 20 (7): 272–276. дои : 10.1016/S0968-0004(00)89042-8 . PMID 7667880 .
- ^ Jump up to: а б Райт, Меган Х.; Исцели, Уильям П.; Манн, Дэвид Дж.; Тейт, Эдвард В. (7 ноября 2009 г.). «Миристоилирование белков в норме и болезни» . Журнал химической биологии . 3 (1): 19–35. дои : 10.1007/s12154-009-0032-8 . ПМК 2816741 . ПМИД 19898886 .
- ^ Левенталь, Илья; Гжибек, Михал; Саймонс, Кай (3 августа 2010 г.). «Смазка их пути: модификации липидов определяют ассоциацию белков с мембранными плотами». Биохимия . 49 (30): 6305–6316. дои : 10.1021/bi100882y . ПМИД 20583817 .
- ^ ХАЯСИ, Нобухиро; ТИТАНИ, Коити (2010). « N -миристоилированные белки, ключевые компоненты внутриклеточных систем передачи сигналов, обеспечивающие быстрые и гибкие клеточные реакции» . Труды Японской академии, серия B. 86 (5): 494–508. Бибкод : 2010PJAB...86..494H . дои : 10.2183/pjab.86.494 . ПМК 3108300 . ПМИД 20467215 .
- ^ Уолл, Марк А.; Коулман, Дэвид Э.; Ли, Итан; Иньигес-Луи, Хорхе А.; Познер, Брюс А.; Гилман, Альфред Г.; Спранг, Стивен Р. (декабрь 1995 г.). «Структура гетеротримера G-белка Giα1β1γ2» . Клетка . 83 (6): 1047–1058. дои : 10.1016/0092-8674(95)90220-1 . ПМИД 8521505 .
- ^ Jump up to: а б Сёдзи, С; Кубота, Ю. (февраль 1989 г.). «[Функция миристоилирования белка в клеточной регуляции и пролиферации вируса]» . Якугаку Засси . 109 (2): 71–85. дои : 10.1248/yakushi1947.109.2_71 . ПМИД 2545855 .
- ^ Ханахан, Дуглас; Вайнберг, Роберт А. (март 2011 г.). «Признаки рака: следующее поколение» . Клетка . 144 (5): 646–674. дои : 10.1016/j.cell.2011.02.013 . ПМИД 21376230 .
- ^ Херпс, AC; Янс, Д.А. (март 2007 г.). «Регуляция функций матричного белка ВИЧ-1». Исследования СПИДа и ретровирусы человека . 23 (3): 341–6. дои : 10.1089/aid.2006.0108 . ПМИД 17411366 .

