Африканский трипаносомоз
| Африканский трипаносомоз | |
|---|---|
| Другие имена | Сонная болезнь, африканская сонная болезнь. |
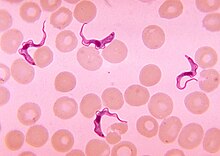 | |
| Трипаносома образуется в мазке крови | |
| Специальность | Инфекционное заболевание |
| Симптомы | Стадия 1 : Лихорадка, головные боли, зуд, боли в суставах. [1] Стадия 2 : Бессонница , спутанность сознания , атаксия. [2] [1] |
| Обычное начало | 1–3 недели после заражения [2] |
| Типы | Trypanosoma brucei gambiense (TbG), Trypanosoma brucei rhodesiense (TbR) [3] |
| Причины | Trypanosoma brucei, распространяемая мухами цеце [3] |
| Метод диагностики | Мазок крови , люмбальная пункция [2] |
| Медикамент | Фексинидазол , пентамидин , сурамин , меларсопрол , эфлорнитин , нифуртимокс. [3] |
| Прогноз | Смертельно без лечения [3] |
| Частота | 977 (2018) [3] |
| Летальные исходы | 3,500 (2015) [4] |
Африканский трипаносомоз , также известный как африканская сонная болезнь или просто сонная болезнь , представляет собой передаваемую насекомыми паразитарную инфекцию человека и других животных. [3] Вызывается видом Trypanosoma brucei . [3] Человек заражается двумя типами: Trypanosoma brucei gambiense (TbG) и Trypanosoma brucei rhodesiense (TbR). [3] TbG является причиной более 92% зарегистрированных случаев. [1] Оба заболевания обычно передаются через укус инфицированной мухи цеце и наиболее распространены в сельской местности. [3]
Первоначально первая стадия заболевания характеризуется лихорадкой, головными болями, зудом и болями в суставах, начинающимися через одну-три недели после укуса. [1] [2] Через несколько недель или месяцев вторая стадия начинается с спутанности сознания, плохой координации, онемения и проблем со сном. [2] Диагностика осуществляется путем обнаружения паразита в мазке крови или жидкости лимфатического узла. [2] Люмбальная пункция часто необходима, чтобы отличить первую и вторую стадии заболевания. [2] Если заболевание не лечить быстро, оно может привести к смерти.
Профилактика тяжелого заболевания включает скрининг населения из группы риска с помощью анализов крови на TbG. [3] Лечение облегчается, если заболевание обнаружено на ранней стадии и до появления неврологических симптомов. [3] Лечение первой стадии проводилось препаратами пентамидин или сурамин . [3] Лечение второй стадии включало эфлорнитин или комбинацию нифуртимокса и эфлорнитина для лечения TbG. [2] [3] Фексинидазол — это более новый метод лечения, который можно принимать внутрь на любой стадии TbG. [3] Хотя меларсопрол эффективен при обоих типах, из-за серьезных побочных эффектов его обычно используют только при TbR. [3] Без лечения сонная болезнь обычно приводит к смерти. [3]
Заболевание регулярно встречается в некоторых регионах Африки к югу от Сахары, где население, подверженное риску, составляет около 70 миллионов человек в 36 странах. [5] По оценкам, в настоящее время инфицировано 11 000 человек, а в 2015 году было зафиксировано 2800 новых случаев заражения. [6] [1] В 2018 году было зарегистрировано 977 новых случаев. [3] В 2015 году от него погибло около 3500 человек по сравнению с 34 000 в 1990 году. [4] [7] Более 80% этих случаев приходится на Демократическую Республику Конго . [1] В новейшей истории произошли три крупные вспышки: одна с 1896 по 1906 год, преимущественно в Уганде и бассейне реки Конго , и две в 1920 и 1970 годах в нескольких африканских странах. [1] Классифицируется как забытая тропическая болезнь . [8] Другие животные, такие как коровы, могут быть переносчиками этой болезни и заражаться; в этом случае она известна как Нагана или трипаносомоз животных . [1]
Признаки и симптомы [ править ]
Симптомы африканского трипаносомоза протекают в две стадии: гемолимфатическую и неврологическую (последняя характеризуется паразитарной инвазией в центральную нервную систему). [9] [10] В дополнение к первоначальным признакам возникают неврологические симптомы, и эти две стадии может быть трудно различить только на основании клинических особенностей. [10]
Сообщалось, что заболевание проявляется атипичными симптомами у инфицированных лиц, прибывших из неэндемичных районов (например, путешественников). Причины этого неясны и могут быть генетическими. Небольшое количество таких случаев также могло привести к искажению результатов. Считается, что у таких лиц инфекция проявляется в основном лихорадкой с желудочно-кишечными симптомами (например, диареей и желтухой) и лишь в редких случаях развивается лимфаденопатия . [11]
Трипаносомная язва [ править ]
Системное заболевание иногда предвещает трипаносомная язва, развивающаяся на месте укуса инфекционной мухи в течение 2 дней после заражения. Язва чаще всего наблюдается при Т. b. rhodesiense и лишь в редких случаях у T. b. gambiense (однако при инфекции T. b. gambiense язвы чаще наблюдаются у лиц из неэндемичных районов). [10]
Гемолимфатическая фаза [ править ]
Инкубационный период для T. b. составляет 1–3 недели. rhodesiense, а более длинный (но менее точно охарактеризованный) у T. b. гамбиенсная инфекция. Первая/начальная стадия, известная как гемолимфатическая фаза, характеризуется неспецифическими генерализованными симптомами. [10] например: лихорадка (перемежающаяся) , головные боли (сильные), [12] боли в суставах , зуд , [9] [10] слабость, недомогание, утомляемость, потеря веса, лимфаденопатия и гепатоспленомегалия . [10]
Диагноз может быть отложен из-за неясности начальных симптомов. Заболевание также можно принять за малярию (которая на самом деле может возникать как коинфекция). [11]
Перемежающаяся лихорадка [ править ]
Лихорадка носит интермиттирующий характер, с приступами продолжительностью от дня до недели, разделенными интервалами от нескольких дней до месяца и более. [9] [10] В течение болезни эпизоды лихорадки становятся реже. [10]
Лимфаденопатия [ править ]
Поражение паразитом кровеносной и лимфатической систем сопровождается сильным увеличением лимфатических узлов , часто достигающих огромных размеров. [9] Чаще всего поражаются задние шейные лимфатические узлы, однако может также наблюдаться поражение подмышечных, паховых и эпитрохлеарных лимфатических узлов. [10] Может появиться симптом Уинтерботтома — характерное увеличение лимфатических узлов на задней части шеи. [9] Симптом Уинтерботтома часто встречается у T. b. гамбиенсная инфекция. [10]
Другие особенности [ править ]
У пострадавших могут дополнительно наблюдаться: кожная сыпь, [12] гемолитическая анемия, гепатомегалия и нарушение функции печени, спленомегалия, эндокринные нарушения, поражение сердца (например, перикардит и застойная сердечная недостаточность) и поражение глаз. [11]
- Язва африканского трипаносомоза человека [13]
- Типичная мелкопятнистая розовая сыпь острого африканского трипаносомоза на коже живота («трипанидная сыпь») [14]
- Многочисленные пятна кровотечения на коже голени у человека, инфицированного Т. b. Родезийский [14]
фаза Неврологическая
Вторая фаза заболевания, неврологическая фаза (также называемая менингоэнцефалической стадией). [10] ), начинается, когда паразит проникает в центральную нервную систему , проходя через гематоэнцефалический барьер . [9] Переход к неврологической фазе происходит примерно через 21–60 дней в случае T. b. rhodesiens e и 300–500 дней в случае T. b. гамбиенсная инфекция. [10]
На самом деле эти две фазы перекрываются, и их трудно отличить только по клиническим признакам; Определение фактической стадии заболевания достигается путем исследования спинномозговой жидкости на наличие паразита. [10]
Нарушения сна [ править ]
Нарушения сна и бодрствования являются ведущим признаком неврологической стадии. [9] [15] и дали этой болезни общее название «сонная болезнь». [9] [10] [15] У инфицированных людей наблюдается дезорганизованный и фрагментированный цикл сна и бодрствования. [9] У пострадавших наблюдается инверсия сна, приводящая к дневному сну. [9] и сонливость, [10] и ночные периоды бодрствования [9] и бессонница. [10] Кроме того, у пострадавших также наблюдаются эпизоды внезапной сонливости. [10]
/ нейрокогнитивные симптомы Неврологические
Неврологические симптомы включают: тремор , общую мышечную слабость, гемипарез , паралич конечностей, [16] аномальный мышечный тонус, нарушение походки, атаксия, нарушения речи, парестезия, гиперестезия, анестезия, нарушение зрения, аномальные рефлексы, судороги и кома. [10] Паркинсоноподобные движения могут возникать вследствие неспецифических двигательных нарушений и нарушений речи. [16]
/ Психиатрические симптомы поведенческие
У людей могут проявляться психиатрические симптомы, которые иногда могут доминировать в клиническом диагнозе и могут включать агрессивность, апатию , [10] [16] раздражительность, психотические реакции [16] галлюцинации , , тревога , эмоциональная лабильность , спутанность сознания мания , дефицит внимания и делирий . [10]
Поздняя/поздняя стадия исходы и заболевания
Без лечения заболевание всегда приводит к летальному исходу с прогрессирующим ухудшением психического состояния, приводящим к коме, системной недостаточности органов и смерти. Невылеченная инфекция T. b. Rhodesiense приведет к смерти в течение нескольких месяцев [17] тогда как невылеченная инфекция T. b. gambiense приведет к смерти через несколько лет. [18] Повреждения, нанесенные на неврологической фазе, необратимы. [19]
Причина [ править ]
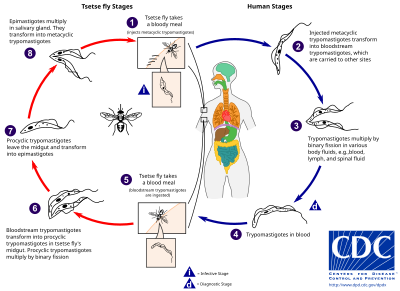
На Trypanosoma brucei gambiense приходится большинство случаев африканского трипаносомоза, при этом человек является основным резервуаром, необходимым для передачи, тогда как Trypanosoma brucei rhodesiense является главным образом зоонозным заболеванием, вызывающим случайное заражение людей. [20] Эпидемиология африканского трипаносомоза зависит от взаимодействия между паразитом (трипаносомой), переносчиком ( мухой цеце ) и хозяином. [20]
Trypanosoma brucei [ править ]
Существует два подвида паразита, которые ответственны за возникновение заболевания у человека. Trypanosoma brucei gambiense вызывает заболевания в западной и центральной Африке , тогда как Trypanosoma brucei rhodesiense имеет ограниченный географический ареал и является причиной заболевания в восточной и южной Африке. Кроме того, третий подвид паразита, известный как Trypanosoma brucei brucei, поражает животных, но не людей. [16]
Человек является основным резервуаром T. b. gambiense , но этот вид также можно обнаружить у свиней и других животных. Дикие животные и крупный рогатый скот являются основным резервуаром T. b. родезийский . Эти паразиты в первую очередь заражают людей в странах Африки к югу от Сахары, поскольку именно там находится переносчик (муха цеце). Две человеческие формы заболевания также сильно различаются по интенсивности. Т. б. gambiense вызывает хроническое заболевание , которое может оставаться в пассивной фазе в течение месяцев или лет, прежде чем появятся симптомы, а инфекция может длиться около трех лет, прежде чем наступит смерть. [16]
Т. б. rhodesiense является острой формой заболевания, и смерть может наступить в течение нескольких месяцев, поскольку симптомы появляются в течение нескольких недель, и он более вирулентен и развивается быстрее, чем T. b. гамбиенсе . Кроме того, трипаносомы окружены оболочкой, состоящей из вариантов поверхностных гликопротеинов (VSG). Эти белки защищают паразита от любых литических факторов, присутствующих в плазме человека. Иммунная система хозяина распознает гликопротеины, присутствующие на оболочке паразита, что приводит к выработке различных антител (IgM и IgG). [16]
Эти антитела затем будут уничтожать паразитов, циркулирующих в крови. Однако из нескольких паразитов, присутствующих в плазме, у небольшого количества из них наблюдаются изменения в поверхностном слое, что приводит к образованию новых VSG. Таким образом, антитела, вырабатываемые иммунной системой, больше не будут распознавать паразита, что приводит к его пролиферации, пока не будут созданы новые антитела для борьбы с новыми VSG. В конце концов, иммунная система больше не сможет бороться с паразитом из-за постоянных изменений ВСГ и возникнет инфекция. [16]
Вектор [ править ]
| Тип | Трипаносома | Распределение | Вектор |
|---|---|---|---|
| Хронический | Т. brucei gambiense | Западная Африка | Г. пальпалис Г. тахиноидес Г. морситанс |
| Острый | Т. brucei rhodesiense | Восточная Африка | Г. морситанс Г. Свиннертони Г. паллидипес Г. фусипес |

( Муха цеце род Glossina ) — крупная коричневая кусающая муха, которая служит одновременно хозяином и переносчиком трипаносомных паразитов . Забирая кровь у млекопитающего-хозяина, инфицированная муха цеце вводит метациклические трипомастиготы в ткани кожи. Из укуса паразиты сначала попадают в лимфатическую систему, а затем попадают в кровь. Внутри млекопитающего-хозяина они трансформируются в трипомастиготы кровотока и переносятся в другие участки тела, достигают других жидкостей организма (например, лимфы, спинномозговой жидкости) и продолжают размножаться путем бинарного деления . [21] [22]
Весь жизненный цикл африканских трипаносом представлен внеклеточными стадиями. Муха цеце заражается трипомастиготами кровотока при приеме крови инфицированного хозяина-млекопитающего. В средней кишке мухи паразиты трансформируются в проциклические трипомастиготы, размножаются бинарным делением, покидают среднюю кишку и превращаются в эпимастиготы. Эпимастиготы достигают слюнных желез мухи и продолжают размножаться путем бинарного деления. [23]
Весь жизненный цикл мухи занимает около трёх недель. Помимо укуса мухи цеце , заболевание может передаваться:
- Передача инфекции от матери ребенку: трипаносома иногда может проникать через плаценту и заражать плод. [24]
- Лаборатории: случайное заражение, например, при обработке крови инфицированного человека и трансплантации органов, хотя это встречается редко.
- Переливание крови
- Сексуальный контакт [25]
Слепни ( Tabanidae ) и конюшни ( Muscidae ), возможно, играют роль в передаче наганы (животной формы сонной болезни) и формы болезни человека. [26]
Патофизиология [ править ]
Триптофол — это химическое соединение, вырабатываемое трипаносомным паразитом при сонной болезни, которое вызывает сон у людей. [27]
Диагностика [ править ]

Золотым стандартом диагностики является выявление трипаносом в образце путем микроскопического исследования. Образцы, которые можно использовать для диагностики, включают язвенную жидкость, аспираты лимфатических узлов, кровь, костный мозг и, на неврологической стадии, спинномозговую жидкость . Обнаружение специфичных к трипаносомам антител можно использовать для диагностики, но чувствительность и специфичность этих методов слишком изменчивы, чтобы их можно было использовать отдельно для клинической диагностики. Далее сероконверсия происходит после появления клинических симптомов во время T. b. rhodesiense , поэтому имеет ограниченное диагностическое применение. [ нужна ссылка ]
Трипаносомы можно обнаружить в образцах с использованием двух разных препаратов. Влажный препарат можно использовать для поиска подвижных трипаносом. Альтернативно фиксированный (высушенный) мазок можно окрасить по методике Гимзы или Филда и исследовать под микроскопом. Часто паразит в образце встречается в относительно небольшом количестве, поэтому перед микроскопическим исследованием можно использовать методы концентрирования паразитов. Для образцов крови они включают центрифугирование с последующим исследованием лейкоцитной пленки ; мини-анионообменник/центрифугирование; и метод количественной лейкоцитарной пленки (QBC). Для других образцов, таких как спинномозговая жидкость, методы концентрирования включают центрифугирование с последующим исследованием осадка. [ нужна ссылка ]
Для обнаружения паразита также доступны три серологических теста: микро-CATT (карточный тест агглютинации на трипаносомоз), wb-CATT и wb-LATEX. В первом используется высушенная кровь, а в двух других — образцы цельной крови. Исследование 2002 года показало, что wb-CATT является наиболее эффективным для диагностики, тогда как wb-LATEX лучше подходит для ситуаций, когда требуется более высокая чувствительность. [28]
Профилактика [ править ]

В настоящее время существует мало медицинских вариантов профилактики африканского трипаносомоза (т.е. не существует вакцины для иммунитета). Хотя риск заражения от укуса мухи цеце незначителен (по оценкам, менее 0,1%), лучше всего использовать средства от насекомых, носить одежду с длинными рукавами, избегать мест с густым скоплением цеце, применять методы расчистки кустарников и отбраковку диких животных. варианты предотвращения заражения доступны для местных жителей пострадавших районов. [16]
В июле 2000 года была принята резолюция о создании Панафриканской кампании по ликвидации цеце и трипаносомоза (ПАТТЕК). Кампания направлена на искоренение популяций переносчиков цеце, а затем и протозойных заболеваний, путем использования мишеней, пропитанных инсектицидами, ловушек для мух, обработанного инсектицидами крупного рогатого скота, опрыскивания сверхмалыми дозами с воздуха/наземных объектов (SAT) мест отдыха цеце и стерильных помещений. техника насекомых (SIT). [30] Использование МСН на Занзибаре оказалось эффективным в уничтожении всей популяции мух цеце, но было дорогостоящим и относительно непрактичным для использования во многих эндемичных странах, пораженных африканским трипаносомозом. [31]
Пилотная программа в Сенегале позволила сократить популяцию мухи цеце на целых 99% за счет внедрения самцов мух, стерилизованных воздействием гамма-лучей . [32] [33]
Регулярный активный надзор, включающий выявление и оперативное лечение новых инфекций, а также борьбу с мухой цеце, является основой стратегии борьбы с сонной болезнью. Систематический скрининг сообществ, подверженных риску, является лучшим подходом, поскольку индивидуальный скрининг нецелесообразен в эндемичных регионах. Систематический скрининг может проводиться в форме мобильных клиник или стационарных скрининговых центров, где бригады ежедневно выезжают в районы с высоким уровнем заражения. Такие усилия по скринингу важны, поскольку ранние симптомы не являются очевидными или достаточно серьезными, чтобы заставить людей с гамбиенсной болезнью обращаться за медицинской помощью, особенно в очень отдаленных районах. Кроме того, диагностика заболевания затруднена, и работники здравоохранения могут не связывать такие общие симптомы с трипаносомозом. Систематический скрининг позволяет выявить заболевание на ранней стадии и начать лечение до его прогрессирования, а также устранить потенциальный резервуар заболевания у человека. [34] Сообщается об одном случае передачи западноафриканской сонной болезни половым путем. [25]
Лечение [ править ]
Первый этап [ править ]
Лечение первой стадии заболевания заключается в приеме фексинидазола внутрь или пентамидина инъекций при T. b. гамбиенсе . [3] Сурамин в виде инъекций применяют при Т. b. родезийский . [3]
Второй этап [ править ]
Фексинидазол можно использовать при второй стадии TbG, если заболевание не тяжелое. [35] [3] В противном случае схема, включающая комбинацию нифуртимокса и эфлорнитина , комбинированное лечение нифуртимоксом и эфлорнитином (NECT) или монотерапию эфлорнитином, оказывается более эффективной и приводит к меньшему количеству побочных эффектов. [36] Эти методы лечения могут заменить меларсопрол , если он доступен. [36] [2] Преимущество НЭКТ заключается в том, что требуется меньше инъекций эфлорнитина. [36]
Внутривенное введение меларсопрола ранее было стандартным лечением второй стадии (неврологической фазы) заболевания и эффективно для обоих типов. [2] Меларсопрол является единственным средством лечения второй стадии T. b. родезийский ; однако он вызывает смерть у 5% людей, принимавших его. [2] Может возникнуть устойчивость к меларсопролу. [2]
Прогноз [ править ]
При отсутствии лечения T. b. gambiense почти всегда приводит к летальному исходу, при этом в долгосрочном 15-летнем наблюдении было показано, что лишь несколько человек выжили после отказа от лечения. Т. б. rhodesiense , являясь более острой и тяжелой формой заболевания, всегда приводит к летальному исходу, если его не лечить. [2]
Прогрессирование заболевания сильно варьирует в зависимости от формы заболевания. Для лиц, инфицированных T. b. gambiense , на которую приходится 92% всех зарегистрированных случаев, человек может быть инфицирован в течение месяцев или даже лет без каких-либо признаков или симптомов до поздней стадии заболевания, когда уже слишком поздно лечиться успешно. Для лиц, пораженных T. b. rhodesiense , на долю которого приходится 2% всех зарегистрированных случаев, симптомы появляются в течение недель или месяцев после заражения. Заболевание прогрессирует быстро и поражает центральную нервную систему, вызывая смерть в течение короткого периода времени. [37]
Эпидемиология [ править ]

В 2010 году от него погибло около 9 000 человек по сравнению с 34 000 в 1990 году. [7] По состоянию на 2000 год количество лет жизни с поправкой на инвалидность (от 9 до 10 лет), потерянных из-за сонной болезни, составило 2,0 миллиона. [39] По оценкам, с 2010 по 2014 год 55 миллионов человек подвергались риску заражения африканским трипаносомозом gambiense и более 6 миллионов человек подвергались риску заражения африканским трипаносомозом родезийского происхождения . [40] В 2014 году Всемирная организация здравоохранения сообщила о 3797 случаях африканского трипаносомоза человека, тогда как прогнозируемое число случаев должно было составлять 5000. Общее число зарегистрированных случаев в 2014 году на 86% меньше общего числа случаев, зарегистрированных в 2000 году. [40]
Заболевание зарегистрировано в 37 странах, все в Африке к югу от Сахары. Он регулярно встречается на юго-востоке Уганды и западной Кении, и в 2008 году от него погибло более 48 000 африканцев. [19] Демократическая Республика Конго является наиболее пораженной страной в мире, на ее долю приходится 75% случаев Trypanosoma brucei gambiense . [20] Население, подверженное риску, составляет около 69 миллионов человек, причем одна треть этого числа относится к группе риска от «очень высокого» до «умеренного», а остальные две трети — от «низкого» до «очень низкого» риска. [5] Число людей, заболевших этим заболеванием, сократилось. При таких темпах ликвидация сонной болезни вполне возможна. Всемирная организация здравоохранения планирует искоренить сонную болезнь к 2030 году. [40] [41]
| Trypanosoma brucei gambiense [42] | 1990 | 1991 | 1992 | 1993 | 1994 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ангола | 1498 | 2094 | 2406 | 1796 | 1274 | 2441 | 6726 | 8275 | 6610 | 5351 | 4546 | 4577 | 3621 | 3115 | 2280 | 1727 | 1105 | 648 | 517 | 247 | 211 | 154 | 70 | 69 | 36 | 35 | 19 | 18 | 79 | 30 | 33 | 174 | 44 |
| Бенин | 0 | 0 | 2 | 1 | 0 | 0 | 0 | 0 | 0 | 20 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Буркина-Фасо | 27 | 27 | 20 | 17 | 18 | 13 | 12 | 1 | 15 | 15 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Камерун | 86 | 69 | 21 | 3 | 20 | 21 | 17 | 10 | 54 | 32 | 27 | 14 | 32 | 33 | 17 | 3 | 15 | 7 | 13 | 24 | 16 | 15 | 7 | 6 | 7 | 6 | 6 | 5 | 7 | 17 | 2 | 11 | 7 |
| Центральноафриканская Республика | 308 | 197 | 362 | 262 | 368 | 676 | 492 | 730 | 1068 | 869 | 988 | 718 | 572 | 539 | 738 | 666 | 460 | 654 | 1194 | 1054 | 395 | 132 | 381 | 59 | 194 | 147 | 124 | 76 | 57 | 86 | 39 | 44 | 110 |
| Чад | 20 | 221 | 149 | 65 | 214 | 315 | 178 | 122 | 134 | 187 | 153 | 138 | 715 | 222 | 483 | 190 | 276 | 97 | 196 | 510 | 232 | 276 | 197 | 195 | 95 | 67 | 53 | 28 | 12 | 16 | 17 | 15 | 18 |
| Конго | 580 | 703 | 727 | 829 | 418 | 475 | 474 | 142 | 201 | 91 | 111 | 894 | 1005 | 717 | 873 | 398 | 300 | 189 | 182 | 87 | 87 | 61 | 39 | 20 | 21 | 36 | 18 | 15 | 24 | 17 | 15 | 18 | 10 |
| Кот-д'Ивуар | 365 | 349 | 456 | 260 | 206 | 326 | 240 | 185 | 121 | 104 | 188 | 92 | 97 | 68 | 74 | 42 | 29 | 13 | 14 | 8 | 8 | 10 | 9 | 7 | 6 | 3 | 0 | 3 | 2 | 1 | 0 | 1 | 0 |
| Демократическая Республика Конго | 7515 | 5825 | 7757 | 11384 | 19021 | 18182 | 19342 | 25094 | 26318 | 18684 | 16951 | 17300 | 13816 | 11459 | 10339 | 10249 | 8013 | 8155 | 7318 | 7178 | 5624 | 5590 | 5968 | 5647 | 3205 | 2351 | 1769 | 1110 | 660 | 604 | 395 | 425 | 516 |
| Экваториальная Гвинея | 63 | 36 | 45 | 30 | 85 | 37 | 46 | 67 | 62 | 28 | 16 | 17 | 32 | 23 | 22 | 17 | 13 | 15 | 11 | 7 | 8 | 1 | 2 | 3 | 0 | 0 | 3 | 4 | 4 | 3 | 1 | 3 | 13 |
| Габон | 80 | 45 | 33 | 80 | 61 | 20 | 32 | 11 | 6 | 38 | 45 | 30 | 26 | 26 | 49 | 53 | 31 | 30 | 24 | 14 | 22 | 17 | 9 | 17 | 10 | 9 | 10 | 9 | 16 | 8 | 11 | 18 | 21 |
| Гана | 3 | 6 | 16 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Гвинея | 52 | 29 | 24 | 27 | 26 | 33 | 38 | 88 | 99 | 68 | 52 | 72 | 132 | 130 | 95 | 94 | 48 | 69 | 90 | 79 | 68 | 57 | 70 | 78 | 33 | 29 | 107 | 140 | 74 | 69 | 36 | 28 | 30 |
| У них было | 0 | 0 | 0 | 27 | 17 | 11 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Нигерия | 24 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 27 | 14 | 14 | 26 | 31 | 10 | 21 | 3 | 0 | 0 | 0 | 2 | 3 | 2 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | 0 | 0 |
| Южный Судан | 67 | 58 | 28 | 62 | 69 | 56 | 157 | 737 | 1726 | 1312 | 1801 | 1919 | 3121 | 3061 | 1742 | 1853 | 789 | 469 | 623 | 373 | 199 | 272 | 317 | 117 | 63 | 45 | 17 | 12 | 17 | 11 | 15 | 10 | 30 |
| Togo | 2 | 0 | 0 | 0 | 0 | 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Уганда | 2066 | 1328 | 2042 | 1764 | 1469 | 1062 | 981 | 1123 | 971 | 1036 | 948 | 310 | 604 | 517 | 378 | 311 | 290 | 120 | 198 | 99 | 101 | 44 | 20 | 9 | 9 | 4 | 4 | 0 | 1 | 2 | 1 | 0 | 0 |
| Общий | 12756 | 10987 | 14088 | 16607 | 23266 | 23671 | 28736 | 36585 | 37385 | 27862 | 25841 | 26095 | 23799 | 19941 | 17100 | 15624 | 11372 | 10466 | 10380 | 9680 | 6973 | 6632 | 7091 | 6228 | 3679 | 2733 | 2131 | 1420 | 953 | 864 | 565 | 747 | 799 |
| Trypanosoma brucei rhodesiense [43] | 1990 | 1991 | 1992 | 1993 | 1994 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | 2021 | 2022 |
| Эфиопия | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | 6 |
| Кения | 91 | 8 | 4 | 2 | 1 | 0 | 2 | 5 | 14 | 22 | 15 | 10 | 11 | 0 | 0 | 0 | 1 | 0 | 0 | 1 | 0 | 0 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Малави | 228 | 195 | 143 | 53 | 31 | 15 | 8 | 7 | 10 | 11 | 35 | 38 | 43 | 70 | 48 | 41 | 58 | 50 | 49 | 39 | 29 | 23 | 18 | 35 | 32 | 30 | 37 | 7 | 15 | 91 | 89 | 49 | 24 |
| Мозамбик | 3 | 7 | 24 | 10 | 16 | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | 1 | Нет данных | 1 | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных |
| Уганда | 1417 | 832 | 606 | 503 | 342 | 497 | 178 | 217 | 283 | 283 | 300 | 426 | 329 | 338 | 335 | 473 | 261 | 119 | 138 | 129 | 112 | 84 | 71 | 43 | 70 | 28 | 10 | 13 | 4 | 5 | 2 | 2 | 0 |
| Объединенная Республика Танзания | 187 | 177 | 366 | 262 | 319 | 422 | 400 | 354 | 299 | 288 | 350 | 277 | 228 | 113 | 159 | 186 | 127 | 126 | 59 | 14 | 5 | 1 | 4 | 1 | 1 | 2 | 3 | 3 | 0 | 3 | 1 | 1 | 1 |
| Замбия | 7 | Нет данных | 4 | 1 | 1 | 1 | 3 | Нет данных | Нет данных | 15 | 9 | 4 | 5 | 15 | 9 | 7 | 6 | 10 | 13 | 4 | 8 | 3 | 6 | 6 | 12 | 8 | 2 | 3 | 5 | 15 | 6 | 3 | 7 |
| Зимбабве | Нет данных | Нет данных | Нет данных | Нет данных | 1 | Нет данных | Нет данных | 9 | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | Нет данных | 3 | Нет данных | Нет данных | 0 | 3 | 2 | 4 | 9 | 1 | 3 | 3 | 1 | 1 | 0 | 2 | 0 | 0 | 0 |
| Общий | 1933 | 1219 | 1147 | 831 | 710 | 935 | 591 | 583 | 606 | 619 | 709 | 755 | 617 | 536 | 552 | 707 | 453 | 305 | 259 | 187 | 154 | 111 | 101 | 85 | 115 | 68 | 52 | 27 | 24 | 116 | 98 | 55 | 38 |
История [ править ]

Это заболевание присутствовало в Африке на протяжении тысячелетий. [44] Из-за отсутствия поездок между коренными народами сонная болезнь у людей ограничивалась изолированными очагами. Ситуация изменилась после того, как арабские работорговцы проникли в Центральную Африку с востока по реке Конго , принося с собой паразитов. Гамбийская сонная болезнь распространилась вверх по реке Конго, а затем дальше на восток. [45]
Арабский писатель XIV века оставил следующее описание случая султана Королевства Мали: «Его конец должна была настичь сонная болезнь ( иллат ан-наум ), болезнь, которая часто постигает жителей этих земель. стран, особенно их вождей, сон охватывает одного из них так, что его едва ли можно разбудить». [45]
Британский военно-морской хирург Джон Аткинс описал болезнь по возвращении из Западной Африки в 1734 году: [45]
Сонная чума (распространенная среди негров) не дает никаких других предварительных признаков, кроме отсутствия аппетита за 2 или 3 дня до этого; их сны крепки, а чувства и чувства очень слабы; ибо тяга, избиение или порка едва ли пробудят в нем достаточно Чувства и Силы, чтобы двигаться; и тот момент, когда вы перестаете бить язвы, забывается, и они снова впадают в состояние нечувствительности, постоянно вытекая изо рта, как при глубоком слюноотделении; дышите медленно, но не неровно и не фыркайте. Молодые люди более подвержены этому, чем пожилые; и приговор, обычно выносимый, — это Смерть, а Прогностик редко терпит неудачу. Если время от времени кто-нибудь из них выздоравливает, он наверняка теряет тот маленький Разум, который у него был, и превращается в Идеота...
Французский военно-морской хирург Мари-Теофиль Грифон дю Белле лечила и описывала случаи, находясь на борту госпитального корабля «Караван» в Габоне в конце 1860-х годов. [46]
разразилась разрушительная эпидемия В 1901 году в Уганде , унесшая жизни более 250 000 человек. [47] включая около двух третей населения пострадавших прибрежных территорий. Согласно «Кембриджской истории Африки» : «Подсчитано, что до половины населения умерло от сонной болезни и оспы на землях по обоим берегам нижнего течения реки Конго ». [48]
Возбудитель и переносчик были идентифицированы в 1903 году Дэвидом Брюсом , а подвиды простейших были дифференцированы в 1910 году. Ранее Брюс показал, что T. brucei является причиной аналогичного заболевания у лошадей и крупного рогатого скота, которое передается мухой цеце. ( Glossina morsitans ). [45]
Первое эффективное лечение, атоксил , препарат на основе мышьяка , разработанный Паулем Эрлихом и Киёси Сигой , был представлен в 1910 году, но серьезным побочным эффектом была слепота.
Сурамин был впервые синтезирован Оскаром Дресселем и Ричардом Коте в 1916 году для компании Bayer . Его ввели в 1920 году для лечения первой стадии заболевания. К 1922 году сурамин обычно комбинировали с трипарсамидом (еще одним пятивалентным мышьякорганическим препаратом), первым препаратом, который проник в нервную систему и был полезен при лечении второй стадии формы gambiense. О трипарсамиде было объявлено в Журнале экспериментальной медицины в 1919 году, и он был протестирован в Бельгийском Конго Луизой Пирс из Института Рокфеллера в 1920 году. Он использовался во время великой эпидемии в Западной и Центральной Африке на миллионах людей и был основой терапии до тех пор, пока 1960-е годы. [49] Американский медицинский миссионер Артур Льюис Пайпер активно использовал трипарсамид для лечения сонной болезни в Бельгийском Конго в 1925 году. [50]
Пентамидин — высокоэффективный препарат для первой стадии заболевания, применяется с 1937 года. [51] В 1950-е годы он широко использовался в качестве профилактического средства в Западной Африке, что привело к резкому снижению уровня инфицирования. В то время считалось, что искоренение этой болезни уже близко. [ нужна ссылка ] [52]
Мышьякоорганический меларсопрол (Арсобал), разработанный в 1940-х годах, эффективен для людей со второй стадией сонной болезни. Однако у 3–10% инъецированных развивается реактивная энцефалопатия (судороги, прогрессирующая кома или психотические реакции), а 10–70% таких случаев заканчиваются смертью; это может вызвать повреждение головного мозга у тех, кто перенес энцефалопатию. Однако благодаря своей эффективности меларсопрол используется до сих пор. Резистентность к меларсопролу растет, и в настоящее время исследуются комбинированная терапия с нифуртимоксом. [ нужна ссылка ]
Эфлорнитин (дифторметилорнитин или ДФМО), самый современный метод лечения, был разработан в 1970-х годах Альбертом Сьердсмой и прошел клинические испытания в 1980-х годах. США Препарат был одобрен Управлением по контролю за продуктами и лекарствами в 1990 году. [53] Aventis , компания, ответственная за его производство, прекратила производство в 1999 году. В 2001 году Aventis совместно с Médecins Sans Frontières и Всемирной организацией здравоохранения подписала долгосрочное соглашение о производстве и безвозмездной передаче препарата. [ нужна ссылка ]
Помимо сонной болезни, предыдущие названия включали негритянскую летаргию, maladie du sommeil (Франция), Schlafkrankheit (Германия), африканскую летаргию, [54] и конголезский трипаносомоз. [54] [55]
- под руководством Великобритании Комиссия по сонной болезни собирала мух цеце, Уганда и Ньясаленд , 1908–1913 гг.
Исследования [ править ]
Геном паразита был секвенирован , и несколько белков были идентифицированы как потенциальные мишени для медикаментозного лечения. Анализ генома также выявил причину, по которой создание вакцины от этой болезни оказалось столь трудным. T. brucei имеет более 800 генов, которые заставляют белки паразита «смешиваться и сочетаться», чтобы избежать обнаружения иммунной системой. [56]
Использование генетически модифицированной формы бактерии, которая естественным образом встречается в кишечнике переносчиков, изучается как метод борьбы с заболеванием. [57]
Недавние открытия показывают, что паразит не способен выжить в кровотоке без жгутика . Это понимание дает исследователям новый подход к атаке на паразита. [58]
Вакцины против трипаносомоза находятся на стадии исследований.
Кроме того, Инициатива «Лекарства от забытых болезней» внесла свой вклад в исследования африканской сонной болезни, разработав соединение под названием фексинидазол . Этот проект был первоначально начат в апреле 2007 года, и в нем приняли участие 749 человек в ДРК и Центральноафриканской Республике . Результаты показали эффективность и безопасность на обеих стадиях заболевания как у взрослых, так и у детей ≥ 6 лет и массой ≥ 20 кг. [59] Европейское агентство лекарственных средств одобрило его для лечения заболеваний первой и второй стадии за пределами Европы в ноябре 2018 года. [60] Лечение было одобрено в ДРК в декабре 2018 года. [61]
Финансирование [ править ]
Согласно текущей статистике финансирования, африканский трипаносомоз человека отнесен к группе кинетопластидных инфекций. Кинетопластиды относятся к группе жгутиковых простейших. [62] К кинетопластидным инфекциям относятся африканская сонная болезнь, болезнь Шагаса и лейшманиоз. В совокупности на эти три заболевания приходится 4,4 миллиона лет жизни с поправкой на инвалидность (DALY) и дополнительно 70 075 регистрируемых смертей ежегодно. [62] В отношении кинетопластидных инфекций общее глобальное финансирование исследований и разработок в 2012 году составило примерно 136,3 миллиона долларов США. На каждое из трех заболеваний: африканскую сонную болезнь, болезнь Шагаса и лейшманиоз, каждое получило примерно треть финансирования, которое составило около 36,8 миллиона долларов США. , 38,7 миллиона долларов США и 31,7 миллиона долларов США соответственно. [62]
В случае сонной болезни финансирование было разделено на фундаментальные исследования, разработку лекарств, вакцины и диагностику. Наибольший объем финансирования был направлен на фундаментальные исследования болезни; На эти усилия было направлено около 21,6 миллиона долларов США. Что касается терапевтических разработок, то было инвестировано около $10,9 млн. [62]
Основным спонсором исследований и разработок кинетопластидной инфекции являются государственные источники. Около 62% финансирования поступает из стран с высоким уровнем дохода, а 9% — из стран с низким и средним уровнем дохода. Государственное финансирование стран с высоким уровнем дохода вносит наибольший вклад в исследования забытых болезней. Однако в последние годы финансирование со стороны стран с высоким уровнем дохода неуклонно снижается; в 2007 году страны с высоким уровнем дохода предоставили 67,5% общего финансирования, тогда как в 2012 году государственные фонды стран с высоким уровнем дохода предоставили только 60% общего финансирования кинетопластидных инфекций. Эта тенденция к снижению оставляет пробел для заполнения другими спонсорами, такими как благотворительные фонды и частные фармацевтические компании. [62]
Большая часть прогресса, достигнутого в исследованиях африканской сонной болезни и забытых болезней в целом, является результатом деятельности других негосударственных спонсоров. Одним из этих основных источников финансирования являются фонды, которые в 21 веке все более активно занимаются открытием лекарств от забытых болезней. В 2012 году благотворительные источники обеспечили 15,9% от общего объема финансирования. [62] Фонд Билла и Мелинды Гейтс является лидером в предоставлении финансирования для разработки лекарств от забытых болезней . В 2012 году они выделили 444,1 миллиона долларов США на исследования забытых болезней. На сегодняшний день они пожертвовали более 1,02 миллиарда долларов США на усилия по обнаружению забытых болезней. [63]
В частности, на кинетопластидные инфекции они жертвовали в среднем 28,15 миллионов долларов США ежегодно в период с 2007 по 2011 год. [62] Они назвали африканский трипаносомоз человека мишенью с высокими возможностями, что означает, что это болезнь, которая предоставляет величайшие возможности для контроля, ликвидации и искоренения посредством разработки новых лекарств, вакцин, программ общественного здравоохранения и диагностики. Они являются вторым по величине источником финансирования забытых заболеваний после Национальных институтов здравоохранения США. [62] В то время, когда государственное финансирование сокращается, а правительственные гранты на научные исследования получить сложнее, филантропический мир вмешался, чтобы продвинуть исследования вперед. [ нужна ссылка ]
Еще одним важным компонентом возросшего интереса и финансирования стала промышленность. В 2012 году они внесли 13,1% общего вклада в исследования и разработки кинетопластидов, а также сыграли важную роль, внося вклад в государственно-частное партнерство (ГЧП), а также в партнерства по разработке продуктов (PDP). [62] Государственно-частное партнерство – это соглашение между одной или несколькими государственными организациями и одной или несколькими частными организациями, существующее для достижения конкретных результатов в области здравоохранения или производства продукции медицинского назначения. Партнерство может существовать по-разному; они могут делиться и обмениваться средствами, имуществом, оборудованием, человеческими ресурсами и интеллектуальной собственностью. Эти государственно-частные партнерства и партнерства по разработке продуктов были созданы для решения проблем в фармацевтической промышленности, особенно связанных с исследованиями забытых болезней. Эти партнерства могут помочь увеличить масштабы усилий по развитию терапии за счет использования различных знаний, навыков и опыта из разных источников. Было доказано, что такие типы партнерства более эффективны, чем независимые отраслевые или общественные группы. [64]
и животные водоем Другие
Трипаносомы как родезийского , так и gambiense типов могут поражать других животных, например, крупный рогатый скот и диких животных. [1] Африканский трипаносомоз обычно считался антропонозным заболеванием, и поэтому программа борьбы с ним была в основном сосредоточена на прекращении передачи заболевания путем лечения случаев заболевания людей и уничтожения переносчика. Однако сообщалось, что животные-резервуары, возможно, играют важную роль в эндемическом характере африканского трипаносомоза и в его возрождении в исторических очагах Западной и Центральной Африки. [65] [66]
Ссылки [ править ]
- ^ Jump up to: Перейти обратно: а б с д и ж г час я Медиа-центр ВОЗ (март 2014 г.). «Информационный бюллетень № 259: Трипаносомоз африканского человека (сонная болезнь)» . Всемирная организация здравоохранения . Архивировано из оригинала 26 апреля 2014 года . Проверено 25 апреля 2014 г.
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л м Кеннеди П.Г. (февраль 2013 г.). «Клинические особенности, диагностика и лечение африканского трипаносомоза человека (сонной болезни)». «Ланцет». Неврология . 12 (2): 186–194. дои : 10.1016/S1474-4422(12)70296-X . ПМИД 23260189 . S2CID 8688394 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т «Трипаносомоз человека африканский (сонная болезнь)» . www.who.int . Проверено 14 мая 2020 г.
- ^ Jump up to: Перейти обратно: а б Ван Х., Нагави М., Аллен С., Барбер Р.М., Бхутта З.А., Картер А. и др. (GBD 2015 Смертность и причины смерти, сотрудники) (октябрь 2016 г.). «Глобальная, региональная и национальная продолжительность жизни, смертность от всех причин и смертность от конкретных причин по 249 причинам смерти, 1980-2015 гг.: систематический анализ для исследования глобального бремени болезней 2015 г.» . Ланцет . 388 (10053): 1459–1544. дои : 10.1016/s0140-6736(16)31012-1 . ПМЦ 5388903 . ПМИД 27733281 .
- ^ Jump up to: Перейти обратно: а б Симарро П.П., Чекки Г., Франко Дж.Р., Паоне М., Диарра А., Руис-Постиго Дж.А. и др. (2012). «Оценка и картирование населения, подверженного риску сонной болезни» . PLOS Забытые тропические болезни . 6 (10): e1859. дои : 10.1371/journal.pntd.0001859 . ПМЦ 3493382 . ПМИД 23145192 .
- ^ Вос Т., Аллен С., Арора М., Барбер Р.М., Бхутта З.А., Браун А. и др. (Сотрудники ГББ 2015 г. по заболеваемости и распространенности заболеваний и травм) (октябрь 2016 г.). «Глобальная, региональная и национальная заболеваемость, распространенность и продолжительность жизни с инвалидностью по 310 заболеваниям и травмам, 1990–2015 гг.: систематический анализ для исследования глобального бремени болезней 2015 г.» . Ланцет . 388 (10053): 1545–1602. дои : 10.1016/S0140-6736(16)31678-6 . ПМК 5055577 . ПМИД 27733282 .
- ^ Jump up to: Перейти обратно: а б Лозано Р., Нагави М., Форман К., Лим С., Сибуя К., Абоянс В. и др. (декабрь 2012 г.). «Глобальная и региональная смертность от 235 причин смерти в 20 возрастных группах в 1990 и 2010 годах: систематический анализ для исследования глобального бремени болезней 2010 года» . Ланцет . 380 (9859): 2095–2128. дои : 10.1016/S0140-6736(12)61728-0 . hdl : 10536/DRO/DU:30050819 . ПМЦ 10790329 . ПМИД 23245604 . S2CID 1541253 .
- ^ «Забытые тропические болезни» . cdc.gov . 6 июня 2011 года. Архивировано из оригинала 4 декабря 2014 года . Проверено 28 ноября 2014 г.
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к Лундквист ГБ, Кристенсон К, Бентивольо М (август 2004 г.). «Почему трипаносомы вызывают сонную болезнь». Физиология . 19 (4): 198–206. дои : 10.1152/физиол.00006.2004 . ПМИД 15304634 . S2CID 17844506 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т «CDC – Африканский трипаносомоз – болезнь» . www.cdc.gov . 28 апреля 2020 г. Проверено 11 августа 2020 г. .
- ^ Jump up to: Перейти обратно: а б с Кеннеди П.Г., Роджерс Дж. (25 января 2019 г.). «Клинические и нейропатогенетические аспекты африканского трипаносомоза человека» . Границы в иммунологии . 10:39 . дои : 10.3389/fimmu.2019.00039 . ПМЦ 6355679 . ПМИД 30740102 .
- ^ Jump up to: Перейти обратно: а б «CDC — Африканский трипаносомоз — Общая информация — Часто задаваемые вопросы о восточноафриканском трипаносомозе» . www.cdc.gov . 22 апреля 2019 г. Проверено 11 августа 2020 г. .
- ^ Гомес-Хуньент Дж., Пинасо М.Дж., Кастро П., Фернандес С., Мас Дж., Чагуаседа С. и др. (март 2017 г.). «Африканский трипаносомоз человека у испанского путешественника, возвращающегося из Танзании» . PLOS Забытые тропические болезни . 11 (3): e0005324. дои : 10.1371/journal.pntd.0005324 . ПМЦ 5373517 . ПМИД 28358876 .
- ^ Jump up to: Перейти обратно: а б Пол М., Стефаниак Дж., Смушкевич П., Ван Эсбрук М., Гейсен Д., Клеринкс Дж. (февраль 2014 г.). «Исход острого восточноафриканского трипаносомоза у польского путешественника, принимавшего пентамидин» . БМК Инфекционные болезни . 14 :111. дои : 10.1186/1471-2334-14-111 . ПМЦ 3941560 . ПМИД 24571399 .
- ^ Jump up to: Перейти обратно: а б Максфилд Л., Бермудес Р. (2020). «Трипаносомоз (Трипансомоз)» . СтатПерлс . Остров сокровищ (Флорида): StatPearls Publishing. ПМИД 30571034 . Проверено 11 августа 2020 г. .
- ^ Jump up to: Перейти обратно: а б с д и ж г час я Брун Р., Блюм Дж., Шаппюи Ф., Бурри С. (январь 2010 г.). «Африканский трипаносомоз человека». Ланцет . 375 (9709): 148–159. дои : 10.1016/S0140-6736(09)60829-1 . hdl : 10144/114145 . ПМИД 19833383 . S2CID 39433996 .
- ^ «Часто задаваемые вопросы о восточноафриканском трипаносомозе» . Паразиты — африканский трипаносомоз (также известный как сонная болезнь) . Центры по контролю и профилактике заболеваний. 29 августа 2012 г. Архивировано из оригинала 11 июля 2017 г.
- ^ «Часто задаваемые вопросы о западноафриканском трипаносомозе» . Паразиты – африканский трипаносомоз (также известный как сонная болезнь) . Центры по контролю и профилактике заболеваний. 29 августа 2012 г. Архивировано из оригинала 19 июня 2017 г.
- ^ Jump up to: Перейти обратно: а б «Уганда: Сонная болезнь достигает тревожного уровня» . Новое видение . 11 мая 2008 г. Архивировано из оригинала 21 мая 2008 г.
- ^ Jump up to: Перейти обратно: а б с Франко-младший, Симарро П.П., Диарра А., Джаннин Дж.Г. (2014). «Эпидемиология африканского трипаносомоза человека» . Клиническая эпидемиология . 6 : 257–275. дои : 10.2147/CLEP.S39728 . ПМК 4130665 . ПМИД 25125985 .
- ^ Джамабо М., Махлалела М., Эдкинс А.Л., Бошофф А. (август 2023 г.). «Борьба с сонной болезнью: современные и перспективные методы лечения и стратегии лечения» . Международный журнал молекулярных наук . 24 (15): 12529. doi : 10.3390/ijms241512529 . ПМК 10420020 . ПМИД 37569903 .
- ^ Вамвири Ф.Н., Чангаси Р.Э. (2016). «Мухи цеце (Glossina) как переносчики африканского трипаносомоза человека: обзор» . БиоМед Исследования Интернэшнл . 2016 : 6201350. дои : 10.1155/2016/6201350 . ПМЦ 4789378 . ПМИД 27034944 .
- ^ «Трипаносомоз африканский» . CDC . 8 июня 2018 года . Проверено 18 июня 2024 г.
- ^ Олове С.А. (1975). «Случай врожденного трипаносомоза в Лагосе». Труды Королевского общества тропической медицины и гигиены . 69 (1): 57–59. дои : 10.1016/0035-9203(75)90011-5 . ПМИД 1170654 .
- ^ Jump up to: Перейти обратно: а б Роча Г., Мартинс А., Гама Г., Брандао Ф., Атугия Дж. (январь 2004 г.). «Возможны случаи половой и врожденной передачи сонной болезни». Ланцет . 363 (9404): 247. doi : 10.1016/S0140-6736(03)15345-7 . ПМИД 14738812 . S2CID 5311361 .
- ^ Черенет Т., Сани Р.А., Панандам Дж.М., Надзр С., Спейбрук Н., ван ден Босше П. (декабрь 2004 г.). «Сезонная распространенность трипаносомоза крупного рогатого скота в зоне, зараженной цеце, и зоне, свободной от цеце, в регионе Амхара, на северо-западе Эфиопии» . Журнал ветеринарных исследований Ондерстепоорта . 71 (4): 307–312. дои : 10.4102/ojvr.v71i4.250 . ПМИД 15732457 .
- ^ Корнфорд Э.М., Бокаш В.Д., Браун Л.Д., Крейн П.Д., Ольдендорф В.Х., Макиннис А.Дж. (июнь 1979 г.). «Быстрое распределение триптофола (3-индол-этанола) в мозг и другие ткани» . Журнал клинических исследований . 63 (6): 1241–1248. дои : 10.1172/JCI109419 . ПМК 372073 . ПМИД 447842 .
- ^ Трук П., Лежон В., Магнус Е., Жамонно В., Нангума А., Верлоо Д. и др. (2002). «Оценка методов микро-CATT, CATT/Trypanosoma brucei gambiense и LATEX/T b gambiense для серодиагностики и надзора за африканским трипаносомозом человека в Западной и Центральной Африке» . Бюллетень Всемирной организации здравоохранения . 80 (11): 882–886. ПМК 2567684 . ПМИД 12481210 . Архивировано из оригинала 19 сентября 2011 года.
- ^ Райайс Дж.Б., Салоу Э., Куртин Ф., Йони В., Барри И., Дофини Ф. и др. (апрель 2015 г.). «Лодки с наживкой: инновационный способ борьбы с речной цеце, переносчиками сонной болезни в Западной Африке» . Паразиты и переносчики . 8 : 236. дои : 10.1186/s13071-015-0851-0 . ПМЦ 4436790 . ПМИД 25928366 .
- ^ Шофилд CJ, Кабайо JP (август 2008 г.). «Борьба с переносчиками трипаносомоза в Африке и Латинской Америке» . Паразиты и переносчики . 1 (1): 24. дои : 10.1186/1756-3305-1-24 . ПМК 2526077 . ПМИД 18673535 .
- ^ Брун Р., Блюм Дж., Шаппюи Ф., Бурри С. (январь 2010 г.). «Африканский трипаносомоз человека» . Ланцет . 375 (9709): 148–159. дои : 10.1016/S0140-6736(09)60829-1 . hdl : 10144/114145 . ПМИД 19833383 . S2CID 39433996 . Архивировано из оригинала (PDF) 27 августа 2021 года . Проверено 25 сентября 2019 г.
См. стр. 154–5.
- ^ Пакет D (31 мая 2019 г.). «Финансируемый США ядерный проект по уничтожению мухи-убийцы спасает коров Западной Африки» . Вашингтон Пост . Проверено 1 июня 2019 г.
- ^ «Проект по искоренению мухи цеце в Сенегале получил награду за лучшие практики устойчивого развития» . МАГАТЭ . 23 июля 2015 года . Проверено 16 ноября 2021 г.
- ^ «Стратегическое направление исследований африканского трипаносомоза» . Специальная программа исследований и подготовки кадров в области тропических болезней . Архивировано из оригинала 22 марта 2006 года . Проверено 1 марта 2006 г.
- ^ «Фексинидазол, первое пероральное средство от сонной болезни, одобренное в Демократической Республике Конго – DNDi» . www.dndi.org . 29 января 2019 года . Проверено 4 ноября 2019 г.
- ^ Jump up to: Перейти обратно: а б с Лютье В., Сейшас Дж., Кеннеди А. (июнь 2013 г.). «Химиотерапия африканского трипаносомоза человека второй стадии» . Кокрановская база данных систематических обзоров . 2013 (6): CD006201. дои : 10.1002/14651858.CD006201.pub3 . ПМК 6532745 . ПМИД 23807762 .
- ^ «Трипаносомоз человека африканский (сонная болезнь)» . Всемирная организация здравоохранения. Март 2014 г. Архивировано из оригинала 26 апреля 2014 г.
- ↑ Данные и статистика ВОЗ о смертности и здоровье. Архивировано 16 января 2013 г. на Wayback Machine , по состоянию на 10 февраля 2009 г.
- ^ Всемирная организация здравоохранения (Женева) (2000 г.). Доклад о состоянии здравоохранения в мире, 2000 г.: Повышение эффективности систем здравоохранения (Отчет). Архивировано из оригинала 22 марта 2006 года.
- ^ Jump up to: Перейти обратно: а б с Франко Дж.Р., Чекки Г., Приотто Г., Паоне М., Диарра А., Граут Л. и др. (май 2017 г.). «Мониторинг ликвидации африканского трипаносомоза человека: обновленная информация к 2014 году» . PLOS Забытые тропические болезни . 11 (5): e0005585. дои : 10.1371/journal.pntd.0005585 . ПМК 5456402 . ПМИД 28531222 .
- ^ Всемирная организация здравоохранения. (2020). [Отчет третьего совещания заинтересованных сторон ВОЗ по ликвидации африканского трипаносомоза человека gambiense: Женева, 18–20 апреля 2018 г. [1]

- ^ «Количество новых зарегистрированных случаев (Tb gambiense)» . Всемирная организация здравоохранения . 19 июня 2023 г. Проверено 27 июня 2023 г.
- ^ «Количество новых зарегистрированных случаев (Tb rhodesiense)» . Всемирная организация здравоохранения . 19 июня 2023 г. Проверено 27 июня 2023 г.
- ^ Стевердинг Д. (февраль 2008 г.). «История африканского трипаносомоза» . Паразиты и переносчики . 1 (1): 3. дои : 10.1186/1756-3305-1-3 . ПМК 2270819 . ПМИД 18275594 .
- ^ Jump up to: Перейти обратно: а б с д Крепкий РП (1944). Диагностика, профилактика и лечение тропических болезней Ститта (Седьмое изд.). Йорк, Пенсильвания: Компания Blakiston. п. 165.
- ^ Февр Э.М., Коулман П.Г., Уэлберн СК, Модлин I (апрель 2004 г.). «Повторный анализ эпидемии сонной болезни 1900-1920 годов в Уганде» . Новые инфекционные заболевания . 10 (4): 567–573. дои : 10.3201/eid1004.020626 . ПМИД 15200843 .
- ^ Фадж Дж.Д. (5 сентября 1985 г.). Кембриджская история Африки: с древнейших времен до ок. 500 г. до н.э. Издательство Кембриджского университета. п. 748. ИСБН 978-0-521-22803-9 . Архивировано из оригинала 18 марта 2015 года.
- ^ Стивединг Д. (март 2010 г.). «Разработка препаратов для лечения сонной болезни: исторический обзор» . Паразиты и переносчики . 3 (1): 15. дои : 10.1186/1756-3305-3-15 . ПМК 2848007 . ПМИД 20219092 .
- ^ Клингман Дж. Д. (апрель 1994 г.). «Артур Льюис Пайпер, доктор медицинских наук: медицинский миссионер в Бельгийском Конго». Журнал общественного здравоохранения . 19 (2): 125–146. дои : 10.1007/BF02260364 . ПМИД 8006209 . S2CID 37502216 . Интернет-архив периодических изданий по состоянию на 15 октября 2013 г.
- ^ Мэгилл Эй Джей (2012). «Лейшманиоз» . В Мэгилле А.Дж., Стрикленде Г.Т., Магуайре Дж.Х., Райане Э.Т., Соломоне Т. (ред.). Тропическая медицина Хантера и новые инфекционные заболевания (9-е изд.). Elsevier Науки о здоровье. п. 723. ИСБН 978-1455740437 .
- ^ Стивединг Д. (март 2010 г.). «Разработка препаратов для лечения сонной болезни: исторический обзор» . Паразиты и переносчики . 3 (1): 15. дои : 10.1186/1756-3305-3-15 . ПМК 2848007 . ПМИД 20219092 .
- ^ Хеллгрен У., Эрикссон О., АденАбди Ю., Густафссон Л.Л. (20 мая 2003 г.). «Эфлорнитин» . Справочник лекарств от тропических паразитарных инфекций . ЦРК Пресс. п. 60. ИСБН 9780203211519 .
- ^ Jump up to: Перейти обратно: а б Робинсон, Виктор, изд. (1939). «Африканская летаргия, сонная болезнь или конголезский трипаносомоз; Trypanosoma gambiense». Современный домашний врач, Новая энциклопедия медицинских знаний . ВМ. Х. Уайз и компания (Нью-Йорк). , стр. 20–21.
- ^ Крепкий РП (1944). Диагностика, профилактика и лечение тропических болезней Ститта (Седьмое изд.). Йорк, Пенсильвания: Компания Blakiston. п. 164.
- ^ Берриман М., Гедин Э., Герц-Фаулер С., Бландин Г., Рено Х., Бартоломеу Д.С. и др. (июль 2005 г.). «Геном африканской трипаносомы Trypanosoma brucei». Наука . 309 (5733): 416–422. Бибкод : 2005Sci...309..416B . дои : 10.1126/science.1112642 . ПМИД 16020726 . S2CID 18649858 .
- ^ Дудумис В., Алам У., Аксой Э., Абд-Алла А.М., Циамис Г., Брелсфоард С. и др. (март 2013 г.). «Симбиоз цеце-вольбахии: достигает совершеннолетия и имеет большой потенциал для борьбы с вредителями и болезнями» . Журнал патологии беспозвоночных . 112 Приложение: S94-103. дои : 10.1016/j.jip.2012.05.010 . ПМЦ 3772542 . ПМИД 22835476 .
- ^ «Прорыв в борьбе со сонной болезнью в Африке» . Архивировано из оригинала 13 мая 2006 года . Проверено 7 апреля 2006 г.
- ^ Месу В.К., Калонджи В.М., Бардонно С., Мордт О.В., Блессон С., Саймон Ф. и др. (январь 2018 г.). «Поральный фексинидазол для лечения африканского трипаносомоза Trypanosoma brucei gambiense на поздней стадии: ключевое многоцентровое рандомизированное исследование не меньшей эффективности» . Ланцет . 391 (10116): 144–154. дои : 10.1016/S0140-6736(17)32758-7 . ПМИД 29113731 . S2CID 46781585 .
- ^ «Краткое заключение CHMP — Фексинидазол Уинтроп» (PDF) . Проверено 19 ноября 2018 г.
- ^ «Фексинидазол, первое пероральное средство от сонной болезни, одобренное в Демократической Республике Конго | DNDi» . Инициатива «Лекарства от забытых болезней» (DNDi) . 29 января 2019 года . Проверено 4 июня 2019 г.
- ^ Jump up to: Перейти обратно: а б с д и ж г час я Моран М., Гузман Дж., Чепмен Н., Абела-Оверстинген Л., Ховард Р., Фаррелл П., Люксфорд Дж. «Исследования и разработки забытых болезней: общественный раскол» (PDF) . Глобальное финансирование инноваций для лечения забытых болезней. Архивировано (PDF) из оригинала 1 апреля 2016 г. Проверено 30 октября 2016 г.
- ^ «Обзор стратегии» . Забытые инфекционные болезни . Фонд Билла и Мелинды Гейтс. 2013. Архивировано из оригинала 1 ноября 2015 года.
- ^ «Справочный документ 8: 8.1 Государственно-частное партнерство и инновации» . Приоритетные лекарства для Европы и мировой обновленный отчет . Всемирная организация здравоохранения. 2013. Архивировано из оригинала (PDF) 20 августа 2014 года.
- ^ Бюшер П., Барт Дж.М., Боэлерт М., Бучетон Б., Чекки Г., Читнис Н. и др. (март 2018 г.). «Угрожают ли загадочные резервуары исчезновению сонной болезни гамбиенса?» . Тенденции в паразитологии . 34 (3): 197–207. дои : 10.1016/j.pt.2017.11.008 . ПМЦ 5840517 . ПМИД 29396200 .
- ^ Вурчакбе Дж., Тиофак З.А., Канте Т.С., Мпоаме М., Симо Г. (2020). «Молекулярная идентификация Trypanosoma brucei gambiense у естественно инфицированных свиней, собак и мелких жвачных животных подтверждает, что домашние животные являются потенциальными резервуарами сонной болезни в Чаде» . Паразит . 27 : 63. doi : 10.1051/parasite/2020061 . ПМЦ 7673351 . ПМИД 33206595 .

Внешние ссылки [ править ]
- «Мечта врача» . Stories.dndi.org . Проверено 14 мая 2020 г.
- «Сонная болезнь» . «Врачи без границ» . Архивировано из оригинала 23 октября 2013 года.
- Ссылки на фотографии сонной болезни (Хардин, доктор медицинских наук/ Университет Айовы )
- Хейл Карпентер Г.Д. (1920). Натуралист на озере Виктория с рассказом о сонной болезни и мухе це-це . Анвин. ОСЛК 2649363 .
![Язва африканского трипаносомоза человека[13]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ee/PMC5373517_pntd.0005324.g001.png/200px-PMC5373517_pntd.0005324.g001.png)
![Типичная мелкопятнистая розовая сыпь острого африканского трипаносомоза на коже живота («трипанидная сыпь»)[14]](http://upload.wikimedia.org/wikipedia/commons/thumb/8/8e/AcuteSleepingSickness.jpg/200px-AcuteSleepingSickness.jpg)
![Многочисленные пятна кровотечения на коже голени у человека, инфицированного Т. b. родезийский [14]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/01/SSHemorragicRash.jpg/191px-SSHemorragicRash.jpg)










