Пенициллин
 Основная структура пенициллина, где «R» - переменная группа. | |
| Клинические данные | |
|---|---|
| AHFS / Drugs.com | Подробная информация для потребителей Micromedex |
| Маршруты администрация | Внутривенно , внутримышечно , внутрь |
| код АТС | |
| Юридический статус | |
| Юридический статус |
|
| Фармакокинетические данные | |
| Метаболизм | Печень |
| Период полувыведения | От 0,5 до 56 часов |
| Экскреция | Почки |
Пенициллины ( P , PCN или PEN ) представляют собой группу β-лактамных антибиотиков, первоначально полученных из Penicillium плесневых грибов , главным образом P. chrysogenum и P. Rubens . Большинство пенициллинов, используемых в клинической практике, синтезируются P. chrysogenum с использованием глубокой ферментации в резервуарах. [2] а затем очищается. [3] [4] Был открыт ряд природных пенициллинов, но в клинической практике используются только два очищенных соединения: пенициллин G ( внутримышечное или внутривенное применение ) и пенициллин V (пероральный). Пенициллины были одними из первых лекарств, эффективных против многих бактериальных инфекций, вызываемых стафилококками и стрептококками . Они до сих пор широко используются при различных бактериальных инфекциях, хотя многие виды бактерий в результате интенсивного использования выработали устойчивость .
Десять процентов населения заявляют об аллергии на пенициллин , но поскольку частота положительных результатов кожных проб снижается на 10% с каждым годом избегания, 90% этих пациентов в конечном итоге могут переносить пенициллин. Кроме того, люди с аллергией на пенициллин обычно могут переносить цефалоспорины (еще одна группа β-лактамов), поскольку иммуноглобулина E (IgE) составляет всего 3%. перекрестная реактивность [5]
Пенициллин был открыт в 1928 году шотландским учёным Александром Флемингом как неочищенный экстракт P. Rubens . [6] Студент Флеминга Сесил Джордж Пейн был первым, кто успешно применил пенициллин для лечения глазной инфекции ( неонатального конъюнктивита ) в 1930 году. Очищенное соединение (пенициллин F) было выделено в 1940 году исследовательской группой под руководством Говарда Флори и Эрнста Бориса Чейна в Университете Флеминга. Оксфорд. Флеминг впервые применил очищенный пенициллин для лечения стрептококкового менингита в 1942 году. [7] 1945 года Нобелевскую премию по физиологии и медицине разделили Чейн, Флеминг и Флори.
Некоторые полусинтетические пенициллины эффективны против более широкого спектра бактерий: к ним относятся антистафилококковые пенициллины , аминопенициллины и антипсевдомонадные пенициллины .
Номенклатура
Термин «пенициллин» определяется как натуральный продукт плесени Penicillium, обладающий противомикробной активностью. [8] Он был придуман Александром Флемингом 7 марта 1929 года, когда он обнаружил антибактериальные свойства Penicillium Rubens . [9] Флеминг объяснил В своей статье 1929 года в Британском журнале экспериментальной патологии , что «чтобы избежать повторения довольно громоздкой фразы «Фильтрат плесневого бульона», будет использоваться название «пенициллин». [10] Таким образом, название отсылает к научному названию формы, описанному Флемингом в его Нобелевской лекции в 1945 году:
Меня часто спрашивали, почему я придумал название «Пенициллин». Я просто следовал совершенно ортодоксальным линиям и придумал слово, которое объясняло, что вещество пенициллин было получено из растения рода Penicillium, точно так же, как много лет назад слово « Дигиталин » было изобретено для вещества, полученного из растения Наперстянка . [11]
В современном использовании термин «пенициллин» используется в более широком смысле для обозначения любого β-лактамного противомикробного препарата, который содержит тиазолидиновое кольцо, слитое с β-лактамным ядром, и может быть, а может и не быть натуральным продуктом. [12] Как и большинство натуральных продуктов, пенициллин присутствует в плесенях Penicillium в виде смеси активных компонентов ( гентамицин — еще один пример натурального продукта, представляющего собой нечеткую смесь активных компонентов). [8] Основные активные компоненты Penicillium перечислены в следующей таблице: [13] [14]
| Химическое название | номенклатура Великобритании | Номенклатура США | Относительная потенция к пенициллину G [15] |
|---|---|---|---|
| 2-пентенилпенициллин | Пенициллин I | Пенициллин Ф [16] | 70–82% |
| Бензилпенициллин | Пенициллин II | Пенициллин G [17] | 100% |
| р -Гидроксибензилпенициллин | Пенициллин III | Пенициллин X [18] | 130–140% |
| н- гептилпенициллин | Пенициллин IV | Пенициллин К [19] | 110–120% |
Другие второстепенные активные компоненты Penicillium включают пенициллин O , [20] [21] пенициллин U1 и пенициллин U6. Впоследствии было обнаружено, что другие названные компоненты природного пенициллина , такие как пенициллин А, не обладают антибиотической активностью и химически не связаны с пенициллинами-антибиотиками. [8]
Точный состав экстрагированного пенициллина зависит от вида используемой плесени Penicillium и питательной среды, используемой для культивирования плесени. [8] , созданный Флемингом, Оригинальный штамм Penicillium Rubens производит в основном пенициллин F, названный в честь Флеминга. Но пенициллин F нестабилен, его трудно выделить, и он вырабатывается плесенью в небольших количествах. [8]
Основной коммерческий штамм Penicillium chrysogenum (штамм Peoria) продуцирует пенициллин G в качестве основного компонента, когда в качестве культуральной среды используется кукурузный отвар. [8] Когда феноксиэтанол в культуральную среду добавляют или феноксиуксусную кислоту, плесень вместо этого вырабатывает пенициллин V в качестве основного пенициллина. [8]
6-Аминопенициллановая кислота (6-АПК) представляет собой соединение, полученное из пенициллина G. 6-АПК содержит бета-лактамное ядро пенициллина G, но с оторванными боковыми цепями; 6-АПК является полезным предшественником для производства других пенициллинов. Существует множество полусинтетических пенициллинов, производных 6-АПК, которые делятся на три группы: антистафилококковые пенициллины, пенициллины широкого спектра действия и антипсевдомонадные пенициллины. Все полусинтетические пенициллины называются пенициллинами, поскольку все они в конечном итоге происходят из пенициллина G.
Пенициллиновые единицы
- Одна единица пенициллина G натрия определяется как 0,600 микрограмм. Следовательно, 2 миллиона единиц (2 мегаединицы) пенициллина G составляют 1,2 г. [22]
- Одна единица калия пенициллина V определяется как 0,625 микрограмма. Следовательно, 400 000 единиц пенициллина V — это 250 мг. [23]
Использование единиц для назначения пенициллина является исторической случайностью и в значительной степени устарело за пределами США. Поскольку первоначальный пенициллин представлял собой нечеткую смесь активных соединений (аморфный желтый порошок), эффективность каждой партии пенициллина варьировалась от партии к партии. Поэтому было невозможно прописать 1 г пенициллина, поскольку активность 1 г пенициллина из одной серии отличалась бы от активности из другой серии. После производства каждую партию пенициллина необходимо было стандартизировать по известной единице пенициллина: затем в каждый стеклянный флакон наполняли необходимое количество единиц. В 1940-х годах стандартным флаконом было 5000 единиц Оксфорда. [24] но в зависимости от партии может содержать от 15 до 20 мг пенициллина. Позже стандартом стал флакон в 1 000 000 международных единиц, который мог содержать от 2,5 до 3 г природного пенициллина (смесь пенициллинов I, II, III и IV и природных примесей). С появлением чистых препаратов пенициллина G (белого кристаллического порошка) нет смысла назначать пенициллин в дозах.
«Единица» пенициллина имела три предыдущих определения, и каждое определение было выбрано как примерно эквивалентное предыдущему.
- Подразделение Оксфорда или Флори (1941 г.). Первоначально это определялось как минимальное количество пенициллина, растворенного в 50 мл мясного экстракта, которое подавляло бы рост стандартного штамма Staphylococcus aureus ( Оксфордский стафилококк ). Эталонным стандартом была большая партия нечистого пенициллина, хранившаяся в Оксфорде . [25] Позже группа Флори изменила этот анализ на более воспроизводимый «чашечный анализ»: в этом анализе раствор пенициллина содержал одну единицу пенициллина на мл, когда 339 микролитров раствора помещали в «чашку» на пластинку с твердый агар создавал 24-миллиметровую зону ингибирования роста оксфордского стафилококка. [26] : 107 [27] [28]
- Первый международный стандарт (1944 г.). Одна 8-граммовая партия чистого кристаллического пенициллина G-натрия хранилась в Национальном институте медицинских исследований в Милл-Хилл в Лондоне (Международный стандарт). Одна пенициллиновая единица определялась как 0,6 мкг Международного стандарта. Также был определен нечистый «рабочий стандарт», который был доступен в гораздо больших количествах по всему миру: одна единица рабочего стандарта составляла 2,7 микрограмма (количество на единицу было намного больше из-за примесей). В то же время был усовершенствован чашечный анализ: вместо указания диаметра зоны 24 мм размер зоны был сопоставлен с эталонной кривой, чтобы обеспечить считывание эффективности. [28] [13] [29]
- Второй международный стандарт (1953 г.). Была получена одна 30-граммовая партия чистого кристаллического пенициллина G натрия: он также хранился в Милл-Хилл. Одна пенициллиновая единица была определена как 0,5988 микрограмма Второго международного стандарта. [30]
Существует более старая единица пенициллина V, которая не эквивалентна нынешней единице пенициллина V. Причина в том, что FDA США ошибочно предположило, что эффективность пенициллина V такая же, как у пенициллина G. Фактически, пенициллин V менее эффективен, чем пенициллин G, и нынешняя единица пенициллина V отражает этот факт.
- Первая международная единица пенициллина V (1959 г.). Одна единица пенициллина V была определена как 0,590 микрограмм эталонного стандарта, хранящегося в Милл-Хилл в Лондоне. [31] Сейчас этот агрегат устарел.
Аналогичный стандарт был установлен и для пенициллина К. [32]
Типы
Пенициллины состоят из отдельного 4-членного бета-лактамного кольца, а также тиазолидного кольца и боковой цепи R. Основной отличительной чертой вариантов внутри этого семейства является R. заместитель
Эта боковая цепь связана с остатком 6-аминопенициллановой кислоты и приводит к вариациям антимикробного спектра, стабильности и чувствительности к бета-лактамазам каждого типа.
Природные пенициллины
Пенициллин G (бензилпенициллин) впервые был получен из гриба пенициллина , встречающегося в природе. Штамм гриба, используемый сегодня для производства пенициллина G, был создан методом генной инженерии для повышения выхода в производственном процессе. Ни один из других природных пенициллинов (F, K, N, X, O, U1 или U6) в настоящее время не используется в клинической практике.
Полусинтетический пенициллин
В этом разделе отсутствует информация о том, почему – нужно взять информацию из раздела истории статьи PV о том, как волшебным образом можно заработать больше. ( декабрь 2022 г. ) |
Пенициллин V (феноксиметилпенициллин) получают путем добавления предшественника феноксиуксусной кислоты в среду, в которой находится генетически модифицированный штамм. [ сомнительно – обсудить ] пенициллиум . Культивируют гриб
Антибиотики, созданные из 6-АПА
Существуют три основные группы других полусинтетических антибиотиков, родственных пенициллинам. Их синтезируют путем добавления различных боковых цепей к предшественнику 6-АРА , выделенному из пенициллина G. Это антистафилококковые антибиотики, антибиотики широкого спектра действия и антипсевдомонадные антибиотики.
Антистафилококковые антибиотики
- Клоксациллин (внутрь или в виде инъекции)
- Диклоксациллин (внутрь или в виде инъекций)
- Флуклоксациллин (внутрь или в виде инъекций)
- Метициллин (только инъекции)
- Нафциллин (только инъекции)
- Оксациллин (внутрь или в виде инъекции)
Антистафилококковые антибиотики называются так потому, что они устойчивы к расщеплению стафилококковой пенициллиназой . Поэтому их также называют устойчивыми к пенициллиназе.
Антибиотики широкого спектра действия
Эту группу антибиотиков называют «широкого спектра действия», поскольку они активны в отношении широкого спектра грамотрицательных бактерий, таких как Escherichia coli и Salmonella typhi , для которых пенициллин не подходит. Однако в настоящее время резистентность этих организмов является обычным явлением.
Существует множество предшественников ампициллина. Это неактивные соединения, которые расщепляются в кишечнике с выделением ампициллина. Ни один из этих пролекарств ампициллина в настоящее время не используется:
- Пивампициллин (пивалоилоксиметиловый эфир ампициллина)
- Бакампициллин
- Метампициллин (формальдегидный эфир ампициллина)
- Талампициллин
- Гетациллин (ампициллин, конъюгированный с ацетоном)
Эпициллин – это аминопенициллин, который никогда не нашел широкого клинического применения.
Антипсевдомонадные антибиотики
Грамотрицательный вид Pseudomonas aeruginosa естественно устойчив ко многим классам антибиотиков. В 1960-х и 1970-х годах было предпринято много попыток разработать антибиотики, активные против видов Pseudomonas . В группе есть два химических класса: карбоксипениинициллины и уреидопенициллины. Все они вводятся инъекционно: ни один препарат нельзя вводить через рот.
Карбоксипенициллины
Уреидопенициллины
Ингибиторы β-лактамаз
Медицинское использование
Термин «пенициллин», когда он используется сам по себе, может относиться к любому из двух химических соединений : пенициллину G или пенициллину V.
| Общее имя | Химическое название | Метод администрация |
|---|---|---|
| Пенициллин V | феноксиметилпенициллин | оральный |
| Пенициллин G | бензилпенициллин | внутривенный внутримышечный |
Пенициллин G
Пенициллин G разрушается желудочной кислотой, поэтому его нельзя принимать внутрь, но можно назначать дозы до 2,4 г (намного выше, чем у пенициллина V). Его вводят внутривенно или внутримышечно. Его можно приготовить в виде нерастворимой соли, и в настоящее время используются два таких препарата: прокаинпенициллин и бензатинбензилпенициллин . Когда необходимо поддерживать высокую концентрацию в крови, пенициллин G необходимо вводить через относительно частые интервалы, поскольку он довольно быстро выводится из кровотока почками.
Пенициллин G лицензирован для лечения септицемии , эмпиемы , пневмонии , перикардита , эндокардита и менингита, вызванных чувствительными штаммами стафилококков и стрептококков. Он также лицензирован для лечения сибирской язвы , актиномикоза , заболеваний шейно-лицевой области, органов грудной клетки и брюшной полости, клостридиальных инфекций , ботулизма , газовой гангрены (с сопутствующей хирургической обработкой и/или хирургическим вмешательством по показаниям), столбняка (в качестве дополнительной терапии к человеческому противостолбнячному иммуноглобулину). ), дифтерия (в качестве дополнительной терапии к антитоксину и для профилактики носительства), рожистый эндокардит, фузоспирохетоз (тяжелые инфекции ротоглотки, нижних дыхательных путей и половых органов), листериозные инфекции, менингит, эндокардит, пастереллезные инфекции, включая бактериемию. и менингит, лихорадка Хаверхилла ; лихорадка от укуса крыс и диссеминированные гонококковые инфекции , менингококковый менингит и/или септицемия, вызванная чувствительными к пенициллину микроорганизмами, и сифилис. [33]
Пенициллин V
Пенициллин V можно принимать внутрь, поскольку он относительно устойчив к желудочной кислоте. Дозы выше 500 мг не полностью эффективны из-за плохой абсорбции. Он используется при тех же бактериальных инфекциях, что и пенициллин G, и является наиболее широко используемой формой пенициллина. [34] Однако он не используется при таких заболеваниях, как эндокардит , когда требуется высокий уровень пенициллина в крови.
Бактериальная восприимчивость
Поскольку устойчивость к пенициллину сейчас настолько распространена, другие антибиотики теперь являются предпочтительным выбором для лечения. Например, пенициллин раньше был препаратом первой линии при инфекциях, вызванных Neisseria gonorrhoeae и Neisseria meningitidis , но больше не рекомендуется для лечения этих инфекций. Устойчивость к пенициллину в настоящее время очень распространена у Staphylococcus aureus , а это означает, что пенициллин не следует использовать для лечения инфекций, вызванных инфекцией S. aureus, если не известно, что инфекционный штамм восприимчив.
| Бактерия | Восприимчивый (S) | Средний (Я) | Устойчивый (R) |
|---|---|---|---|
| Золотистый стафилококк | ≤0,12 мкг/мл | - | ≥0,25 мкг/мл |
| Streptococcus pneumoniae менингит | ≤0,06 мкг/мл | - | ≥0,12 мкг/мл |
| Streptococcus pneumoniae (не менингит) | ≤2 мкг/мл | ≥8 мкг/мл | |
| Группа стрептококков Viridans | 0,12 мкг/мл | 0,25–2 мкг/мл | 4 мкг/мл |
| Листерия моноцитогенная | ≤2 мкг/мл | - | - |
| Бацилла сибирской язвы | ≤0,12 мкг/мл | - | ≥0,25 мкг/мл |
Побочные эффекты
Распространенные (≥ 1% людей) побочные реакции, связанные с применением пенициллинов, включают диарею , гиперчувствительность , тошноту , сыпь , нейротоксичность , крапивницу и суперинфекцию (включая кандидоз ). Нечастые побочные эффекты (0,1–1% людей) включают лихорадку , рвоту , эритему , дерматит , ангионевротический отек , судороги (особенно у людей с эпилепсией ) и псевдомембранозный колит . [35] Пенициллин также может вызывать сывороточную болезнь или реакцию, подобную сывороточной болезни, у некоторых людей. Сывороточная болезнь — это реакция гиперчувствительности III типа , которая возникает через одну-три недели после воздействия лекарств, включая пенициллин. Это не настоящая лекарственная аллергия, поскольку аллергия представляет собой реакцию гиперчувствительности I типа , но повторное воздействие возбудителя может привести к анафилактической реакции. [36] [37] Аллергия возникает у 1–10% людей и проявляется кожной сыпью после воздействия. IgE-опосредованная анафилаксия возникает примерно у 0,01% пациентов. [38] [35]
Боль и воспаление в месте инъекции также характерны для парентерально вводимых бензатинбензилпенициллина, бензилпенициллина и, в меньшей степени, прокаинбензилпенициллина. Это состояние известно как ливедоидный дерматит или синдром Николау. [39] [40]
Структура
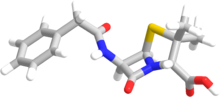
Термин « пенам » используется для описания общего ядра скелета пенициллинов. Это ядро имеет молекулярную формулу RC 9 H 11 N 2 O 4 S, где R — вариабельная боковая цепь, которая отличает пенициллины друг от друга. Ядро пенама имеет молярную массу 243 г/моль, при этом более крупные пенициллины имеют молярную массу около 450 - например, клоксациллин имеет молярную массу 436 г/моль. 6-АПК (C 8 H 12 N 2 O 3 S) образует основную структуру пенициллинов. Он состоит из закрытого дипептида, образующегося в результате конденсации L-цистеина и D-валина. Это приводит к образованию β-лактамных и тиазолидиновых колец. [41]
Ключевой структурной особенностью пенициллинов является четырехчленное β-лактамное кольцо; этот структурный фрагмент необходим для антибактериальной активности пенициллина. Кольцо β-лактама само по себе слито с пятичленным тиазолидиновым кольцом. Слияние этих двух колец приводит к тому, что β-лактамное кольцо становится более реакционноспособным, чем моноциклические β-лактамы, поскольку два слитых кольца искажают амидную связь β-лактама и, следовательно, устраняют резонансную стабилизацию, обычно присущую этим химическим связям. [42] Ацильная боковая цепь присоединена к β-лактамному кольцу. [43]
Различные β-лактамные антибиотики были получены после химической модификации структуры 6-АПК в ходе синтеза, в частности, путем химических замен в ацильной боковой цепи. Например, первый химически измененный пенициллин, метициллин, имел замены метоксигруппами в положениях 2' и 6' бензольного кольца 6-АРА пенициллина G. [41] Это различие делает метициллин устойчивым к активности β-лактамазы , фермента, благодаря которому многие бактерии естественным образом невосприимчивы к пенициллинам. [44]
Фармакология
Вход в бактерии
Пенициллин может легко проникать в бактериальные клетки грамположительных видов . Это связано с тем, что грамположительные бактерии не имеют внешней клеточной мембраны и просто заключены в толстую клеточную стенку . [45] Молекулы пенициллина достаточно малы, чтобы проходить через пространства гликопротеинов в клеточной стенке. По этой причине грамположительные бактерии очень чувствительны к пенициллину (о чем впервые свидетельствует открытие пенициллина в 1928 г.). [46] ). [47]
Пенициллин или любая другая молекула проникает в грамотрицательные бактерии другим путем. У бактерий более тонкие клеточные стенки, но внешняя поверхность покрыта дополнительной клеточной мембраной, называемой внешней мембраной. Наружная мембрана представляет собой липидный слой ( липополисахаридная цепь), который блокирует прохождение водорастворимых ( гидрофильных ) молекул, таких как пенициллин. Таким образом, он действует как первая линия защиты от любого токсического вещества, что является причиной относительной устойчивости к антибиотикам по сравнению с грамположительными видами. [48] Но пенициллин все же может проникать в грамотрицательные виды путем диффузии через водные каналы, называемые поринами (белками внешней мембраны), которые диспергированы среди жирных молекул и могут транспортировать питательные вещества и антибиотики в бактерии. [49] Порины достаточно велики, чтобы обеспечить диффузию большинства пенициллинов, но скорость диффузии через них определяется конкретным размером молекул лекарства. Например, пенициллин G имеет большие размеры и медленно проникает через порины; в то время как более мелкие ампициллин и амоксициллин диффундируют гораздо быстрее. [50] Напротив, крупный ванкомицин не может проходить через порины и, следовательно, неэффективен для грамотрицательных бактерий. [51] Размер и количество поринов у разных бактерий различны. В результате действия двух факторов — размера пенициллина и порина — грамотрицательные бактерии могут быть невосприимчивы или иметь различную степень чувствительности к конкретному пенициллину. [52]
Механизм действия


Пенициллин убивает бактерии, подавляя завершение синтеза пептидогликанов , структурного компонента бактериальной клеточной стенки . Он специфически ингибирует активность ферментов, которые необходимы для сшивания пептидогликанов на заключительном этапе биосинтеза клеточной стенки. Он делает это путем связывания пенициллинсвязывающих белков с β-лактамным кольцом — структурой, обнаруженной в молекулах пенициллина. [54] [55] Это приводит к ослаблению клеточной стенки из-за меньшего количества поперечных связей и означает, что вода бесконтрольно поступает в клетку, поскольку она не может поддерживать правильный осмотический градиент. клеток Это приводит к лизису и гибели .
Бактерии постоянно реконструируют свои пептидогликановые клеточные стенки, одновременно строя и разрушая части клеточной стенки по мере роста и деления. На последних стадиях биосинтеза пептидогликана образуется пентапептид уридиндифосфат- N -ацетилмурамовой кислоты (UDP-MurNAc), в котором четвертая и пятая аминокислоты представляют собой D -аланил- D -аланин. Перенос D-аланина осуществляется (катализируется) ферментом DD -транспептидазой ( к такому типу относятся пенициллин-связывающие белки ). [50] Структурная целостность бактериальной клеточной стенки зависит от перекрестного связывания UDP-MurNAc и N -ацетилглюкозамина. [56] Пенициллин и другие β-лактамные антибиотики действуют как аналог D -аланина- D -аланина (дипептида) в UDP-MurNAc из-за конформационного сходства. Затем DD-транспептидаза связывает четырехчленное β-лактамное кольцо пенициллина вместо UDP-MurNAc. [50] Как следствие, DD-транспептидаза инактивируется, блокируется образование поперечных связей между UDP-MurNAc и N -ацетилглюкозамином, в результате чего развивается дисбаланс между продукцией и деградацией клеточной стенки, вызывающий быструю гибель клетки. [57]
Ферменты, которые гидролизуют поперечные связи пептидогликана, продолжают функционировать, даже если те, которые образуют такие поперечные связи, этого не делают. Это ослабляет клеточную стенку бактерии, и осмотическое давление становится все более некомпенсированным, что в конечном итоге приводит к гибели клеток ( цитолиз ). Кроме того, накопление предшественников пептидогликана вызывает активацию гидролаз и аутолизинов бактериальной клеточной стенки, которые дополнительно переваривают пептидогликаны клеточной стенки. Небольшой размер пенициллинов увеличивает их эффективность, позволяя им проникать на всю глубину клеточной стенки. Это контрастирует с гликопептидными антибиотиками ванкомицином и тейкопланином , которые намного крупнее пенициллинов. [58]
Грамположительные бактерии называются протопластами , когда они теряют клеточные стенки. Грамотрицательные не теряют полностью клеточных стенок и называются сферопластами . бактерии после обработки пенициллином [53]
Пенициллин демонстрирует синергический эффект с аминогликозидами , поскольку ингибирование синтеза пептидогликанов позволяет аминогликозидам легче проникать через клеточную стенку бактерий, что позволяет им нарушать синтез бактериального белка внутри клетки. Это приводит к снижению MBC для восприимчивых организмов. [59]
Пенициллины, как и другие β блокируют не только деление бактерий, в том числе цианобактерий и деление цианелл, фотосинтетических органелл глаукофитов -лактамные антибиотики , , деление хлоропластов мохообразных , но . Напротив, они не оказывают влияния на пластиды высокоразвитых сосудистых растений . Это подтверждает эндосимбиотическую теорию эволюции . пластидного деления у наземных растений [60]
Некоторые бактерии вырабатывают ферменты, разрушающие β-лактамное кольцо, называемые β-лактамазами , которые делают бактерии устойчивыми к пенициллину. Поэтому некоторые пенициллины модифицируются или назначаются вместе с другими препаратами для использования против устойчивых к антибиотикам бактерий или у пациентов с ослабленным иммунитетом. Применение клавулановой кислоты или тазобактама, ингибиторов β-лактамаз, наряду с пенициллином придает пенициллину активность в отношении бактерий, продуцирующих β-лактамазу. Ингибиторы β-лактамаз необратимо связываются с β-лактамазой, предотвращая разрушение бета-лактамных колец на молекуле антибиотика. Альтернативно, флуклоксациллин представляет собой модифицированный пенициллин, который обладает активностью против бактерий, продуцирующих β-лактамазу, благодаря ацильной боковой цепи, которая защищает бета-лактамное кольцо от β-лактамазы. [38]
Фармакокинетика
Пенициллин имеет низкое связывание с белками плазмы. Биодоступность . пенициллина зависит от типа: пенициллин G имеет низкую биодоступность, менее 30%, тогда как пенициллин V имеет более высокую биодоступность, от 60 до 70% [61]
Пенициллин имеет короткий период полураспада и выводится через почки. [61] Это означает, что его необходимо принимать не менее четырех раз в день, чтобы поддерживать адекватный уровень пенициллина в крови. Поэтому в ранних руководствах по использованию пенициллина рекомендовалось делать инъекции пенициллина каждые три часа, а дозировка пенициллина была описана как попытка наполнить ванну с вынутой пробкой. [8] В этом больше нет необходимости, поскольку гораздо большие дозы пенициллина дешевы и легко доступны; однако некоторые авторитеты рекомендуют по этой причине использовать постоянные инфузии пенициллина. [62]
Сопротивление
Когда Александр Флеминг открыл сырой пенициллин в 1928 году, он сделал одно важное наблюдение: на многие бактерии пенициллин не влияет. [46] Это явление было обнаружено Эрнстом Чейном и Эдвардом Абрахамом при попытке точно определить пенициллин. В 1940 году они обнаружили, что невосприимчивые бактерии, такие как Escherichia coli, производят специфические ферменты, которые могут расщеплять молекулы пенициллина, делая их, таким образом, устойчивыми к антибиотику. Они назвали фермент пенициллиназой . [63] Пенициллиназа теперь классифицируется как член ферментов, называемых β-лактамазами. Эти β-лактамазы в природе присутствуют во многих других бактериях, и многие бактерии производят их при постоянном воздействии антибиотиков. У большинства бактерий устойчивость может осуществляться посредством трех различных механизмов: снижения проницаемости бактерий, снижения аффинности связывания пенициллин-связывающих белков (PBP) или разрушения антибиотика за счет экспрессии β-лактамазы. [64] Используя любой из них, бактерии обычно развивают устойчивость к различным антибиотикам — явление, называемое множественной лекарственной устойчивостью .
Реальный процесс механизма сопротивления может быть очень сложным. В случае пониженной проницаемости у бактерий механизмы различны у грамположительных и грамотрицательных бактерий. У грамположительных бактерий блокировка пенициллина обусловлена изменениями клеточной стенки. Например, устойчивость S. aureus к ванкомицину обусловлена дополнительным синтезом пептидогликана, который делает клеточную стенку намного толще, предотвращая эффективное проникновение пенициллина. [47] Резистентность грамотрицательных бактерий обусловлена мутационными изменениями в структуре и количестве поринов. [52] У таких бактерий, как Pseudomonas aeruginosa , количество пор снижено; тогда как у таких бактерий, как виды Enterobacter , Escherichia coli и Klebsiella pneumoniae , существуют модифицированные порины, такие как неспецифические порины (такие как группы OmpC и OmpF), которые не могут транспортировать пенициллин. [65]
Сопротивление, обусловленное изменениями PBP, весьма разнообразно. Распространенный случай встречается у Streptococcus pneumoniae , где имеется мутация в гене PBP, а мутантные PBP имеют пониженную аффинность связывания с пенициллинами. [66] имеется шесть мутантных PBP У S. pneumoniae , из которых PBP1a, PBP2b, PBP2x и иногда PBP2a ответственны за снижение аффинности связывания. [67] S. aureus может активировать скрытый ген, который продуцирует другой PBP, PBD2, который имеет низкую аффинность связывания с пенициллинами. [68] Существует другой штамм S. aureus, называемый метициллин-резистентным S. aureus (MRSA), который устойчив не только к пенициллину и другим β-лактамам, но и к большинству антибиотиков. Бактериальный штамм появился после появления метициллина в 1959 году. [44] При MRSA мутации в генах ( система mec ) PBP приводят к образованию варианта белка под названием PBP2a (также называемого PBP2'), [69] при этом делая четыре нормальных PBP. PBP2a имеет низкую аффинность связывания с пенициллином, а также не имеет активности гликозилтрансферазы, необходимой для полного синтеза пептидогликана (который осуществляется четырьмя нормальными PBP). [67] У Helicobacter cinaedi имеется множество мутаций в разных генах, которые создают варианты PBP. [70]
Ферментативное разрушение β-лактамазами является важнейшим механизмом устойчивости к пенициллину. [71] и описывается как «самая большая угроза использованию [пенициллинов]». [72] Это был первый обнаруженный механизм устойчивости к пенициллину. В ходе экспериментов по очистке и проверке биологической активности пенициллина в 1940 году было обнаружено, что E. coli нечувствительна. [73] Причина была обнаружена в выработке фермента пенициллиназы (следовательно, первой известной β-лактамазы) в E. coli , который легко расщепляет пенициллин. [63] Существует более 2000 типов β-лактамаз, каждый из которых имеет уникальную аминокислотную последовательность и, следовательно, ферментативную активность. [72] Все они способны гидролизовать β-лактамные кольца, но их точные сайты-мишени различны. [74] Они секретируются на поверхности бактерий в больших количествах у грамположительных бактерий, но в меньшем количестве у грамотрицательных видов. Следовательно, при смешанной бактериальной инфекции грамположительные бактерии могут защищать чувствительные к пенициллину грамотрицательные клетки. [50]
существуют необычные механизмы У P. aeruginosa , при которых может наблюдаться устойчивость, опосредованная биопленками, и образование персистерных клеток, устойчивых к множеству лекарств . [75]
История
Открытие

Начиная с конца 19 века появились сообщения об антибактериальных свойствах плесени Penicillium , но ученые не смогли понять, какой процесс вызывает этот эффект. [76] Шотландский врач Александр Флеминг из больницы Святой Марии в Лондоне (ныне часть Имперского колледжа ) был первым, кто доказал, что Penicillium Rubens обладает антибактериальными свойствами. [77] 3 сентября 1928 года он случайно заметил, что грибковое заражение бактериальной культуры ( Staphylococcus aureus ), по-видимому, убивает бактерии. Он подтвердил это наблюдение новым экспериментом 28 сентября 1928 года. [78] [79] Он опубликовал свой эксперимент в 1929 году и назвал антибактериальное вещество (экстракт гриба) пенициллином. [46]
К. Дж. Ла Туш идентифицировал гриб как Penicillium rubrum реклассифицировал его (позже Чарльз Том как P. notatum и P. chrysogenum , но позже исправил как P. Rubens ). [80] Флеминг выразил первоначальный оптимизм по поводу того, что пенициллин будет полезным антисептиком из-за его высокой эффективности и минимальной токсичности по сравнению с другими антисептиками того времени, и отметил его лабораторную ценность при выделении Bacillus influenzae (теперь называемой Haemophilus influenzae ). [81] [82]
Флеминг никого не убедил в важности своего открытия. [81] Во многом это произошло потому, что пенициллин было настолько трудно выделить, что его разработка в качестве лекарства казалась невозможной. Предполагается, что если бы Флемингу удалось больше заинтересовать других ученых своей работой, пенициллин, возможно, был бы разработан несколькими годами раньше. [81]
Важность его работы была признана размещением 19 ноября 1999 года Международного исторического химического памятника в Лабораторном музее Александра Флеминга в Лондоне. [83]
Разработка и медицинское применение

В 1930 году Сесил Джордж Пейн, патолог Королевского лазарета в Шеффилде успешно вылечил офтальмию новорожденных , гонококковую инфекцию у младенцев, с помощью пенициллина (экстракт грибка). , 25 ноября 1930 года [84] [85] [86]
В 1940 году австралийский учёный Говард Флори (впоследствии барон Флори) и группа исследователей ( Эрнст Чейн , Эдвард Абрахам , Артур Дункан Гарднер , Норман Хитли , Маргарет Дженнингс , Джин Орр-Юинг и Артур Гордон Сандерс) в Школе сэра Уильяма Данна Патология Оксфордского университета добилась прогресса в получении концентрированного пенициллина из грибкового культурального бульона, который показал как in vitro , так и in vivo . бактерицидное действие [87] [88] В 1941 году они лечили полицейского Альберта Александра с тяжелой инфекцией лица; его состояние улучшилось, но затем закончились запасы пенициллина, и он умер. Впоследствии еще несколько пациентов прошли успешное лечение. [89] В декабре 1942 года выжившие после пожара в Кокоанат-Гроув в Бостоне стали первыми пациентами с ожогами, которых успешно вылечили пенициллином. [90]
Первое успешное использование чистого пенициллина произошло в 1942 году, когда Флеминг вылечил Гарри Ламберта от инфекции нервной системы (стрептококковый менингит ), которая в противном случае была бы смертельной. К тому времени оксфордская команда смогла произвести лишь небольшое количество. Флори охотно отдал Флемингу единственный доступный образец. У Ламберта началось улучшение уже на следующий день лечения, и он полностью вылечился в течение недели. [91] [92] Флеминг опубликовал результаты своего клинического исследования в журнале The Lancet в 1943 году. [7] После прорыва в медицине 5 апреля 1943 года британский военный кабинет учредил Комитет по пенициллину, который привел к проектам массового производства . [93] [94]
Массовое производство
Когда медицинское применение было установлено, команда Оксфорда обнаружила, что невозможно производить пригодные для использования количества в их лаборатории. [89] Не сумев убедить британское правительство, Флори и Хитли в июне 1941 года отправились в США со своими образцами пресс-форм, чтобы заинтересовать правительство США крупномасштабным производством. [95] Они обратились в Северную региональную исследовательскую лабораторию Министерства сельского хозяйства США (NRRL, ныне Национальный центр исследований в области сельскохозяйственного использования ) в Пеории, штат Иллинойс, где были созданы мощности для крупномасштабной ферментации. [96] Сразу же последовала массовая культура плесени и поиск лучших форм. [95]
14 марта 1942 года первый пациент был пролечен от стрептококкового сепсиса американским пенициллином производства компании Merck & Co. [97] Половина общего количества препарата, произведенного в то время, была использована для лечения одной пациентки, Энн Миллер. [98] К июню 1942 года в США было достаточно пенициллина для лечения десяти пациентов. [99] В июле 1943 года Совет военного производства разработал план массовой раздачи запасов пенициллина войскам союзников, сражавшимся в Европе. [100] Результаты исследований ферментации кукурузного настоя в NRRL позволили Соединенным Штатам произвести 2,3 миллиона доз ко времени вторжения в Нормандию весной 1944 года. После всемирных поисков в 1943 году была обнаружена заплесневелая дыня. на в Пеории, штат Иллинойс, рынке Было обнаружено, что он содержит лучший штамм плесени для производства с использованием процесса замачивания кукурузного щелока. [101] Pfizer Ученый компании Джаспер Х. Кейн предложил использовать метод глубокой ферментации для производства больших количеств пенициллина фармацевтического качества. [102] [26] : 109 Крупномасштабное производство стало результатом разработки инженером-химиком Маргарет Хатчинсон Руссо установки для глубокого брожения . [103] Как прямой результат войны и Управления военного производства, к июню 1945 года производилось более 646 миллиардов единиц техники в год. [100]
Дж. Рэймонд Реттью внес значительный вклад в американскую военную кампанию, разработав методы производства пенициллина в коммерческих количествах, при этом он объединил свои знания о грибной икре с функцией сепаратора сливок Sharples. [104] К 1943 году лаборатория Реттью производила большую часть пенициллина в мире. Во время Второй мировой войны пенициллин существенно повлиял на количество смертей и ампутаций, вызванных инфицированными ранами среди союзных войск, спасая примерно 12–15% жизней. [105] Однако доступность была сильно ограничена из-за сложности производства больших количеств пенициллина и быстрого почечного клиренса препарата, что требовало частого приема. Методы массового производства пенициллина были запатентованы Эндрю Джексоном Мойером в 1945 году. [106] [107] [108] посоветовал Флори не запатентовал пенициллин, поскольку сэр Генри Дейл ему сделать это неэтично. [89]
Пенициллин активно выводится из организма, и около 80% дозы пенициллина выводится из организма в течение трех-четырех часов после приема. Действительно, в раннюю эпоху пенициллина этот препарат был настолько дефицитен и так высоко ценился, что стало обычным делом собирать мочу у пациентов, проходящих лечение, чтобы пенициллин в моче можно было изолировать и использовать повторно. [109] Это не было удовлетворительным решением, поэтому исследователи искали способ замедлить выведение пенициллина. Они надеялись найти молекулу, которая могла бы конкурировать с пенициллином за переносчик органической кислоты, ответственный за выведение, так, чтобы переносчик преимущественно выделял конкурирующую молекулу, а пенициллин сохранялся. препарат пробенецид урикозурический . Подходящим оказался При совместном применении пробенецида и пенициллина пробенецид конкурентно ингибирует выведение пенициллина, увеличивая концентрацию пенициллина и продлевая его активность. В конце концов, появление методов массового производства и полусинтетических пенициллинов решило проблемы с поставками, поэтому использование пробенецида сократилось. [109] Однако пробенецид по-прежнему эффективен при некоторых инфекциях, требующих особенно высоких концентраций пенициллинов. [110]
После Второй мировой войны Австралия была первой страной, сделавшей этот препарат доступным для гражданского использования. В США пенициллин стал доступен широкой публике 15 марта 1945 года. [111]
Флеминг, Флори и Чейн разделили Нобелевскую премию по физиологии и медицине 1945 года за разработку пенициллина.
- Техник, готовящий пенициллин, 1943 год.
- Пенициллин начал массово производиться в 1944 году.
- Плакат времен Второй мировой войны, восхваляющий использование пенициллина
- Дороти Ходжкин определила химическую структуру пенициллина.
Определение структуры и полный синтез

Химическая структура пенициллина была впервые предложена Эдвардом Абрахамом в 1942 году. [87] и позже было подтверждено в 1945 году с помощью рентгеновской кристаллографии Дороти Кроуфут Ходжкин , которая также работала в Оксфорде. [112] Позже, в 1964 году, она получила Нобелевскую премию по химии за это и другие определения структуры.
Химик Джон Шиэн из Массачусетского технологического института (MIT) завершил первый химический синтез пенициллина в 1957 году. [113] [114] [115] Шиэн начал свои исследования синтеза пенициллина в 1948 году и в ходе этих исследований разработал новые методы синтеза пептидов , а также новые защитные группы — группы, которые маскируют реакционную способность определенных функциональных групп. [115] [116] Хотя первоначальный синтез, разработанный Шиханом, не подходил для массового производства пенициллинов, одним из промежуточных соединений в синтезе Шиэна была 6-аминопенициллановая кислота (6-АПК), ядро пенициллина. [113] [114] [115] [117]
6-APA была обнаружена исследователями из Beecham Research Laboratories (позже Beecham Group ) в Суррее в 1957 году (опубликовано в 1959 году). [118] Присоединение различных групп к «ядру» пенициллина 6-АПК позволило создать новые формы пенициллинов, более универсальные и обладающие лучшей активностью. [119]
Развитие пенициллина
Узкий диапазон излечимых заболеваний или «спектр активности» пенициллинов, наряду с плохой активностью перорально активного феноксиметилпенициллина, привели к поиску производных пенициллина, которые могли бы лечить более широкий спектр инфекций. Выделение 6-АРА, ядра пенициллина, позволило получить полусинтетические пенициллины с различными улучшениями по сравнению с бензилпенициллином (биодоступность, спектр, стабильность, переносимость).
Первой крупной разработкой стал ампициллин, появившийся в 1961 году. Он обладал более широким спектром действия, чем любой из оригинальных пенициллинов. Дальнейшая разработка привела к появлению пенициллинов, устойчивых к β-лактамазам, включая флуклоксациллин, диклоксациллин и метициллин. Они были значимы из-за своей активности против видов бактерий, продуцирующих β-лактамазу, но были неэффективны против метициллин-резистентных штаммов Staphylococcus aureus (MRSA), которые появились впоследствии. [120]
Еще одним развитием линии истинных пенициллинов стали антипсевдомонадные пенициллины, такие как карбенициллин, тикарциллин и пиперациллин, полезные благодаря своей активности против грамотрицательных бактерий. Однако полезность β-лактамного кольца была такова, что родственные антибиотики, включая мециллинамы, карбапенемы и, что наиболее важно, цефалоспорины, все еще сохраняют его в центре своей структуры. [121]
Производство

Пенициллин получают путем ферментации различных видов сахара грибом Penicillium Rubens . [122] В процессе ферментации образуется пенициллин в качестве вторичного метаболита , когда рост грибка подавляется стрессом. [122] Путь биосинтеза, описанный ниже, подвергается ингибированию по принципу обратной связи с участием побочного продукта. L -лизин ингибирует фермент гомоцитратсинтазу . [123]
Клетки Penicillium выращивают с использованием метода, называемого периодической культурой с подпиткой, при котором клетки постоянно подвергаются стрессу, необходимому для индукции производства пенициллина. Хотя использование глюкозы в качестве источника углерода подавляет ферменты биосинтеза пенициллина, лактоза не оказывает никакого эффекта, а уровень щелочного pH подавляет эту регуляцию. Избыток фосфатов , доступного кислорода и использование аммония в качестве источника азота подавляют выработку пенициллина, в то время как метионин может действовать как единственный источник азота/серы со стимулирующим эффектом. [124]
Биотехнологический Penicillium метод направленной эволюции был применен для получения путем мутации большого числа штаммов . Эти методы включают подверженную ошибкам ПЦР , перетасовку ДНК , ITCHY и ПЦР с перекрытием цепей .
Полусинтетические пенициллины получают из ядра пенициллина 6-АРА.
Биосинтез

В целом, существует три основных и важных этапа биосинтеза пенициллина G (бензилпенициллина).
- Первым шагом является конденсация трех аминокислот — L -α-аминоадипиновой кислоты, L -цистеина и L -валина в трипептид . [125] [126] [127] Прежде чем конденсироваться в трипептид, аминокислота L -валин должна подвергнуться эпимеризации и превратиться в D -валин. [128] [129] Конденсированный трипептид называется δ-( L -α-аминоадипил) -L- цистеин- D -валин (ACV). Реакция конденсации и эпимеризация катализируются ферментом δ-( L -α-аминоадипил) -L -цистеин -D -валин-синтетазой (ACVS), нерибосомальной пептидной синтетазой или NRPS.
- Вторым этапом биосинтеза пенициллина G является окислительное превращение линейного ACV в бициклический промежуточный продукт изопенициллин N с помощью изопенициллин-N-синтазы (IPNS), который кодируется геном pcbC . [125] [126] Изопенициллин N является очень слабым промежуточным продуктом, поскольку не проявляет сильной антибиотической активности. [128]
- Последней стадией является трансамидирование изопенициллин N N-ацилтрансферазой , при котором α-аминоадипильная боковая цепь изопенициллина N удаляется и заменяется фенилацетильной боковой цепью. Эта реакция кодируется геном penDE , уникальным в процессе получения пенициллинов. [125]
См. также
Ссылки
- ^ Уоллинг А.Д. (15 сентября 2006 г.). «Советы из других журналов: использование антибиотиков во время беременности и лактации» . Американский семейный врач . 74 (6): 1035. Архивировано из оригинала 15 декабря 2016 года . Проверено 25 сентября 2015 г.
- ^ «Национальные исторические химические достопримечательности Американского химического общества. Производство пенициллина посредством глубокой ферментации» . Американское химическое общество . 12 июня 2008 г. Архивировано из оригинала 24 октября 2020 г. Проверено 15 июня 2022 г.
- ^ Баррейро К., Гарсиа-Эстрада К. (апрель 2019 г.). «Протеомика и Penicillium chrysogenum: раскрытие секретов производства пенициллина». Журнал протеомики . 198 . Эльзевир: 119–131. дои : 10.1016/j.jprot.2018.11.006 . ПМИД 30414515 . S2CID 53250114 .
- ^ Мештрович Т (29 августа 2018 г.). «Производство пенициллина» . Новости Медицинские науки о жизни . Архивировано из оригинала 4 апреля 2023 г. Проверено 15 июня 2022 г.
- ^ Ванат М., Антьеренс С., Батлер CC, Савик Л., Савик С., Павитт Ш. и др. (июнь 2021 г.). «Лечение аллергии на пенициллин в первичной медико-санитарной помощи: качественное исследование с участием пациентов и врачей первичной медико-санитарной помощи» . Семейная практика BMC . 22 (1): 112. дои : 10.1186/s12875-021-01465-1 . ПМЦ 8194168 . ПМИД 34116641 .
- ^ Лалчхандама К. (2020). «Переоценка соплей и плесени Флеминга» . Научное видение . 20 (1): 29–42. дои : 10.33493/scivis.20.01.03 .
- ^ Jump up to: Перейти обратно: а б Флеминг А (1943). «Стрептококковый менингит, лечение пенициллином». Ланцет . 242 (6267): 434–438. дои : 10.1016/S0140-6736(00)87452-8 .
- ^ Jump up to: Перейти обратно: а б с д и ж г час Робинсон Ф.А. (июль 1947 г.). «Химия пенициллина». Аналитик . 72 (856): 274–6. Бибкод : 1947Ана....72..274R . дои : 10.1039/an9477200274 . ПМИД 20259048 .
- ^ Диггинс ФВ (1999). «Правдивая история открытия пенициллина с опровержением дезинформации в литературе». Британский журнал биомедицинской науки . 56 (2): 83–93. ПМИД 10695047 .
- ^ Крылов А.К. (1929). «[Гастроэнтерологические аспекты клинической картины внутренних болезней]» . Терапевтический архив . 63 (2): 139–41. ПМК 2041430 . ПМИД 2048009 . ; Перепечатано как Флеминг А. (1979). «Об антибактериальном действии культур Penicillium с особым упором на их использование при выделении B. influenzae» . Британский журнал экспериментальной патологии . 60 (1): 3–13. JSTOR 4452419 . ПМК 2041430 .
- ^ Флеминг А (1945). «Нобелевская лекция» . www.nobelprize.org . Архивировано (PDF) из оригинала 31 марта 2018 г. Проверено 19 июля 2020 г.
- ^ Патрик Г.Л. (2017). Медицинская химия (6-е изд.). Оксфорд, Великобритания: Издательство Оксфордского университета. п. 425. ИСБН 978-0198749691 .
- ^ Jump up to: Перейти обратно: а б «Рекомендации Международной конференции по пенициллину». Наука . 101 (2611): 42–43. 12 января 1945 г. Бибкод : 1945Sci...101...42. . дои : 10.1126/science.101.2611.42 . ПМИД 17758593 .
- ^ Комитет медицинских исследований, Совет медицинских исследований (1945). «Химия пенициллина» . Наука . 102 (2660). Американская ассоциация содействия развитию науки: 627–629. Бибкод : 1945Sci...102..627M . дои : 10.1126/science.102.2660.627 . ISSN 0036-8075 . JSTOR 1673446 . ПМИД 17788243 . Архивировано из оригинала 9 мая 2022 года . Проверено 9 мая 2022 г.
- ^ Игл H (июль 1946 г.). «Относительная активность пенициллинов F, G, K и X против спирохет и стрептококков in vitro» . Журнал бактериологии . 52 (1): 81–8. дои : 10.1128/JB.52.1.81-88.1946 . ПМК 518141 . ПМИД 16561156 .
- ^ «Пенициллин Ф» . ПабХим . Национальный центр биотехнологической информации, Национальная медицинская библиотека. Архивировано из оригинала 07 мая 2021 г. Проверено 26 декабря 2020 г.
- ^ «Пенициллин Г» . ПабХим . Национальный центр биотехнологической информации, Национальная медицинская библиотека. Архивировано из оригинала 25 декабря 2020 г. Проверено 26 декабря 2020 г.
- ^ «Пенициллин Х» . ПабХим . Национальный центр биотехнологической информации, Национальная медицинская библиотека. Архивировано из оригинала 5 мая 2021 г. Проверено 26 декабря 2020 г.
- ^ «Пенициллин К» . ПабХим . Национальный центр биотехнологической информации, Национальная медицинская библиотека. Архивировано из оригинала 06 мая 2021 г. Проверено 26 декабря 2020 г.
- ^ «Пенициллин О» . ПабХим . Национальный центр биотехнологической информации, Национальная медицинская библиотека. Архивировано из оригинала 5 мая 2021 г. Проверено 26 декабря 2020 г.
- ^ Фишман Л.С., Хьюитт В.Л. (сентябрь 1970 г.). «Природные пенициллины». Медицинские клиники Северной Америки . 54 (5): 1081–99. дои : 10.1016/S0025-7125(16)32579-2 . ПМИД 4248661 .
- ^ Род Фармасьютикалс (30 ноября 2020 г.). «Бензилпенициллин натрия 1200 мг порошок для инъекций» . Справочник электронных лекарств . Datapharm Ltd. Архивировано из оригинала 15 января 2021 г. Проверено 28 декабря 2020 г.
- ^ Сандоз ГмбХ. «Пенициллин-ВК» (PDF) . FDA США. Архивировано (PDF) из оригинала 21 января 2021 г. Проверено 28 декабря 2020 г.
- ^ «Пенициллин, 5000 Оксфордских единиц» . Национальный музей американской истории . Центр Беринга, Вашингтон, округ Колумбия Архивировано из оригинала 06 мая 2021 г. . Проверено 28 декабря 2020 г.
- ^ Робинсон Г.Л. (февраль 1947 г.). «Пенициллины в общей практике» . Последипломный медицинский журнал . 23 (256): 86–92. дои : 10.1136/pgmj.23.256.86 . ПМК 2529492 . ПМИД 20284177 .
- ^ Jump up to: Перейти обратно: а б Гринвуд Д. (2008). Противомикробные препараты: хроника медицинского триумфа двадцатого века . Оксфорд, Великобритания: Издательство Оксфордского университета. п. 107. ИСБН 978-0-19-953484-5 .
- ^ Абрахам Э.П., Чейн Э., Флетчер С.М., Гарднер А.Д., Хитли Н.Г., Дженнингс М.А. и др. (1941). «Дальнейшие наблюдения за пенициллином». Ланцет . 238 (6155): 177–189. дои : 10.1016/S0140-6736(00)72122-2 .
- ^ Jump up to: Перейти обратно: а б Фостер Дж.В., Вудрафф Х.Б. (август 1943 г.). «Микробиологические аспекты пенициллина: I. Методы анализа» . Журнал бактериологии . 46 (2): 187–202. дои : 10.1128/JB.46.2.187-202.1943 . ПМК 373803 . ПМИД 16560688 .
- ^ Хартли П. (июнь 1945 г.). «Мировой стандарт и единицы пенициллина». Наука . 101 (2634): 637–8. Бибкод : 1945Sci...101..637H . дои : 10.1126/science.101.2634.637 . ПМИД 17844083 .
- ^ Хамфри Дж. Х., Мюссе М. В., Перри В. Л. (1953). «Второй международный стандарт пенициллина» . Бюллетень Всемирной организации здравоохранения . 9 (1): 15–28. ПМК 2542105 . ПМИД 13082387 .
- ^ Хамфри Дж. Х., Лайтбаун Дж. В., Массетт М. В. (1959). «Международный стандарт на феноксиметилпенициллин» . Бюллетень Всемирной организации здравоохранения . 20 (6): 1221–7. ПМЦ 2537888 . ПМИД 14405369 .
- ^ Хамфри Дж. Х., Лайтбаун Дж. В. (1954). «Международный эталонный препарат пенициллина К» . Бюллетень Всемирной организации здравоохранения . 10 (6): 895–9. ПМК 2542178 . ПМИД 13199652 .
- ^ «Пенициллин G для инъекций калия, USP» (PDF) . FDA США. Июль 2016 г. Архивировано (PDF) из оригинала 1 апреля 2021 г. Проверено 28 декабря 2020 г.
- ^ Панди Н., Каселла М. (2020), «Бета-лактамные антибиотики» , StatPearls , Остров сокровищ (Флорида): StatPearls Publishing, PMID 31424895 , заархивировано из оригинала 15 декабря 2020 г. , получено 5 января 2021 г.
- ^ Jump up to: Перейти обратно: а б Росси С., изд. (2006). Справочник австралийских лекарственных средств . Аделаида: Справочник австралийских лекарств. ISBN 978-0-9757919-2-9 .
- ^ Бхаттачарья С. (январь 2010 г.). «Факты об аллергии на пенициллин: обзор» . Журнал передовых фармацевтических технологий и исследований . 1 (1): 11–7. дои : 10.4103/2231-4040.70513 . ПМЦ 3255391 . ПМИД 22247826 .
- ^ Блюменталь К.Г., Питер Дж.Г., Трубиано Дж.А., Филлипс Э.Дж. (январь 2019 г.). «Аллергия на антибиотики» . Ланцет . 393 (10167): 183–198. дои : 10.1016/S0140-6736(18)32218-9 . ПМК 6563335 . ПМИД 30558872 .
- ^ Jump up to: Перейти обратно: а б Хитчингс А., Лонсдейл Д., Беррейдж Д., Бейкер Э. (2015). Топ-100 лекарств: клиническая фармакология и практическое назначение . Черчилль Ливингстон. стр. 174–181. ISBN 978-0-7020-5516-4 .
- ^ Ким К.К., Че Д.С. (2015). «Синдром Николау: обзор литературы» . Всемирный журнал дерматологии . 4 (2): 103. doi : 10.5314/wjd.v4.i2.103 .
- ^ Сапуто В., Бруни Дж. (1998). «[Синдром Николау, вызванный препаратами пенициллина: обзор литературы в поисках потенциальных факторов риска]». Медицинская и хирургическая педиатрия . 20 (2): 105–23. ПМИД 9706633 .
- ^ Jump up to: Перейти обратно: а б Фернандес Р., Амадор П., Пруденсио К. (2013). «β-Лактамы: химическая структура, механизм действия и механизмы резистентности» . Обзоры по медицинской микробиологии . 24 (1): 7–17. дои : 10.1097/MRM.0b013e3283587727 . hdl : 10400.22/7041 .
- ^ Николау (1996), стр. 43.
- ^ Фишер Дж. Ф., Мобашери С. (октябрь 2009 г.). «Три десятилетия ацил-фермента бета-лактамазы класса А» . Современная наука о белках и пептидах . 10 (5): 401–7. дои : 10.2174/138920309789351967 . ПМК 6902449 . ПМИД 19538154 .
- ^ Jump up to: Перейти обратно: а б Морелл Э.А., Балкин Д.М. (декабрь 2010 г.). «Метициллин-резистентный золотистый стафилококк: широко распространенный патоген подчеркивает необходимость разработки новых противомикробных препаратов» . Йельский журнал биологии и медицины . 83 (4): 223–33. ПМК 3002151 . ПМИД 21165342 .
- ^ Силхави Т.Дж., Кане Д., Уокер С. (май 2010 г.). «Оболочка бактериальной клетки» . Перспективы Колд-Спринг-Харбор в биологии . 2 (5): а000414. doi : 10.1101/cshperspect.a000414 . ПМЦ 2857177 . ПМИД 20452953 .
- ^ Jump up to: Перейти обратно: а б с Флеминг А (1929). «Об антибактериальном действии культур Penicillium с особым упором на их использование при выделении B. influenzæ» . Британский журнал экспериментальной патологии . 10 (3): 226–236. ПМК 2048009 . Перепечатано как Флеминг А. (1980). «Классика инфекционных болезней: об антибактериальном действии культур пенициллий с особым упором на их использование при выделении B. influenzae Александром Флемингом, перепечатано из Британского журнала экспериментальной патологии 10: 226–236, 1929» . Обзоры инфекционных болезней . 2 (1): 129–39. дои : 10.1093/clinids/2.1.129 . ПМК 2041430 . ПМИД 6994200 .
- ^ Jump up to: Перейти обратно: а б Ламберт П.А. (2002). «Клеточная непроницаемость и поглощение биоцидов и антибиотиков грамположительными бактериями и микобактериями». Журнал прикладной микробиологии . 92 (Дополнительно): 46S–54S. дои : 10.1046/j.1365-2672.92.5s1.7.x . ПМИД 12000612 . S2CID 24067247 .
- ^ Вергалли Дж., Бодренко И.В., Маси М., Мойние Л., Акоста-Гутьеррес С., Нейсмит Дж.Х. и др. (март 2020 г.). «Порины и транслокация малых молекул через внешнюю мембрану грамотрицательных бактерий» (PDF) . Обзоры природы. Микробиология . 18 (3): 164–176. дои : 10.1038/s41579-019-0294-2 . ПМИД 31792365 . S2CID 208520700 . Архивировано (PDF) из оригинала 22 октября 2021 г. Проверено 30 июля 2021 г.
- ^ Маси М., Винтерхальтер М., Пажес Ж.М. (2019). «Порины внешней мембраны». Стенки и мембраны бактериальных клеток . Субклеточная биохимия. Том. 92. стр. 79–123. дои : 10.1007/978-3-030-18768-2_4 . ISBN 978-3-030-18767-5 . ПМИД 31214985 . S2CID 195066847 .
- ^ Jump up to: Перейти обратно: а б с д Соареш ГМ, Фигейредо ЛК, Фавери М, Кортелли СК, Дуарте ПМ, Ферес М (2012). «Механизмы действия системных антибиотиков, применяемых при пародонтологическом лечении, и механизмы устойчивости бактерий к этим препаратам» . Журнал прикладной устной науки . 20 (3): 295–309. дои : 10.1590/s1678-77572012000300002 . ПМЦ 3881775 . ПМИД 22858695 .
- ^ Антоноплис А., Занг Х., Вегнер Т., Вендер П.А., Цегельски Л. (сентябрь 2019 г.). «Конъюгат ванкомицина-аргинина ингибирует рост устойчивой к карбапенемам кишечной палочки и воздействует на синтез клеточной стенки» . АКС Химическая биология . 14 (9): 2065–2070. doi : 10.1021/acschembio.9b00565 . ПМК 6793997 . ПМИД 31479234 .
- ^ Jump up to: Перейти обратно: а б Брейе З., Джубе Б., Караман Р. (март 2020 г.). «Резистентность грамотрицательных бактерий к современным антибактериальным средствам и подходы к ее решению» . Молекулы . 25 (6): 1340. doi : 10,3390/molecules25061340 . ПМЦ 7144564 . ПМИД 32187986 .
- ^ Jump up to: Перейти обратно: а б Кушни Т.П., О'Дрисколл, Н.Х., Лэмб А.Дж. (декабрь 2016 г.). «Морфологические и ультраструктурные изменения в бактериальных клетках как показатель механизма антибактериального действия» . Клеточные и молекулярные науки о жизни . 73 (23): 4471–4492. дои : 10.1007/s00018-016-2302-2 . hdl : 10059/2129 . ПМЦ 11108400 . ПМИД 27392605 . S2CID 2065821 . Архивировано из оригинала 07.10.2017 . Проверено 10 октября 2019 г.
- ^ Йокум Р.Р., Расмуссен-младший, Стромингер Дж.Л. (май 1980 г.). «Механизм действия пенициллина. Пенициллин ацилирует активный центр D-аланинкарбоксипептидазы Bacillus stearothermophilus» . Журнал биологической химии . 255 (9): 3977–86. дои : 10.1016/S0021-9258(19)85621-1 . ПМИД 7372662 .
- ^ «Бензилпенициллин» . www.drugbank.ca . Архивировано из оригинала 23 января 2019 года . Проверено 22 января 2019 г.
- ^ ДеМестер К.Е., Лян Х., Дженсен М.Р., Джонс З.С., Д'Амброзио Е.А., Сцинто С.Л. и др. (август 2018 г.). «Синтез функционализированных N-ацетилмурамовых кислот для исследования рециркуляции и биосинтеза клеточной стенки бактерий» . Журнал Американского химического общества . 140 (30): 9458–9465. дои : 10.1021/jacs.8b03304 . ПМК 6112571 . ПМИД 29986130 .
- ^ Гордон Э., Муз Н., Дуэ Э., Дидеберг О. (июнь 2000 г.). «Кристаллическая структура пенициллинсвязывающего белка 2x из Streptococcus pneumoniae и его ацил-ферментной формы: влияние на лекарственную устойчивость». Журнал молекулярной биологии . 299 (2): 477–85. дои : 10.1006/jmbi.2000.3740 . ПМИД 10860753 .
- ^ Ван Бамбеке Ф., Ламберт Д., член парламента Минжо-Леклерка, Тулкенс П. (1999). Механизм действия (PDF) . Архивировано (PDF) из оригинала 25 января 2022 г. Проверено 13 марта 2014 г.
- ^ Уинстенли Т.Г., Гастингс Дж.Г. (февраль 1989 г.). «Синергия пенициллина и аминогликозидов и постантибиотический эффект на энтерококки». Журнал антимикробной химиотерапии . 23 (2): 189–99. дои : 10.1093/jac/23.2.189 . ПМИД 2708179 .
- ^ Кастен Б., Рески Р. (30 марта 1997 г.). «β-лактамные антибиотики ингибируют деление хлоропластов у мха (Physcomitrella patens), но не у томата (Lycopersicon esculentum)» . Журнал физиологии растений . 150 (1–2): 137–140. Бибкод : 1997JPPhy.150..137K . дои : 10.1016/S0176-1617(97)80193-9 . Архивировано из оригинала 21 июля 2011 года . Проверено 30 марта 2009 г.
- ^ Jump up to: Перейти обратно: а б Левисон М.Э., Левисон Дж.Х. (декабрь 2009 г.). «Фармакокинетика и фармакодинамика антибактериальных средств» . Клиники инфекционных заболеваний Северной Америки . 23 (4): 791–815, vii. дои : 10.1016/j.idc.2009.06.008 . ПМЦ 3675903 . ПМИД 19909885 .
- ^ Уолтон А.Л., Хауден Б.П., Грейсон Л.М., Корман Т.М. (май 2007 г.). «Домашняя терапия пенициллином с постоянной инфузией при серьезных инфекциях, вызванных чувствительными к пенициллину патогенами». Международный журнал противомикробных средств . 29 (5): 544–8. дои : 10.1016/j.ijantimicag.2006.10.018 . ПМИД 17398076 .
- ^ Jump up to: Перейти обратно: а б Авраам Э.П., Чейн Э (1940). «Фермент бактерий, способный разрушать пенициллин. 1940 год» . Обзоры инфекционных болезней . 10 (4): 677–8. Бибкод : 1940Natur.146..837A . дои : 10.1038/146837a0 . ПМИД 3055168 . S2CID 4070796 .
- ^ Райс Л.Б. (февраль 2012 г.). «Механизмы резистентности и клиническая значимость резистентности к β-лактамам, гликопептидам и фторхинолонам» . Труды клиники Мэйо . 87 (2): 198–208. дои : 10.1016/j.mayocp.2011.12.003 . ПМЦ 3498059 . ПМИД 22305032 .
- ^ Пажес Ж.М., Джеймс С.Э., Винтерхальтер М. (декабрь 2008 г.). «Порин и проникающий антибиотик: селективный диффузионный барьер у грамотрицательных бактерий» (PDF) . Обзоры природы. Микробиология . 6 (12): 893–903. дои : 10.1038/nrmicro1994 . ПМИД 18997824 . S2CID 6969441 . Архивировано (PDF) из оригинала 23 ноября 2018 г. Проверено 30 июля 2021 г.
- ^ Джейкобс М.Р. (май 1999 г.). «Лекарственно-устойчивый Streptococcus pneumoniae: рациональный выбор антибиотиков». Американский медицинский журнал . 106 (5А): 19С–25С, обсуждение 48С-52С. дои : 10.1016/s0002-9343(98)00351-9 . ПМИД 10348060 .
- ^ Jump up to: Перейти обратно: а б Запун А., Контрерас-Мартель С., Верне Т. (март 2008 г.). «Пенициллинсвязывающие белки и устойчивость к бета-лактамам» . Обзоры микробиологии FEMS . 32 (2): 361–85. дои : 10.1111/j.1574-6976.2007.00095.x . ПМИД 18248419 .
- ^ Пикок С.Дж., Патерсон Г.К. (2015). «Механизмы устойчивости золотистого стафилококка к метициллину» (PDF) . Ежегодный обзор биохимии . 84 : 577–601. doi : 10.1146/annurev-biochem-060614-034516 . ПМИД 26034890 .
- ^ Рейгарт В. (2009). «Метициллин-резистентный золотистый стафилококк (MRSA): молекулярные аспекты устойчивости к противомикробным препаратам и вирулентности» . Клиническая лабораторная наука . 22 (2): 115–9. ПМИД 19534446 . Архивировано из оригинала 12 января 2021 г. Проверено 08 января 2021 г.
- ^ Римбара Э., Мори С., Ким Х., Сузуки М., Сибаяма К. (февраль 2018 г.). «Мутации в генах, кодирующих пенициллин-связывающие белки и откачивающие насосы, играют роль в резистентности к β-лактамам у Helicobacter cinaedi» . Антимикробные средства и химиотерапия . 62 (2): e02036-17. дои : 10.1128/AAC.02036-17 . ПМЦ 5786776 . ПМИД 29203490 .
- ^ Тук К.Л., Хинчлифф П., Брэггинтон Э.К., Коленсо К.К., Хирвонен В.Х., Такебаяши Ю. и др. (август 2019 г.). «β-лактамазы и ингибиторы β-лактамаз в 21 веке» . Журнал молекулярной биологии . 431 (18): 3472–3500. дои : 10.1016/j.jmb.2019.04.002 . ПМЦ 6723624 . ПМИД 30959050 .
- ^ Jump up to: Перейти обратно: а б Бономо РА (январь 2017 г.). «β-лактамазы: в центре внимания текущие проблемы» . Перспективы Колд-Спринг-Харбора в медицине . 7 (1): а025239. doi : 10.1101/cshperspect.a025239 . ПМК 5204326 . ПМИД 27742735 .
- ^ Дэвис Дж., Дэвис Д. (сентябрь 2010 г.). «Происхождение и эволюция устойчивости к антибиотикам» . Обзоры микробиологии и молекулярной биологии . 74 (3): 417–33. дои : 10.1128/MMBR.00016-10 . ПМЦ 2937522 . ПМИД 20805405 .
- ^ Буш К. (октябрь 2018 г.). «Прошлые и настоящие перспективы β-лактамаз» . Антимикробные средства и химиотерапия . 62 (10): e01076-18. дои : 10.1128/AAC.01076-18 . ПМК 6153792 . ПМИД 30061284 .
- ^ Панг З., Раудонис Р., Глик Б.Р., Лин Т.Дж., Ченг З. (2019). «Устойчивость к антибиотикам у Pseudomonas aeruginosa: механизмы и альтернативные терапевтические стратегии» . Достижения биотехнологии . 37 (1): 177–192. дои : 10.1016/j.biotechadv.2018.11.013 . ПМИД 30500353 .
- ^ Догерти Т.Дж., Пуччи М.Дж. (2011). Открытие и разработка антибиотиков . Springer Science & Business Media. стр. 79–80.
- ^ Ландау Р., Ахилладелис Б., Скрябин А. (1999). Фармацевтические инновации: революция в здравоохранении человека . Фонд химического наследия. п. 162.
- ^ Хейвен К.Ф. (1994). Чудеса науки: 50 увлекательных 5-минутных чтений . Литтлтон, Колорадо: Безлимитные библиотеки. п. 182. ИСБН 978-1-56308-159-0 .
- ^ Баучер Х.В., Талбот Г.Х., Бенджамин Д.К., Брэдли Дж., Гвидос Р.Дж., Джонс Р.Н. и др. (июнь 2013 г.). «Прогресс 10 x '20 — разработка новых лекарств, активных против грамотрицательных бацилл: обновленная информация Американского общества инфекционистов» . Клинические инфекционные болезни . 56 (12): 1685–1694. дои : 10.3201/eid2305.161556 . ПМК 5403050 .
- ^ Хубракен Дж., Фрисвад Дж.К., Самсон Р.А. (июнь 2011 г.). «Штамм Флеминга, продуцирующий пенициллин, - это не Penicillium chrysogenum, а P. Rubens» . ИМА Гриб . 2 (1): 87–95. дои : 10.5598/imafungus.2011.02.01.12 . ПМЦ 3317369 . ПМИД 22679592 .
- ^ Jump up to: Перейти обратно: а б с Лакс Э (2004). Плесень в пальто доктора Флори: история пенициллинового чуда . Холт в мягкой обложке. ISBN 978-0-8050-7778-0 .
- ^ Крылов А.К. (1991). «[Гастроэнтерологические аспекты клинической картины внутренних болезней]». Терапевтический архив . 63 (2): 139–41. ПМИД 2048009 .
- ^ «Открытие и разработка пенициллина» . Международные исторические химические достопримечательности . Американское химическое общество. Архивировано из оригинала 28 июня 2019 года . Проверено 21 августа 2018 г.
- ^ Уэйнрайт М., Свон Х.Т. (январь 1986 г.). «К. Г. Пейн и самые ранние из сохранившихся клинических записей пенициллиновой терапии» . Медицинская история . 30 (1): 42–56. дои : 10.1017/S0025727300045026 . ПМЦ 1139580 . ПМИД 3511336 .
- ^ Хауи Дж. (июль 1986 г.). «Пенициллин: 1929-40» . Британский медицинский журнал . 293 (6540): 158–9. дои : 10.1136/bmj.293.6540.158 . ПМЦ 1340901 . ПМИД 3089435 .
- ^ Уэйнрайт М. (январь 1987 г.). «История терапевтического применения сырого пенициллина» . Медицинская история . 31 (1): 41–50. дои : 10.1017/s0025727300046305 . ПМЦ 1139683 . ПМИД 3543562 .
- ^ Jump up to: Перейти обратно: а б Джонс Д.С., Джонс Дж.Х. (01 декабря 2014 г.). «Сэр Эдвард Пенли Абрахам CBE. 10 июня 1913 г. - 9 мая 1999 г.» . Биографические мемуары членов Королевского общества . 60 : 5–22. дои : 10.1098/rsbm.2014.0002 . ISSN 0080-4606 . S2CID 71557916 . Архивировано из оригинала 26 ноября 2023 года . Проверено 10 мая 2017 г.
- ^ «Эрнст Б. Чейн - Нобелевская лекция: Химическая структура пенициллинов» . www.nobelprize.org . Архивировано из оригинала 30 апреля 2017 г. Проверено 10 мая 2017 г.
- ^ Jump up to: Перейти обратно: а б с «Сделать пенициллин возможным: вспоминает Норман Хитли» . Научные часы . Томсон Сайентифик . 2007. Архивировано из оригинала 21 февраля 2007 года . Проверено 13 февраля 2007 г.
- ^ Леви С.Б. (2002). Антибиотический парадокс: как неправильное использование антибиотиков разрушает их лечебную силу . Да Капо Пресс. стр. 5–7. ISBN 978-0-7382-0440-6 .
- ^ Беннетт Дж.В., Чанг К.Т. (2001). «Александр Флеминг и открытие пенициллина». Достижения прикладной микробиологии . 49 . Эльзевир: 163–84. дои : 10.1016/s0065-2164(01)49013-7 . ISBN 978-0-12-002649-4 . ПМИД 11757350 .
- ^ Кэрнс Х., Левин В.С., Дати Э.С., Смит Х. (1944). «Пневмококковый менингит, лечение пенициллином». Ланцет . 243 (6299): 655–659. дои : 10.1016/S0140-6736(00)77085-1 .
- ^ Мэтьюз Дж. А. (2008). «Рождение эры биотехнологий: пенициллин в Австралии, 1943–80». Прометей . 26 (4): 317–333. дои : 10.1080/08109020802459306 . S2CID 143123783 .
- ^ Болдри П. (1976). Битва с бактериями: свежий взгляд . Архив Кубка. п. 115. ИСБН 978-0-521-21268-7 . Архивировано из оригинала 5 мая 2021 г. Проверено 31 декабря 2020 г.
- ^ Jump up to: Перейти обратно: а б Баучер Х.В., Талбот Г.Х., Бенджамин Д.К., Брэдли Дж., Гвидос Р.Дж., Джонс Р.Н. и др. (июнь 2013 г.). «Прогресс 10 x '20 — разработка новых лекарств, активных против грамотрицательных бацилл: обновленная информация Американского общества инфекционистов» . Клинические инфекционные болезни . 56 (12): 1685–94. дои : 10.1093/cid/cit152 . ПМК 3707426 . ПМИД 23599308 .
- ^ Кэрролл А. (2 июня 2014 г.). «Вот где: пенициллин приходит в Пеорию» . ИсторияНет . Архивировано из оригинала 07 января 2021 г. Проверено 4 января 2021 г.
- ^ Гроссман CM (июль 2008 г.). «Первое использование пенициллина в Соединенных Штатах». Анналы внутренней медицины . 149 (2): 135–6. дои : 10.7326/0003-4819-149-2-200807150-00009 . ПМИД 18626052 . S2CID 40197907 .
- ^ Ротман Л. (14 марта 2016 г.). «История пенициллина: что случилось с первым американским пациентом» . Время . Архивировано из оригинала 17 марта 2019 года . Проверено 12 марта 2019 г.
- ^ Мейлер Дж. С., Мейсон Б. «Пенициллин: чудодейственное лекарство военного времени и его производство в Пеории, штат Иллинойс» . lib.niu.edu. Архивировано из оригинала 7 октября 2018 года . Проверено 11 февраля 2008 г.
- ^ Jump up to: Перейти обратно: а б Параскандола Дж (1980). История антибиотиков: симпозиум . Американский институт истории фармацевтики № 5. ISBN 978-0-931292-08-8 .
- ^ «История пенициллина и антибиотиков» . МысльКо . Архивировано из оригинала 8 апреля 2023 г. Проверено 9 июня 2024 г.
- ^ Лерер С. (2006). Исследователи тела: драматические прорывы в медицине от древних времен до современной науки (2-е изд.). Нью-Йорк: iUniverse. стр. 329–330. ISBN 978-0-595-40731-6 .
- ^ Мадхаван Дж. (20 августа 2015 г.). Думайте как инженер . Публикации Oneworld. стр. 83–85, 91–93. ISBN 978-1-78074-637-1 . Архивировано из оригинала 23 марта 2017 года . Проверено 20 ноября 2016 г. .
- ^ «Исторический указатель Дж. Рэймонда Реттью» . Изучите сайт PAhistory.com . Архивировано из оригинала 5 января 2020 года . Проверено 27 июня 2019 г.
- ^ Гойотт Д. (2017). «Хирургическое наследие Второй мировой войны. Часть II: Эпоха антибиотиков» (PDF) . Хирургический технолог . 109 : 257–264. Архивировано (PDF) из оригинала 5 мая 2021 г. Проверено 08 января 2021 г.
- ^ США 2442141 , Мойер А.Дж., «Способ производства пенициллина», выдан 25 марта 1948 г., передан сельскому хозяйству США.
- ^ США 2443989 , Мойер А.Дж., «Способ производства пенициллина», выдан 22 июня 1948 г., передан сельскому хозяйству США.
- ^ США 2476107 , Мойер А.Дж., «Способ производства пенициллина», выдан 12 июля 1949 г., передан сельскому хозяйству США.
- ^ Jump up to: Перейти обратно: а б Сильверторн ДУ (2004). Физиология человека: комплексный подход (3-е изд.). Река Аппер-Седл (Нью-Джерси): Pearson Education. ISBN 978-0-8053-5957-2 .
- ^ Люке Пас Д., Лакбар И., Таттевин П. (март 2021 г.). «Обзор современных стратегий лечения инфекционного эндокардита». Экспертный обзор противоинфекционной терапии . 19 (3): 297–307. дои : 10.1080/14787210.2020.1822165 . ПМИД 32901532 . S2CID 221572394 .
- ^ «Открытие и разработка пенициллина» . Американское химическое общество . 1999. Архивировано из оригинала 03 января 2015 г. Проверено 4 января 2015 г.
- ^ «Нобелевская премия по химии 1964 года» . NobelPrize.org . Архивировано из оригинала 16 июля 2017 г. Проверено 9 мая 2022 г.
- ^ Jump up to: Перейти обратно: а б Шиэн Дж. К., Хенери-Логан К. Р. (5 марта 1957 г.). «Полный синтез пенициллина V». Журнал Американского химического общества . 79 (5): 1262–1263. дои : 10.1021/ja01562a063 .
- ^ Jump up to: Перейти обратно: а б Шихан Дж. К., Хенери-Логанм КР (20 июня 1959 г.). «Полный синтез пенициллина V». Журнал Американского химического общества . 81 (12): 3089–3094. дои : 10.1021/ja01521a044 .
- ^ Jump up to: Перейти обратно: а б с Кори Э.Дж. , Робертс Дж.Д. «Биографические мемуары: Джон Кларк Шиэн» . Пресса Национальной академии. Архивировано из оригинала 3 марта 2016 года . Проверено 28 января 2013 г.
- ^ Николау К.К. , Вурлумис Д., Винсингер Н., Баран П.С. (январь 2000 г.). «Искусство и наука тотального синтеза на заре двадцать первого века». Ангеванде Хеми . 39 (1): 44–122. doi : 10.1002/(SICI)1521-3773(20000103)39:1<44::AID-ANIE44>3.0.CO;2-L . ПМИД 10649349 .
- ^ «Профессор Джон Шиэн умер в возрасте 76 лет» . Новости МТИ . 1 апреля 1992 года. Архивировано из оригинала 30 июня 2008 года . Проверено 28 января 2013 г.
- ^ Бэтчелор Ф.Р., Дойл Ф.П., Нейлер Дж.Х., Ролинсон Г.Н. (январь 1959 г.). «Синтез пенициллина: 6-аминопенициллановая кислота при ферментации пенициллина». Природа . 183 (4656): 257–8. Бибкод : 1959Natur.183..257B . дои : 10.1038/183257b0 . ПМИД 13622762 . S2CID 4268993 .
- ^ Ролинсон Г.Н., Геддес А.М. (январь 2007 г.). «50-летие открытия 6-аминопенициллановой кислоты (6-АПК)». Международный журнал противомикробных средств . 29 (1): 3–8. дои : 10.1016/j.ijantimicag.2006.09.003 . ПМИД 17137753 .
- ^ Колли Э.В., Макникол М.В., Бракен П.М. (март 1965 г.). «Метициллин-резистентные стафилококки в больнице общего профиля». Ланцет . 1 (7385): 595–7. дои : 10.1016/S0140-6736(65)91165-7 . ПМИД 14250094 .
- ^ Джеймс К.В., Гурк-Тернер С. (январь 2001 г.). «Перекрестная реактивность бета-лактамных антибиотиков» . Слушания . 14 (1): 106–7. дои : 10.1080/08998280.2001.11927741 . ПМК 1291320 . ПМИД 16369597 .
- ^ Jump up to: Перейти обратно: а б Косалькова К., Санчес-Орехас И.С., Куэто Л., Гарсия-Эстрада К. (2021). «Ферментация Penicillium chrysogenum и анализ бензилпенициллина с помощью биоанализа и ВЭЖХ». В Баррейро С., Барредо Дж.Л. (ред.). Антимикробная терапия . Методы молекулярной биологии. Том. 2296. Нью-Йорк, штат Нью-Йорк: Springer US. стр. 195–207. дои : 10.1007/978-1-0716-1358-0_11 . ISBN 978-1-0716-1357-3 . ПМИД 33977449 .
- ^ Луэнго Х.М., Ревилла Г., Лопес М.Х., Вильянуэва Х.Р., Мартин Х.Ф. (декабрь 1980 г.). «Ингибирование и репрессия гомоцитратсинтазы лизином в Penicillium chrysogenum» . Журнал бактериологии . 144 (3): 869–876. дои : 10.1128/jb.144.3.869-876.1980 . ПМЦ 294747 . ПМИД 6777369 .
- ^ Озченгиз Г., Демейн А.Л. (01 марта 2013 г.). «Последние достижения в биосинтезе пенициллинов, цефалоспоринов и клавамов и его регуляция». Достижения биотехнологии . 31 (2): 287–311. doi : 10.1016/j.biotechadv.2012.12.001 . ПМИД 23228980 .
- ^ Jump up to: Перейти обратно: а б с Аль-Абдалла К., Бракхадж А.А., Герке А., Платтнер Х., Спрот П., Танчер А. (2004). «Регуляция биосинтеза пенициллина у нитчатых грибов». В Брахаге А.А. (ред.). Молекулярная биотехнология грибковых бета-лактамных антибиотиков и родственных им пептидсинтетаз . Достижения в области биохимической инженерии/биотехнологии. Том. 88. стр. 45–90. дои : 10.1007/b99257 . ISBN 978-3-540-22032-9 . ПМИД 15719552 .
- ^ Jump up to: Перейти обратно: а б Брахаге А.А. (сентябрь 1998 г.). «Молекулярная регуляция биосинтеза бета-лактамов у мицелиальных грибов» . Обзоры микробиологии и молекулярной биологии . 62 (3): 547–85. дои : 10.1128/MMBR.62.3.547-585.1998 . ПМК 98925 . ПМИД 9729600 .
- ^ Шофилд С.Дж., Болдуин Дж.Э., Байфорд М.Ф., Клифтон И., Хайду Дж., Хенсгенс С. и др. (декабрь 1997 г.). «Белки пути биосинтеза пенициллина». Современное мнение в области структурной биологии . 7 (6): 857–64. дои : 10.1016/s0959-440x(97)80158-3 . ПМИД 9434907 .
- ^ Jump up to: Перейти обратно: а б Мартин Х.Ф., Гутьеррес С., Фернандес Ф.Х., Веласко Х., Фиерро Ф., Маркос А.Т. и др. (сентябрь 1994 г.). «Экспрессия генов и обработка ферментов биосинтеза пенициллинов и цефалоспоринов». Антони ван Левенгук . 65 (3): 227–43. дои : 10.1007/BF00871951 . ПМИД 7847890 . S2CID 25327312 .
- ^ Бейкер В.Л., Лонерган Г.Т. (декабрь 2002 г.). «Химия некоторых производных флуорескамина-амина, имеющих отношение к биосинтезу бензилпенициллина путем ферментации». Журнал химической технологии и биотехнологии . 77 (12): 1283–8. Бибкод : 2002JCTB...77.1283B . дои : 10.1002/jctb.706 .
Дальнейшее чтение
- Николау К.К. , Кори Э.Дж. (1996). Классика в тотальном синтезе: цели, стратегии, методы (5-е изд.). Вайнхайм: ВЧ. ISBN 978-3-527-29284-4 .
- Дюркхаймер В., Блюмбах Дж., Латтрелл Р., Шойнеманн К.Х. (1 марта 1985 г.). «Последние разработки в области β-лактамных антибиотиков». Angewandte Chemie International Edition на английском языке . 24 (3): 180–202. дои : 10.1002/anie.198501801 .
- Хамед Р.Б., Гомес-Кастелланос-младший, Генри Л., Духо С., Макдонаф М.А., Шофилд С.Дж. (январь 2013 г.). «Ферменты биосинтеза β-лактамов». Отчеты о натуральных продуктах . 30 (1): 21–107. дои : 10.1039/c2np20065a . ПМИД 23135477 .
- Лакс Э (2004). Плесень в пальто доктора Флори: история пенициллинового чуда . Генри Холта и компании ISBN 978-0805067903 .
Внешние ссылки
- Модель структуры пенициллина , Дороти Ходжкин и др., Музей истории науки, Оксфорд.
- Открытие пенициллина , снятый правительством фильм об открытии пенициллина сэром Александром Флемингом и продолжающемся развитии его использования в качестве антибиотика Говардом Флори и Эрнстом Борисом Чейном на YouTube .
- Пенициллин в Периодической таблице видео (Ноттингемский университет)
- «Пенициллин, выпущенный гражданским лицам, будет стоить 35 долларов на пациента» , Popular Science , август 1944 г., статья внизу страницы.
- Эпизод 2 (из 4): «Медицинские препараты» шоу BBC Four и PBS : Дополнительная жизнь: Краткая история продолжительной жизни (2021)



