Аланиновая рацемаза
| аланин рацемаза | |||
|---|---|---|---|
 Гомотетрамер аланинрацемазы, Oenococcus oeni | |||
| Идентификаторы | |||
| Номер ЕС. | 5.1.1.1 | ||
| Номер CAS. | 9024-06-0 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| Ала_racemase_N | |||
|---|---|---|---|
 Кристаллическая структура аланинрацемазы патогенной бактерии Psedsmonas aeruginosa размером 1,45 Å содержит как внутреннюю, так и внешнюю формы альдимина. | |||
| Идентификаторы | |||
| Символ | Ала_racemase_N | ||
| Пфам | PF01168 | ||
| Пфам Клан | CL0036 | ||
| ИнтерПро | ИПР001608 | ||
| PROSITE | PDOC00332 | ||
| СКОП2 | 1sft / SCOPe / СУПФАМ | ||
| |||
| Ала_racemase_C | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | Ала_racemase_C | ||
| Пфам | PF00842 | ||
| ИнтерПро | ИПР011079 | ||
| PROSITE | PDOC00332 | ||
| СКОП2 | 1sft / SCOPe / СУПФАМ | ||
| |||
В энзимологии аланинрацемаза , ( КФ 5.1.1.1 ) представляет собой фермент катализирующий реакцию химическую .
- L-аланин D-аланин
Следовательно, этот фермент имеет один субстрат — L-аланин и один продукт — D-аланин .
Этот фермент принадлежит к семейству изомераз , а именно к рацемазам и эпимеразам, действующим на аминокислоты и их производные. Систематическое название этого класса ферментов — аланинрацемаза . Этот фермент также называют L-аланинрацемазой . Этот фермент участвует в аланина и аспартата метаболизме , а также метаболизме D- аланина . В нем используется один кофактор – пиридоксальфосфат . по крайней мере два соединения, 3-фтор-D-аланин и D-циклосерин, Известно, что ингибируют этот фермент .
D-аланин, продуцируемый аланинрацемазой, используется для биосинтеза пептидогликана. Пептидогликан содержится в клеточных стенках всех бактерий, в том числе многих вредных для человека. Фермент отсутствует у высших эукариот, но встречается повсеместно у прокариот, что делает аланинрацемазу отличной мишенью для разработки противомикробных препаратов. [1] Аланинрацемазу можно обнаружить у некоторых беспозвоночных. [2]
Бактерии могут иметь один (ген alr) или два гена аланинрацемазы. У видов бактерий с двумя генами аланинрацемазы один из них экспрессируется постоянно, а другой индуцируется, что затрудняет выборку обоих генов для исследований лекарств. Однако нокаутные исследования показали, что без экспрессии гена alr бактериям для выживания потребуется внешний источник D-аланина. Таким образом, ген alr является возможной мишенью для противомикробных препаратов. [1]
По состоянию на 2002 год аланинрацемаза - единственный известный белок, содержащий левую α-спираль из 5 аминокислот, самую длинную левую α-спираль, обнаруженную на тот момент. [3]
Структурные исследования
[ редактировать ]Чтобы катализировать взаимное превращение D и L аланина, аланиновая рацемаза должна располагать остатки, способные обмениваться протонами, по обе стороны от альфа-углерода аланина. Структурные исследования комплексов фермент-ингибитор позволяют предположить, что этими остатками являются тирозин 265 и лизин 39. Альфа-протон L-энантиомера ориентирован на Tyr265, а альфа-протон D-энантиомера ориентирован на Lys39 (рис. 1).
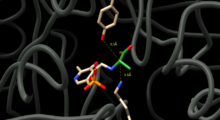
Расстояние между остатками фермента и энантиомерами составляет 3,5 Å и 3,6 Å соответственно. [4] Структурные исследования ферментных комплексов с синтетическим аналогом L-аланина – ингибитором прочного связывания [5] и пропионат [6] дополнительно подтвердите, что Tyr265 и Lys39 являются каталитическими основаниями реакции. [5] [7]
Комплексы PLP-L-Ala и PLP-D-Ala почти совмещаемы. [4] Области, которые не перекрываются, представляют собой плечи, соединяющие пиридиновое кольцо PLP и альфа-углерод аланина. Взаимодействие между атомами кислорода фосфата и атомами азота пиридина с 5'-фосфопиридоксильной областью PLP-Ala, вероятно, создает прочное связывание с ферментом. [4]

Структуру аланинрацемазы Bacillus stearothermophilus (Geobacillus stearothermophilus) определяли методом рентгеновской кристаллографии с разрешением 1,9 А. [7] аланинрацемазы Мономер состоит из двух доменов: восьмицепочечного альфа/бета-цилиндра на N-конце и С-концевого домена, по существу состоящего из бета-цепи. Модель двухдоменной структуры показана на рисунке 2. N-концевой домен также обнаружен в семействе белков PROSC ( пролинсинтетазой гомолог , котранскрибируемый бактериальный ), которые, как известно, не обладают аланинрацемазной активностью. Кофактор пиридоксаль-5'-фосфат (PLP) . расположен внутри и над устьем альфа/бета-цилиндра и ковалентно связан через альдиминовую связь с остатком лизина , который находится на С-конце первой бета-цепи альфа-цепи /бета-баррель.
Предлагаемый механизм
[ редактировать ]Механизмы реакции трудно полностью доказать экспериментально. Традиционный механизм, приписываемый аланинрацемазной реакции, представляет собой двухосновный механизм с промежуточным карбанионом, стабилизированным PLP. PLP используется в качестве стока электронов для стабилизации отрицательного заряда, возникающего в результате депротонирования альфа-углерода. Двухосновной механизм способствует специфичности реакции по сравнению с одноосновным механизмом. Второй каталитический остаток заранее расположен для быстрой отдачи протона после образования карбанионного промежуточного продукта и, таким образом, снижает вероятность возникновения альтернативных реакций. Как выявили Ватанабэ и др., есть два потенциальных конфликта с этим традиционным механизмом. Во-первых, Arg219 образует водородную связь с пиридиновым азотом PLP. [7] Группа аргинина имеет рКа около 12,6 и поэтому маловероятно, что она будет протонировать пиридин. Обычно в реакциях PLP кислый аминокислотный остаток, такой как группа карбоновой кислоты, с pKa около 5, протонирует пиридиновое кольцо. [8] Протонирование пиридинового азота позволяет азоту принять дополнительный отрицательный заряд. Следовательно, из-за Arg219 образование промежуточного карбаниона, стабилизированного PLP, менее вероятно. Другая выявленная проблема заключалась в необходимости другого основного остатка для возврата Lys39 и Tyr265 обратно в их протонированные и непротонированные формы для L-аланина и наоборот для D-аланина. Ватанабэ и др. не обнаружили аминокислотных остатков или молекул воды, кроме карбоксилатной группы PLP-Ala, которые были бы достаточно близки (в пределах 4,5 А) для протонирования или депротонирования Lys или Tyr. Это показано на рисунке 3. [4]

На основе кристаллических структур N-(5'-фосфопиридоксил) L-аланина (PKP-L-Ala ( и N-(5'-фосфопиридоксил) D-аланина (PLP-D-Ala)
Ватанабэ и др. предложил альтернативный механизм в 2002 году, как видно на рисунке 4. В этом механизме карбоксилатные атомы кислорода PLP-Ala непосредственно участвуют в катализе, опосредуя перенос протона между Lys39 и Tyr265. Кристаллизационная структура показала, что отношение карбоксилатного кислорода PLP-L-Ala к OH Tyr265 составляло всего 3,6 А, а соотношение карбоксилатного кислорода PLP-L-Ala к азоту Lys39 составляло только 3,5 А. Следовательно, оба были достаточно близки, чтобы вызвать реакцию.

Этот механизм поддерживается мутациями Arg219. Мутации, превращающие Arg219 в карбоксилат, приводят к обнаружению хиноноидного промежуточного соединения, тогда как с аргинином ничего не было обнаружено. [9] Промежуточное соединение аргинин имеет гораздо больше свободной энергии и более нестабильно, чем мутанты с кислотным остатком. [8] Дестабилизация промежуточного продукта повышает специфичность реакции. [9] [10]
Ссылки
[ редактировать ]- ^ Jump up to: а б Миллиган Дэниел Л.; и др. (2007). «Аланиновая рацемаза Mycobacterium smegmatis необходима для роста в отсутствие D-аланина» . Журнал бактериологии . 189 (22): 8381–8386. дои : 10.1128/jb.01201-07 . ПМК 2168708 . ПМИД 17827284 .
- ^ Абэ, Х; Ёсикава, Н.; Саровер, МГ; Окада, С. (2005). «Физиологическая функция и метаболизм свободного D-аланина у водных животных» . Биологический и фармацевтический вестник . 28 (9): 1571–7. дои : 10.1248/bpb.28.1571 . ПМИД 16141518 .
- ^ Ховмеллер, Свен; Чжоу, Тупин; Олсон, Томас (май 2002 г.). «Конформации аминокислот в белках» . Акта Кристаллографика. Раздел D. Биологическая кристаллография . 58 (Часть 5): 768–776. дои : 10.1107/s0907444902003359 . ISSN 0907-4449 . ПМИД 11976487 .
- ^ Jump up to: а б с д Ватанабе А., Ёсимура Т., Миками Б., Хаяси Х., Кагамияма Х., Эсаки Н. (2002) Механизм реакции аланинрацемазы из Bacillus stearothermophilus: рентгеновские кристаллографические исследования связанного фермента внутри -(5'-фосфопиридоксил)аланина. Journal of Biological Chemistry 277, 19166-19172.
- ^ Jump up to: а б Стампер Г.Ф., Моролло А.А. и Ринге Д. (1998) Биохимия 37,10438 –10445
- ^ Моролло А.А., Пецко Г.А. и Ринге Д. (1999) Биохимия 38, 3293–3301.
- ^ Jump up to: а б с Шоу Дж. П., Петско Г. А. и Ринг Д. (1997) Определение структуры аланинрацемазы из Bacillus stearothermophilus при разрешении 1,9-A. Биохимия 36, 1329–1342.
- ^ Jump up to: а б Тони, Майкл Д. (2004) Специфичность реакции ферментов пиридоксальфосфата, Архивы биохимии и биофизики 433, 279-287.
- ^ Jump up to: а б Сан С., Тони, доктор медицинских наук (1998) Доказательства двухосновного механизма с участием тирозина-265 из мутантов аргинина-219 по аланиновой рацемазе. Биохимия 38, 4058-4065.
- ^ Рубинштейн, А., Майор, Д.Т. (2010) Понимание каталитической специфичности аланиновой рацемазы на основе квантово-механического молекулярно-механического моделирования биохимии мутанта аргинина 210 49, 3957-3963.
Дальнейшее чтение
[ редактировать ]- МАРР АГ, УИЛСОН П.В. (1954). «Аланиновая рацемаза Brucella abortus». Арх. Биохим. Биофиз . 49 (2): 424–33. дои : 10.1016/0003-9861(54)90211-8 . ПМИД 13159289 .
- Вуд, Вашингтон (1955). [25] Рацемазы аминокислот . Методы энзимологии. Том. 2. С. 212–217. дои : 10.1016/S0076-6879(55)02189-7 . ISBN 9780121818029 .
- ВУД ВА, ГУНСАЛУС IC (1951). «Образование D-аланина; рацемаза у Streptococcus faecalis» . Ж. Биол. Хим . 190 (1): 403–16. дои : 10.1016/S0021-9258(18)56082-8 . ПМИД 14841188 .
