Рамоплан
 Структура Рамопланина А2 с вариабельной ацильной боковой цепью, выделенной синим цветом. | |
| Клинические данные | |
|---|---|
| Маршруты администрация | Оральный |
| код АТС |
|
| Юридический статус | |
| Юридический статус |
|
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| Информационная карта ECHA | 100.161.388 |
| Химические и физические данные | |
| Формула | С 119 Н 154 Cl N 21 О 40 |
| Молярная масса | 2 554 .10 g·mol −1 |
| 3D model ( JSmol ) | |
| | |
Рамопланин ( МНН ) представляет собой гликолиподепсипептидный антибиотик , полученный из штамма ATCC 33076 Actinoplanes . [1] Эффективен против грамположительных бактерий. [2]
Механизм
[ редактировать ]Он оказывает бактерицидное действие путем ингибирования биосинтеза клеточной стенки , действуя путем ингибирования стадии трансгликозилирования синтеза пептидогликана . [3] Рамопланин специфически связывается и изолирует липидные промежуточные соединения I и II, предотвращая внутриклеточную гликозилтрансферазу (MurG) и другие этапы системы сборки пептидогликана. [4]
Использование
[ редактировать ]Его разработка была ускорена Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США в качестве лечения множественной устойчивой к антибиотикам Clostridium difficile инфекции желудочно-кишечного тракта . [5] В отличие от ванкомицина , он всасывается в желудочно-кишечном тракте, хотя нестабилен в кровотоке, поэтому его можно принимать только перорально при Clostridium difficile . инфекциях желудочно-кишечного тракта, вызванных [6] [7] [8]
Рамопланин «особенно полезен» в случаях E. faecalis, независимо от его чувствительности к ванкомицину . [2]
Химия
[ редактировать ]Рамопланин представляет собой смесь трех родственных соединений, которые различаются по ацильной группе на N-конце Asn, причем наиболее распространенной формой (показана в информационном окне) является A2. [4] : Рис. 1
Синтез
[ редактировать ]Биосинтез
[ редактировать ]Биосинтез осуществляется кластером из 33 генов, содержащим гены нерибосомальных пептидсинтетаз и поддерживающие ферменты для синтеза аминокислот и жирных кислот, выявленный при секвенировании штамма-продуцента в 2002 году. Первоначальное исследование функций отдельных генов было проведено в 2012 году. [9]
Полный синтез
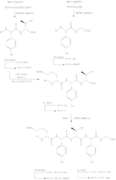
[ редактировать ]Общий синтез агликонов Рамопланина А1, А2 и А3 включает получение остатков 3–9 (гептапептид 15), пентадепсипептида 26 (остатки 1, 2 и 15–17) вместе с пентапептидом 34 (остатки 10–14), последующее связывание, и циклизация с образованием 49-членного агликонового ядра соединения. [10] Синтез агликона рамопланина А2 и агликона А3 очень похож на схему 6, где для агликона рамопланина А1 требуется соответствующая ацильная группа и ДМФ , тогда как для синтеза агликона рамопланина А3 необходимы как Bu
4 NF , i-PrOH , а затем обработка ацильной группой и ДМФ. [4]
- Синтез агликона рамопланина А2
- 1 - Синтез субъединицы Hpg3-Phe9
- 2. Получение Fmoc-L-HAsn(Trt)-Obn.
- 3 - Синтез депсипептидной субъединицы
- 4 - Синтез субъединицы Orn10-Gly14
- 5 – Получение ацильной группы
- 6 - Снятие защиты
Ссылки
[ редактировать ]- ^ Фарвер Д.К., Хедж Д.Д., Ли С.К. (май 2005 г.). «Рамопланин: липогликодепсипептидный антибиотик». Анналы фармакотерапии . 39 (5): 863–868. дои : 10.1345/aph.1E397 . ПМИД 15784805 . S2CID 6026698 .
- ^ Перейти обратно: а б Ли, виджей (01 января 2007 г.), Тейлор, Джон Б.; Триггл, Дэвид Дж. (ред.), «7.22 - Антиграмположительные агенты природного происхождения» , Comprehensive Medicinal Chemistry II , Oxford: Elsevier, стр. 653–671, doi : 10.1016/b0-08-045044-x /00222-4 , ISBN 978-0-08-045044-5 , получено 4 июня 2022 г.
- ^ Фанг X, Тиянонт К., Чжан Ю, Ваннер Дж., Богер Д., Уокер С. (январь 2006 г.). «Механизм действия рамопланина и эндурацидина». Молекулярные биосистемы . 2 (1): 69–76. дои : 10.1039/b515328j . ПМИД 16880924 .
- ^ Перейти обратно: а б с Шин Д., Рю Ю., Богер Д.Л. (август 2004 г.). «Полный синтез и структура агликонов рамопланин А1 и А3: два второстепенных компонента комплекса рамопланин» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (33): 11977–11979. дои : 10.1073/pnas.0401419101 . ПМК 514419 . ПМИД 15175429 .
- ^ Фулко П., Венцель Р.П. (декабрь 2006 г.). «Рамопланин: местное антибактериальное средство на основе липогликопсипептидов». Экспертный обзор противоинфекционной терапии . 4 (6): 939–945. дои : 10.1586/14787210.4.6.939 . ПМИД 17181409 . S2CID 12881565 .
- ^ Шейнфельд Н. (январь 2007 г.). «Сравнение доступных и исследуемых антибиотиков при осложненных кожных инфекциях и резистентных к лечению золотистых стафилококках и энтерококках». Журнал лекарств в дерматологии . 6 (1): 97–103. ПМИД 17373167 .
- ^ Балагопал А., Сирс CL (октябрь 2007 г.). «Clostridium difficile: новые терапевтические возможности». Современное мнение в фармакологии . 7 (5): 455–458. дои : 10.1016/j.coph.2007.05.007 . ПМИД 17644040 .
- ^ Гердинг Д.Н., Муто К.А., Оуэнс Р.К. (январь 2008 г.). «Лечение инфекции Clostridium difficile» . Клинические инфекционные болезни . 46 (Приложение 1): S32–S42. дои : 10.1086/521860 . ПМИД 18177219 .
- ^ Хёрц А.Дж., Гамбургер Дж.Б., Гуден Д.М., Беднар М.М., Маккафферти Д.Г. (январь 2012 г.). «Исследования по биосинтезу липодепсипептидного антибиотика Рамопланина А2». Биоорганическая и медицинская химия . 20 (2): 859–865. дои : 10.1016/j.bmc.2011.11.062 . ПМИД 22222159 .
- ^ Цзян В., Ваннер Дж., Ли Р.Дж., Буно П.Ю., Богер Д.Л. (февраль 2003 г.). «Полный синтез рамопланина А2 и агликона рамопланозы» . Журнал Американского химического общества . 125 (7): 1877–1887. дои : 10.1021/ja0212314 . ПМИД 12580615 .