Цефменоксим
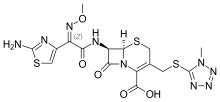 | |
| Клинические данные | |
|---|---|
| AHFS / Drugs.com | Международные названия лекарств |
| Маршруты администрация | Внутримышечный , внутривенный |
| код АТС | |
| Фармакокинетические данные | |
| Биодоступность | 100% (с учетом IM ) |
| Связывание с белками | от 50% до 70% |
| Метаболизм | Незначительный |
| Период полувыведения | 1 час |
| Экскреция | Почка , без изменений |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Химические и физические данные | |
| Формула | С 16 Ч 17 Н 9 О 5 С 3 |
| Молярная масса | 511.55 g·mol −1 |
| 3D model ( JSmol ) | |
| | |
Цефменоксим третьего поколения — цефалоспориновый антибиотик . [1]
Синтез
[ редактировать ]Алкилирование этил- 2 -гидроксиимино-3-оксобутаноата (1) диметилсульфатом дает этил (2Z)-2-метоксиимино-3-оксобутаноат (2). Галогенирование молекулярным бромом приводит к этиловому эфиру 4-бром-2-метоксиимино-3-оксобутаноата (3). Обработка тиомочевиной дает этил (Z)-2-(2-амино-4-тиазолил)-2-метоксииминоацетат (4), который подвергают реакции с хлорацетилхлоридом с образованием амида (5). Омыление гидроксидом калия дает (6), который галогенируют пентахлоридом фосфора до (7). Образование амида с промежуточным соединением цефалоспорина (8) затем дает (9). Удаление защитной группы бромидом бензилтриэтиламмония дает (10). Трет-бутиловый эфир снимали защиту с помощью трифторуксусной кислоты, получая (11). Наконец, образование тиоэфира с 5-меркапто-1-метилтетразолом (12) завершает синтез цефменоксима. [2] [3] [4] [5]
Ссылки
[ редактировать ]- ^ Камполи-Ричардс Д.М., Тодд П.А. (август 1987 г.). «Цефменоксим. Обзор его антибактериальной активности, фармакокинетических свойств и терапевтического применения». Наркотики . 34 (2): 188–221. дои : 10.2165/00003495-198734020-00002 . ПМИД 3304966 .
- ^ US 4098888 , Ochiai M, Okada T, Aki O, Morimoto A, Kawakita K, Matsushita Y, «Соединения тиазолилацетамидоцефалоспоринового типа», выдан 7 апреля 1978 г., передан Takeda Pharmaceutical Co Ltd.
- ^ Отиаи М., Аки О., Моримото А., Окада Т., Мацусита Ю. (ноябрь 1977 г.). «Новые производные цефалоспоринов с высокой антибактериальной активностью» . Химический и фармацевтический вестник . 25 (11): 3115–3117. дои : 10.1248/cpb.25.3115 . ПМИД 603968 .
- ^ Очиаи М., Моримото А., Мияваки Т., Мацусита Ю., Окада Т., Нацугари Х. и др. (февраль 1981 г.). «Синтез и взаимосвязь структура-активность производных 7 бета-[2-(2-аминотиазол-4-ил)ацетамидо]цефалоспорина. V. Синтез и антибактериальная активность 7 бета-[2-(2-аминотиазол-4-ил) Производные -2-метоксииминоацетамидо]-цефалоспорина и родственные соединения» . Журнал антибиотиков . 34 (2): 171–185. дои : 10.7164/антибиотики.34.171 . ПМИД 6271716 .
- ^ Отиаи М., Моримото А., Мияваки Т. (февраль 1981 г.). «Синтез и взаимосвязь структура-активность производных 7 бета-[2-(2-аминотиазол-4-ил)ацетамидо]цефалоспорина. VI. Альтернативные синтезы 7 бета-[2-(2-аминотиазол-4-ил)-( З)-2-метоксииминоацетамидо]производные цефалоспорина» . Журнал антибиотиков . 34 (2): 186–192. дои : 10.7164/антибиотики.34.186 . ПМИД 6271717 .
Дальнейшее чтение
[ редактировать ]- Ёкота Н., Когучи М., Сузуки Й., Фукаяма С., Исихара Р., Дегучи К. и др. (май 1995 г.). «[Антибактериальная активность цефменоксима против недавних свежих клинических изолятов от пациентов с синуситом]». Японский журнал антибиотиков . 48 (5): 602–609. ПМИД 7637194 .
- Паладино Дж.А., Фелл Р.Э. (март 1994 г.). «Фармакоэкономический анализ двойной индивидуализации цефменоксима в лечении внутрибольничной пневмонии». Анналы фармакотерапии . 28 (3): 384–389. дои : 10.1177/106002809402800316 . ПМИД 8193431 . S2CID 29444681 .
- Дункер Г.И., Райх У., Краусс Р. (1994). «Цефменоксим в культуре органов роговицы». Офтальмологическая. Международный журнал офтальмологии. Международный журнал офтальмологии. Журнал офтальмологии . 208 (5): 262–266. дои : 10.1159/000310505 . ПМИД 7816419 .
Внешние ссылки
[ редактировать ]- База данных болезней (DDB): 30892
