Клавулановая кислота
 | |
 | |
| Клинические данные | |
|---|---|
| Произношение | / ˌ k l æ v j ʊ ˈ l æ n ɪ k / |
| AHFS / Drugs.com | Международные названия лекарств |
| Беременность категория |
|
| Маршруты администрация | Орал, IV |
| код АТС |
|
| Юридический статус | |
| Юридический статус |
|
| Фармакокинетические данные | |
| Биодоступность | «Хорошо усваивается» |
| Метаболизм | Печеночная (обширная) |
| Период полувыведения | 1 час |
| Экскреция | Почечный (30–40%) |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.055.500 |
| Химические и физические данные | |
| Формула | C8H9NOC8H9NO5 |
| Молярная масса | 199.162 g·mol −1 |
| 3D model ( JSmol ) | |
| (проверять) | |
Клавулановая кислота представляет собой β-лактамный препарат , который действует как по механизму действия ингибитор β-лактамаз . Хотя сам по себе он не эффективен в качестве антибиотика , в сочетании с антибиотиками пенициллиновой группы он может преодолеть устойчивость к антибиотикам у бактерий , секретирующих β-лактамазу , которая в противном случае инактивирует большинство пенициллинов.
В наиболее распространенных препаратах клавуланат калия (клавулановая кислота в виде соли калия) сочетается с:
- амоксициллин ( ко-амоксиклав , торговые названия Аугментин, Клавулин, Тыклав, Клавасептин ( ветеринарный ), Клавамокс ( ветеринарный ), Синулокс ( ветеринарный ) и др.)
- тикарциллин ( ко-тикарклав , торговое название Тиментин)
Клавулановая кислота была запатентована в 1974 году. [1]
Медицинское использование
[ редактировать ]Амоксициллин-клавулановая кислота является препаратом первой линии для лечения многих типов инфекций, включая инфекции носовых пазух и инфекции мочевыводящих путей , включая пиелонефрит . Частично это связано с его эффективностью против грамотрицательных бактерий , которые, как правило, сложнее контролировать с помощью химиотерапевтических антибиотиков, чем грамположительные бактерии .
Побочные эффекты
[ редактировать ]Применение клавулановой кислоты с пенициллинами было связано с увеличением частоты холестатической желтухи и острого гепатита во время терапии или вскоре после нее. Сопутствующая желтуха обычно проходит самостоятельно и очень редко приводит к летальному исходу. [2] [3]
Комитет Великобритании по безопасности лекарственных средств (CSM) рекомендует применять такие методы лечения, как препараты амоксициллина/клавулановой кислоты, только для бактериальных инфекций, которые могут быть вызваны устойчивыми к амоксициллину штаммами, продуцирующими β-лактамазу, и что лечение обычно не должно превышать 14 дней.
аллергических реакциях . Сообщалось об [4]
Источники
[ редактировать ]Название происходит от штамма Streptomyces clavuligerus , который продуцирует клавулановую кислоту. [5] [6]
Биосинтез
[ редактировать ]
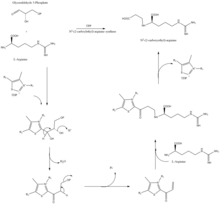
β - лактамоподобная структура клавулановой кислоты структурно похожа на пенициллин , но биосинтез этой молекулы включает другой биохимический путь. Клавулановая кислота производится бактерией Streptomyces clavuligerus с использованием глицеральдегид-3-фосфата и L -аргинина в качестве исходных материалов. [7] [8] Хотя каждый из промежуточных продуктов пути известен, точный механизм всех ферментативных реакций до конца не изучен. В этом процессе в основном участвуют 3 фермента: клаваминатсинтаза , β-лактамсинтетаза и N. 2 -(2-карбоксиэтил)-L-аргинин (СЕА) синтаза . [7] Клаваминатсинтаза представляет собой негемовую оксигеназу, зависящую от железа и α-кетоглутарата и кодируемую orf5 кластера генов клавулановой кислоты . Конкретный механизм работы этого фермента до конца не изучен, но этот фермент регулирует 3 этапа общего синтеза клавулановой кислоты. Все три стадии происходят в одной и той же области каталитического железосодержащего реакционного центра, но не происходят последовательно и затрагивают разные области структуры клавулановой кислоты. [9]
β-лактамсинтетаза представляет собой белок массой 54,5 кДа, который кодируется orf3 кластера генов клавулановой кислоты и демонстрирует сходство с аспарагинсинтазой – ферментами класса B. Точный механизм того, как этот фермент работает при синтезе β-лактама, не доказан, но считается, что он происходит в координации с СЕА-синтазой и АТФ . [10]

СЕА-синтаза представляет собой белок массой 60,9 кДа и является первым геном, обнаруженным в кластере генов биосинтеза клавулановой кислоты, кодируемом orf2 кластера генов клавулановой кислоты. Конкретный механизм работы этого фермента все еще исследуется; однако известно, что этот фермент обладает способностью связывать глицеральдегид-3-фосфат с L-аргинином в присутствии тиаминдифосфата (TDP или тиаминпирофосфата ), что является первой стадией биосинтеза клавулановой кислоты. [11]
История
[ редактировать ]Клавулановая кислота была открыта примерно в 1974-75 годах британскими учёными, работавшими в фармацевтической компании Beecham, из бактерий Streptomyces clavuligerus . [12] После нескольких попыток Бичем наконец подал заявку на патентную защиту препарата в США в 1981 году, и в 1985 году были выданы патенты США № 4 525 352, 4 529 720 и 4 560 552.
Клавулановая кислота обладает незначительной собственной антимикробной активностью, несмотря на то, что имеет общее β-лактамное кольцо, характерное для β-лактамных антибиотиков . Однако сходство химической структуры позволяет молекуле взаимодействовать с ферментом β-лактамазой, секретируемым некоторыми бактериями, придавая устойчивость к β-лактамным антибиотикам.
Клавулановая кислота является ингибитором суицида , ковалентно связываясь с остатком серина в активном центре β-лактамазы. Это реструктурирует молекулу клавулановой кислоты, создавая гораздо более реакционноспособную разновидность, которая атакует другую аминокислоту в активном центре, навсегда инактивируя ее и, таким образом, инактивируя фермент.
Это ингибирование восстанавливает антимикробную активность β-лактамных антибиотиков против бактерий, секретирующих лактамазу. Несмотря на это, появились штаммы бактерий, устойчивые даже к таким сочетаниям.
Ссылки
[ редактировать ]- ^ Фишер Дж., Ганеллин С.Р. (2006). Открытие аналоговых лекарств . Джон Уайли и сыновья. п. 490. ИСБН 9783527607495 .
- ^ Объединенный формулярный комитет. Британский национальный формуляр , 47-е издание. Лондон: Британская медицинская ассоциация и Королевское фармацевтическое общество Великобритании; 2004.
- ^ «Рекорд лекарств – Амоксициллин-клавуланат» . LiverTox - Клиническая и исследовательская информация о лекарственном повреждении печени . 2012. ПМИД 31643176 . Архивировано из оригинала 23 ноября 2016 года . Проверено 24 апреля 2013 г.
- ^ Тортахада Гирбес М., Феррер Франко А., Грасиа Антекера М., Клемент Паредес А., Гарсиа Муньос Э., Таллон Герола М. (2008). «Гиперчувствительность к клавулановой кислоте у детей» . Аллергология и иммунопатология . 36 (5): 308–310. дои : 10.1016/S0301-0546(08)75228-5 . ПМИД 19080805 . Архивировано из оригинала 7 апреля 2012 г. Проверено 11 ноября 2011 г.
- ^ Аруланантам Х., Кершоу, Нью-Джерси, Хьюитсон К.С., Хьюз С.Э., Тиркеттл Дж.Э., Шофилд С.Дж. (январь 2006 г.). «ORF17 из кластера генов биосинтеза клавулановой кислоты катализирует АТФ-зависимое образование N-глицилклавамининовой кислоты» . Журнал биологической химии . 281 (1): 279–287. дои : 10.1074/jbc.M507711200 . ПМИД 16251194 .
- ^ Талан К., Пак Х.У., Вонг А., Битти П.Х., Дженсен С.Е. (март 2004 г.). «Два набора паралогичных генов кодируют ферменты, участвующие в ранних стадиях биосинтеза клавулановой кислоты и метаболита клавама у Streptomyces clavuligerus» . Антимикробные средства и химиотерапия . 48 (3): 930–939. doi : 10.1128/AAC.48.3.930-939.2004 . ПМК 353097 . ПМИД 14982786 .
- ^ Перейти обратно: а б с д и Таунсенд, Калифорния (октябрь 2002 г.). «Новые реакции биосинтеза клавулановой кислоты». Современное мнение в области химической биологии . 6 (5): 583–589. дои : 10.1016/S1367-5931(02)00392-7 . ПМИД 12413541 .
- ^ Ридинг К., Коул М. (май 1977 г.). «Клавулановая кислота: бета-лактам, ингибирующий бета-лактамазы, из Streptomyces clavuligerus» . Антимикробные средства и химиотерапия . 11 (5): 852–857. дои : 10.1128/AAC.11.5.852 . ПМК 352086 . ПМИД 879738 .
- ^ Басби Р.В., Таунсенд, Калифорния (июль 1996 г.). «Один мономерный центр железа в клаваминатсинтазе катализирует три непоследовательных окислительных превращения» . Биоорганическая и медицинская химия . 4 (7): 1059–1064. дои : 10.1016/0968-0896(96)00088-0 . ПМИД 8831977 .
- ^ Бахманн Б.О., Таунсенд, Калифорния (сентябрь 2000 г.). «Кинетический механизм бета-лактамсинтетазы Streptomyces clavuligerus». Биохимия . 39 (37): 11187–11193. дои : 10.1021/bi000709i . ПМИД 10985764 .
- ^ Халили Н., Ли Р., Таунсенд, Калифорния (1999). «Происхождение β-лактамных атомов углерода в клавулановой кислоте в результате необычной реакции, опосредованной тиаминпирофосфатом». Журнал Американского химического общества . 121 (39): 9223–9224. дои : 10.1021/ja9923134 .
- ^ Сазерленд Р. (июнь 1991 г.). «Ингибиторы бета-лактамаз и устранение устойчивости к антибиотикам». Тенденции в фармакологических науках . 12 (6): 227–232. дои : 10.1016/0165-6147(91)90557-9 . ПМИД 2048218 .