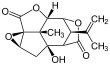
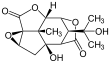
Пикротоксин
Пикротоксинин (слева) и пикротин (справа) | |||
| Клинические данные | |||
|---|---|---|---|
| код АТС |
| ||
| Идентификаторы | |||
| Номер CAS | |||
| ПабХим CID | |||
| ИЮФАР/БПС | |||
| Лекарственный Банк | |||
| ХимическийПаук | |||
| НЕКОТОРЫЙ | |||
| КЕГГ | |||
| ЧЭБИ | |||
| ЧЕМБЛ | |||
| Панель управления CompTox ( EPA ) | |||
| Информационная карта ECHA | 100.004.288 | ||
| Химические и физические данные | |||
| 3D model ( JSmol ) | |||
| | |||
Пикротоксин , также известный как коккулин , представляет собой ядовитое кристаллическое растительное соединение. Впервые он был выделен французским фармацевтом и химиком Пьером Франсуа Гийомом Булле (1777–1869) в 1812 году. [1] Название «пикротоксин» представляет собой сочетание греческих слов «пикрос» (горький) и «токсикон» (яд). [2] Смесь двух различных соединений, пикротоксин встречается в природе в плодах растения Anamirta cocculus , хотя его также можно синтезировать химическим путем.
Благодаря взаимодействию с тормозным нейромедиатором ГАМК пикротоксин действует как стимулятор и противосудорожное средство. В основном он поражает центральную нервную систему, вызывая судороги и паралич дыхания в достаточно высоких дозах.
Химическая структура и синтез
[ редактировать ]Пикротоксин представляет собой эквимолярную смесь двух соединений: пикротоксинина (C 15 H 16 O 6 ; CAS# 17617-45-7) и пикротина (C 15 H 18 O 7 ; CAS # 21416-53-5). [3] Из двух соединений пикротин менее активен. [4]
В природе пикротоксин встречается в плодах Anamirta cocculus , вьющегося растения из Индии и других частей Юго-Восточной Азии. Растение известно своими большими стеблями из белого дерева и душистыми цветами. Здесь растут небольшие косточковые плоды Cocculus indicus , которые обычно сушат. [ нужна ссылка ]
В настоящее время существует целых пять синтезов пикротоксинина, один из которых был опубликован совсем недавно, в июне 2020 года. [5] В большинстве синтезов используется карвон в качестве стереохимического шаблона .
![Начните с метил (1S,4S,5R,7R,8S,9R,10R,11R)-10-(ацетилокси)-7-гидрокси-11-метил-3-оксо-9-(проп-1-ен-2- ил)-4,5-бис[(триметилсилил)окси]-2-оксатрицикло[5.3.1.04,11]ундекан-8-карбоксилат. (1) Внутримолекулярная переэтерификация с высвобождением метилацетата; затем (2) снятие защиты с триметилсилилзащищенного вицинального диола с последующей (3) восстановительной дегидратацией до олефина и (4) стереоспецифическим эпоксидированием до глицидного эфира](http://upload.wikimedia.org/wikipedia/commons/thumb/9/96/Picrotoxinin_Synthesis.png/500px-Picrotoxinin_Synthesis.png)
В 1988 году исследователи из Университета Тохоку в Японии завершили полный стереоселективный синтез как (-)-пикротоксинина, так и (-)-пикротина, начиная с (+)-5β- гидроксикарвона . В этом синтезе восемь асимметричных центров были стереоселективно получены на цис -конденсированной гидриндановой кольцевой системе с использованием нескольких различных реакций: перегруппировки Кляйзена с введением четвертичного центра, селенорганического восстановления эпоксидного кетона и стереоспецифического построения глицидного эфира. . [7]
Вместо этого в синтезе в июне 2020 года использовалось быстрое формирование полициклического ядра с последующим манипулированием состояниями окисления ключевых атомов углерода для создания целевой молекулы. [5]
Некоторые исследования показывают, что пикритоксин может быть получен путем циклофункционализации циклоалкенильных систем. В кинетически контролируемых условиях этот процесс обычно приводит к экзоциклизации и образованию мостиковых кольцевых систем, подобных тем, которые обнаружены в пикротоксине. [8]
Было разработано несколько методов индивидуального выделения пикротоксинина и пикротина. Реакция с находящимся поблизости цис- спиртом является ключевым препятствием и может быть ингибирована предварительной обработкой ( защитой ) трифторуксусным ангидридом в пиридине : [9]
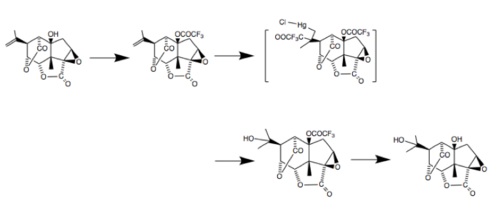
Пикротоксин также использовался в качестве исходного материала в нескольких синтетических процессах, включая создание dl -пикротоксадиена, который сохраняет определенные особенности скелета пикротоксина. [10]
Механизм действия
[ редактировать ]Некоторые мышечные волокна ракообразных имеют возбуждающую и тормозную иннервацию. Пикротоксин блокирует торможение. [11] Были предложены две разные, но связанные теории механизма действия пикротоксина на синапсы . Одна из теорий заключается в том, что он действует как неконкурентный блокатор каналов ГАМК А. рецептора хлоридных [12] в частности, хлорид-ионофор, активированный гамма-аминомасляной кислотой. [13] Исследование 2006 года показало, что, хотя структурно он не похож на ГАМК, пикротоксин предотвращает поток ионов через хлоридные каналы, активируемые ГАМК. Вероятно, он действует внутри самих ионных каналов, а не в местах узнавания ГАМК. Поскольку он ингибирует каналы, активируемые ГАМК, препараты, усиливающие ГАМК, такие как барбитураты и бензодиазепины, могут использоваться в качестве противоядия. [14]
Другие исследования показывают, что вместо этого токсин действует как неконкурентный антагонист или ингибитор рецепторов ГАМК. Исследование Ньюленда и Калл-Кенди показало, что в достаточно высоких концентрациях пикротоксин снижает амплитуду токов ГАМК. Их данные показали, что маловероятно, что пикротоксин действовал просто как блокатор потенциалзависимых каналов, хотя он действительно уменьшал частоту открытия каналов. Скорее, они обнаружили, что пикротоксин «предпочтительно связывается с формой рецептора, связанной с агонистом». Это означает, что даже в присутствии низких концентраций пикротоксина реакция нейронов на ГАМК снижается. [15]
Токсичность
[ редактировать ]Пикротоксин действует как стимулятор центральной нервной системы и дыхания. Он чрезвычайно токсичен для рыб и людей, а также грызунов и других млекопитающих. Согласно Регистру токсического действия химических веществ, LDLo, или самая низкая зарегистрированная смертельная доза, составляет 0,357 мг/кг. Симптомы отравления пикротоксином включают кашель, затрудненное дыхание, головную боль, головокружение, спутанность сознания, желудочно-кишечные расстройства, тошноту или рвоту, а также изменения частоты сердечных сокращений и артериального давления. Хотя это особенно опасно при проглатывании, системные эффекты также могут возникнуть в результате вдыхания или всасывания в кровоток через повреждения кожи. [16] Пикротоксин также действует как конвульсивное средство. Было обнаружено, что в более высоких дозах он вызывает клонические судороги или сердечные аритмии, причем особенно высокие дозы в конечном итоге приводят к летальному исходу, как правило, из-за паралича дыхания. [17]
Клиническое применение и другое использование
[ редактировать ]Из-за своей токсичности пикротоксин в настоящее время чаще всего используется в качестве исследовательского инструмента. Однако из-за своего антагонистического действия на рецепторы ГАМК его использовали в качестве стимулятора центральной нервной системы. Ранее он также использовался в качестве противоядия при отравлении депрессантами ЦНС, особенно барбитуратами . [18]
Хотя пикротоксин обычно не используется, он эффективен как пестицид, так и педикулицид . В 19 веке его использовали при приготовлении твердого мультума , который добавляли в пиво, чтобы сделать его более опьяняющим. С тех пор этот препарат был объявлен вне закона. [19] [20]
Несмотря на свою потенциальную токсичность для млекопитающих в достаточно больших дозах, пикротоксин также иногда используется для повышения производительности лошадей. классифицирует его как нелегальное «вещество класса I» Американская ассоциация четвероногих лошадей . Вещества, отнесенные к классу I, могут влиять на производительность и не имеют терапевтического применения в медицине лошадей. [21] В 2010 году дрессировщик лошадей Роберт Димитт был отстранен от занятий после того, как его лошадь Stoli Signature дала положительный результат на это вещество. Как и у людей, он используется для противодействия отравлению барбитуратами. [22]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Булле П.Ф. (1812 г.). «Анализ химического препарата де ла Кок дю Левант, Menispermum cocculus». Бюллетень аптеки (на французском языке). 4 :5–34.
Menispermum coculus» переименован в «Anamirta coculus».
- ^ (Булле, 1812), с. 31.
- ^ Лоу В., Нокс С., Джумбу Ю., Джуисон Т., Го А.С., Лю Ю. и др. «Пикротоксин» . Наркобанк . Проверено 26 апреля 2017 г.
- ^ Гаммилл Р., Тулинский Дж. (1994). «Химия и фармакология лигандов ГАМК А и ГАМК В » . Современная медицинская химия . 1 (3): 242 . Проверено 26 апреля 2017 г.
- ^ Jump up to: а б Кроссли С.В., Тонг Дж., Ламбрехт М.Дж., Бердж Х.Э., Шенви Р.А. (июль 2020 г.). «Синтез (-)-пикротоксинина путем активации сильных связей на поздней стадии» . Журнал Американского химического общества . 142 (26): 11376–11381. дои : 10.1021/jacs.0c05042 . ПМК 8011636 . ПМИД 32573211 .
- ^ Трост Б. , Крише М.Ю. (1996). «Пикротоксинин» . Журнал Американского химического общества . 118 :233. дои : 10.1021/ja953060r . Проверено 7 мая 2017 г.
- ^ Мияшита М., Сузуки Т., Ёсикоши А. (май 1989 г.). «Стереоселективный общий синтез (-)-пикротоксинина и (-)-пикротина». Журнал Американского химического общества . 111 (10): 3728–3734. дои : 10.1021/ja00192a035 .
- ^ Трост Б, Флеминг I (1991). Комплексный органический синтез (Том 4 изд.). Оксфорд, Великобритания: Pergamon Press. п. 373. ИСБН 9780080405957 . Проверено 7 мая 2017 г.
- ^ Кори Э.Дж., Пирс Х.Л. (1980). «Тотальный синтез пикротина». Буквы тетраэдра . 21 (19): 1823–1824. дои : 10.1016/s0040-4039(00)92789-8 .
- ^ Конрой Х. (июнь 1952 г.). «Пикротоксин. II. Скелет пикротоксинина. Полный синтез dl-пикротоксадиена». Журнал Американского химического общества . 74 (12): 3046–3051. дои : 10.1021/ja01132a028 .
- ^ Ван дер Клот В.Г., Роббинс Дж., Кук И.М. (март 1958 г.). «Блокирование пикротоксином периферического торможения у раков». Наука . 127 (3297): 521–522. Бибкод : 1958Sci...127..521В . дои : 10.1126/science.127.3297.521 . ПМИД 13529017 .
- ^ Ро Дж.М., Доневан С.Д., Рогавски М.А. (декабрь 1996 г.). «Прямая активация ГАМК-рецепторов барбитуратами в культивируемых нейронах гиппокампа крысы» . Журнал физиологии . 497 (2): 509–22. дои : 10.1113/jphysicalol.1996.sp021784 . ПМК 1161000 . ПМИД 8961191 .
- ^ Лоу В., Нокс С., Джумбу Ю., Джуисон Т., Го А.С., Лю Ю. и др. «Пикротоксин» . Наркобанк . Проверено 26 апреля 2017 г.
- ^ Олсен Р.В. (апрель 2006 г.). «Пикротоксиноподобные блокаторы каналов ГАМКА-рецепторов» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (16): 6081–2. Бибкод : 2006PNAS..103.6081O . дои : 10.1073/pnas.0601121103 . ПМЦ 1458832 . PMID 16606858 .
- ^ Newland CF, Cull-Candy SG (февраль 1992 г.). «О механизме действия пикротоксина на рецепторные каналы ГАМК в диссоциированных симпатических нейронах крысы» . Журнал физиологии . 447 : 191–213. doi : 10.1113/jphysical.1992.sp018998 . ПМЦ 1176032 . ПМИД 1317428 .
- ^ «Пикротоксин» (PDF) . Биотехнология Санта-Крус . Проверено 26 апреля 2017 г.
- ^ «Пикротоксин» . Токснет . Национальная медицинская лаборатория США . Проверено 26 апреля 2017 г.
- ^ Нильссон Э, Эйрих Б (2009). «О лечении отравлений барбитуратами». Акта Медика Скандинавия . 137 (6): 381–9. дои : 10.1111/j.0954-6820.1950.tb12129.x . ПМИД 15432128 .
- ^ Бёттгер А., Воткнехт У., Болле С., Вольф А. (2018). «Препараты растительного происхождения, влияющие на ионные каналы». Уроки кофеина, каннабиса и других продуктов: наркотики растительного происхождения и их взаимодействие с рецепторами человека . Учебные материалы по биологическим наукам. п. 129. дои : 10.1007/978-3-319-99546-5_8 . ISBN 978-3-319-99545-8 .
- ^ Белл Дж (1869). Отчет Комитета по связи алкоголя с медициной . США: Коллинз. п. 32.
- ^ «Единые рекомендации по классификации иностранных веществ, рекомендуемые наказания и типовые правила» (PDF) . Международная ассоциация комиссаров по гонкам, Inc. Проверено 26 апреля 2017 г.
- ^ Леморо П. (2 сентября 2017 г.). «Два четвероногих тренера лошади отстранены за нарушение правил использования наркотиков в Прейри Медоуз» . Форма ежедневных гонок. Форма ежедневных гонок . Проверено 26 апреля 2017 г.
Дальнейшее чтение
[ редактировать ]- Эренбергер К., Бенко Э., Феликс Д. (1982). «Подавляющее действие пикротоксина, антагониста ГАМК, на лабиринтный спонтанный нистагм и головокружение у человека». Acta Oto-Laryngologica . 93 (1–6): 269–73. дои : 10.3109/00016488209130882 . ПМИД 7064710 .
- Дюпон Л., Дидеберг О., Ламотт-Брассёр Дж., Анжено Л. (1976). «Кристаллическая и молекулярная структура пикротоксина C 15 H 16 O 6 ·C 15 H 18 O 7 ». Acta Crystallographica B (на французском языке). 32 (11): 2987–2993. дои : 10.1107/S0567740876009424 . hdl : 2268/31560 .
- Олсен Р.В., ДеЛори Т.М. (1999). «Физиология и фармакология рецепторов ГАМК» . В Siegel GJ, Agranoff BW, Albers RW и др. (ред.). Базовая нейрохимия: молекулярные, клеточные и медицинские аспекты (6-е изд.). Филадельфия, Пенсильвания, США: Липпинкотт-Рэйвен.