Соман
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК 3,3-Диметилбутан-2-ил метилфосфонофторидат | |
| Другие имена ГД; Фторфосфонофтористая кислота, метил-, 1, 2, 2-триметилпропиловый эфир; 2-(фторметилфосфорил)окси-3,3-диметилбутан; пинаколил метилфосфонофторидат; 1,2,2-триметилпропилметилфосфонофторидат; оксид метилпинаколилоксифторфосфина; пинаколилоксиметилфосфонилфторид; пинаколилметанфторфосфонат; Метилфторпинаколилфосфонат; оксид фторметилпинаколилоксифосфина; Метилпинаколилоксифосфонилфторид; пинаколил метилфторфосфонат; 1,2,2-триметилпропоксифторметилфосфиноксид | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЕМБЛ | |
| ХимическийПаук | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 7 Ч 16 Ф О 2 П | |
| Молярная масса | 182.175 g·mol −1 |
| Появление | При этом чистая бесцветная жидкость с запахом, напоминающим гнилые фрукты. С примесями, янтарного или темно-коричневого цвета, с запахом камфорного масла. |
| Плотность | 1,022 г/см 3 |
| Температура плавления | -42 ° C (-44 ° F; 231 К) |
| Точка кипения | 198 ° C (388 ° F; 471 К) |
| Умеренный | |
| Давление пара | 0,40 мм рт.ст. (53 Па) |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Высокотоксичный |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Зоман (или GD , EA 1210 , Zoman , PFMP , A-255 , систематическое название: O -пинаколил метилфосфонофторидат) [1] является чрезвычайно токсичным химическим веществом. Это нервно-паралитический агент , препятствующий нормальному функционированию нервной системы млекопитающих путем ингибирования фермента холинэстеразы . Он является ингибитором как ацетилхолинэстеразы , так и бутирилхолинэстеразы . [2] Как химическое оружие , оно классифицируется как оружие массового уничтожения Организацией Объединенных Наций в соответствии с резолюцией ООН 687 . Его производство строго контролируется, а хранение запасов запрещено Конвенцией о химическом оружии 1993 года, где оно классифицируется как вещество Списка 1 . Зоман был третьим из так называемых нервно-паралитических агентов G-серии, обнаруженных наряду с GA (табуном), ГБ (зарином) и GF (циклозарином).
В чистом виде зоман представляет собой летучую , едкую и бесцветную жидкость со слабым запахом, напоминающим запах нафталина или гнилых фруктов. [3] Чаще всего он имеет цвет от желтого до коричневого и сильный запах, похожий на камфару . LCt для зомана составляет 70 50 мг·мин/м. 3 у людей.
GD можно загустить для использования в качестве химического спрея с помощью акрилоидного сополимера. Его также можно использовать в качестве бинарного химического оружия ; его химическими предшественниками являются метилфосфонилдифторид и смесь пинаколилового спирта и амина . [3] [ не удалось пройти проверку ]
История
[ редактировать ]После Первой мировой войны, во время которой иприт и фосген использовались в качестве боевых отравляющих веществ, в 1925 году был подписан Женевский протокол с целью запретить химическую войну. Тем не менее исследования боевых отравляющих веществ и их применение продолжались. В 1936 году новый, более опасный химический агент был обнаружен, когда Герхард Шредер из IG Farben в Германии выделил табун (названный в США GA для немецкого агента А), первый агент нервно-паралитического действия, при разработке новых инсектицидов . За этим открытием последовало выделение зарина (обозначенного в США как GB) в 1938 году, также открытого Шрейдером.
Во время Второй мировой войны исследования нервно-паралитических веществ продолжались в США и Германии. Летом 1944 года немцами был разработан зоман — бесцветная жидкость с запахом камфоры (в США обозначенная GD). Зоман оказался даже более токсичным, чем табун и зарин. Нобелевский лауреат Рихард Кун вместе с Конрадом Хенкелем открыл зоман во время исследований фармакологии табуна и зарина в Институте медицинских исследований кайзера Вильгельма в Гейдельберге . [4] Это исследование было заказано немецкой армией. Зоман производился в небольших количествах на опытном заводе на заводе IG Farben в Людвигсхафене . Он никогда не использовался во время Второй мировой войны. [5]
Производство и накопление зомана было запрещено Конвенцией о химическом оружии 1993 года . Когда конвенция вступила в силу, стороны заявили о мировых запасах зомана в размере 9 057 тонн. Запасы были уничтожены к 2018 году. [6]
Кристаллическая структура зомана в комплексе с ацетилхолинэстеразой была определена Millard et al. в 1999 г. методом рентгеновской кристаллографии: 1сом . Другие решенные структуры ацетилхолинэстеразы со связанным с ними зоманом включают 2wfz , 2wg0 и 2wg1 .
Структура и реакционная способность
[ редактировать ]
Зоман (C(±)P(±)-зоман) имеет четыре стереоизомера , каждый из которых обладает разной токсичностью, хотя во многом схож. Стереоизомерами являются C(+)P(+)-зоман, C(+)P(-)-зоман, C(-)P(-)-зоман и C(-)P(+)-зоман. [7] [8]
Зоман имеет фосфонильную группу с ковалентно связанным с ней фторидом и (большим) углеводородом. Таким образом, структура аналогична структуре зарина, к которому присоединена только меньшая углеводородная группа (изопропил). Из-за сходства химических структур реакционная способность двух соединений практически одинакова. Зоман и зарин вступают в реакцию с использованием фосфокислородной группы, которая может связываться с аминокислотами, такими как серин.
Синтез
[ редактировать ]Производство зомана очень похоже на производство зарина. Разница в том, что изопропанол, образующийся при зариновых процессах, заменяется пинаколиловым спиртом :

Зоман синтезируется путем взаимодействия пинаколилового спирта с метилфосфонилдифторидом . Результатом этой реакции является образование зомана, который описывается как «бесцветная жидкость с фруктовым запахом». Низкое давление пара зомана также приводит к образованию летучей газовой формы зомана. кислый фтороводород Кроме того, в результате отщепления фторида и протона образуется . Эта кислота косвенно опасна для человека. Контакт кожи с фтористым водородом вызовет немедленную реакцию с водой, в результате которой образуется плавиковая кислота . [5]
Механизмы действия
[ редактировать ]Зоман — фосфорорганическое нервно-паралитическое вещество, механизм действия которого аналогичен Табуну. Нервно-паралитические агенты ингибируют ацетилхолинэстеразу (АХЭ), образуя аддукт с ферментом через остаток серина на этом ферменте. Эти аддукты могут разлагаться гидролитически или, например, под действием некоторых оксимов и тем самым регенерировать фермент. Второй тип реакции, при котором комплекс фермент-органофосфат (ФФ) подвергается последующей реакции, обычно описывается как «старение». Когда комплекс фермент-ОП стареет, он больше не регенерируется с помощью обычных оксимных реактиваторов. Скорость этого процесса зависит от ОП. Зоман – это ОП, который быстрее всего стимулирует скорость старения, сокращая период полураспада до нескольких минут.
АХЭ — это фермент, участвующий в нейротрансмиссии. Из-за резкого уменьшения периода полураспада этого фермента нейротрансмиссия прекращается в считанные минуты. [5]
Метаболизм
[ редактировать ]Попадая в организм человека, зоман не только ингибирует АХЭ, но и является субстратом для других эстераз. Реакция зомана с этими эстеразами позволяет провести детоксикацию соединения. Реакций метаболической токсичности зомана не известно.
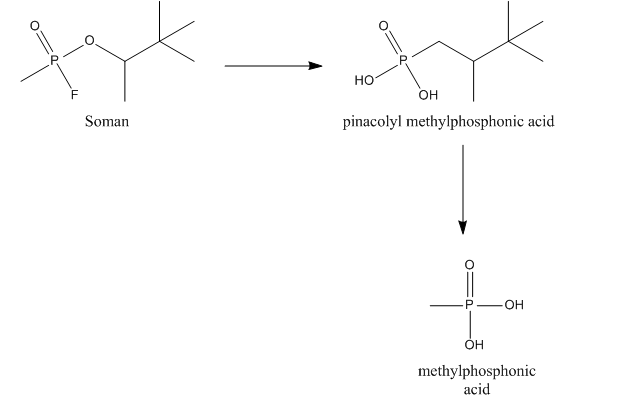
Зоман может гидролизоваться так называемой А-эстеразой, точнее диизопропилфторфосфатазой. Эта эстераза, также называемая соманазой, реагирует с ангидридной связью между фосфором и фтором и обеспечивает гидролиз фторида. Соманаза также гидролизует метильную группу зомана, что приводит к образованию пинаколилметилфосфоновой кислоты (ПМПА), которая является менее сильным ингибитором АХЭ. [9] [10]
Зоман также может связываться с другими эстеразами , например, AChE , холинэстеразой (ChE) и карбоксилэстеразами (CarbE). При этом связывании зоман теряет фторид. После связывания с АХЭ или ХЭ зоман также теряет фосфорильную группу, что приводит к образованию метилфосфоновой кислоты (МФК). Связывание с CarbE снижает общую концентрацию зомана в крови, что приводит к снижению токсичности. Кроме того, CarbE участвуют в детоксикации путем гидролиза зомана до PMPA. Таким образом, CarbE обеспечивает детоксикацию зомана двумя способами. [9] [10]
Важность детоксикации зомана после воздействия была продемонстрирована в экспериментах Фоннума и Стерри (1981). Они сообщили, что только 5% LD50 ингибировали АХЭ у крыс, что приводило к острым токсическим эффектам. Это показывает, что метаболические реакции обеспечили детоксикацию оставшихся 95% дозы. [11]
Признаки и симптомы
[ редактировать ]Поскольку зоман тесно связан с такими соединениями, как зарин, показания к отравлению зоманом относительно схожи. Одним из первых заметных признаков отравления зоманом является миоз . Некоторыми, но не всеми, из последних показаний являются рвота, сильная мышечная боль и проблемы с периферической нервной системой. Эти симптомы проявляются уже через 10 минут после заражения и могут сохраняться в течение многих дней. [12]
Помимо прямого токсического воздействия на нервную систему, люди, подвергшиеся воздействию зомана, могут испытывать долгосрочные последствия, большинство из которых являются психологическими. Субъекты, подвергшиеся воздействию небольшой дозы зомана, страдали от тяжелых токсических эффектов; После лечения у субъектов часто развивалась депрессия, появлялись антисоциальные мысли, они были замкнутыми и подавленными, беспокойно спали и видели плохие сны. Эти симптомы продолжались шесть месяцев после заражения, но исчезли без длительного ущерба. [13]
Токсичность и эффективность
[ редактировать ]ЛК . 50 зомана в воздухе оценивается в 70 мг/мин на м 3 . По сравнению со значением ЛК 50 для крысы смертельная концентрация для человека значительно ниже (954,3 мг мин/м2). 3 против 70 мг мин/м 3 ). Для таких соединений, как зоман, которые также могут использоваться в качестве оружия, LC 50 первые эффекты часто проявляются в пределах дозы . Миоз является одним из первых симптомов интоксикации зоманом и может наблюдаться при дозах менее 1% от ЛК 50 . [14]
Воздействие на животных
[ редактировать ]Были проведены эксперименты, в которых крысы подвергались воздействию зомана, чтобы проверить, можно ли наблюдать поведенческие эффекты при низких дозах без возникновения явных симптомов. Воздействие на крыс зомана в дозе менее 3% ЛД 50 вызывало изменения поведения. Активное избегание подвергшихся воздействию крыс было меньше, чем избегание необлученных крыс (эксперимент с двусторонним челноком). Также пострадали координация движений (задача на преодоление препятствий), поведение в открытом поле, а также активное и пассивное избегание. Можно сделать вывод, что крысы, подвергшиеся воздействию зомана, с меньшей успешностью выполняли задачи, требующие одновременно двигательной активности и функции высших структур центральной нервной системы (ЦНС). При этом зоман оказывает преимущественно центральное действие.
Знания о влиянии низких доз зомана и других ингибиторов холинэстеразы на крыс, возможно, могли бы быть использованы для объяснения относительно высокой частоты авиационных происшествий из-за ошибок сельскохозяйственных пилотов. Если бы эти знания можно было применить к людям, можно было бы объяснить такую высокую заболеваемость снижением активности холинэстеразы из-за воздействия пестицидов. Неизвестно, можно ли провести экстраполяцию от крыс к человеку. [15]
Ссылки
[ редактировать ]- ^ [1] Архивировано 12 сентября 2013 г. в Wayback Machine Сенате США , 103-й Конгресс, 2-я сессия. (25 мая 1994 г.). Паспорт безопасности материала — смертельные нервно-паралитические агенты Сомен (GD и утолщенный GD). Проверено 6 ноября 2004 г.
- ^ Миллард CB, Крайгер Г., Ордентлич А. и др. (июнь 1999 г.). «Кристаллические структуры старой фосфонилированной ацетилхолинэстеразы: продукты реакции нервно-паралитического агента на атомном уровне». Биохимия . 38 (22): 7032–9. дои : 10.1021/bi982678l . ПМИД 10353814 . S2CID 11744952 .
- ^ Jump up to: а б «CDC | Факты о Зомане» . Emergency.cdc.gov . Центры по контролю и профилактике заболеваний. Архивировано из оригинала 22 декабря 2017 г. Проверено 20 марта 2018 г.
- ^ Шмальц Ф. (сентябрь 2006 г.). «Нейронауки и исследования химического оружия массового поражения в нацистской Германии». Журнал истории нейронаук . 15 (3): 186–209. дои : 10.1080/09647040600658229 . ISSN 0964-704X . ПМИД 16887760 . S2CID 46250604 .
- ^ Jump up to: а б с Люки, Брайан Дж., Салем, Гарри (2007). Боевые химические агенты: химия, фармакология, токсикология и терапия . ЦРК Пресс. стр. 10–13. ISBN 9781420046618 .
- ^ «Доклад ОЗХО о выполнении Конвенции о запрещении разработки, производства, накопления и применения химического оружия и о его уничтожении в 2017 году» (PDF) . Организация по запрещению химического оружия. 2018-11-19. п. 45 . Проверено 9 февраля 2024 г.
- ^ Лангенберг Дж.П., Спрут Х.Э., Ван Дер Виль Х.Дж., Трэп ХК, Хельмих Р.Б., Бергерс В.В., Ван Хелден Х.П., Беншоп Х.П. (01.07.1998). «Ингаляционная токсикокинетика стереоизомеров зомана у атропинизированных морских свинок при воздействии паров зомана только через нос». Токсикология и прикладная фармакология . 151 (1): 79–87. дои : 10.1006/taap.1998.8451 . ISSN 0041-008X . ПМИД 9705889 .
- ^ Де Йонг Л.П., Ван Дейк С., Беншоп Х.П. (1 августа 1988 г.). «Гидролиз четырех стереоизомеров зомана, катализируемый гомогенатом печени и плазмой крысы, морской свинки и мартышки, а также плазмой человека». Биохимическая фармакология . 37 (15): 2939–2948. дои : 10.1016/0006-2952(88)90279-1 . ISSN 0006-2952 . ПМИД 3395367 .
- ^ Jump up to: а б Йоканович М (25 сентября 2001 г.). «Биотрансформация фосфорорганических соединений». Токсикология . 166 (3): 139–160. дои : 10.1016/s0300-483x(01)00463-2 . ISSN 0300-483X . ПМИД 11543910 .
- ^ Jump up to: а б Йоканович М (10 июля 2009 г.). «Современное понимание механизмов метаболической детоксикации боевых нервно-паралитических агентов». Письма по токсикологии . 188 (1): 1–10. дои : 10.1016/j.toxlet.2009.03.017 . ISSN 1879-3169 . ПМИД 19433263 .
- ^ Фоннум Ф., Стерри С.Х. (1981). «Факторы, модифицирующие токсичность фосфорорганических соединений, в том числе зомана и зарина». Фундамент. Прил. Токсикол . 1 (2): 143–147. дои : 10.1016/S0272-0590(81)80050-4 . ПМИД 7184780 .
- ^ Сиделл Ф.Р. (1974). «Зоман и зарин: клинические проявления и лечение случайного отравления фосфорорганическими соединениями». Клиническая токсикология . 7 (1): 1–17. дои : 10.3109/15563657408987971 . ПМИД 4838227 .
- ^ Сиделл Ф.Р. (1974). «Зоман и зарин: клинические проявления и лечение случайного отравления фосфорорганическими соединениями». Клиническая токсикология . 7 (1): 1–17. дои : 10.3109/15563657408987971 . ISSN 0009-9309 . ПМИД 4838227 .
- ^ Бей Т.А., Салливан Дж.Б., Уолтер Ф.Г. (2001)Фосфорорганические и карбаматные инсектициды. В: Салливан Дж. Б., Кригер Г. Р. (ред.) Клиническое здоровье окружающей среды.и токсическое воздействие. Липпинкотт Уильямс и Уильямс, Филадельфия, стр. 1046–1057.
- ^ ВОЛЬТУИС ОЛ, ВАНВЕРШ РА (1 апреля 1984 г.). «Поведенческие изменения у крыс после низких доз ингибиторов холинэстеразы». Токсикологические науки . 4 (2 часть 2): 195–208. дои : 10.1093/toxsci/4.2part2.195 . ISSN 1096-6080 . ПМИД 6724212 .
Внешние ссылки
[ редактировать ]- Сенат США, 103-й Конгресс, 2-я сессия (25 мая 1994 г.). Паспорт безопасности материала — смертельные агенты нервно-паралитического действия Сомен (GD и утолщенный GD) ( архивировано 12 сентября 2013 г. в Wayback Machine ). Проверено 6 ноября 2004 г.
- Ингибиторы и субстраты АХЭ в Протеопедии
- 2wfz в Протеопедии
- 2wg0 в Протеопедии
- 2wg1 в Протеопедии
- 1сом в Протеопедии
- https://somanтоксикология.wixsite.com/meusite (на португальском языке)
