Холинацетилтрансфераза
| Холинацетилтрансфераза | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 2.3.1.6 | ||
| Номер CAS. | 9012-78-6 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
| ЧАТ | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | CHAT , CHOACTASE, CMS1A, CMS1A2, CMS6, холин-О-ацетилтрансфераза | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 118490 ; МГИ : 88392 ; Гомологен : 40693 ; GeneCards : ЧАТ ; ОМА : ЧАТ - ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Холинацетилтрансфераза (обычно сокращенно ChAT , но иногда CAT ) представляет собой трансферазу, фермент ответственный за синтез нейромедиатора ацетилхолина . ХАТ катализирует перенос ацетильной группы от кофермента ацетил-КоА к холину , образуя ацетилхолин (АХ). ХАТ обнаруживается в высоких концентрациях в холинергических нейронах как центральной нервной системы (ЦНС), так и периферической нервной системы (ПНС). Как и большинство белков нервных окончаний, ХАТ вырабатывается в теле нейрона и транспортируется к нервному окончанию , где его концентрация наиболее высока. Присутствие ХАТ в нервной клетке классифицирует эту клетку как «холинергический» нейрон. У человека фермент холин-ацетилтрансфераза кодируется CHAT геном . [5]
История
[ редактировать ]Холинацетилтрансфераза была впервые описана Дэвидом Нахмансоном и А.Л. Мачадо в 1943 году. [6] Немецкий биохимик Нахмансон изучал процесс проведения нервных импульсов и использования энергетических химических реакций в клетках, опираясь на работы нобелевских лауреатов Отто Варбурга и Отто Мейергофа о ферментации , гликолизе и сокращении мышц . Основываясь на предыдущих исследованиях, показывающих, что «действие ацетилхолина на структурные белки» отвечает за нервные импульсы, Нахмансон и Мачадо исследовали происхождение ацетилхолина. [7]
Из головного мозга и нервной ткани был извлечен фермент, образующий ацетилхолин. Образование происходит только в присутствии аденозинтрифосфата (АТФ) . Фермент называется холин ацетилаза.
- Нахмансон и Мачадо, 1943 г. [6]
АТФ ) на На момент этого открытия механизм действия ацетилтрансферазы был неизвестен, однако Нахмансон предположил, что ацетилфосфат или фосфорилхолин заменяют фосфат (из холин или ацетат-ион. [6] Лишь в 1945 году коэнзим А (КоА) был открыт одновременно и независимо тремя лабораториями. [8] [9] [10] Нахмансон — один из них. Впоследствии, в 1951 году, был открыт ацетил-КоА, который тогда назывался «активным ацетатом». [11] Трехмерная структура крысиного ЧАТ была решена только почти 60 лет спустя, в 2004 году. [12]
Структура
[ редактировать ]Трехмерная структура ChAT была расшифрована методом рентгеновской кристаллографии PDB : 2FY2 . Холин связан в активном центре ChAT посредством нековалентных взаимодействий между положительно заряженным амином холина и гидроксильной группой Tyr552, в дополнение к водородной связи группой холина между гидроксильной и остатком гистидина His324.
Субстрат холина помещается в карман внутри ChAT, а ацетил-КоА — в карман на поверхности белка. Трехмерная кристаллическая структура показывает, что ацетильная группа ацетил-КоА примыкает к карману связывания холина, сводя к минимуму расстояние между донором ацетильной группы и получателем.
Гомология
[ редактировать ]ChAT очень консервативен в геноме животных. В частности, среди млекопитающих наблюдается очень высокое сходство последовательностей. человека и кошки ( Felis catus Например, ChAT ) имеют 89% идентичности последовательностей.Идентичность последовательности с дрозофилой составляет около 30%. [13]
Формы чата
[ редактировать ]Существует две формы ХАТ: растворимая форма и мембраносвязанная форма. [14] На растворимую форму приходится 80-90% общей активности фермента, тогда как на мембраносвязанную форму приходится остальная часть активности 10-20%. [15] Однако уже давно ведутся споры о том, как последняя форма ChAT связана с мембраной. [16] Мембраносвязанная форма ХАТ связана с синаптическими везикулами. [17]
Общие и периферические изоформы ChAT
[ редактировать ]Существуют две изоформы ChAT, обе кодируемые одной и той же последовательностью. Общий тип ChAT (cChAT) присутствует как в ЦНС, так и в ПНС. ChAT периферического типа (pChAT) преимущественно экспрессируется в ПНС у людей и возникает в результате пропуска экзонов (экзоны 6–9) во время посттранскрипционной модификации . Следовательно, аминокислотная последовательность очень похожа; однако в pChAT отсутствуют части последовательности, присутствующие в cChAT. Изоформа pChAT была открыта в 2000 году на основе наблюдений за тем, что антитела ChAT, полученные из головного мозга, не окрашивают периферические холинергические нейроны, как это происходит с антителами, обнаруженными в мозге. Этот механизм сплайсинга генов , который приводит к различиям cChAT и pChAT, наблюдался у различных видов, включая как позвоночных млекопитающих, так и беспозвоночных моллюсков, что позволяет предположить, что этот механизм приводит к некоторым еще невыявленным эволюционным преимуществам.
Функция
[ редактировать ]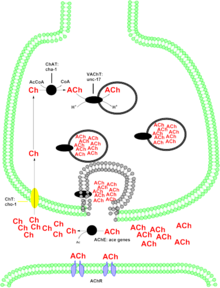
Холинергические системы участвуют в многочисленных неврологических функциях. Изменения в некоторых холинергических нейронах могут быть причиной нарушений при болезни Альцгеймера . Белок, кодируемый этим геном, синтезирует нейромедиатор ацетилхолин . Ацетилхолин действует на два класса рецепторов центральной нервной системы – мускариновые и никотиновые , каждый из которых участвует в различных физиологических реакциях. Роль ацетилхолина в никотиновых рецепторах все еще изучается. Вероятно, это связано с путями вознаграждения/подкрепления, о чем свидетельствует вызывающая зависимость природа никотина , который также связывается с никотиновым рецептором. Мускариновое действие ацетилхолина на ЦНС участвует в обучении и памяти. Утрата холинергической иннервации в неокортексе связана с потерей памяти, о чем свидетельствуют запущенные случаи болезни Альцгеймера. В периферической нервной системе холинергические нейроны участвуют в контроле висцеральных функций, таких как, помимо прочего, сокращение сердечной мышцы и функция желудочно-кишечного тракта.
Его часто используют в качестве иммуногистохимического маркера двигательных нейронов (мотонейронов).
Мутации
[ редактировать ]Мутанты ChAT были выделены у нескольких видов, включая C. elegans , Drosophila и человека. Большинство нелетальных мутантов, имеющих фенотип недикого типа, проявляют некоторую активность, но значительно меньшую, чем дикий тип.
У C. elegans несколько мутаций ChAT были связаны с геном cha-1. Все мутации приводят к значительному снижению активности ChAT. В некоторых случаях процент потери активности может превышать 98%. Фенотипические эффекты включают замедление роста, уменьшение размера, нескоординированное поведение и отсутствие чувствительности к ингибиторам холинэстеразы . [19] Все изолированные чувствительные к температуре мутанты были дрозофилы летальными. Перед смертью у пораженных мух наблюдается изменение поведения, включая неконтролируемые движения и изменение активности электроретинограммы . [20]
Человеческий ген, ответственный за кодирование ChAT, — это CHAT. Мутации в CHAT связаны с врожденным миастеническим синдромом — заболеванием, которое приводит к общей недостаточности и слабости двигательных функций. Дальнейшие симптомы включают фатальное апноэ . Было показано, что из десяти изолированных мутантов у 1 полностью отсутствует активность, у 8 активность значительно снижена, а у 1 функция неизвестна. [21]
Клиническое значение
[ редактировать ]болезнь Альцгеймера
[ редактировать ]( Болезнь Альцгеймера БА) связана с трудностями в памяти и познании. Концентрации ацетилхолина и ХАТ заметно снижаются в неокортексе головного мозга и гиппокампе. [22] Хотя потеря клеток и дисфункция холинергических нейронов считаются факторами, способствующими развитию болезни Альцгеймера, обычно они не считаются основным фактором развития этого заболевания. Предполагается, что агрегация и отложение бета-амилоидного белка нарушает метаболизм нейронов и дополнительно повреждает холинергические аксоны в коре и холинергические нейроны в базальном отделе переднего мозга. [23]
Боковой амиотрофический склероз
[ редактировать ]Боковой амиотрофический склероз (БАС) является одним из наиболее распространенных заболеваний двигательных нейронов. При БАС обнаруживается значительная потеря иммунореактивности ChAT. [24] Предполагается, что холинергическая функция участвует в неконтролируемом повышении внутриклеточной концентрации кальция, причина которого до сих пор остается неясной. [25]
Наркотики
[ редактировать ]Неостигмин метилсульфат, антихолинэстеразный агент, использовался для воздействия на ChAT. В частности, было показано, что использование неостигмина метилсульфата оказывает положительный эффект против врожденного миастенического синдрома. [26]
воздействие эстрадиола увеличивает ХАТ у самок крыс. Было показано, что [27]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б с GRCh38: Версия Ensembl 89: ENSG00000070748 – Ensembl , май 2017 г.
- ^ Перейти обратно: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000021919 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Штраус В.Л., Кемпер Р.Р., Джаякар П., Конг К.Ф., Херш Л.Б., Хилт Д.К., Рабин М. (февраль 1991 г.). «Ген холин-ацетилтрансферазы человека картируется в области 10q11-q22.2 путем гибридизации in situ» . Геномика . 9 (2): 396–8. дои : 10.1016/0888-7543(91)90273-H . ПМИД 1840566 .
- ^ Перейти обратно: а б с Нахмансон Д., Мачадо А.Л. (1943). «Образование ацетилхолина. Новый фермент: холинацетилаза». Дж. Нейрофизиология . 6 (5): 397–403. дои : 10.1152/jn.1943.6.5.397 .
- ^ Берман Р., Уилсон И.Б., Нахмансон Д. (сентябрь – октябрь 1953 г.). «Специфичность холинацетилазы в отношении биологической функции». Биохимика и биофизика Acta . 12 (1–2): 315–24. дои : 10.1016/0006-3002(53)90150-4 . ПМИД 13115440 .
- ^ Липманн Ф., Каплан Н.О. (1946). «Общий фактор ферментативного ацетилирования сульфаниламида и холина» . Ж. Биол. Хим . 162 (3): 743–744. дои : 10.1016/S0021-9258(17)41419-0 .
- ^ Липтон М.А. (1946). «Механизм ферментативного синтеза ацетилхолина». Фед. Проц . 5 (1 часть 2): 145. PMID 21066687 .
- ^ Нахмансон Д., Берман М. (1946). «Исследования холинацетилазы; по получению кофермента и его влиянию на фермент» . Ж. Биол. Хим . 165 (2): 551–63. дои : 10.1016/S0021-9258(17)41168-9 . ПМИД 20276121 .
- ^ Джонс Д.Х., Нельсон В.Л. (1968). «Метод выделения продуктов кофермента А». Анальный. Биохим . 26 (3): 350–7. дои : 10.1016/0003-2697(68)90195-4 . ПМИД 5716187 .
- ^ Говиндасами Л., Педерсен Б., Лиан В., Кукар Т., Гу Ю, Джин С., Агбандже-Маккенна М., Ву Д., Маккенна Р. (ноябрь 2004 г.). «Структурные данные и функциональные последствия холин-ацетилтрансферазы». Журнал структурной биологии . 148 (2): 226–35. дои : 10.1016/j.jsb.2004.06.005 . ПМИД 15477102 .
- ^ Ода Ю. (ноябрь 1999 г.). «Холин-ацетилтрансфераза: строение, распределение и патологические изменения в центральной нервной системе». Международная патология . 49 (11): 921–37. дои : 10.1046/j.1440-1827.1999.00977.x . ПМИД 10594838 . S2CID 23621617 .
- ^ Тандон А., Бачу М., Уэлдон П., Полоса С., Коллиер Б. (1996). «Влияние применения колхицина на преганглионарные аксоны на активность холин-ацетилтрансферазы, а также содержание и высвобождение ацетилхолина в верхнем шейном ганглии». Дж. Нейрохем . 66 (3): 1033–41. дои : 10.1046/j.1471-4159.1996.66031033.x . ПМИД 8769864 . S2CID 44586742 .
- ^ Пахуд Г., Салем Н., ван де Гур Дж., Медилански Дж., Пеллегринелли Н., Эдер-Колли Л. (25 мая 1998 г.). «Изучение субклеточной локализации мембраносвязанной холин-ацетилтрансферазы в центральной нервной системе дрозофилы и ее связи с мембранами». Европейский журнал неврологии . 10 (5): 1644–53. дои : 10.1046/j.1460-9568.1998.00177.x . ПМИД 9751137 . S2CID 24196247 .
- ^ Брюс Дж., Херш Л.Б. (декабрь 1987 г.). «Исследования детергента, высвобождающего холин-ацетилтрансферазу из мембранных фракций мозга крысы и человека». Нейрохим Рез . 12 (12): 1059–66. дои : 10.1007/bf00971705 . ПМИД 2450285 . S2CID 4336737 .
- ^ Кэрролл П.Т. (1994). «Мембраносвязанная холин-О-ацетилтрансфераза в ткани гиппокампа крысы связана с синаптическими везикулами». Мозговой Рес . 633 (1–2): 112–8. дои : 10.1016/0006-8993(94)91529-6 . ПМИД 8137149 . S2CID 1139292 .
- ^ Рэнд, Джеймс. «Ацетилхолин» . Червячная Книга.
- ^ Рэнд Дж.Б., Рассел Р.Л. (февраль 1984 г.). «Мутанты нематоды Caenorhabditis elegans с дефицитом холинацетилтрансферазы» . Генетика . 106 (2): 227–48. дои : 10.1093/генетика/106.2.227 . ПМК 1202253 . ПМИД 6698395 .
- ^ Гринспен Р.Дж. (1980). «Мутации холин-ацетилтрансферазы и связанные с ней нервные дефекты». Журнал сравнительной физиологии . 137 (1): 83–92. дои : 10.1007/BF00656920 . S2CID 45897606 .
- ^ Оно К., Цуджино А., Бренгман Дж.М., Харпер С.М., Байзер З., Удд Б., Бейринг Р., Робб С., Киркхэм Ф.Дж., Энгель А.Г. (13 февраля 2001 г.). «Мутации холин-ацетилтрансферазы вызывают миастенический синдром, связанный с эпизодическим апноэ у людей» . Труды Национальной академии наук . 98 (4): 2017–2022. Бибкод : 2001ПНАС...98.2017О . дои : 10.1073/pnas.98.4.2017 . ПМК 29374 . ПМИД 11172068 .
- ^ Бартус Р.Т., Дин Р.Л., Бир Б., Липпа А.С. (30 июля 1982 г.). «Холинергическая гипотеза гериатрической дисфункции памяти». Наука . 217 (4558): 408–14. Бибкод : 1982Sci...217..408B . дои : 10.1126/science.7046051 . ПМИД 7046051 .
- ^ Геула С., Месулам М.М., Сарофф Д.М., Ву К.К. (январь 1998 г.). «Взаимосвязь между бляшками, клубками и потерей кортикальных холинергических волокон при болезни Альцгеймера» . J Neuropathol Exp Neurol . 57 (1): 63–75. дои : 10.1097/00005072-199801000-00008 . ПМИД 9600198 .
- ^ Ода Ю, Имаи С, Наканиси И, Итикава Т, Дегучи Т (декабрь 1995 г.). «Иммуногистохимическое исследование холин-ацетилтрансферазы в спинном мозге больных боковым амиотрофическим склерозом». Патол Междунар . 45 (12): 933–9. дои : 10.1111/j.1440-1827.1995.tb03418.x . ПМИД 8808298 . S2CID 23763400 .
- ^ Моррисон Б.М., Моррисон Дж.Х. (январь 1999 г.). «Боковой амиотрофический склероз, связанный с мутациями супероксиддисмутазы: предполагаемый механизм дегенерации». Мозговой Res Мозговой Res Rev. 29 (1): 121–35. дои : 10.1016/s0165-0173(98)00049-6 . ПМИД 9974153 . S2CID 28937351 .
- ^ Грир М., Шотланд М. (июль 1960 г.). «Миастения у новорожденных». Педиатрия . 26 : 101–8. дои : 10.1542/педс.26.1.101 . ПМИД 13851666 . S2CID 8672902 .
- ^ Луине В.Н. (август 1985 г.). «Эстрадиол увеличивает активность холин-ацетилтрансферазы в определенных базальных ядрах переднего мозга и проекционных областях самок крыс». Экспериментальная неврология . 89 (2): 484–90. дои : 10.1016/0014-4886(85)90108-6 . ПМИД 2990988 . S2CID 1525252 .
Дальнейшее чтение
[ редактировать ]- Ода Ю (2000). «Холин ацетилтрансфераза: строение, распределение и патологические изменения в центральной нервной системе». Патол. Межд . 49 (11): 921–37. дои : 10.1046/j.1440-1827.1999.00977.x . ПМИД 10594838 . S2CID 23621617 .
- Ван Дж, Фу Х, Чжан Д, Ю Л, Ли Н, Лу З, Гао Ю, Ван М, Лю Х, Чжоу С, Хань В, Ян Б, Ван Дж (2017). «ХАТ-положительные нейроны участвуют в нейрогенезе субвентрикулярной зоны после окклюзии средней мозговой артерии у мышей» . Поведение. Мозговой Рес . 316 : 145–151. дои : 10.1016/j.bbr.2016.09.007 . ПМК 5048585 . ПМИД 27609645 .
- Ода Ю, Наканиси И, Дегучи Т (1993). «Комплементарная ДНК для холин-ацетилтрансферазы человека индуцирует две формы фермента с разной молекулярной массой в культивируемых клетках». Мозговой Рес. Мол. Мозговой Рес . 16 (3–4): 287–94. дои : 10.1016/0169-328X(92)90237-6 . ПМИД 1337937 .
- Ван Дж, Лу З, Фу Х, Чжан Д, Ю Л, Ли Н, Гао Ю, Лю Икс, Инь С, Кэ Дж, Ли Л, Чжай М, Ву С, Фань Дж, Лев Л, Лю Дж, Чен Х , Ян Ц, Ван Дж (2017). «Сигнальный путь никотинового рецептора альфа-7 участвует в нейрогенезе, индуцированном ChAT-положительными нейронами в субвентрикулярной зоне» . Разрешение трансл. инсульта . 8 (5): 484–493. дои : 10.1007/s12975-017-0541-7 . ПМК 5704989 . ПМИД 28551702 .
- Туссен Дж.Л., Жоффруа В., Шмитт М., Вернер А., Гарнье Дж.М., Симони П., Кемпф Дж. (1992). «Холин-ацетилтрансфераза человека (CHAT): частичная последовательность гена и потенциальные контрольные области». Геномика . 12 (2): 412–6. дои : 10.1016/0888-7543(92)90395-9 . ПМИД 1339386 .
- Лоренци М.В., Тринидад AC, Чжан Р., Штраус В.Л. (1992). «Две мРНК транскрибируются из человеческого гена холин-ацетилтрансферазы». ДНК Клеточная Биол . 11 (8): 593–603. дои : 10.1089/dna.1992.11.593 . ПМИД 1388731 .
- Мисава Х., Исии К., Дегучи Т. (1992). «Экспрессия гена мышиной холин-ацетилтрансферазы. Альтернативный сплайсинг и идентификация высокоактивной промоторной области» . Ж. Биол. Хим . 267 (28): 20392–9. дои : 10.1016/S0021-9258(19)88714-8 . ПМИД 1400357 .
- Червини Р., Рокки М., ДиДонато С., Финоккьяро Г. (1992). «Выделение и субхромосомная локализация фрагмента ДНК гена холинацетилтрансферазы человека». Неврология. Летт . 132 (2): 191–4. дои : 10.1016/0304-3940(91)90299-9 . ПМИД 1784419 . S2CID 23030200 .
- Штраус В.Л., Кемпер Р.Р., Джаякар П., Конг К.Ф., Херш Л.Б., Хилт Д.К., Рабин М. (1991). «Ген холин-ацетилтрансферазы человека картируется в области 10q11-q22.2 путем гибридизации in situ» . Геномика . 9 (2): 396–8. дои : 10.1016/0888-7543(91)90273-H . ПМИД 1840566 .
- Виегас-Пекиньо Э., Беррард С., Брис А., Апиу Ф., Малле Дж. (1991). «Локализация фрагмента гена холинацетилтрансферазы человека длиной 900 п.н. в 10q11.2 путем нерадиоактивной гибридизации in situ». Геномика . 9 (1): 210–2. дои : 10.1016/0888-7543(91)90242-7 . ПМИД 2004764 .
- Ито Н., Слеммон-младший, Хоук Д.Х., Уильямсон Р., Морита Э., Итакура К., Робертс Э., Шайвли Дж.Э., Кроуфорд Г.Д., Сальватерра П.М. (1986). «Клонирование кДНК холин-ацетилтрансферазы дрозофилы» . Учеб. Натл. акад. наук. США . 83 (11): 4081–5. Бибкод : 1986PNAS...83.4081I . дои : 10.1073/pnas.83.11.4081 . ПМК 323670 . ПМИД 3086876 .
- Херш Л.Б., Такане К., Гилис К., Мумау С., Слотер С. (1988). «Консервация аминокислотных последовательностей между холинацетилтрансферазой человека и свиньи». Дж. Нейрохем . 51 (6): 1843–5. дои : 10.1111/j.1471-4159.1988.tb01166.x . ПМИД 3183663 . S2CID 24613238 .
- Беррард С., Брайс А., Лотспейх Ф., Браун А., Бард Ю.А., Маллет Дж. (1988). «Клонирование кДНК и полная последовательность холин-ацетилтрансферазы свиньи: трансляция соответствующей РНК in vitro дает активный белок» . Учеб. Натл. акад. наук. США . 84 (24): 9280–4. дои : 10.1073/pnas.84.24.9280 . ПМЦ 373252 . ПМИД 3480542 .
- Шире М.А., Ле Ван Тай А., Вебер М.Дж. (1995). «Ген холин-ацетилтрансферазы человека: локализация альтернативных первых экзонов». Дж. Нейроски. Рез . 40 (4): 427–38. дои : 10.1002/jnr.490400402 . ПМИД 7616604 . S2CID 42856768 .
- Баузеро П., Шмитт М., Туссен Дж.Л., Симони П., Жоффруа В., Кеш Д., Дюкло С., Кемпф Дж., Квирин-Стрикер С. (1993). «Идентификация и анализ промотора гена холин-ацетилтрансферазы человека». НейроОтчет . 4 (3): 287–90. дои : 10.1097/00001756-199303000-00015 . ПМИД 7682855 .
- Квирин-Стрикер С., Наппи В., Симони П., Туссен Дж.Л., Шмитт М. (1994). «Транс-активация рецепторами гормонов щитовидной железы 5'-фланкирующей области гена ChAT человека». Мозговой Рес. Мол. Мозговой Рес . 23 (3): 253–65. дои : 10.1016/0169-328X(94)90232-1 . ПМИД 8057782 .
- Эриксон Дж.Д., Вароки Х., Шефер М.К., Моди В., Диблер М.Ф., Вейхе Э., Рэнд Дж., Эйден Л.Е., Боннер Т.И., Усдин Т.Б. (1994). «Функциональная идентификация везикулярного переносчика ацетилхолина и его экспрессия из локуса «холинергического» гена» . Ж. Биол. Хим . 269 (35): 21929–32. дои : 10.1016/S0021-9258(17)31734-9 . ПМИД 8071310 .
- Кенгаку М., Мисава Х., Дегучи Т. (1993). «Множественные виды мРНК холин-ацетилтрансферазы из спинного мозга крысы». Мозговой Рес. Мол. Мозговой Рес . 18 (1–2): 71–6. дои : 10.1016/0169-328X(93)90174-N . ПМИД 8479291 .
- Мисава Х., Мацуура Дж., Ода Ю., Такахаши Р., Дегучи Т. (1997). «МРНК холин-ацетилтрансферазы человека с разными 5'-областями продуцируют основной продукт трансляции массой 69 кДа». Мозговой Рес. Мол. Мозговой Рес . 44 (2): 323–33. дои : 10.1016/S0169-328X(96)00231-8 . ПМИД 9073174 .
- Лённерберг П., Ибаньес КФ (1999). «Новые, специфичные для семенников транскрипты мРНК, кодирующие укороченную на N-конце холин-ацетилтрансферазу». Мол. Репродукция. Дев . 53 (3): 274–81. doi : 10.1002/(SICI)1098-2795(199907)53:3<274::AID-MRD3>3.0.CO;2-8 . ПМИД 10369388 . S2CID 39464614 .
- Сакакибара А., Хаттори С. (2000). «Chat, адаптерный белок, связанный с Cas/HEF1, который объединяет несколько сигнальных путей» . Ж. Биол. Хим . 275 (9): 6404–10. дои : 10.1074/jbc.275.9.6404 . ПМИД 10692442 .
Внешние ссылки
[ редактировать ]- Холин + ацетилтрансфераза Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)