Бета-кетоацил-АСР-синтаза
| 3-оксоацил-АСР-синтаза, митохондриальная | |||
|---|---|---|---|
| Идентификаторы | |||
| Символ | ОКСМ | ||
| ген NCBI | 54995 | ||
| HGNC | 26063 | ||
| МОЙ БОГ | 610324 | ||
| RefSeq | НМ_017897 | ||
| ЮниПрот | Q9NWU1 | ||
| Другие данные | |||
| Номер ЕС | 2.3.1.41 | ||
| Локус | Хр. 3 п24.2 | ||
| |||
| Бета-кетоацилсинтаза, N-концевой домен | |||
|---|---|---|---|
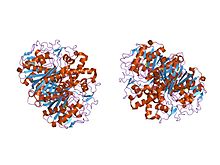 Кристаллическая структура бета-кетоацил-[ацил-белка-переносчика] синтазы II из Streptococcus pneumoniae, триклинная форма | |||
| Идентификаторы | |||
| Символ | кетоацил-синт | ||
| Пфам | PF00109 | ||
| Пфам Клан | CL0046 | ||
| ИнтерПро | ИПР014030 | ||
| PROSITE | PDOC00529 | ||
| СКОП2 | 1кас / СКОПе / СУПФАМ | ||
| |||
| Бета-кетоацилсинтаза, С-концевой домен | |||
|---|---|---|---|
 Arabidopsis thaliana митохондриальный комплекс бета-кетоацил-acp-синтазы с гексановой кислотой | |||
| Идентификаторы | |||
| Символ | Кетоацил-синт_С | ||
| Пфам | PF02801 | ||
| Пфам Клан | CL0046 | ||
| ИнтерПро | ИПР014031 | ||
| PROSITE | PDOC00529 | ||
| СКОП2 | 1кас / СКОПе / СУПФАМ | ||
| |||
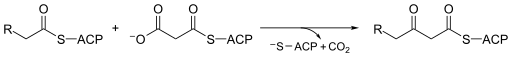
В молекулярной биологии бета-кетоацил-АСР-синтаза EC 2.3.1.41 представляет собой фермент, участвующий в синтезе жирных кислот . Обычно он использует малонил-КоА в качестве источника углерода для удлинения ACP-связанных ацильных частиц, что приводит к образованию ACP-связанных β-кетоацильных форм , таких как ацетоацетил - ACP . [1]
Бета-кетоацил-АСР- синтаза — это высококонсервативный фермент , который встречается почти у всех живых существ на Земле в виде домена синтазы жирных кислот (FAS). ФАС существует в двух типах, удачно названных типами I и II. У животных , грибов и низших эукариот бета-кетоацил-АПБ-синтазы составляют один из каталитических доменов более крупных многофункциональных белков (тип I), тогда как у большинства прокариот , а также в пластидах и митохондриях бета-кетоацил-АПФ-синтазы являются отдельные белковые цепи, которые обычно образуют димеры (Тип II). [1] [2] Бета-кетоацил-АСР-синтаза III, возможно, наиболее известная из этого семейства ферментов, катализирует между конденсацию Клайзена ацетил -КоА и малонил-АПБ . На изображении ниже показано, как КоА помещается в активный центр в качестве субстрата синтазы III.

Бета-кетоацил-АПБ-синтазы I и II катализируют только реакции ацил-АПБ с малонил-АПБ. Синтазы I и II способны продуцировать длинноцепочечные ацил-АСР. Оба эффективны вплоть до ацил-АСР с 14- углеродной цепью, после чего синтаза II является более эффективным выбором для дальнейшего добавления углерода. ФАС I типа катализирует все реакции, необходимые для создания пальмитиновой кислоты , которая является необходимой функцией у животных для метаболических процессов , один из которых включает образование сфингозинов . [1]
Бета-кетоацил-АСР-синтаза встречается как компонент ряда ферментативных систем, включая синтетазы жирных кислот (FAS); многофункциональная синтаза 6-метизалициловой кислоты (MSAS) из Penicillium patulum , [3] участвует в биосинтезе поликетидного ; антибиотика который поликетидные ферментные системы антибиотик-синтазы; Wa Emericella nidulans многофункциональный белок , участвующий в биосинтезе конидиального зеленого пигмента ; Белок клубеньков nodE Rhizobium , который, вероятно, действует как бета-кетоацилсинтаза в синтезе Nod-фактора жирно-ацильной цепи клубеньков; и дрожжевой митохондриальный белок CEM1.
Структура
[ редактировать ]
Бета-кетоацилсинтаза содержит два белковых домена . Активный сайт расположен между N- и C-концевыми доменами. N-концевой домен содержит большую часть структур, участвующих в образовании димеров , а также активного центра цистеин . Остатки обоих доменов способствуют субстрата связыванию и катализу. [4]
У животных и прокариот бета-кетоацил-АСР-синтаза представляет собой домен FAS типа I, который представляет собой большой ферментный комплекс, имеющий несколько доменов, катализирующих множество различных реакций. Аналогично, бета-кетоацил-АСР-синтаза у растений обнаруживается в ФАС II типа; Обратите внимание, что было документально подтверждено, что синтазы в растениях обладают рядом субстратных специфичностей . [1] Наличие сходных кетоацилсинтаз, присутствующих во всех живых организмах, указывает на общего предка . [5] Дальнейшее исследование бета-кетоацил-АСР-синтаз I и II E. coli показало, что обе они гомодимерны , но синтазы II немного больше. Однако, хотя они оба участвуют в метаболизме жирных кислот , они также имеют сильно различающуюся первичную структуру . [6] В синтазе II каждая субъединица состоит из пятинитевого бета-складчатого листа, окруженного множеством альфа-спиралей , как показано на изображении слева. Активные центры расположены относительно близко, на расстоянии всего около 25 ангстрем друг от друга, и состоят в основном из гидрофобного кармана. [4] Некоторые эксперименты также показали наличие «туннелей транспорта жирных кислот» внутри домена бета-кетоацил-АСР-синтазы, которые приводят к одной из многих «полостей жирных кислот», которые по существу действуют как активный центр. [7]
Механизм
[ редактировать ]бета-кетоацил-синтазы Механизм является предметом споров среди химиков. Многие согласны с тем, что Cys171 активного центра атакует карбонил ацетил-АПБ и, как и большинство ферментов, стабилизирует промежуточное соединение с другими остатками в активном центре. Впоследствии ACP удаляется и депротонирует His311 при этом . Затем тиоэфир . регенерируется с цистеином в активном центре Декарбоксилирование малонил-КоА, который также находится в активном центре, первоначально создает енолят , который стабилизируется His311 и His345. Енолят таутомеризуется с образованием карбаниона , который атакует тиоэфир ацетил-ферментного комплекса. [8] Некоторые источники предполагают, что активированная молекула воды также находится в активном центре и служит средством гидратации высвободившегося CO 2 или атаки C3 малонил-КоА. Другой предложенный механизм рассматривает создание тетраэдрического переходного состояния . [1] Движущей силой реакции является декарбоксилирование малонил-АПБ; энергия , захватываемая этой связью, технически исходит от АТФ , которая изначально используется для карбоксилирования ацетил-КоА в малонил-КоА. [9]

Биологическая функция
[ редактировать ]Основная функция бета-кетоацил-АСР-синтазы — производство жирных кислот различной длины для использования организмом. Эти области применения включают хранение энергии и создание клеточных мембран . Жирные кислоты также могут использоваться для синтеза простагландинов , фосфолипидов и витаминов , а также многого другого. Кроме того, пальмитиновая кислота , которая создается бета-кетоацил-синтазами ФАС I типа, используется в ряде биологических функций. Это предшественник стеариновой . и пальмитолеиновой кислот Пальмитолеиновую кислоту впоследствии можно использовать для создания ряда других жирных кислот. [10] Пальмитиновая кислота также используется для синтеза сфингозинов , которые играют роль в клеточных мембранах. [1]
Клиническое значение
[ редактировать ]Различные типы бета-кетоацил-АСР-синтаз в ФАС типа II называются FabB, FabF и FabH-синтазами. FabH катализирует типичную реакцию кетоацилсинтазы с малонил-АПБ и ацетил-КоА. FabB и FabF катализируют другие родственные реакции. Учитывая, что их функция необходима для правильной биологической функции, связанной с синтезом липопротеинов , фосфолипидов и липополисахаридов , они стали мишенью при разработке антибактериальных препаратов . Чтобы адаптироваться к окружающей среде , бактерии изменяют фосфолипидный состав своих мембран. Таким образом, ингибирование этого пути может стать рычагом воздействия на размножение бактерий . [11] Изучая Yersinia pestis , вызывающую бубонную , легочную и септическую чуму, исследователи показали, что FabB, FabF и FabH теоретически могут быть ингибированы одним и тем же препаратом из-за сходства в их сайтах связывания . Однако такой препарат еще не разработан. [12] Церуленин , молекула, которая, по-видимому, ингибирует, имитируя «переходное состояние конденсации», может ингибировать только B или F, но не H. Другая молекула, тиолактомицин, которая имитирует малонил-АПБ в активном центре, может ингибировать только FabB. [13] Наконец, платенсимицин также может использоваться в качестве антибиотика из-за его ингибирования FabF. [14]
Эти виды препаратов весьма актуальны. Например, Y. pestis был основным возбудителем Юстиниановой чумы , Черной смерти и современной чумы. Даже за последние пять лет в Китае , Перу и Мадагаскаре произошла вспышка инфекции, вызванной Y. pestis . Если его не лечить в течение 24 часов, это обычно приводит к смерти. Более того, есть опасения, что теперь его можно использовать в качестве возможного биологического оружия . [12]
К сожалению, многие препараты, нацеленные на бета-кетоацилсинтазы прокариот, несут множество побочных эффектов . Учитывая сходство прокариотических кетоацилсинтаз и митохондриальных, эти типы лекарств имеют тенденцию непреднамеренно действовать также на митохондриальные синтазы, что приводит ко многим биологическим последствиям для человека. [2]
Промышленное применение
[ редактировать ]Недавние усилия в области биоинженерии включают разработку белков FAS, которые включают домены бета-кетоацил-ACP-синтазы, чтобы способствовать синтезу разветвленных углеродных цепей в качестве возобновляемого источника энергии. Разветвленные углеродные цепи содержат больше энергии и могут использоваться при более низких температурах из-за более низкой температуры замерзания . Используя E. coli в качестве выбранного организма, инженеры заменили эндогенный домен FabH в FAS, который благоприятствует неразветвленным цепям , на версии FabH, которые способствуют разветвлению из-за их высокой субстратной специфичности для разветвленных ацил-ACP. [15]
См. также
[ редактировать ]- Бета-кетоацил-АСР-синтаза I
- Бета-кетоацил-АСР-синтаза II
- Бета-кетоацил-АСР-синтаза III
- 3-оксоацил-(ацил-белок-носитель) редуктаза
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и ж Витковски А., Джоши А.К., Смит С. (2002). «Механизм реакции β-кетоацилсинтазы, катализируемой синтазой жирных кислот животных †». Биохимия . 41 (35): 10877–10887. дои : 10.1021/bi0259047 . ПМИД 12196027 .
- ^ Jump up to: а б Кристенсен CE, Крагелунд Б.Б., фон Веттштайн-Ноулз П., Хенриксен А (01 февраля 2007 г.). «Структура человеческой β-кетоацил [ACP] синтазы из митохондриальной синтазы жирных кислот II типа» . Белковая наука . 16 (2): 261–272. дои : 10.1110/ps.062473707 . ISSN 0961-8368 . ПМК 2203288 . ПМИД 17242430 .
- ^ Бек Дж., Рипка С., Зигнер А., Шильц Э., Швейцер Э. (сентябрь 1990 г.). «Многофункциональный ген синтазы 6-метилсалициловой кислоты Penicillium patulum. Его генная структура относительно структуры других поликетидсинтаз». Европейский журнал биохимии . 192 (2): 487–98. дои : 10.1111/j.1432-1033.1990.tb19252.x . ПМИД 2209605 .
- ^ Jump up to: а б Хуан В., Цзя Дж., Эдвардс П., Дехеш К., Шнайдер Г., Линдквист Ю. (март 1998 г.). «Кристаллическая структура бета-кетоацил-ацил-протеинсинтазы-переносчика II из E.coli раскрывает молекулярную архитектуру конденсирующих ферментов» . Журнал ЭМБО . 17 (5): 1183–91. дои : 10.1093/emboj/17.5.1183 . ПМК 1170466 . ПМИД 9482715 .
- ^ Белд Дж., Блатти Дж.Л., Бенке С., Мендес М., Буркарт, доктор медицинских наук (01 августа 2014 г.). «Эволюция ацил-АСР-тиоэстераз и β-кетоацил-АСР-синтаз, выявленная путем белок-белковых взаимодействий» . Журнал прикладной психологии . 26 (4): 1619–1629. Бибкод : 2014JAPco..26.1619B . дои : 10.1007/s10811-013-0203-4 . ISSN 0921-8971 . ПМК 4125210 . ПМИД 25110394 .
- ^ Гарвин Дж.Л., Клагес А.Л., Кронан Дж.Э. (25 декабря 1980 г.). «Структурные, ферментативные и генетические исследования бета-кетоацил-ацил-протеин-синтаз I и II Escherichia coli» . Журнал биологической химии . 255 (24): 11949–11956. дои : 10.1016/S0021-9258(19)70226-9 . ISSN 0021-9258 . ПМИД 7002930 .
- ^ Цуй В, Лян Ю, Тянь В, Цзи М, Ма Икс (01 марта 2016 г.). «Регулирующее влияние β-кетоацилсинтазного домена синтазы жирных кислот на длину жирной ацильной цепи при синтезе жирных кислот de novo» . Biochimica et Biophysical Acta (BBA) - Молекулярная и клеточная биология липидов . 1861 (3): 149–155. дои : 10.1016/j.bbalip.2015.12.002 . ПМИД 26680361 .
- ^ Ли В., Энгельс Б. (2014). «Возвращение к состоянию протонирования каталитических остатков в состоянии покоя KasA: подробный механизм активации KasA его собственным субстратом». Биохимия . 53 (5): 919–931. дои : 10.1021/bi401308j . ПМИД 24479625 .
- ^ Тимочко Дж., Берг, Страйер (2013). Биохимия. Краткий курс . Соединенные Штаты Америки: WH Freeman and Company. ISBN 978-1-4292-8360-1 .
- ^ «Пальмитиновая кислота, насыщенная жирная кислота, в клеточной культуре» . Сигма-Олдрич . Проверено 29 февраля 2016 г.
- ^ Чжан Ю.М., Rock CO (1 марта 2008 г.). «Мембранный липидный гомеостаз у бактерий». Обзоры природы Микробиология . 6 (3): 222–233. дои : 10.1038/nrmicro1839 . ISSN 1740-1526 . ПМИД 18264115 . S2CID 7888484 .
- ^ Jump up to: а б Нансон Дж.Д., Химиари З., Сварбрик К.М., Форвуд Дж.К. (15 октября 2015 г.). «Структурная характеристика бета-кетоацил-ацил-синтаз белка-носителя, FabF и FabH, Yersinia pestis» . Научные отчеты . 5 : 14797. Бибкод : 2015NatSR...514797N . дои : 10.1038/srep14797 . ПМК 4606726 . ПМИД 26469877 .
- ^ Прайс AC, Чой К.Х., Хит Р.Дж., Ли З., Уайт С.В., Рок CO (2 марта 2001 г.). «Ингибирование β-кетоацил-ацил-синтазы белка-носителя тиолактомицином и церуленином. СТРУКТУРА И МЕХАНИЗМ» . Журнал биологической химии . 276 (9): 6551–6559. дои : 10.1074/jbc.M007101200 . ISSN 0021-9258 . ПМИД 11050088 .
- ^ Райт Х.Т., Рейнольдс К.А. (1 октября 2007 г.). «Антибактериальные мишени в биосинтезе жирных кислот» . Современное мнение в микробиологии . Антимикробные препараты/Геномика. 10 (5): 447–453. дои : 10.1016/j.mib.2007.07.001 . ПМК 2271077 . ПМИД 17707686 .
- ^ Цзян В., Цзян И., Бентли Дж.Дж., Лю Д., Сяо Ю., Чжан Ф. (01.08.2015). «Увеличенное производство жирных кислот с разветвленной цепью путем замены β-кетоацил-(ацил-белка-носителя) синтазы III (FabH)». Биотехнология и биоинженерия . 112 (8): 1613–1622. дои : 10.1002/бит.25583 . ISSN 1097-0290 . ПМИД 25788017 . S2CID 35469786 .
Внешние ссылки
[ редактировать ]- бета + кетоацил + ACP + синтаза в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)
Дальнейшее чтение
[ редактировать ]- Цзян В., Цзян Ю., Бентли Дж.Дж., Лю Д., Сяо Ю., Чжан Ф. (август 2015 г.). «Увеличенное производство жирных кислот с разветвленной цепью путем замены β-кетоацил-(ацил-белка-носителя) синтазы III (FabH)». Биотехнология и биоинженерия . 112 (8): 1613–22. дои : 10.1002/бит.25583 . ПМИД 25788017 . S2CID 35469786 .
- Витковски А., Джоши А.К., Смит С. (сентябрь 2002 г.). «Механизм реакции бета-кетоацилсинтазы, катализируемой синтазой жирных кислот животных». Биохимия . 41 (35): 10877–87. дои : 10.1021/bi0259047 . ПМИД 12196027 .
- Кристенсен CE, Крагелунд Б.Б., фон Веттштейн-Ноулз П., Хенриксен А. (февраль 2007 г.). «Структура бета-кетоацил [ACP] синтазы человека из митохондриальной синтазы жирных кислот II типа» . Белковая наука . 16 (2): 261–72. дои : 10.1110/ps.062473707 . ПМК 2203288 . ПМИД 17242430 .
- Ли В., Энгельс Б. (февраль 2014 г.). «Возврат к состоянию протонирования каталитических остатков в состоянии покоя KasA: подробный механизм активации KasA собственным субстратом». Биохимия . 53 (5): 919–31. дои : 10.1021/bi401308j . ПМИД 24479625 .