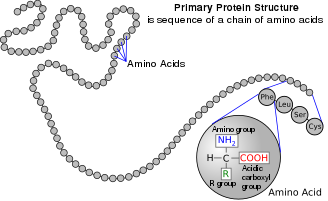
Аминокислота

Аминокислоты — это органические соединения , которые содержат как амино , так и карбоновой кислоты функциональные группы . [ 1 ] Хотя в природе существует более 500 аминокислот, наиболее важными являются 22 α-аминокислоты, включенные в белки . [ 2 ] Только эти 22 присутствуют в генетическом коде жизни. [ 3 ] [ 4 ]
Аминокислоты можно классифицировать по расположению основных структурных функциональных групп ( альфа- (α-) , бета- (β-) , гамма- (γ-) аминокислоты и т. д.); другие категории относятся к полярности , ионизации и типу группы боковой цепи ( алифатическая , ациклическая , ароматическая , полярная и т. д.). В виде белков аминокислотные остатки составляют второй по величине компонент ( вода самый крупный — ) мышц и других тканей человека . [ 5 ] Помимо своей роли остатков в белках, аминокислоты участвуют в ряде процессов, таких как транспорт нейромедиаторов и биосинтез . Считается, что они сыграли ключевую роль в создании жизни на Земле и ее возникновении . [ 6 ]
Amino acids are formally named by the IUPAC-IUBMB Joint Commission on Biochemical Nomenclature in terms of the fictitious "neutral" structure shown in the illustration. For example, the systematic name of alanine is 2-aminopropanoic acid, based on the formula CH3−CH(NH2)−COOH. The Commission justified this approach as follows:[7]
The systematic names and formulas given refer to hypothetical forms in which amino groups are unprotonated and carboxyl groups are undissociated. This convention is useful to avoid various nomenclatural problems but should not be taken to imply that these structures represent an appreciable fraction of the amino-acid molecules.
History
[edit]The first few amino acids were discovered in the early 1800s.[8][9] In 1806, French chemists Louis-Nicolas Vauquelin and Pierre Jean Robiquet isolated a compound from asparagus that was subsequently named asparagine, the first amino acid to be discovered.[10][11] Cystine was discovered in 1810,[12] although its monomer, cysteine, remained undiscovered until 1884.[13][11][a] Glycine and leucine were discovered in 1820.[14] The last of the 20 common amino acids to be discovered was threonine in 1935 by William Cumming Rose, who also determined the essential amino acids and established the minimum daily requirements of all amino acids for optimal growth.[15][16]
The unity of the chemical category was recognized by Wurtz in 1865, but he gave no particular name to it.[17] The first use of the term "amino acid" in the English language dates from 1898,[18] while the German term, Aminosäure, was used earlier.[19] Proteins were found to yield amino acids after enzymatic digestion or acid hydrolysis. In 1902, Emil Fischer and Franz Hofmeister independently proposed that proteins are formed from many amino acids, whereby bonds are formed between the amino group of one amino acid with the carboxyl group of another, resulting in a linear structure that Fischer termed "peptide".[20]
General structure
[edit]
2-, alpha-, or α-amino acids[21] have the generic formula H2NCHRCOOH in most cases,[b] where R is an organic substituent known as a "side chain".[22]
Of the many hundreds of described amino acids, 22 are proteinogenic ("protein-building").[23][24][25] It is these 22 compounds that combine to give a vast array of peptides and proteins assembled by ribosomes.[26] Non-proteinogenic or modified amino acids may arise from post-translational modification or during nonribosomal peptide synthesis.
Chirality
[edit]The carbon atom next to the carboxyl group is called the α–carbon. In proteinogenic amino acids, it bears the amine and the R group or side chain specific to each amino acid. With four distinct substituents, the α–carbon is stereogenic in all α-amino acids except glycine. All chiral proteogenic amino acids have the L configuration. They are "left-handed" enantiomers, which refers to the stereoisomers of the alpha carbon.
A few D-amino acids ("right-handed") have been found in nature, e.g., in bacterial envelopes, as a neuromodulator (D-serine), and in some antibiotics.[27][28] Rarely, D-amino acid residues are found in proteins, and are converted from the L-amino acid as a post-translational modification.[29][c]
Side chains
[edit]Polar charged side chains
[edit]Five amino acids possess a charge at neutral pH. Often these side chains appear at the surfaces on proteins to enable their solubility in water, and side chains with opposite charges form important electrostatic contacts called salt bridges that maintain structures within a single protein or between interfacing proteins.[32] Many proteins bind metal into their structures specifically, and these interactions are commonly mediated by charged side chains such as aspartate, glutamate and histidine. Under certain conditions, each ion-forming group can be charged, forming double salts.[33]
The two negatively charged amino acids at neutral pH are aspartate (Asp, D) and glutamate (Glu, E). The anionic carboxylate groups behave as Brønsted bases in most circumstances.[32] Enzymes in very low pH environments, like the aspartic protease pepsin in mammalian stomachs, may have catalytic aspartate or glutamate residues that act as Brønsted acids.

There are three amino acids with side chains that are cations at neutral pH: arginine (Arg, R), lysine (Lys, K) and histidine (His, H). Arginine has a charged guanidino group and lysine a charged alkyl amino group, and are fully protonated at pH 7. Histidine's imidazole group has a pKa of 6.0, and is only around 10% protonated at neutral pH. Because histidine is easily found in its basic and conjugate acid forms it often participates in catalytic proton transfers in enzyme reactions.[32]
Polar uncharged side chains
[edit]The polar, uncharged amino acids serine (Ser, S), threonine (Thr, T), asparagine (Asn, N) and glutamine (Gln, Q) readily form hydrogen bonds with water and other amino acids.[32] They do not ionize in normal conditions, a prominent exception being the catalytic serine in serine proteases. This is an example of severe perturbation, and is not characteristic of serine residues in general. Threonine has two chiral centers, not only the L (2S) chiral center at the α-carbon shared by all amino acids apart from achiral glycine, but also (3R) at the β-carbon. The full stereochemical specification is (2S,3R)-L-threonine.
Hydrophobic side chains
[edit]Nonpolar amino acid interactions are the primary driving force behind the processes that fold proteins into their functional three dimensional structures.[32] None of these amino acids' side chains ionize easily, and therefore do not have pKas, with the exception of tyrosine (Tyr, Y). The hydroxyl of tyrosine can deprotonate at high pH forming the negatively charged phenolate. Because of this one could place tyrosine into the polar, uncharged amino acid category, but its very low solubility in water matches the characteristics of hydrophobic amino acids well.
Special case side chains
[edit]Several side chains are not described well by the charged, polar and hydrophobic categories. Glycine (Gly, G) could be considered a polar amino acid since its small size means that its solubility is largely determined by the amino and carboxylate groups. However, the lack of any side chain provides glycine with a unique flexibility among amino acids with large ramifications to protein folding.[32] Cysteine (Cys, C) can also form hydrogen bonds readily, which would place it in the polar amino acid category, though it can often be found in protein structures forming covalent bonds, called disulphide bonds, with other cysteines. These bonds influence the folding and stability of proteins, and are essential in the formation of antibodies. Proline (Pro, P) has an alkyl side chain and could be considered hydrophobic, but because the side chain joins back onto the alpha amino group it becomes particularly inflexible when incorporated into proteins. Similar to glycine this influences protein structure in a way unique among amino acids. Selenocysteine (Sec, U) is a rare amino acid not directly encoded by DNA, but is incorporated into proteins via the ribosome. Selenocysteine has a lower redox potential compared to the similar cysteine, and participates in several unique enzymatic reactions.[34] Pyrrolysine (Pyl, O) is another amino acid not encoded in DNA, but synthesized into protein by ribosomes.[35] It is found in archaeal species where it participates in the catalytic activity of several methyltransferases.
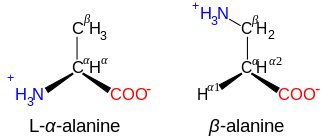
β- and γ-amino acids
[edit]Amino acids with the structure NH+3−CXY−CXY−CO−2, such as β-alanine, a component of carnosine and a few other peptides, are β-amino acids. Ones with the structure NH+3−CXY−CXY−CXY−CO−2 are γ-amino acids, and so on, where X and Y are two substituents (one of which is normally H).[7]
Zwitterions
[edit]
The common natural forms of amino acids have a zwitterionic structure, with −NH+3 (−NH+2− in the case of proline) and −CO−2 functional groups attached to the same C atom, and are thus α-amino acids, and are the only ones found in proteins during translation in the ribosome. In aqueous solution at pH close to neutrality, amino acids exist as zwitterions, i.e. as dipolar ions with both NH+3 and CO−2 in charged states, so the overall structure is NH+3−CHR−CO−2. At physiological pH the so-called "neutral forms" −NH2−CHR−CO2H are not present to any measurable degree.[36] Although the two charges in the zwitterion structure add up to zero it is misleading to call a species with a net charge of zero "uncharged".
In strongly acidic conditions (pH below 3), the carboxylate group becomes protonated and the structure becomes an ammonio carboxylic acid, NH+3−CHR−CO2H. This is relevant for enzymes like pepsin that are active in acidic environments such as the mammalian stomach and lysosomes, but does not significantly apply to intracellular enzymes. In highly basic conditions (pH greater than 10, not normally seen in physiological conditions), the ammonio group is deprotonated to give NH2−CHR−CO−2.
Although various definitions of acids and bases are used in chemistry, the only one that is useful for chemistry in aqueous solution is that of Brønsted:[37][38] an acid is a species that can donate a proton to another species, and a base is one that can accept a proton. This criterion is used to label the groups in the above illustration. The carboxylate side chains of aspartate and glutamate residues are the principal Brønsted bases in proteins. Likewise, lysine, tyrosine and cysteine will typically act as a Brønsted acid. Histidine under these conditions can act both as a Brønsted acid and a base.
Isoelectric point
[edit]
For amino acids with uncharged side-chains the zwitterion predominates at pH values between the two pKa values, but coexists in equilibrium with small amounts of net negative and net positive ions. At the midpoint between the two pKa values, the trace amount of net negative and trace of net positive ions balance, so that average net charge of all forms present is zero.[39] This pH is known as the isoelectric point pI, so pI = 1/2(pKa1 + pKa2).
For amino acids with charged side chains, the pKa of the side chain is involved. Thus for aspartate or glutamate with negative side chains, the terminal amino group is essentially entirely in the charged form −NH+3, but this positive charge needs to be balanced by the state with just one C-terminal carboxylate group is negatively charged. This occurs halfway between the two carboxylate pKa values: pI = 1/2(pKa1 + pKa(R)), where pKa(R) is the side chain pKa.[38]
Similar considerations apply to other amino acids with ionizable side-chains, including not only glutamate (similar to aspartate), but also cysteine, histidine, lysine, tyrosine and arginine with positive side chains.
Amino acids have zero mobility in electrophoresis at their isoelectric point, although this behaviour is more usually exploited for peptides and proteins than single amino acids. Zwitterions have minimum solubility at their isoelectric point, and some amino acids (in particular, with nonpolar side chains) can be isolated by precipitation from water by adjusting the pH to the required isoelectric point.
Physicochemical properties
[edit]The 20 canonical amino acids can be classified according to their properties. Important factors are charge, hydrophilicity or hydrophobicity, size, and functional groups.[28] These properties influence protein structure and protein–protein interactions. The water-soluble proteins tend to have their hydrophobic residues (Leu, Ile, Val, Phe, and Trp) buried in the middle of the protein, whereas hydrophilic side chains are exposed to the aqueous solvent. (In biochemistry, a residue refers to a specific monomer within the polymeric chain of a polysaccharide, protein or nucleic acid.) The integral membrane proteins tend to have outer rings of exposed hydrophobic amino acids that anchor them in the lipid bilayer. Some peripheral membrane proteins have a patch of hydrophobic amino acids on their surface that sticks to the membrane. In a similar fashion, proteins that have to bind to positively charged molecules have surfaces rich in negatively charged amino acids such as glutamate and aspartate, while proteins binding to negatively charged molecules have surfaces rich in positively charged amino acids like lysine and arginine. For example, lysine and arginine are present in large amounts in the low-complexity regions of nucleic-acid binding proteins.[40] There are various hydrophobicity scales of amino acid residues.[41]
Some amino acids have special properties. Cysteine can form covalent disulfide bonds to other cysteine residues. Proline forms a cycle to the polypeptide backbone, and glycine is more flexible than other amino acids.
Glycine and proline are strongly present within low complexity regions of both eukaryotic and prokaryotic proteins, whereas the opposite is the case with cysteine, phenylalanine, tryptophan, methionine, valine, leucine, isoleucine, which are highly reactive, or complex, or hydrophobic.[40][42][43]
Many proteins undergo a range of posttranslational modifications, whereby additional chemical groups are attached to the amino acid residue side chains sometimes producing lipoproteins (that are hydrophobic),[44] or glycoproteins (that are hydrophilic)[45] allowing the protein to attach temporarily to a membrane. For example, a signaling protein can attach and then detach from a cell membrane, because it contains cysteine residues that can have the fatty acid palmitic acid added to them and subsequently removed.[46]
Table of standard amino acid abbreviations and properties
[edit]Although one-letter symbols are included in the table, IUPAC–IUBMB recommend[7] that "Use of the one-letter symbols should be restricted to the comparison of long sequences".
The one-letter notation was chosen by IUPAC-IUB based on the following rules:[47]
- Initial letters are used where there is no ambuiguity: C cysteine, H histidine, I isoleucine, M methionine, S serine, V valine,[47]
- Where arbitrary assignment is needed, the structurally simpler amino acids are given precedence: A Alanine, G glycine, L leucine, P proline, T threonine,[47]
- F PHenylalanine and R aRginine are assigned by being phonetically suggestive,[47]
- W tryptophane is assigned based on the double ring being visually suggestive to the bulky letter W,[47]
- K lysine and Y tyrosine are assigned as alphabetically nearest to their initials L and T (note that U was avoided for its similarity with V, while X was reserved for undetermined or atypical amino acids); for tyrosine the mnemonic tYrosine was also proposed,[48]
- D aspartate was assigned arbitrarily, with the proposed mnemonic asparDic acid;[49] E glutamate was assigned in alphabetical sequence being larger by merely one methylene –CH2– group,[48]
- N asparagine was assigned arbitrarily, with the proposed mnemonic asparagiNe;[49] Q glutamine was assigned in alphabetical sequence of those still available (note again that O was avoided due to similarity with D), with the proposed mnemonic Qlutamine.[49]
| Amino acid | 3- and 1-letter symbols | Side chain | Hydropathy index[50] |
Molar absorptivity[51] | Molecular mass | Abundance in proteins (%)[52] |
Standard genetic coding, IUPAC notation | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 | 1 | Class | Chemical polarity[53] | Net charge at pH 7.4[53] |
Wavelength, λmax (nm) |
Coefficient ε (mM−1·cm−1) | |||||
| Alanine | Ala | A | Aliphatic | Nonpolar | Neutral | 1.8 | 89.094 | 8.76 | GCN | ||
| Arginine | Arg | R | Fixed cation | Basic polar | Positive | −4.5 | 174.203 | 5.78 | MGR, CGY[54] | ||
| Asparagine | Asn | N | Amide | Polar | Neutral | −3.5 | 132.119 | 3.93 | AAY | ||
| Aspartate | Asp | D | Anion | Brønsted base | Negative | −3.5 | 133.104 | 5.49 | GAY | ||
| Cysteine | Cys | C | Thiol | Brønsted acid | Neutral | 2.5 | 250 | 0.3 | 121.154 | 1.38 | UGY |
| Glutamine | Gln | Q | Amide | Polar | Neutral | −3.5 | 146.146 | 3.9 | CAR | ||
| Glutamate | Glu | E | Anion | Brønsted base | Negative | −3.5 | 147.131 | 6.32 | GAR | ||
| Glycine | Gly | G | Aliphatic | Nonpolar | Neutral | −0.4 | 75.067 | 7.03 | GGN | ||
| Histidine | His | H | Cationic | Brønsted acid and base | Positive, 10% Neutral, 90% |
−3.2 | 211 | 5.9 | 155.156 | 2.26 | CAY |
| Isoleucine | Ile | I | Aliphatic | Nonpolar | Neutral | 4.5 | 131.175 | 5.49 | AUH | ||
| Leucine | Leu | L | Aliphatic | Nonpolar | Neutral | 3.8 | 131.175 | 9.68 | YUR, CUY[55] | ||
| Lysine | Lys | K | Cation | Brønsted acid | Positive | −3.9 | 146.189 | 5.19 | AAR | ||
| Methionine | Met | M | Thioether | Nonpolar | Neutral | 1.9 | 149.208 | 2.32 | AUG | ||
| Phenylalanine | Phe | F | Aromatic | Nonpolar | Neutral | 2.8 | 257, 206, 188 | 0.2, 9.3, 60.0 | 165.192 | 3.87 | UUY |
| Proline | Pro | P | Cyclic | Nonpolar | Neutral | −1.6 | 115.132 | 5.02 | CCN | ||
| Serine | Ser | S | Hydroxylic | Polar | Neutral | −0.8 | 105.093 | 7.14 | UCN, AGY | ||
| Threonine | Thr | T | Hydroxylic | Polar | Neutral | −0.7 | 119.119 | 5.53 | ACN | ||
| Tryptophan | Trp | W | Aromatic | Nonpolar | Neutral | −0.9 | 280, 219 | 5.6, 47.0 | 204.228 | 1.25 | UGG |
| Tyrosine | Tyr | Y | Aromatic | Brønsted acid | Neutral | −1.3 | 274, 222, 193 | 1.4, 8.0, 48.0 | 181.191 | 2.91 | UAY |
| Valine | Val | V | Aliphatic | Nonpolar | Neutral | 4.2 | 117.148 | 6.73 | GUN | ||
Two additional amino acids are in some species coded for by codons that are usually interpreted as stop codons:
| 21st and 22nd amino acids | 3-letter | 1-letter | Molecular mass |
|---|---|---|---|
| Selenocysteine | Sec | U | 168.064 |
| Pyrrolysine | Pyl | O | 255.313 |
In addition to the specific amino acid codes, placeholders are used in cases where chemical or crystallographic analysis of a peptide or protein cannot conclusively determine the identity of a residue. They are also used to summarize conserved protein sequence motifs. The use of single letters to indicate sets of similar residues is similar to the use of abbreviation codes for degenerate bases.[56][57]
| Ambiguous amino acids | 3-letter | 1-letter | Amino acids included | Codons included |
|---|---|---|---|---|
| Any / unknown | Xaa | X | All | NNN |
| Asparagine or aspartate | Asx | B | D, N | RAY |
| Glutamine or glutamate | Glx | Z | E, Q | SAR |
| Leucine or isoleucine | Xle | J | I, L | YTR, ATH, CTY[58] |
| Hydrophobic | Φ | V, I, L, F, W, Y, M | NTN, TAY, TGG | |
| Aromatic | Ω | F, W, Y, H | YWY, TTY, TGG[59] | |
| Aliphatic (non-aromatic) | Ψ | V, I, L, M | VTN, TTR[60] | |
| Small | π | P, G, A, S | BCN, RGY, GGR | |
| Hydrophilic | ζ | S, T, H, N, Q, E, D, K, R | VAN, WCN, CGN, AGY[61] | |
| Positively-charged | + | K, R, H | ARR, CRY, CGR | |
| Negatively-charged | − | D, E | GAN |
Unk is sometimes used instead of Xaa, but is less standard.
Ter or * (from termination) is used in notation for mutations in proteins when a stop codon occurs. It corresponds to no amino acid at all.[62]
In addition, many nonstandard amino acids have a specific code. For example, several peptide drugs, such as Bortezomib and MG132, are artificially synthesized and retain their protecting groups, which have specific codes. Bortezomib is Pyz–Phe–boroLeu, and MG132 is Z–Leu–Leu–Leu–al. To aid in the analysis of protein structure, photo-reactive amino acid analogs are available. These include photoleucine (pLeu) and photomethionine (pMet).[63]
Occurrence and functions in biochemistry
[edit]Proteinogenic amino acids
[edit]Amino acids are the precursors to proteins.[26] They join by condensation reactions to form short polymer chains called peptides or longer chains called either polypeptides or proteins. These chains are linear and unbranched, with each amino acid residue within the chain attached to two neighboring amino acids. In nature, the process of making proteins encoded by RNA genetic material is called translation and involves the step-by-step addition of amino acids to a growing protein chain by a ribozyme that is called a ribosome.[64] The order in which the amino acids are added is read through the genetic code from an mRNA template, which is an RNA derived from one of the organism's genes.
Twenty-two amino acids are naturally incorporated into polypeptides and are called proteinogenic or natural amino acids.[28] Of these, 20 are encoded by the universal genetic code. The remaining 2, selenocysteine and pyrrolysine, are incorporated into proteins by unique synthetic mechanisms. Selenocysteine is incorporated when the mRNA being translated includes a SECIS element, which causes the UGA codon to encode selenocysteine instead of a stop codon.[65] Pyrrolysine is used by some methanogenic archaea in enzymes that they use to produce methane. It is coded for with the codon UAG, which is normally a stop codon in other organisms.[66]
Several independent evolutionary studies have suggested that Gly, Ala, Asp, Val, Ser, Pro, Glu, Leu, Thr may belong to a group of amino acids that constituted the early genetic code, whereas Cys, Met, Tyr, Trp, His, Phe may belong to a group of amino acids that constituted later additions of the genetic code.[67][68][69]
Стандартные и нестандартные аминокислоты
[ редактировать ]20 аминокислот, которые кодируются непосредственно кодонами универсального генетического кода, называются стандартными или каноническими аминокислотами. Модифицированная форма метионина ( N -формилметионин ) часто включается вместо метионина в качестве исходной аминокислоты белков бактерий, митохондрий и пластид (включая хлоропласты). Остальные аминокислоты называются нестандартными или неканоническими . Большинство нестандартных аминокислот также непротеиногенны (т.е. не могут быть включены в белки во время трансляции), но две из них являются протеиногенными, поскольку могут быть включены в белки трансляционно, используя информацию, не закодированную в универсальном генетическом коде.
Двумя нестандартными протеиногенными аминокислотами являются селеноцистеин (присутствует у многих неэукариот, а также у большинства эукариот, но не кодируется непосредственно ДНК) и пирролизин (обнаруживается только у некоторых архей и по крайней мере у одной бактерии ). Включение этих нестандартных аминокислот встречается редко. Например, 25 белков человека включают в свою первичную структуру селеноцистеин. [ 70 ] а структурно охарактеризованные ферменты (селеноферменты) используют селеноцистеин в качестве каталитического фрагмента в своих активных центрах. [ 71 ] Пирролизин и селеноцистеин кодируются вариантными кодонами. Например, селеноцистеин кодируется стоп-кодоном и элементом SECIS . [ 72 ] [ 73 ] [ 74 ]
N -формилметионин (который часто является исходной аминокислотой белков бактерий, митохондрий и хлоропластов ) обычно рассматривается как форма метионина , а не как отдельная протеиногенная аминокислота. Не встречающиеся в природе комбинации кодон- тРНК также могут быть использованы для «расширения» генетического кода и образования новых белков, известных как аллопротеины, включающих непротеиногенные аминокислоты . [ 75 ] [ 76 ] [ 77 ]
Непротеиногенные аминокислоты
[ редактировать ]Помимо 22 протеиногенных аминокислот , множество непротеиногенных известно аминокислот. Они либо не содержатся в белках (например, карнитин , ГАМК , левотироксин ), либо не производятся напрямую и изолированно стандартными клеточными механизмами. Например, гидроксипролин синтезируется из пролина . Другой пример — селенометионин ).
Непротеиногенные аминокислоты, содержащиеся в белках, образуются путем посттрансляционной модификации . Такие модификации могут также определять локализацию белка, например, добавление длинных гидрофобных групп может вызвать связывание белка с фосфолипидной мембраной. [ 78 ] Примеры:
- карбоксилирование , глутамата кальция позволяет лучше катионы связывать [ 79 ]
- Гидроксипролин , образующийся в результате гидроксилирования пролина , является основным компонентом соединительной ткани коллагена . [ 80 ]
- Гипузин в факторе инициации трансляции EIF5A содержит модификацию лизина. [ 81 ]
Некоторые непротеиногенные аминокислоты не встречаются в белках. Примеры включают 2-аминоизомасляную кислоту и нейротрансмиттер гамма-аминомасляную кислоту . Непротеиногенные аминокислоты часто встречаются в качестве промежуточных продуктов в метаболических путях стандартных аминокислот – например, орнитин и цитруллин встречаются в цикле мочевины аминокислот , являющемся частью катаболизма (см. ниже). [ 82 ] Редким исключением из доминирования α-аминокислот в биологии является β-аминокислота бета-аланин (3-аминопропановая кислота), которая используется растениями и микроорганизмами при синтезе пантотеновой кислоты (витамина В 5 ), компонента коэнзим А. [ 83 ]
В питании млекопитающих
[ редактировать ]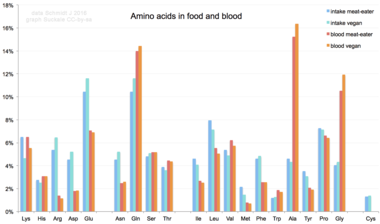
Аминокислоты не являются типичным компонентом пищи: животные питаются белками. В процессе пищеварения белок расщепляется на аминокислоты. Затем они используются для синтеза новых белков и других биомолекул или окисляются до мочевины и углекислого газа в качестве источника энергии. [ 84 ] Путь окисления начинается с удаления аминогруппы трансаминазой ; аминогруппа затем подается в цикл мочевины . Другим продуктом трансамидирования является кетокислота , вступающая в цикл лимонной кислоты . [ 85 ] Глюкогенные аминокислоты также могут превращаться в глюкозу посредством глюконеогенеза . [ 86 ]
Из 20 стандартных аминокислот девять ( His , Ile , Leu , Lys , Met , Phe , Thr , Trp и Val ) называются незаменимыми аминокислотами, поскольку организм человека не может синтезировать их из других соединений на уровне, необходимом для нормального роста. поэтому их необходимо получать из пищи. [ 87 ] [ 88 ] [ 89 ]
Полунезаменимые и условно незаменимые аминокислоты и потребности подростков
[ редактировать ]Кроме того, у детей цистеин, тирозин и аргинин считаются полунезаменимыми аминокислотами, а таурин — полунезаменимой аминосульфоновой кислотой. Некоторые аминокислоты условно незаменимы для определенного возраста или состояния здоровья. Незаменимые аминокислоты также могут варьироваться от вида к виду. [ д ] Метаболические пути, синтезирующие эти мономеры, еще не полностью развиты. [ 90 ] [ 91 ]
Небелковые функции
[ редактировать ]Многие протеиногенные и непротеиногенные аминокислоты выполняют биологические функции, помимо того, что они являются предшественниками белков и пептидов. У человека аминокислоты также играют важную роль в различных путях биосинтеза. Для защиты растений от травоядных животных иногда используются аминокислоты. [ 95 ] Примеры:
Стандартные аминокислоты
[ редактировать ]- Триптофан является предшественником нейромедиатора серотонина . [ 96 ]
- Тирозин (и его предшественник фенилаланин) являются предшественниками катехоламиновых нейротрансмиттеров дофамина , адреналина и норадреналина , а также различных следовых аминов .
- Фенилаланин является предшественником фенэтиламина и тирозина в организме человека. В растениях он является предшественником различных фенилпропаноидов , которые играют важную роль в метаболизме растений.
- Глицин является предшественником порфиринов, таких как гем . [ 97 ]
- Аргинин является предшественником оксида азота . [ 98 ]
- Орнитин и S -аденозилметионин являются предшественниками полиаминов . [ 99 ]
- Аспартат , глицин и глутамин являются предшественниками нуклеотидов . [ 100 ] Однако не все функции других распространенных нестандартных аминокислот известны.
Роль нестандартных аминокислот
[ редактировать ]- Карнитин используется в транспорте липидов .
- гамма-аминомасляная кислота является нейромедиатором. [ 101 ]
- 5-HTP (5-гидрокситриптофан) используется для экспериментального лечения депрессии. [ 102 ]
- L -ДОФА ( L -дигидроксифенилаланин) для лечения болезни Паркинсона , [ 103 ]
- Эфлорнитин ингибирует орнитиндекарбоксилазу и используется при лечении сонной болезни . [ 104 ]
- Канаванин , аналог аргинина, обнаруженный во многих бобовых, является антифидантом , защищающим растение от хищников. [ 105 ]
- Мимозин, содержащийся в некоторых бобовых, является еще одним возможным антифидантом . [ 106 ] Это соединение является аналогом тирозина и может отравить животных, пасущихся на этих растениях.
Использование в промышленности
[ редактировать ]Корма для животных
[ редактировать ]Аминокислоты иногда добавляют в корм для животных , поскольку некоторые компоненты этих кормов, такие как соевые бобы , содержат низкие уровни некоторых незаменимых аминокислот , особенно лизина, метионина, треонина и триптофана. [ 107 ] Аналогичным образом аминокислоты используются для хелатирования катионов металлов с целью улучшения усвоения минералов из кормовых добавок. [ 108 ]
Еда
[ редактировать ]Пищевая промышленность является крупным потребителем аминокислот, особенно глутаминовой кислоты , которая используется в качестве усилителя вкуса . [ 109 ] и аспартам (1-метиловый эфир аспартилфенилаланина), который используется в качестве искусственного подсластителя . [ 110 ] Аминокислоты иногда добавляются в пищу производителями для облегчения симптомов дефицита минералов, таких как анемия, за счет улучшения усвоения минералов и уменьшения негативных побочных эффектов от приема неорганических минеральных добавок. [ 111 ]
Химические строительные блоки
[ редактировать ]Аминокислоты представляют собой недорогое сырье, используемое в синтезе хиральных пулов в качестве энантиомерно чистых строительных блоков. [ 112 ] [ 113 ]
Аминокислоты используются при синтезе некоторых косметических средств . [ 107 ]
Желаемое использование
[ редактировать ]Удобрения
[ редактировать ]Хелатирующая . способность аминокислот иногда используется в удобрениях для облегчения доставки минералов к растениям с целью устранения дефицита минералов, такого как хлороз железа Эти удобрения также используются для предотвращения возникновения недостатков и для улучшения общего состояния растений. [ 114 ]
Биоразлагаемые пластики
[ редактировать ]Аминокислоты рассматривались как компоненты биоразлагаемых полимеров, которые находят применение в качестве экологически чистой упаковки, а также в медицине для доставки лекарств и изготовления протезных имплантатов . [ 115 ] Интересным примером таких материалов является полиаспартат , водорастворимый биоразлагаемый полимер, который может найти применение в одноразовых подгузниках и сельском хозяйстве. [ 116 ] Благодаря своей растворимости и способности хелатировать ионы металлов полиаспартат также используется в качестве биоразлагаемого средства против накипи и ингибитора коррозии . [ 117 ] [ 118 ]
Синтез
[ редактировать ]
Химический синтез
[ редактировать ]Коммерческое производство аминокислот обычно основано на мутантных бактериях, которые перепроизводят отдельные аминокислоты, используя глюкозу в качестве источника углерода. Некоторые аминокислоты производятся путем ферментативного превращения синтетических промежуточных продуктов. 2-аминотиазолин-4-карбоновая кислота является промежуточным продуктом в одном промышленном синтезе L -цистеина Например, . Аспарагиновую кислоту получают добавлением аммиака к фумарату с помощью лиазы. [ 111 ]
Биосинтез
[ редактировать ]В растениях азот сначала усваивается в органические соединения в виде глутамата , образующегося из альфа-кетоглутарата и аммиака в митохондриях. Что касается других аминокислот, растения используют трансаминазы для перемещения аминогруппы от глутамата к другой альфа-кетокислоте. Например, аспартатаминотрансфераза превращает глутамат и оксалоацетат в альфа-кетоглутарат и аспартат. [ 119 ] Другие организмы также используют трансаминазы для синтеза аминокислот.
Нестандартные аминокислоты обычно образуются путем модификации стандартных аминокислот. Например, гомоцистеин образуется путем транссульфурации или деметилирования метионина через промежуточный метаболит S -аденозилметионин . [ 120 ] в то время как производится посттрансляционной модификацией пролина гидроксипролин . [ 121 ]
Микроорганизмы и растения синтезируют множество редких аминокислот. Например, некоторые микробы производят 2-аминоизомасляную кислоту и лантионин , который представляет собой производное аланина с сульфидными мостиками. Обе эти аминокислоты содержатся в пептидных лантибиотиках, таких как аламетицин . [ 122 ] Однако в растениях 1-аминоциклопропан-1-карбоновая кислота представляет собой небольшую дизамещенную циклическую аминокислоту, которая является промежуточным продуктом в производстве растительного гормона этилена . [ 123 ]
Первичный синтез
[ редактировать ]Предполагается, что образование аминокислот и пептидов предшествует и, возможно, вызывает возникновение жизни на Земле . Аминокислоты могут образовываться из простых предшественников в различных условиях. [ 124 ] Поверхностный химический метаболизм аминокислот и очень небольших соединений мог привести к накоплению аминокислот, коферментов и небольших молекул углерода на основе фосфатов. [ 125 ] [ необходимы дополнительные ссылки ] Аминокислоты и подобные строительные блоки могли бы быть преобразованы в протопептиды , причем пептиды считаются ключевыми игроками в зарождении жизни. [ 126 ]
В знаменитом эксперименте Юри-Миллера при прохождении электрической дуги через смесь метана, водорода и аммиака образуется большое количество аминокислот. С тех пор ученые открыли ряд способов и компонентов, с помощью которых могло происходить потенциально пребиотическое образование и химическая эволюция пептидов, таких как конденсирующие агенты, конструкция самореплицирующихся пептидов и ряд неферментативных механизмов, с помощью которых аминокислоты кислоты могли возникнуть и превратиться в пептиды. [ 126 ] Несколько гипотез ссылаются на синтез Стрекера, посредством которого цианистый водород, простые альдегиды, аммиак и вода производят аминокислоты. [ 124 ]
Согласно обзору, аминокислоты и даже пептиды «довольно регулярно обнаруживаются в различных экспериментальных бульонах , которые разрешено готовить из простых химикатов. Это потому, что нуклеотиды гораздо труднее синтезировать химическим путем, чем аминокислоты». В хронологическом порядке это предполагает, что должен был существовать «белковый мир» или, по крайней мере, «мир полипептидов», за которым, возможно, позже последовали « мир РНК » и « мир ДНК ». [ 127 ] Картирование кодонов и аминокислот может быть биологической информационной системой, лежащей в основе первобытного зарождения жизни на Земле. [ 128 ] Хотя аминокислоты и, следовательно, простые пептиды должны были образоваться при различных экспериментально исследованных геохимических сценариях, переход от абиотического мира к первым формам жизни в значительной степени все еще не решен. [ 129 ]
Реакции
[ редактировать ]Аминокислоты подвергаются реакциям, ожидаемым от составляющих их функциональных групп. [ 130 ] [ 131 ]
Образование пептидной связи
[ редактировать ]
Поскольку как аминная, так и карбоксильная группы аминокислот могут вступать в реакцию с образованием амидных связей, одна молекула аминокислоты может вступать в реакцию с другой и соединяться посредством амидной связи. Эта полимеризация аминокислот и создает белки. Эта реакция конденсации дает вновь образованную пептидную связь и молекулу воды. В клетках эта реакция не происходит напрямую; вместо этого аминокислота сначала активируется путем присоединения к молекуле транспортной РНК через сложноэфирную связь. Эта аминоацил-тРНК образуется в результате АТФ -зависимой реакции, осуществляемой аминоацил-тРНК-синтетазой . [ 132 ] Эта аминоацил-тРНК затем является субстратом для рибосомы, которая катализирует атаку аминогруппы удлиняющейся белковой цепи на сложноэфирную связь. [ 133 ] В результате этого механизма все белки, образуемые рибосомами, синтезируются, начиная с их N -конца и продвигаясь к их С -концу.
Однако не все пептидные связи образуются таким образом. В некоторых случаях пептиды синтезируются специфическими ферментами. Например, трипептид глутатион является важной частью защиты клеток от окислительного стресса. Этот пептид синтезируется в два этапа из свободных аминокислот. [ 134 ] На первом этапе гамма-глутамилцистеинсинтетаза конденсирует цистеин и глутамат посредством пептидной связи, образующейся между карбоксилом боковой цепи глутамата (гамма-углерод этой боковой цепи) и аминогруппой цистеина. Этот дипептид затем конденсируется с глицином под действием глутатионсинтетазы с образованием глутатиона. [ 135 ]
В химии пептиды синтезируют с помощью множества реакций. Один из наиболее часто используемых в твердофазном синтезе пептидов использует ароматические оксимные производные аминокислот в качестве активированных единиц. Они последовательно добавляются к растущей пептидной цепи, которая прикрепляется к твердой смоляной подложке. [ 136 ] Библиотеки пептидов используются при поиске лекарств посредством высокопроизводительного скрининга . [ 137 ]
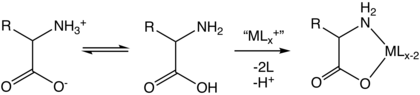
Сочетание функциональных групп позволяет аминокислотам быть эффективными полидентатными лигандами для хелатов металлов с аминокислотами. [ 138 ] Множественные боковые цепи аминокислот также могут подвергаться химическим реакциям.
Катаболизм
[ редактировать ]
* Глюкогенные , продукты, способные образовывать глюкозу путем глюконеогенеза.
* Кетогенные – продукты, не обладающие способностью образовывать глюкозу. Эти продукты все еще могут использоваться для кетогенеза или синтеза липидов .
* Аминокислоты катаболизируются как в глюкогенные, так и в кетогенные продукты.
Деградация аминокислоты часто включает дезаминирование путем перемещения ее аминогруппы в α-кетоглутарат с образованием глутамата . В этом процессе участвуют трансаминазы, часто те же, что и те, которые используются при аминировании во время синтеза. У многих позвоночных аминогруппа затем удаляется в ходе цикла мочевины и выводится из организма в виде мочевины . Однако вместо этого в результате деградации аминокислот может образовываться мочевая кислота или аммиак. Например, сериндегидратаза превращает серин в пируват и аммиак. [ 100 ] После удаления одной или нескольких аминогрупп оставшуюся часть молекулы иногда можно использовать для синтеза новых аминокислот или использовать для получения энергии путем участия в гликолизе или цикле лимонной кислоты , как подробно показано на изображении справа.
Комплексообразование
[ редактировать ]Аминокислоты являются бидентатными лигандами, образующими аминокислотные комплексы переходных металлов . [ 140 ]
Химический анализ
[ редактировать ]Общий азот органического вещества в основном формируется за счет аминогрупп белков. Общий азот по Кьельдалю ( TKN ) — это показатель азота, широко используемый при анализе (сточных) вод, почвы, пищевых продуктов, кормов и органических веществ в целом. Как следует из названия, метод Кьельдаля применяется . Существуют более чувствительные методы. [ 141 ] [ 142 ]
См. также
[ редактировать ]Примечания
[ редактировать ]- ^ Позднее открытие объясняется тем, что цистеин окисляется до цистина на воздухе.
- ^ Пролин и другие циклические аминокислоты являются исключением из этой общей формулы. Циклизация α-аминокислоты приводит к образованию соответствующего вторичного амина. Их иногда называют иминокислотами .
- ^ Соглашение L и D для конфигурации аминокислот относится не к оптической активности самой аминокислоты, а скорее к оптической активности изомера глицеральдегида, из которого эта аминокислота теоретически может быть синтезирована ( D -глицеральдегид является правовращающим). - глицеральдегид L является левовращающим). Альтернативное соглашение заключается в использовании обозначений ( S ) и ( R ) для указания абсолютной конфигурации . [ 30 ] Почти все аминокислоты в белках имеют ( S ) у α-углерода, при этом цистеин является ( R ), а глицин нехиральным . [ 31 ] Цистеин имеет боковую цепь в том же геометрическом положении, что и другие аминокислоты, но терминология R / S поменяна местами, поскольку сера имеет более высокий атомный номер по сравнению с карбоксильным кислородом, что дает боковой цепи более высокий приоритет по методу Кана-Ингольда-Прелога. правила последовательности .
- ^ Например, жвачные животные, такие как коровы, получают ряд аминокислот через микробы в первых двух камерах желудка .
Ссылки
[ редактировать ]- ^ Нельсон Д.Л., Кокс М.М. (2005). Принципы биохимии (4-е изд.). Нью-Йорк: WH Freeman. ISBN 0-7167-4339-6 .
- ^ Флисси, Арески; Рикар, Эмма; Кампар, Клементина; Шевалье, Микаэль; Дюфрен, Йоанн; Михалик, Юрай; Жак, Филипп; Флао, Кристоф; Лисачек, Фредерик; Леклер, Валери; Пупин, Мод (2020). «Норин: обновление ресурса нерибосомальных пептидов» . Исследования нуклеиновых кислот . 48 (Д1): Д465–Д469. дои : 10.1093/nar/gkz1000 . ПМЦ 7145658 . ПМИД 31691799 .
- ^ Ричард Каммак, изд. (2009). «Вестник 2009» . Комитет по биохимической номенклатуре ИЮПАК и NC-IUBMB. Пирролизин. Архивировано из оригинала 12 сентября 2017 года . Проверено 16 апреля 2012 г.
- ^ Ротер, Майкл; Кшицкий, Джозеф А. (1 января 2010 г.). «Селеноцистеин, пирролизин и уникальный энергетический метаболизм метаногенных архей» . Архея . 2010 : 1–14. дои : 10.1155/2010/453642 . ISSN 1472-3646 . ПМЦ 2933860 . ПМИД 20847933 .
- ^ Лэтэм MC (1997). «Глава 8. Состав тела, функции питания, обмена веществ и энергетики» . Питание человека в развивающихся странах . Серия «Продовольствие и питание» – № 29. Рим: Продовольственная и сельскохозяйственная организация Объединенных Наций. Архивировано из оригинала 8 октября 2012 года . Проверено 9 сентября 2012 года .
- ^
Луизи, Пьер Луиджи (13 июля 2006 г.). Возникновение жизни: от химического происхождения к синтетической биологии . Издательство Кембриджского университета. п. 13. ISBN 9781139455640 . Проверено 5 августа 2024 г.
Конечно, если бы на Земле существовали только дикетопиперазины, а не аминокислоты; или если бы сахара не имели того размера, который они имеют; или если бы липиды были в три раза короче, то у нас не было бы жизни.
- ^ Перейти обратно: а б с «Номенклатура и символика аминокислот и пептидов» . Совместная комиссия IUPAC-IUB по биохимической номенклатуре. 1983. Архивировано из оригинала 9 октября 2008 года . Проверено 17 ноября 2008 г.
- ^ Викери Х.Б., Шмидт К.Л. (1931). «История открытия аминокислот». хим. Преподобный . 9 (2): 169–318. дои : 10.1021/cr60033a001 .
- ^ Хансен С. (май 2015 г.). «Открытие протеиногенных аминокислот с 1805 года в Париже по 1935 год в Иллинойсе» (PDF) (на немецком языке). Берлин. Архивировано из оригинала (PDF) 1 декабря 2017 года.
- ^ Воклен Л.Н., Робике П.Ж. (1806). «Открытие нового растительного принципа у Asparagus sativus». Анналы де Шими . 57 : 88–93.
- ^ Перейти обратно: а б Анфинсен CB, Эдсолл Дж. Т., Ричардс Ф. М. (1972). Достижения в области химии белков . Нью-Йорк: Академическая пресса. стр. 99, 103 . ISBN 978-0-12-034226-6 .
- ^ Волластон WH (1810 г.). «О кистозной окиси, новом виде мочевых камней». Философские труды Королевского общества . 100 : 223–230. дои : 10.1098/rstl.1810.0015 . S2CID 110151163 .
- ^ Бауман Э (1884). «Уберцистин и цистеин» . Z Физиол Хим . 8 (4): 299–305. Архивировано из оригинала 14 марта 2011 года . Проверено 28 марта 2011 г.
- ^ Браконнот HM (1820 г.). «О превращении животных веществ в новые вещества с помощью серной кислоты». Анналы химии и физики . 2-я серия. 13 :113–125.
- ^ Симони Р.Д., Хилл Р.Л., Воган М. (сентябрь 2002 г.). «Открытие аминокислоты треонина: работа Уильяма К. Роуза [классическая статья]» . Журнал биологической химии . 277 (37): Е25. дои : 10.1016/S0021-9258(20)74369-3 . ПМИД 12218068 . Архивировано из оригинала 10 июня 2019 года . Проверено 4 июля 2015 г.
- ^ Маккой Р.Х., Мейер С.Э., Роуз У.К. (1935). «Опыты по кормлению смесями высокоочищенных аминокислот. VIII. Выделение и идентификация новой незаменимой аминокислоты» . Журнал биологической химии . 112 : 283–302. дои : 10.1016/S0021-9258(18)74986-7 .
- ^ Ментен, П. Химический словарь: этимологический и исторический подход . Де Бек, Брюссель. ссылка Архивировано 28 декабря 2019 года в Wayback Machine .
- ^ Харпер Д. «амино-» . Интернет-словарь этимологии . Архивировано из оригинала 2 декабря 2017 года . Проверено 19 июля 2010 г.
- ^ Паал С (1894). «О влиянии фенил-и-цианата на органические аминокислоты» . Отчеты Немецкого химического общества . 27 : 974–979. дои : 10.1002/cber.189402701205 . Архивировано из оригинала 25 июля 2020 года.
- ^ Фрутон Дж.С. (1990). «Глава 5 — Эмиль Фишер и Франц Хофмайстер» . Контрасты в научном стиле: исследовательские группы в области химических и биохимических наук . Том. 191. Американское философское общество. стр. 163–165. ISBN 978-0-87169-191-0 .
- ^ «Альфа-аминокислота» . Мерриам-Вебстер Медикал . Архивировано из оригинала 3 января 2015 года . Проверено 3 января 2015 г. .
- ^ Кларк, Джим (август 2007 г.). «Знакомство с аминокислотами» . химгид . Архивировано из оригинала 30 апреля 2015 года . Проверено 4 июля 2015 г.
- ^ Якубке Х.Д., Севальд Н. (2008). «Аминокислоты» . Пептиды от А до Я: Краткая энциклопедия . Германия: Wiley-VCH. п. 20. ISBN 9783527621170 . Архивировано из оригинала 17 мая 2016 года . Проверено 5 января 2016 г. - через Google Книги.
- ^ Поллегиони Л., Серви С., ред. (2012). Неприродные аминокислоты: методы и протоколы . Методы молекулярной биологии. Том. 794. Хумана Пресс. п. v. doi : 10.1007/978-1-61779-331-8 . ISBN 978-1-61779-331-8 . OCLC 756512314 . S2CID 3705304 .
- ^ Хертвек С. (октябрь 2011 г.). «Биосинтез и зарядка пирролизина, 22-й генетически кодируемой аминокислоты». Angewandte Chemie, международное издание . 50 (41): 9540–9541. дои : 10.1002/anie.201103769 . ПМИД 21796749 . S2CID 5359077 .

- ^ Перейти обратно: а б «Глава 1: Белки — рабочие молекулы организма» . Структуры жизни . Национальный институт общих медицинских наук. 27 октября 2011 года. Архивировано из оригинала 7 июня 2014 года . Проверено 20 мая 2008 г.
- ^ Михал Г., Шомбург Д., ред. (2012). Биохимические пути: Атлас биохимии и молекулярной биологии (2-е изд.). Оксфорд: Уайли-Блэквелл. п. 5. ISBN 978-0-470-14684-2 .
- ^ Перейти обратно: а б с Крейтон, штат Техас (1993). «Глава 1» . Белки: строение и молекулярные свойства . Сан-Франциско: WH Freeman. ISBN 978-0-7167-7030-5 .
- ^ Генчи, Джузеппе (1 сентября 2017 г.). «Обзор d-аминокислот» . Аминокислоты . 49 (9): 1521–1533. дои : 10.1007/s00726-017-2459-5 . ISSN 1438-2199 . ПМИД 28681245 . S2CID 254088816 .
- ^ Кан, RS ; Ингольд, СК ; Прелог, В. (1966). «Спецификация молекулярной хиральности». Angewandte Chemie, международное издание . 5 (4): 385–415. дои : 10.1002/anie.196603851 .
- ^ Хатем СМ (2006). «Газохроматографическое определение энантиомеров аминокислот в табаке и бутылочных винах» . Университет Гиссена. Архивировано из оригинала 22 января 2009 года . Проверено 17 ноября 2008 г.
- ^ Перейти обратно: а б с д и ж Гарретт, Реджинальд Х.; Гришэм, Чарльз М. (2010). Биохимия (4-е изд.). Бельмонт, Калифорния: Брукс/Коул, Cengage Learning. стр. 74, 134–176, 430–442. ISBN 978-0-495-10935-8 . OCLC 297392560 .
- ^ Новиков Антон П.; Сафонов Алексей Владимирович; Герман Константин Евгеньевич; Григорьев Михаил С. (1 декабря 2023 г.). «Какие взаимодействия мы можем получить при переходе от цвиттер-ионов к «дриттерным» ионам: взаимодействия анион-анион C–O⋯Re(O4) и Re–O⋯Re(O4) составляют структурное различие между перренатом и пертехнетатом L-гистидиния» . CrystEngComm . 26 : 61–69. дои : 10.1039/D3CE01164J . ISSN 1466-8033 . S2CID 265572280 .
- ^ Папп, Лаура Ванда; Лу, Джун; Холмгрен, Арне; Ханна, Кум Кум (1 июля 2007 г.). «От селена к селенопротеинам: синтез, идентичность и их роль в здоровье человека» . Антиоксиданты и окислительно-восстановительная сигнализация . 9 (7): 775–806. дои : 10.1089/ars.2007.1528 . ISSN 1523-0864 . ПМИД 17508906 .
- ^ Хао, Бинг; Гонг, Вэйминь; Фергюсон, Цунео К.; Джеймс, Кэри М.; Кшицкий, Джозеф А.; Чан, Майкл К. (24 мая 2002 г.). «Новый UAG-кодируемый остаток в структуре метаногенметилтрансферазы» . Наука . 296 (5572): 1462–1466. Бибкод : 2002Sci...296.1462H . дои : 10.1126/science.1069556 . ISSN 0036-8075 . ПМИД 12029132 . S2CID 35519996 .
- ^ Стейнхардт, Дж.; Рейнольдс, Дж. А. (1969). Множественные равновесия в белках . Нью-Йорк: Академическая пресса. стр. 176–21. ISBN 978-0126654509 .
- ^ Брёнстед, Дж. Н. (1923). «Некоторые замечания о понятии кислот и оснований». Recueil des Travaux Chimiques des Pays-Bas . 42 (8): 718–728. дои : 10.1002/recl.19230420815 .
- ^ Перейти обратно: а б Воллхардт, К. Питер К. (2007). Органическая химия: строение и функции . Нил Эрик Шор (5-е изд.). Нью-Йорк: WH Freeman. стр. 58–66. ISBN 978-0-7167-9949-8 . OCLC 61448218 .
- ^ Феннема ОР (19 июня 1996 г.). Пищевая химия 3-е изд . ЦРК Пресс. стр. 327–328. ISBN 978-0-8247-9691-4 .
- ^ Перейти обратно: а б Нтунтуми С., Властаридис П., Моссиалос Д., Статопулос С., Илиопулос И., Промпонас В. и др. (ноябрь 2019 г.). «Области низкой сложности в белках прокариот выполняют важные функциональные роли и высоко консервативны» . Исследования нуклеиновых кислот . 47 (19): 9998–10009. дои : 10.1093/nar/gkz730 . ПМК 6821194 . ПМИД 31504783 .
- ^ Урри Д.В. (2004). «Изменение свободной энергии Гиббса для гидрофобной ассоциации: вывод и оценка с помощью обратных температурных переходов». Письма по химической физике . 399 (1–3): 177–183. Бибкод : 2004CPL...399..177U . дои : 10.1016/S0009-2614(04)01565-9 .
- ^ Маркотт Э.М., Пеллегрини М., Йейтс Т.О., Айзенберг Д. (октябрь 1999 г.). «Перепись белковых повторов». Журнал молекулярной биологии . 293 (1): 151–60. дои : 10.1006/jmbi.1999.3136 . ПМИД 10512723 .
- ^ Хаэрти В., Голдинг ГБ (октябрь 2010 г.). Бонен Л. (ред.). «Последовательности низкой сложности и повторы отдельных аминокислот: а не просто «мусорные» пептидные последовательности». Геном . 53 (10): 753–62. дои : 10.1139/G10-063 . ПМИД 20962881 .
- ^ Маги Т., Seabra MC (апрель 2005 г.). «Жировое ацилирование и пренилирование белков: что интересного в жирах». Современное мнение в области клеточной биологии . 17 (2): 190–196. дои : 10.1016/j.ceb.2005.02.003 . ПМИД 15780596 .
- ^ Пилобелло К.Т., Махал Л.К. (июнь 2007 г.). «Расшифровка гликокода: сложность и аналитическая задача гликомики». Современное мнение в области химической биологии . 11 (3): 300–305. дои : 10.1016/j.cbpa.2007.05.002 . ПМИД 17500024 .
- ^ Смотрис Ю.Е., Линдер М.Е. (2004). «Пальмитоилирование внутриклеточных сигнальных белков: регуляция и функция». Ежегодный обзор биохимии . 73 (1): 559–587. doi : 10.1146/annurev.biochem.73.011303.073954 . ПМИД 15189153 .
- ^ Перейти обратно: а б с д и «Комиссия IUPAC-IUB по биохимической номенклатуре. Однобуквенное обозначение аминокислотных последовательностей» . Журнал биологической химии . 243 (13): 3557–3559. 10 июля 1968 г. doi : 10.1016/S0021-9258(19)34176-6 .
- ^ Перейти обратно: а б Шафран, М. (апрель 1998 г.). «Названия аминокислот и комнатные игры: от тривиальных названий до однобуквенного кода, названия аминокислот напрягают память студентов. Возможна ли более рациональная номенклатура?» . Биохимическое образование . 26 (2): 116–118. дои : 10.1016/S0307-4412(97)00167-2 .
- ^ Перейти обратно: а б с Адога, Годвин I; Николсон, Б.Х. (январь 1988 г.). «Письма в редакцию» . Биохимическое образование . 16 (1): 49. дои : 10.1016/0307-4412(88)90026-X .
- ^ Кайт Дж., Дулитл РФ (май 1982 г.). «Простой метод отображения гидропатического характера белка». Журнал молекулярной биологии . 157 (1): 105–132. CiteSeerX 10.1.1.458.454 . дои : 10.1016/0022-2836(82)90515-0 . ПМИД 7108955 .
- ^ Фрайфельдер Д. (1983). Физическая биохимия (2-е изд.). WH Фриман и компания. ISBN 978-0-7167-1315-9 . [ нужна страница ]
- ^ Козловский Л.П. (январь 2017 г.). «Протеом-p I : база данных изоэлектрических точек протеома» . Исследования нуклеиновых кислот . 45 (Д1): Д1112–Д1116. дои : 10.1093/nar/gkw978 . ПМК 5210655 . ПМИД 27789699 .
- ^ Перейти обратно: а б Хаусман Р.Э., Купер Г.М. (2004). Клетка: молекулярный подход . Вашингтон, округ Колумбия: ASM Press. п. 51. ИСБН 978-0-87893-214-6 .
- ^ Кодоны также могут выражаться: CGN, AGR.
- ^ кодоны также могут выражаться с помощью: CUN, UUR.
- ^ Осланд Р., Абрамс К., Ампе К., Болл Л.Дж., Бедфорд М.Т., Чезарени Дж., Джимона М., Херли Дж.Х., Джарчау Т., Лехто В.П., Леммон М.А., Линдинг Р., Майер Б.Дж., Нагай М., Судол М., Уолтер Ю., Уиндер С.Дж. (февраль 2002 г.). «Нормализация номенклатуры пептидных мотивов как лигандов модульных белковых доменов». Письма ФЭБС . 513 (1): 141–144. дои : 10.1111/j.1432-1033.1968.tb00350.x . ПМИД 11911894 .
- ^ Комиссия IUPAC – IUB по биохимической номенклатуре (1972). «Однобуквенное обозначение аминокислотных последовательностей» . Чистая и прикладная химия . 31 (4): 641–645. дои : 10.1351/pac197231040639 . ПМИД 5080161 .
- ^ Кодоны также могут выражаться с помощью: CTN, ATH, TTR; MTY, YTR, АТА; МТИ, ХТА, YTG
- ^ Кодоны также могут выражаться с помощью: TWY, CAY, TGG.
- ^ Кодоны также могут выражаться с помощью: NTR, VTY.
- ^ Кодоны также могут выражаться с помощью: VAN, WCN, MGY, CGP.
- ^ «HGVS: Номенклатура вариантов последовательностей, рекомендации по белкам» . Архивировано из оригинала 24 сентября 2021 года . Проверено 23 сентября 2021 г.
- ^ Суханек М., Радзиковска А., Тиле С. (апрель 2005 г.). «Фотолейцин и фотометионин позволяют идентифицировать белок-белковые взаимодействия в живых клетках» . Природные методы . 2 (4): 261–267. дои : 10.1038/nmeth752 . ПМИД 15782218 .
- ^ Роднина М.В., Берингер М., Винтермейер В. (январь 2007 г.). «Как рибосомы образуют пептидные связи». Тенденции биохимических наук . 32 (1): 20–26. дои : 10.1016/j.tibs.2006.11.007 . ПМИД 17157507 .
- ^ Дрисколл Д.М., Коупленд PR (2003). «Механизм и регуляция синтеза селенопротеинов». Ежегодный обзор питания . 23 (1): 17–40. дои : 10.1146/annurev.nutr.23.011702.073318 . ПМИД 12524431 .
- ^ Кшицкий Я.А. (декабрь 2005 г.). «Прямое генетическое кодирование пирролизина». Современное мнение в микробиологии . 8 (6): 706–712. дои : 10.1016/j.mib.2005.10.009 . ПМИД 16256420 .
- ^ Вонг, JT-F. (1975). «Теория коэволюции генетического кода» . Труды Национальной академии наук . 72 (5): 1909–1912. Бибкод : 1975PNAS...72.1909T . дои : 10.1073/pnas.72.5.1909 . ПМК 432657 . ПМИД 1057181 .
- ^ Трифонов Е.Н. (декабрь 2000 г.). «Консенсусный временной порядок аминокислот и эволюция триплетного кода». Джин . 261 (1): 139–151. дои : 10.1016/S0378-1119(00)00476-5 . ПМИД 11164045 .
- ^ Хиггс П.Г., Пудриц Р.Э. (июнь 2009 г.). «Термодинамические основы синтеза пребиотических аминокислот и природа первого генетического кода». Астробиология . 9 (5): 483–90. arXiv : 0904.0402 . Бибкод : 2009AsBio...9..483H . дои : 10.1089/ast.2008.0280 . ПМИД 19566427 . S2CID 9039622 .
- ^ Крюков Г.В., Кастеллано С., Новоселов С.В., Лобанов А.В., Зехтаб О., Гиго Р., Гладышев В.Н. (май 2003 г.). «Характеристика селенопротеомов млекопитающих» . Наука . 300 (5624): 1439–1443. Бибкод : 2003Sci...300.1439K . дои : 10.1126/science.1083516 . ПМИД 12775843 . S2CID 10363908 . Архивировано из оригинала 23 июля 2018 года . Проверено 12 июня 2019 г.
- ^ Громер С., Уриг С., Беккер К. (январь 2004 г.). «Тиоредоксиновая система - от науки к клинике». Обзоры медицинских исследований . 24 (1): 40–89. дои : 10.1002/мед.10051 . ПМИД 14595672 . S2CID 1944741 .
- ^ Чонг Х (2008). Моделирование электростатического вклада в сворачивание и связывание белков (кандидатская диссертация). Государственный университет Флориды. п. 1 сноска. Архивировано из оригинала 28 января 2020 года . Проверено 28 января 2020 г.
- ^ Стюарт Л., Бургин AB (2005). «Цельный синтез генов: гено-матическое будущее» . Границы в разработке и открытии лекарств . 1 . Издательство Bentham Science : 299. doi : 10.2174/1574088054583318 . ISBN 978-1-60805-199-1 . ISSN 1574-0889 . Архивировано из оригинала 14 апреля 2021 года . Проверено 5 января 2016 г.
- ^ Эльжановский А., Остелл Дж. (7 апреля 2008 г.). «Генетические коды» . Национальный центр биотехнологической информации (NCBI). Архивировано из оригинала 20 августа 2016 года . Проверено 10 марта 2010 г.
- ^ Се Дж., Шульц П.Г. (декабрь 2005 г.). «Добавление аминокислот в генетический репертуар». Современное мнение в области химической биологии . 9 (6): 548–554. дои : 10.1016/j.cbpa.2005.10.011 . ПМИД 16260173 .
- ^ Ван Ц, Пэрриш А.Р., Ван Л. (март 2009 г.). «Расширение генетического кода для биологических исследований» . Химия и биология . 16 (3): 323–336. doi : 10.1016/j.chembiol.2009.03.001 . ПМК 2696486 . ПМИД 19318213 .
- ^ Саймон М. (2005). Новые вычисления: акцент на биоинформатике . Нью-Йорк: AIP Press/Springer Science+Business Media. стр. 105–106 . ISBN 978-0-387-22046-8 .
- ^ Бленис Дж., Реш, доктор медицинских наук (декабрь 1993 г.). «Субклеточная локализация, определяемая ацилированием и фосфорилированием белков». Современное мнение в области клеточной биологии . 5 (6): 984–989. дои : 10.1016/0955-0674(93)90081-Z . ПМИД 8129952 .
- ^ Вермеер С. (март 1990 г.). «Гамма-карбоксиглутаматсодержащие белки и витамин К-зависимая карбоксилаза» . Биохимический журнал . 266 (3): 625–636. дои : 10.1042/bj2660625 . ПМЦ 1131186 . ПМИД 2183788 .
- ^ Бхаттачарджи А., Бансал М. (март 2005 г.). «Структура коллагена: тройная спираль Мадраса и текущий сценарий». ИУБМБ Жизнь . 57 (3): 161–172. дои : 10.1080/15216540500090710 . ПМИД 16036578 . S2CID 7211864 .
- ^ Парк М.Х. (февраль 2006 г.). «Посттрансляционный синтез аминокислоты, полученной из полиамина, гипузина, в эукариотическом факторе инициации трансляции 5А (eIF5A)» . Журнал биохимии . 139 (2): 161–169. дои : 10.1093/jb/mvj034 . ПМК 2494880 . ПМИД 16452303 .
- ^ Курис Э., Николис И., Муанард С., Осовска С., Зеррук Н., Бенасет С., Кинобер Л. (ноябрь 2005 г.). «Почти все о цитруллине у млекопитающих». Аминокислоты . 29 (3): 177–205. дои : 10.1007/s00726-005-0235-4 . ПМИД 16082501 . S2CID 23877884 .
- ^ Коксон К.М., Чакауя Э., Оттенхоф Х.Х., Уитни Х.М., Бланделл Т.Л., Абелл С., Смит А.Г. (август 2005 г.). «Биосинтез пантотената у высших растений». Труды Биохимического общества . 33 (Часть 4): 743–746. дои : 10.1042/BST0330743 . ПМИД 16042590 .
- ^ Саками В., Харрингтон Х (1963). «Обмен аминокислот». Ежегодный обзор биохимии . 32 (1): 355–398. дои : 10.1146/annurev.bi.32.070163.002035 . ПМИД 14144484 .
- ^ Броснан Дж. Т. (апрель 2000 г.). «Глутамат на стыке обмена аминокислот и углеводов» . Журнал питания . 130 (дополнение 4S): 988S–990S. дои : 10.1093/jn/130.4.988S . ПМИД 10736367 .
- ^ Янг В.Р., Аджами А.М. (сентябрь 2001 г.). «Глютамин: император или его одежда?» . Журнал питания . 131 (9 доп.): 2449S–2459S, 2486S–2487S. дои : 10.1093/jn/131.9.2449S . ПМИД 11533293 .
- ^ Молодой VR (август 1994 г.). «Потребности взрослых в аминокислотах: необходимость серьезного пересмотра текущих рекомендаций» . Журнал питания . 124 (8 дополнений): 1517S–1523S. дои : 10.1093/jn/124.suppl_8.1517S . ПМИД 8064412 .
- ^ Фюрст П., Штеле П. (июнь 2004 г.). «Какие основные элементы необходимы для определения потребности человека в аминокислотах?» . Журнал питания . 134 (6 Доп.): 1558S–1565S. дои : 10.1093/jn/134.6.1558S . ПМИД 15173430 .
- ^ Ридс П.Дж. (июль 2000 г.). «Незаменимые и незаменимые аминокислоты для человека» . Журнал питания . 130 (7): 1835–1840 гг. дои : 10.1093/jn/130.7.1835S . ПМИД 10867060 .
- ^ Имура К., Окада А. (январь 1998 г.). «Обмен аминокислот у пациентов детского возраста». Питание . 14 (1): 143–148. дои : 10.1016/S0899-9007(97)00230-X . ПМИД 9437700 .
- ^ Лоренцо Р., Камило М.Е. (2002). «Таурин: условно незаменимая аминокислота для человека? Обзор здоровья и болезней». Больничное питание . 17 (6): 262–270. ПМИД 12514918 .
- ^ Бродли К.Дж. (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакология и терапия . 125 (3): 363–375. doi : 10.1016/j.pharmthera.2009.11.005 . ПМИД 19948186 .
- ^ Линдеманн Л., Хонер MC (май 2005 г.). «Ренессанс следовых аминов, вдохновленный новым семейством GPCR». Тенденции в фармакологических науках . 26 (5): 274–281. дои : 10.1016/j.tips.2005.03.007 . ПМИД 15860375 .
- ^ Ван X, Ли Дж, Донг Дж, Юэ Дж (февраль 2014 г.). «Эндогенные субстраты CYP2D мозга». Европейский журнал фармакологии . 724 : 211–218. дои : 10.1016/j.ejphar.2013.12.025 . ПМИД 24374199 .
- ^ Хилин Дж. В. (1969). «Токсичные пептиды и аминокислоты в пищевых продуктах и кормах». Журнал сельскохозяйственной и пищевой химии . 17 (3): 492–496. дои : 10.1021/jf60163a003 .
- ^ Савельева К.В., Чжао С., Погорелов В.М., Раджан И., Ян Кью, Куллинан Э., Ланторн Т.Х. (2008). Бартоломуччи А. (ред.). «Генетическое нарушение обоих генов триптофангидроксилазы резко снижает уровень серотонина и влияет на поведение моделей, чувствительных к антидепрессантам» . ПЛОС ОДИН . 3 (10): е3301. Бибкод : 2008PLoSO...3.3301S . дои : 10.1371/journal.pone.0003301 . ПМК 2565062 . ПМИД 18923670 .
- ^ Шемин Д., Риттенберг Д. (декабрь 1946 г.). «Биологическое использование глицина для синтеза протопорфирина гемоглобина» . Журнал биологической химии . 166 (2): 621–625. дои : 10.1016/S0021-9258(17)35200-6 . ПМИД 20276176 . Архивировано из оригинала 7 мая 2022 года . Проверено 3 ноября 2008 г.
- ^ Техеро Дж., Бисвас А., Ван ЗК, Пейдж RC, Хак М.М., Хеманн С., Цвайер Дж.Л., Мисра С., Штуер DJ (ноябрь 2008 г.). «Стабилизация и характеристика промежуточного продукта гем-оксиреакции в индуцибельной синтазе оксида азота» . Журнал биологической химии . 283 (48): 33498–33507. дои : 10.1074/jbc.M806122200 . ПМК 2586280 . ПМИД 18815130 .
- ^ Родригес-Касо С., Монтаньес Р., Касканте М., Санчес-Хименес Ф., Медина М.А. (август 2006 г.). «Математическое моделирование обмена полиаминов у млекопитающих» . Журнал биологической химии . 281 (31): 21799–21812. дои : 10.1074/jbc.M602756200 . ПМИД 16709566 .
- ^ Перейти обратно: а б Страйер Л., Берг Дж.М., Тимочко Дж.Л. (2002). Биохимия (5-е изд.). Нью-Йорк: WH Freeman. стр. 693–698 . ISBN 978-0-7167-4684-3 .
- ^ Петров О.А. (декабрь 2002 г.). «ГАМК и глутамат в мозге человека». Нейробиолог . 8 (6): 562–573. дои : 10.1177/1073858402238515 . ПМИД 12467378 . S2CID 84891972 .
- ^ Тернер Э.Х., Лофтис Дж.М., Блэквелл А.Д. (март 2006 г.). «Серотонин по меню: добавка предшественника серотонина 5-гидрокситриптофана» . Фармакология и терапия . 109 (3): 325–338. doi : 10.1016/j.pharmthera.2005.06.004 . ПМИД 16023217 . S2CID 2563606 . Архивировано из оригинала 13 апреля 2020 года . Проверено 12 июня 2019 г.
- ^ Костшева Р.М., Новак П., Костшева Дж.П., Костшева Р.А., Брус Р. (март 2005 г.). «Особенности лечения болезни Паркинсона L-ДОФА». Аминокислоты . 28 (2): 157–164. дои : 10.1007/s00726-005-0162-4 . ПМИД 15750845 . S2CID 33603501 .
- ^ Хеби О., Перссон Л., Рентала М. (август 2007 г.). «Нацеливание на ферменты биосинтеза полиаминов: многообещающий подход к терапии африканской сонной болезни, болезни Шагаса и лейшманиоза». Аминокислоты . 33 (2): 359–366. дои : 10.1007/s00726-007-0537-9 . ПМИД 17610127 . S2CID 26273053 .
- ^ Розенталь Г.А. (2001). «L-Канаванин: инсектицидный аллелохимический препарат высших растений». Аминокислоты . 21 (3): 319–330. дои : 10.1007/s007260170017 . ПМИД 11764412 . S2CID 3144019 .
- ^ Хаммонд, Эндрю К. (1 мая 1995 г.). «Лейценовый токсикоз и борьба с ним у жвачных животных» . Журнал зоотехники . 73 (5): 1487–1492. дои : 10.2527/1995.7351487x . ПМИД 7665380 . Архивировано из оригинала 7 мая 2022 года . Проверено 7 мая 2022 г.
- ^ Перейти обратно: а б Лейхтенбергер В., Хутмахер К., Драуз К. (ноябрь 2005 г.). «Биотехнологическое производство аминокислот и их производных: современное состояние и перспективы». Прикладная микробиология и биотехнология . 69 (1): 1–8. дои : 10.1007/s00253-005-0155-y . ПМИД 16195792 . S2CID 24161808 .
- ^ Эшмид HD (1993). Роль хелатов аминокислот в питании животных . Вествуд: Публикации Нойеса.
- ^ Гараттини С. (апрель 2000 г.). «Глутаминовая кислота, двадцать лет спустя» . Журнал питания . 130 (дополнение 4S): 901S–909S. дои : 10.1093/jn/130.4.901S . ПМИД 10736350 .
- ^ Стегинк Л.Д. (июль 1987 г.). «История аспартама: модель клинических испытаний пищевой добавки». Американский журнал клинического питания . 46 (1 приложение): 204–215. дои : 10.1093/ajcn/46.1.204 . ПМИД 3300262 .
- ^ Перейти обратно: а б Драуз К., Грейсон И., Климанн А., Криммер Х.П., Лейхтенбергер В., Векбекер С. (2007). «Аминокислоты». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a02_057.pub2 . ISBN 978-3527306732 .
- ^ Ханессян С. (1993). «Размышления о полном синтезе натуральных продуктов: искусство, ремесло, логика и подход Хирона» . Чистая и прикладная химия . 65 (6): 1189–1204. дои : 10.1351/pac199365061189 . S2CID 43992655 .
- ^ Блазер Х.У. (1992). «Хиральный пул как источник энантиоселективных катализаторов и вспомогательных веществ». Химические обзоры . 92 (5): 935–952. дои : 10.1021/cr00013a009 .
- ^ Эшмид HD (1986). Внекорневая подкормка растений хелатами аминокислот . Парк-Ридж: Публикации Нойеса.
- ^ Санда Ф., Эндо Т. (1999). «Синтез и функции полимеров на основе аминокислот» . Макромолекулярная химия и физика . 200 (12): 2651–2661. doi : 10.1002/(SICI)1521-3935(19991201)200:12<2651::AID-MACP2651>3.0.CO;2-P .
- ^ Гросс Р.А., Калра Б. (август 2002 г.). «Биоразлагаемые полимеры для окружающей среды» . Наука . 297 (5582): 803–807. Бибкод : 2002Sci...297..803G . дои : 10.1126/science.297.5582.803 . ПМИД 12161646 . Архивировано из оригинала 25 июля 2020 года . Проверено 12 июня 2019 г.
- ^ Лоу К.С., Уиллер А.П., Коскан Л.П. (1996). Коммерческая полиаспарагиновая кислота и ее использование . Достижения в серии «Химия». Том. 248. Вашингтон, округ Колумбия: Американское химическое общество .
- ^ Томбре С.М., Сарваде Б.Д. (2005). «Синтез и биоразлагаемость полиаспарагиновой кислоты: критический обзор». Журнал макромолекулярной науки, часть A. 42 (9): 1299–1315. дои : 10.1080/10601320500189604 . S2CID 94818855 .
- ^ Джонс Р.К., Бьюкенен Б.Б., Груиссем В. (2000). Биохимия и молекулярная биология растений . Роквилл, Мэриленд: Американское общество физиологов растений. стр. 371–372 . ISBN 978-0-943088-39-6 .
- ^ Броснан Дж. Т., Броснан М. Е. (июнь 2006 г.). «Серосодержащие аминокислоты: обзор» . Журнал питания . 136 (6 Доп.): 1636S–1640S. дои : 10.1093/jn/136.6.1636S . ПМИД 16702333 .
- ^ Кивирикко К.И., Пихлажаниеми Т (1998). «Коллагенгидроксилазы и субъединица протеиндисульфидизомеразы пролил-4-гидроксилаз». Достижения энзимологии и смежных областей молекулярной биологии . Достижения в энзимологии и смежных областях молекулярной биологии. Том. 72. С. 325–398. дои : 10.1002/9780470123188.ch9 . ISBN 9780470123188 . ПМИД 9559057 .
- ^ Уитмор Л., Уоллес Б.А. (май 2004 г.). «Анализ состава последовательностей пептайбола: значение для синтеза in vivo и формирования каналов». Европейский биофизический журнал . 33 (3): 233–237. дои : 10.1007/s00249-003-0348-1 . ПМИД 14534753 . S2CID 24638475 .
- ^ Александр Л., Грирсон Д. (октябрь 2002 г.). «Биосинтез и действие этилена в томатах: модель климактерического созревания плодов» . Журнал экспериментальной ботаники . 53 (377): 2039–2055. дои : 10.1093/jxb/erf072 . ПМИД 12324528 .
- ^ Перейти обратно: а б Китадай, Норио; Маруяма, Сигенори (2018). «Происхождение строительных блоков жизни: обзор » Геонаучные границы . 9 (4): 1117–1153. Бибкод : 2018GeoFr... 9.1117K дои : 10.1016/j.gsf.2017.07.007 . S2CID 102659869 .
- ^ Данчин, Антуан (12 июня 2017 г.). «От химического метаболизма к жизни: происхождение процесса генетического кодирования» . Журнал органической химии Байльштейна . 13 (1): 1119–1135. дои : 10.3762/bjoc.13.111 . ISSN 1860-5397 . ПМК 5480338 . ПМИД 28684991 .
- ^ Перейти обратно: а б Френкель-Пинтер, Моран; Саманта, Моусуми; Ашкенаси, Гонен; Леман, Люк Дж. (10 июня 2020 г.). «Пребиотические пептиды: молекулярные центры происхождения жизни» . Химические обзоры . 120 (11): 4707–4765. doi : 10.1021/acs.chemrev.9b00664 . ISSN 0009-2665 . ПМИД 32101414 . S2CID 211536416 .
- ^ Милнер-Уайт, Э. Джеймс (6 декабря 2019 г.). «Белковые трехмерные структуры в зарождении жизни» . Фокус на интерфейсе . 9 (6): 20190057. doi : 10.1098/rsfs.2019.0057 . ПМК 6802138 . ПМИД 31641431 .
- ^ Чаттерджи, Санкар; Ядав, Сурья (июнь 2022 г.). «Коэволюция биомолекул и пребиотических информационных систем в происхождении жизни: модель визуализации для сборки первого гена» . Жизнь . 12 (6): 834. Бибкод : 2022Life...12..834C . дои : 10.3390/life12060834 . ISSN 2075-1729 . ПМЦ 9225589 . ПМИД 35743865 .
- ^ Киршнинг, Андреас (26 мая 2021 г.). «Пара кофермент/белок и молекулярная эволюция жизни» . Отчеты о натуральных продуктах . 38 (5): 993–1010. дои : 10.1039/D0NP00037J . ISSN 1460-4752 . ПМИД 33206101 . S2CID 227037164 .
- ^ Элмор Д.Т., Барретт Г.К. (1998). Аминокислоты и пептиды . Кембридж, Великобритания: Издательство Кембриджского университета. стр. 48–60 . ISBN 978-0-521-46827-5 .
- ^ Гаттеридж А., Торнтон Дж. М. (ноябрь 2005 г.). «Понимание каталитического инструментария природы». Тенденции биохимических наук . 30 (11): 622–629. дои : 10.1016/j.tibs.2005.09.006 . ПМИД 16214343 .
- ^ Ибба М., Сёлль Д. (май 2001 г.). «Ренессанс синтеза аминоацил-тРНК» . Отчеты ЭМБО . 2 (5): 382–387. doi : 10.1093/embo-reports/kve095 . ПМЦ 1083889 . ПМИД 11375928 .
- ^ Лендьел П., Сёлль Д. (июнь 1969 г.). «Механизм биосинтеза белка» . Бактериологические обзоры . 33 (2): 264–301. дои : 10.1128/ММБР.33.2.264-301.1969 . ПМК 378322 . ПМИД 4896351 .
- ^ Ву Дж., Фанг Ю.З., Ян С., Луптон-младший, Тернер Н.Д. (март 2004 г.). «Метаболизм глутатиона и его значение для здоровья» . Журнал питания . 134 (3): 489–492. дои : 10.1093/jn/134.3.489 . ПМИД 14988435 .
- ^ Мейстер А. (ноябрь 1988 г.). «Метаболизм глутатиона и его селективная модификация» . Журнал биологической химии . 263 (33): 17205–17208. дои : 10.1016/S0021-9258(19)77815-6 . ПМИД 3053703 .
- ^ Карпино Л.А. (1992). «1-Гидрокси-7-азабензотриазол. Эффективная добавка для связывания пептидов». Журнал Американского химического общества . 115 (10): 4397–4398. дои : 10.1021/ja00063a082 .
- ^ Мараско Д., Перретта Г., Сабателла М., Руво М. (октябрь 2008 г.). «Прошлые и будущие перспективы библиотек синтетических пептидов». Современная наука о белках и пептидах . 9 (5): 447–467. дои : 10.2174/138920308785915209 . ПМИД 18855697 .
- ^ Конара С., Ганьона К., Клирфилд А., Томпсон С., Хартл Дж., Эриксон С., Нельсон С. (2010). «Определение структуры и характеристика бисглицинатов меди и цинка методами рентгеновской кристаллографии и масс-спектрометрии». Журнал координационной химии . 63 (19): 3335–3347. дои : 10.1080/00958972.2010.514336 . S2CID 94822047 .
- ^ Стипанюк М.Х. (2006). Биохимические, физиологические и молекулярные аспекты питания человека (2-е изд.). Сондерс Эльзевир.
- ^ Дгайм Р.Д., Дхаван Р., Арндцен Б.А. (сентябрь 2001 г.). «Использование монооксида углерода и иминов в качестве синтонов, производных пептидов: простой катализируемый палладием синтез имидазолинов, полученных из α-аминокислот». Ангеванде Хеми . 40 (17): 3228–3230. doi : 10.1002/(SICI)1521-3773(19980703)37:12<1634::AID-ANIE1634>3.0.CO;2-C . ПМИД 29712039 .
- ^ Муньос-Уэрта Р.Ф., Гевара-Гонсалес Р.Г., Контрерас-Медина Л.М., Торрес-Пачеко И., Прадо-Оливарес Х., Окампо-Веласкес Р.В. (август 2013 г.). «Обзор методов определения азотного статуса растений: преимущества, недостатки и последние достижения» . Датчики . 13 (8). Базель, Швейцария: 10823–43. Бибкод : 2013Senso..1310823M . дои : 10.3390/s130810823 . ПМК 3812630 . ПМИД 23959242 .
- ^ Мартин П.Д., Мэлли Д.Ф., Мэннинг Дж., Фуллер Л. (2002). «Определение органического углерода и азота в почве на полевом уровне методом ближней инфракрасной спектроскопии». Канадский журнал почвоведения . 82 (4): 413–422. дои : 10.4141/S01-054 .
Дальнейшее чтение
[ редактировать ]- Тимочко Ю.Л. (2012). «Белковый состав и структура» . Биохимия . Нью-Йорк: WH Freeman и компания. стр. 28–31. ISBN 9781429229364 .
- Дулиттл РФ (1989). «Избыточность в белковых последовательностях». В Фасман Г.Д. (ред.). Предсказания структуры белка и принципы конформации белка . Нью-Йорк: Пленум Пресс . стр. 599–623. ISBN 978-0-306-43131-9 . LCCN 89008555 .
- Нельсон Д.Л., Кокс М.М. (2000). Ленингерские принципы биохимии (3-е изд.). Стоит издательства . ISBN 978-1-57259-153-0 . LCCN 99049137 .
- Мейеренрих У (2008). Аминокислоты и асимметрия жизни (PDF) . Берлин: Springer Verlag . ISBN 978-3-540-76885-2 . LCCN 2008930865 . Архивировано из оригинала (PDF) 12 января 2012 года.
Внешние ссылки
[ редактировать ] СМИ, связанные с аминокислотами, на Викискладе?
СМИ, связанные с аминокислотами, на Викискладе?