Аминокислотные комплексы переходных металлов
Аминокислотные комплексы переходных металлов представляют собой большое семейство координационных комплексов, содержащих сопряженные основания аминокислот , 2-аминокарбоксилаты. Аминокислоты широко распространены в природе, и все они действуют как лиганды по отношению к переходным металлам. [1] В данную статью не включены комплексы амидов (в том числе пептидных) и сложноэфирных производных аминокислот. Также исключены полиаминокислоты, включая хелатирующие агенты ЭДТА и NTA .
Режимы привязки
[ редактировать ]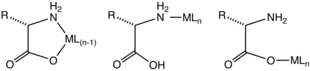
Чаще всего аминокислоты координируются с ионами металлов как бидентатные лиганды N,O, используя аминогруппу и карбоксилат. Это лиганды «LX». Образуется пятичленное хелатное кольцо. Хелатное кольцо лишь слегка гофрировано на sp. 3 -гибридизированные углеродный и азотистый центры.
Для аминокислот, содержащих координирующие заместители, образующиеся комплексы более разнообразны по структуре, поскольку эти заместители могут координироваться. Гистидин , аспарагиновая кислота , метионин и цистеин иногда образуют тридентатные комплексы N,N,O, N,O,O, S,N,O и S,N,O соответственно.
С помощью кинетически инертных ионов металлов охарактеризованы комплексы, содержащие монодентатные аминокислоты. Эти комплексы существуют либо в виде изомеров N-, либо O-связи. Можно предположить, что такие монодентатные комплексы кратковременно существуют для многих кинетически лабильных ионов металлов (например, Zn 2+ ).
Стехиометрия и структура
[ редактировать ]Гомолептические комплексы (только аминокислотные лиганды)
[ редактировать ]Смешивание простых солей металлов с растворами аминокислот при нейтральном или повышенном pH часто приводит к образованию бис- или трис-комплексов. Для ионов металлов, которые предпочитают октаэдрическую координацию, эти комплексы часто принимают стехиометрию M(aa) 3 (aa = аминокарбоксилат, такой как глицинат, H 2 NCH 2 CO 2 − ).
Комплексы стехиометрии 3:1 имеют формулу [M(O 2 CC(R)HNH 2 ) 3 ] С . Такие комплексы принимают октаэдрическую координационную геометрию . Эти комплексы могут существовать в виде фациальных и меридиональных изомеров, оба из которых являются хиральными. Стереохимические возможности возрастают, когда аминокислотные лиганды не являются гомохиральными . как фиолетовый меридиональный, так и красно-розовый лицевой изомеры трис(глицинато)кобальта(III). Охарактеризованы [6] С L- аланином , L- лейцином и другими аминокислотами получается четыре стереоизомера. [7] С цистеином аминокислота связывается через N и тиолат. [8]
Комплексы со стехиометрией 2:1 иллюстрирует глицинат меди(II) [Cu(O 2 CC(R)HNH 2 ) 2 ], который существует как в безводной, так и в пентакоординатной геометрии. Когда металл имеет плоскую квадратную форму, эти комплексы могут существовать в виде цис- и транс-изомеров. Стереохимические возможности возрастают, когда аминокислотные лиганды не являются гомохиральными . Известны также гомолептические комплексы, в которых аминокарбоксилат представляет собой тридентатные аминокислоты. Одним из таких комплексов является Ni(κ 3 -гистидинат) 2 .
Пептиды и белки
[ редактировать ]Помимо аминокислот, пептиды и белки связывают кофакторы металлов посредством своих боковых цепей. По большей части α-амино- и карбоксилатные группы недоступны для связывания, поскольку в противном случае они участвуют в пептидной связи. Ситуация сложнее для N-концевых и О-концевых остатков, где α-амино- и карбоксилатные группы недоступны соответственно. Особенно важны в этом отношении гистидин ( имидазол ), цистеин ( тиолат ), метионин ( тиоэфир ).
Гетеролептические комплексы (аминокислоты плюс другие лиганды)
[ редактировать ]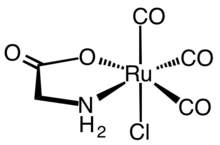
Для аминокислот характерны смешанно-лигандные комплексы. Хорошо известные примеры включают [Co(en) 2 (глицинат)] 2+ , где en ( этилендиамин ) — лиганд-наблюдатель. В области металлоорганических комплексов один из примеров Cp*Ir(κ 3 -метионин).
Синтез и реакции
[ редактировать ]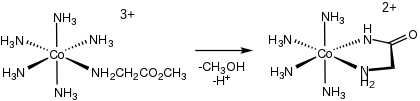
Хорошо изученным комплексом является трис(глицинато)кобальт(III) . Его получают реакцией глицина с трис(карбонато)кобальтом(III) натрия . [6] Подобные синтетические методы применимы и для получения трис(хелатов) других аминокислот . [10]
Обычно аминокислотные комплексы получают реакциями замещения лигандов аквакомплексов металлов и сопряженных оснований аминокислот: [11]
- [PtCl 4 ] 2- + 2 Н 2 NCH(R)CO 2 − → [Pt(H 2 NCH(R)CO 2 ) 2 ] + 4 Cl −
Что касается бионеорганической химии , аминокислотные комплексы могут образовываться путем гидролиза эфиров и амидов аминокислот (en = этилендиамин ):
- [(en) 2 CoOH(м 1Н -H 2 NCH(R)CO 2 Et)] 2+ → [(en) 2 CoOH(k 2НО -H 2 NCH(R)CO 2 )] 2+ + этанол
Поскольку их 5-членное хелатное кольцо MNC 2 O достаточно стабильно, аминокислотные комплексы представляют собой защитные группы для аминокислот, обеспечивая разнообразные реакции боковых цепей. [12]
Аминокарбоксилатные комплексы
[ редактировать ]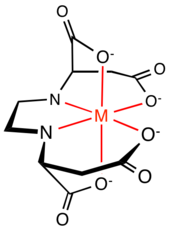
Органические соединения, содержащие две и более 2- и 3-аминокарбоксилатные группы, широко используются в природе, промышленности и научных исследованиях. Известные примеры включают ЭДТА и NTA .
Ссылки
[ редактировать ]- ^ Северин, К.; Бергс, Р.; Бек, В. (1998). «Биоорганометаллическая химия-комплексы переходных металлов с α-аминокислотами и пептидами». Энджью. хим. Межд. Эд . 37 (12): 1635–1654. doi : 10.1002/(SICI)1521-3773(19980703)37:12<1634::AID-ANIE1634>3.0.CO;2-C . ПМИД 29711516 .
- ^ К.-К. Гу; Ю.-Х. Солнце; Р. Чжан; Н.-В. Чжан; Х.-В. Че (2007). «Трис(глицинато-κ 2 N,O)кобальт(III)». Acta Crystallogr . E63 (3): m740–m742. doi : 10.1107/S1600536807005636 .
- ^ А. Аббаси, Б. Сафаркупайе, Н. Хосрави, А. Шайестех (217). «Структурные исследования бис(гистидинато)никеля(II): комбинированные экспериментальные и вычислительные исследования» . Comptes Rendus Chimie . 20 (5): 467. doi : 10.1016/j.crci.2016.12.006 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ М. Шарвиц, Т. ван Алмсик, В. С. Шелдрик (2007). "(S-Метилцистеинато)(η 5 -пентаметилциклопентадиенил)иридий(III) трифторметансульфонат полугидрат». Acta Crystallogr . E63 : m230-m232. doi : 10.1107/S1600536806053360 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Байдья, Н.; Ндреу, Д.; Олмстед, ММ; Масчарак, ПК (1991). «Синтез, структура и свойства сесквигидрата бис(L-цистеинато-N,S)никелата(II) калия». Неорганическая химия . 30 (10): 2448–2451. дои : 10.1021/ic00010a043 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Перейти обратно: а б Кауфман, Джордж Б.; Карбасси, Мохаммед; Кюно, Эйшин (1989). Трис(глицинато)кобальт(III) . Неорганические синтезы. Том. 25. стр. 135–139. дои : 10.1002/9780470132562.ch32 . ISBN 978-0-470-13256-2 .
- ^ Деннинг, Р.Г.; Пайпер, Т.С. (1966). «Оптическая активность, абсолютная конфигурация и реакции перегруппировки трис-аминокислотных комплексов кобальта (III) с L-аланином, L-лейцином и L-пролином». Неорганическая химия . 5 (6): 1056–1065. дои : 10.1021/ic50040a022 .
- ^ Арнольд, Алан П.; Джексон, В. Грегори (1990). «Стереоспецифичность в синтезе ионов трис(( R )-цистеинато- N,S )- и трис(( R )-цистеинсульфинато-N,S)кобальтата(III)». Неорганическая химия . 29 (18): 3618–3620. дои : 10.1021/ic00343a061 .
- ^ Моттерлини Р., Оттербейн Л.Е. (сентябрь 2010 г.). «Терапевтический потенциал угарного газа». обзорная статья. Обзоры природы. Открытие наркотиков . 9 (9): 728–43. дои : 10.1038/nrd3228 . ПМИД 20811383 . S2CID 205477130 .
- ^ Деннинг, Р.Г.; Пайпер, Т.С. (1966). «Оптическая активность, абсолютная конфигурация и реакции перегруппировки трис-аминокислотных комплексов кобальта (III) с L-аланином, L-лейцином и L-пролином». Неорганическая химия . 5 (6): 1056–1065. дои : 10.1021/ic50040a022 .
- ^ Яковидис, А.; Хаджилиадис, Н. (1994). «Комплексные соединения платины(II) и (IV) с аминокислотами, пептидами и их производными». Обзоры координационной химии . 135–136: 17–63. дои : 10.1016/0010-8545(94)80064-2 .
- ^ Вольфганг Бек (2009). «Ионы металлов и комплексы металлов как защитные группы аминокислот и пептидов – реакции на координированных аминокислотах» . З. Натурфорш . 64б : 1221–1245. дои : 10.1515/znb-2009-11-1202 . S2CID 96555456 .

![Со(глицинат)3[2]](http://upload.wikimedia.org/wikipedia/commons/thumb/e/ed/SEZMEQ.png/180px-SEZMEQ.png)
![[Ni(κ3-гистидинат)2]2-[3]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/9b/RAGZAD.png/143px-RAGZAD.png)
![[Cp*Ir(κ3-метионин)]+[4]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/41/GEVLID.png/168px-GEVLID.png)
![[Ni(цистеинат)2]2-[5]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/47/KIWZOF.png/180px-KIWZOF.png)