Молекулы, выделяющие угарный газ
Молекулы, выделяющие угарный газ ( CORM ), представляют собой химические соединения, предназначенные для выделения контролируемого количества угарного газа (CO). CORM разрабатываются как потенциальные терапевтические агенты для локальной доставки CO к клеткам и тканям, тем самым преодолевая ограничения протоколов ингаляции CO.
CO наиболее известен своей токсичностью при отравлении угарным газом в высоких дозах. Однако CO является газотрансмиттером , и дополнительные низкие дозы CO связаны с терапевтическим эффектом. Доклинические исследования были сосредоточены на противовоспалительной активности CO, имеющей важное применение при сердечно-сосудистых заболеваниях, онкологии, трансплантационной хирургии и нейропротекции. [1]
История
[ редактировать ]Терапевтический интерес к CO восходит к изучению искусственных эфиров ( карбонатов ) в 1790-х годах Томасом Беддосом , Джеймсом Уоттом , Джеймсом Линдом , Хамфри Дэви , Тибериусом Кавалло и многими другими. [2]
Тетракарбонил никеля был первым карбонильным комплексом, использованным для локальной доставки CO, и первой молекулой для доставки CO, которая, как было предложено в 1891 году, имела терапевтический потенциал. [2] Аббревиатура CORM была придумана в 2002 году и стала первой современной биомедицинской и фармацевтической инициативой. [3] Ферментативная реакция гемоксигеназы вдохновила на разработку синтетических CORM.
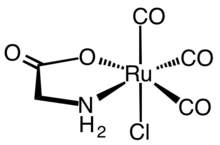
Первые синтетические CORM обычно представляли собой карбонильные комплексы металлов . Типичным CORM, который был подробно охарактеризован как с биохимической, так и с фармакологической точки зрения, является комплекс рутения(II) Ru( глицинат )Cl(CO) 3 , широко известный как CORM-3. Терапевтические данные, относящиеся к металлическим CORM, пересматриваются, чтобы выяснить, действительно ли наблюдаемые эффекты обусловлены CO или же реакционная способность металлов опосредует физиологические эффекты посредством истощения тиолов, облегчения восстановления, блокировки ионных каналов или окислительно-восстановительного катализа. [4] [5] Несмотря на вопросы, касающиеся переходных металлов, чистый газ CO и альтернативные неметаллические пролекарства CO и устройства для доставки лекарств подтвердили терапевтический потенциал CO.
Классификации CORM
[ редактировать ]CORM переходных металлов
[ редактировать ]Большинство терапевтически значимых CORM представляют собой комплексы переходных металлов, в основном на основе железа , молибдена , рутения , марганца , кобальта , рения и других. [6]
ФотоСОРМы
[ редактировать ]Высвобождение CO из агентов-носителей можно вызвать фотохимически. Эти носители называются фотоСОРМ и включают в себя как металлокомплексы, так и безметалловые ( органические ) соединения различных структурных мотивов, которые можно рассматривать как особый тип фотолабильной защитной группы . [7]
И-CORM
[ редактировать ]CORM, запускаемые ферментами (ET-CORM), были разработаны для улучшения селективной местной доставки CO. Некоторые пролекарства ET-CORM активируются ферментами эстеразы для локального высвобождения CO. [8]
пролекарства CO
[ редактировать ]Органические CORM разрабатываются для преодоления реакционной способности и некоторых ограничений токсичности неорганических CORM.
Метиленхлорид был первым органическим CORM, вводимым перорально, на основании предыдущих сообщений об образовании карбоксигемоглобина в результате метаболизма. Второй органический CORM, CORM-A1 (боранокарбонат натрия), был разработан на основе отчета 1960-х годов о выделении CO из боранокарбоната калия. [2]
В 2003 году в качестве источника терапевтического CO были предложены циклические оксоуглероды, включая дельтовую кислоту , квадратную кислоту , кроконовую кислоту , родизоновую кислоту и их соли. [9]
В последние годы наблюдается рост интереса к органическим пролекарствам CO из-за необходимости учитывать проблемы разработки лекарств при разработке терапевтических средств на основе CO. [10] Эти пролекарства CO имеют настраиваемую скорость высвобождения, триггерное высвобождение и способность высвобождать более одной полезной нагрузки из одного пролекарства. [11]
Ферментные гибриды
[ редактировать ]На основе синергизма системы гемоксигеназы и доставки CO возник новый класс молекулярных гибридных CORM (HYCO), состоящий из соединенных индукторов HO-1 и видов CORM. Один из таких HYCO включает фрагмент диметилфумарата , который активирует NRF2 , тем самым индуцируя HO-1, тогда как фрагмент CORM также высвобождает CO. [12]
Материалы, выделяющие угарный газ
[ редактировать ]Материалы, выделяющие оксид углерода (CORMA), по сути, представляют собой новые лекарственные формы и платформы для доставки лекарств, которые появились для преодоления фармацевтических ограничений большинства видов CORM. [13] Типичный CORMA, разработанный Хаббеллом, состоит из состава мицелл, полученных из триблок- сополимеров с CORM-структурой, высвобождение которой инициируется посредством добавления цистеина . Другие каркасы, выделяющие CO, включают полимеры , пептиды , кремнезема наночастицы , наноалмазы , магнитные наночастицы , нановолокон гель , металлодендримеры и конъюгаты CORM-белок (макромолекула). [14] [15]
и другие передовые устройства для доставки лекарств, такие как инкапсулированные CORM и технологии, основанные на экстракорпоральных мембранах . Были разработаны [5]
Инфузия карбоксигемоглобина
[ редактировать ]Карбоксигемоглобин можно вводить для доставки CO. Наиболее распространенные подходы основаны на использовании полиэтиленгликоля , ПЭГилированного бычьего карбоксигемоглобина и конъюгированного с малеимидом ПЭГ человеческого карбоксигемоглобина. [16]
Порфирины
[ редактировать ]Порфириновые структуры, такие как гем , гемин и металлические аналоги протопорфирина IX (PPIX) (такие как кобальт PPIX), были использованы для индукции гемоксигеназы и последующей биотрансформации с высвобождением CO, неорганического иона и биливердина / билирубина . [17] Некоторые аналоги PPIX, такие как олово PPIX, олово-мезопорфирин и цинк PPIX, являются ингибиторами гемоксигеназы .
Эндогенный CO
[ редактировать ]HMOX считается основным источником эндогенного производства CO, хотя в последние годы были выявлены и другие второстепенные его участники. [18] CO образуется в организме человека со скоростью 16,4 мкмоль/час, ~86% происходит из гема посредством гемоксигеназы и ~14% из негемовых источников, включая фотоокисление, перекисное окисление липидов и ксенобиотики. [19] Средний уровень карбоксигемоглобина (CO-Hb) у некурящего составляет менее 3% CO-Hb (тогда как у курильщика уровень CO-Hb может достигать около 10%), [20] хотя географическое положение, род занятий, здоровье и поведение являются влияющими переменными.
Гемоксигеназа
[ редактировать ]В конце 1960-х годов Руди Шмид охарактеризовал фермент, который облегчает реакцию катаболизма гема, тем самым идентифицировав фермент гемоксигеназу (HMOX).
HMOX представляет собой гемсодержащий член семейства белков теплового шока (HSP), идентифицированный как HSP32 . На сегодняшний день идентифицированы три изоформы HMOX, включая вызванную стрессом HMOX-1 и конститутивную HMOX-2. HMOX-1 считается белком спасения клеток, который индуцируется в ответ на окислительный стресс и многочисленные болезненные состояния. Кроме того, HMOX-1 индуцируется бесчисленным количеством молекул, включая статины , гемин и натуральные продукты . [21] [22]
HMOX катализирует распад гема до биливердина / билирубина , ионов двухвалентного железа и CO. Несмотря на то, что HO присутствует во всем организме, он оказывает значительную активность в селезенке при расщеплении гемоглобина во время рециркуляции эритроцитов (0,8% пула эритроцитов в день), что приходится ~ 80% эндогенного производства CO, производного гема. Большая часть оставшихся 20% продукции CO, производной гема, связана с печеночным катаболизмом гемопротеинов ( миоглобина , цитохромов , каталазы , пероксидазы , растворимой гуанилатциклазы , синтазы оксида азота ) и неэффективного эритропоэза в костном мозге . [23]
Скорость ферментации и каталитическую активность HMOX можно повысить с помощью множества пищевых веществ и ксенобиотиков для увеличения производства CO.
Незначительные источники CO
[ редактировать ]Об образовании CO в результате липидов перекисного окисления впервые сообщалось в конце 1960-х годов, и он считается второстепенным фактором, вносящим вклад в эндогенное производство CO. [24] [25] Другие способствующие источники включают: микробиом, редуктазу цитохрома P450 , человеческую ациредуктондиоксигеназу , тирозиназу , перекисное окисление липидов , альфа-кетокислоты и другие окислительные и окислительно-восстановительные механизмы. [18]
CO фармакология
[ редактировать ]Оксид углерода является одной из трех газообразных сигнальных молекул наряду с оксидом азота и сероводородом . Эти газы вместе называются газотрансмиттерами . CO является классическим примером гормезиса , при котором низкие дозы необходимы и полезны, тогда как отсутствие или чрезмерное воздействие CO может быть токсичным.
Сигнализация
[ редактировать ]Первые доказательства того, что CO является сигнальной молекулой, появились после наблюдения за тем, как CO стимулирует растворимую гуанилатциклазу и последующую выработку циклического гуанозинмонофосфата (цГМФ), который действует как сосудорасширяющее средство в сосудов гладкомышечных клетках . Противовоспалительное p38 ( действие CO объясняется активацией пути митоген-активируемой протеинкиназы MAPK). Хотя CO обычно взаимодействует с атомом двухвалентного железа гема в гемопротеине , [26] было продемонстрировано, что CO активирует кальций-зависимые калиевые каналы путем образования водородных связей с поверхностными остатками гистидина. [18] [27]
CO может оказывать ингибирующее действие на многочисленные белки, включая цитохром P450 и цитохром с-оксидазу . [28]
Фармакокинетика
[ редактировать ]CO имеет примерно в 210 раз большее сродство к гемоглобину , чем кислород . Равновесная константа диссоциации реакции Hb-CO ⇌ Hb + CO сильно благоприятствует комплексу CO, поэтому высвобождение CO для легочной экскреции обычно занимает некоторое время.
Основываясь на этом сродстве связывания, кровь, по сути, является необратимым поглотителем CO и представляет собой терапевтическую проблему для доставки O2 к клеткам и тканям.
CO считается нереактивным в организме и в основном выводится через легкие . [29]
Ссылки
[ редактировать ]- ^ Моттерлини Р., Оттербейн Л.Е. (сентябрь 2010 г.). «Терапевтический потенциал угарного газа». обзорная статья. Обзоры природы. Открытие наркотиков . 9 (9): 728–743. дои : 10.1038/nrd3228 . ПМИД 20811383 . S2CID 205477130 .
- ^ Перейти обратно: а б с Хоппер КП, Замбрана ПН, Гебель У, Уолборн Дж (июнь 2021 г.). «Краткая история угарного газа и его терапевтического происхождения». Оксид азота . 111–112: 45–63. дои : 10.1016/j.niox.2021.04.001 . ПМИД 33838343 . S2CID 233205099 .
- ^ Моттерлини Р., Кларк Дж. Э., Форести Р., Саратчандра П., Манн Б. Е., Грин С. Дж. (февраль 2002 г.). «Молекулы, высвобождающие угарный газ: характеристика биохимической и сосудистой активности» . Исследование кровообращения . 90 (2): Е17–Е24. дои : 10.1161/hh0202.104530 . ПМИД 11834719 . S2CID 12515186 .
- ^ Саутэм Х.М., Смит Т.В., Лайон Р.Л., Ляо С., Тревитт С.Р., Миддлмисс Л.А. и др. (сентябрь 2018 г.). «В основе мощных антимикробных и цитотоксических свойств CO-высвобождающей молекулы-3 лежит тиол-реактивный ион Ru(II), а не высвобождение CO» . Редокс-биология . 18 : 114–123. дои : 10.1016/j.redox.2018.06.008 . ПМК 6067063 . ПМИД 30007887 .
- ^ Перейти обратно: а б Ян X, Лу В, Ван М, Тан С, Ван Б (октябрь 2021 г.). « «CO в таблетке»: на пути к пероральной доставке угарного газа в терапевтических целях» . Журнал контролируемого выпуска . 338 : 593–609. дои : 10.1016/j.jconrel.2021.08.059 . ПМЦ 8526413 . ПМИД 34481027 .
- ^ Шацшнейдер У (март 2015 г.). «Новые свинцовые структуры и механизмы активации молекул, высвобождающих CO (CORM)» . Британский журнал фармакологии . 172 (6): 1638–1650. дои : 10.1111/bph.12688 . ПМК 4369270 . ПМИД 24628281 .
- ^ Вайнштайн Р., Сланина Т., Канд Д., Клан П. (декабрь 2020 г.). «Активируемое в ближнем ИК-свете высвобождение: от малых молекул к наноматериалам» . Химические обзоры . 120 (24): 13135–13272. doi : 10.1021/acs.chemrev.0c00663 . ПМЦ 7833475 . ПМИД 33125209 .
- ^ Стамеллу Е., Сторц Д., Ботов С., Нтасис Е., Ведель Дж., Соллаццо С. и др. (2014). «Различная конструкция молекул, высвобождающих CO, запускаемых ферментами (ET-CORM), обнаруживает количественные различия в биологической активности с точки зрения токсичности и воспаления» . Редокс-биология . 2 : 739–748. дои : 10.1016/j.redox.2014.06.002 . ПМЦ 4085349 . ПМИД 25009775 .
- ^ Альберто Р., Моттерлини Р. (май 2007 г.). «Химия и биологическая активность молекул, выделяющих CO (CORM) и комплексов переходных металлов». Далтон Транзакции (17): 1651–1660. дои : 10.1039/b701992k . ПМИД 17443255 .
- ^ Цзи Икс, Дамера К, Чжэн Ю, Ю Б, Оттербейн ЛЭ, Ван Б (февраль 2016 г.). «На пути к терапии на основе угарного газа: критические проблемы доставки и разработки лекарств» . Журнал фармацевтических наук . 105 (2): 406–416. дои : 10.1016/j.xphs.2015.10.018 . ПМЦ 4755352 . ПМИД 26869408 .
- ^ Цзи Икс, Ван Б (июнь 2018 г.). «Стратегии в отношении пролекарств органического монооксида углерода». Отчеты о химических исследованиях . 51 (6): 1377–1385. дои : 10.1021/acs.accounts.8b00019 . ПМИД 29762011 .
- ^ Пол О (январь 2021 г.). «Роль угарного газа, гемоксигеназы 1 и фактора транскрипции Nrf2 в модуляции хронической боли и их взаимодействии с опиоидами и каннабиноидами». Обзоры медицинских исследований . 41 (1): 136–155. дои : 10.1002/мед.21726 . ПМИД 32820550 . S2CID 221219782 .
- ^ Хайнеманн С.Х., Хоши Т., Вестерхаузен М., Шиллер А. (апрель 2014 г.). «Окись углерода - физиология, обнаружение и контролируемый выброс» . обзорная статья. Химические коммуникации . 50 (28): 3644–3660. дои : 10.1039/c3cc49196j . ПМК 4072318 . ПМИД 24556640 .
- ^ Нгуен Д., Бойер С. (октябрь 2015 г.). «Макромолекулярные и неорганические наноматериалы для доставки монооксида углерода: последние разработки и будущие тенденции». обзорная статья. ACS Биоматериалы, наука и инженерия . 1 (10): 895–913. doi : 10.1021/acsbimaterials.5b00230 . ПМИД 33429521 .
- ^ Каутц А.К., Кунц ПК, Джаниак С. (ноябрь 2016 г.). «Системы конъюгатов CO-высвобождающих молекул (CORM)» . обзорная статья. Транзакции Далтона . 45 (45): 18045–18063. дои : 10.1039/c6dt03515a . ПМИД 27808304 .
- ^ Хоппер К.П., Мейнель Л., Штайгер С., Оттербейн Л.Е. (июль 2018 г.). «Где клинический прорыв в терапии гем-оксигеназы-1 / угарного газа?». Текущий фармацевтический дизайн . 24 (20): 2264–2282. дои : 10.2174/1381612824666180723161811 . ПМИД 30039755 . S2CID 51712930 .
- ^ Мэн, доктор медицины (июль 1988 г.). «Гем-оксигеназа: функция, множественность, регуляторные механизмы и клиническое применение» . обзорная статья. Журнал ФАСЭБ . 2 (10): 2557–2568. дои : 10.1096/fasebj.2.10.3290025 . ПМИД 3290025 . S2CID 22652094 .
- ^ Перейти обратно: а б с Хоппер С.П., Де Ла Круз Л.К., Лайлс К.В., Уэрхэм Л.К., Гилберт Дж.А., Эйхенбаум З. и др. (декабрь 2020 г.). «Роль монооксида углерода в коммуникации микробиома кишечника и кишечника». Химические обзоры . 120 (24): 13273–13311. doi : 10.1021/acs.chemrev.0c00586 . ПМИД 33089988 . S2CID 224824871 .
- ^ Ван Р., изд. (2001). Окись углерода и функции сердечно-сосудистой системы . обзорная статья (первое изд.). ЦРК Пресс. п. 5. ISBN 978-1-4200-4101-9 .
- ^ Том С.Р. (2008). «Глава 15: Патофизиология и лечение угарного газа». В Neuman TS, Thom SR (ред.). Физиология и медицина гипербарической оксигенации . обзорная статья. стр. 321–347. дои : 10.1016/B978-1-4160-3406-3.50020-2 . ISBN 978-1-4160-3406-3 .
- ^ Корреа-Коста М., Оттербейн Л.Е. (2014). «Ешь, чтобы исцелиться: природные индукторы системы гем-оксигеназы-1». В Фолкертс Г., Гарссен Дж. (ред.). Фарма-Питание . обзорная статья. Достижения AAPS в серии фармацевтических наук. Том. 12. Спрингер, Чам. стр. 243–256. дои : 10.1007/978-3-319-06151-1_12 . ISBN 978-3-319-06150-4 .
- ^ Феррандис М.Л., Девеса I (2008). «Индукторы гемоксигеназы-1». обзорная статья. Текущий фармацевтический дизайн . 14 (5): 473–486. дои : 10.2174/138161208783597399 . ПМИД 18289074 .
- ^ Бреман Х.Дж., Вонг Р.Дж., Стивенсон Д.К. (30 октября 2001 г.). «Глава 15: Источники, поглотители и измерение окиси углерода». В Ван Р. (ред.). Окись углерода и сердечно-сосудистые функции . обзорная статья (2-е изд.). ЦРК Пресс. ISBN 978-0-8493-1041-6 .
- ^ Вольф Д.Г. (декабрь 1976 г.). «Образование окиси углерода при перекисном окислении микросомальных липидов». первичная статья. Связь с биохимическими и биофизическими исследованиями . 73 (4): 850–857. дои : 10.1016/0006-291X(76)90199-6 . ПМИД 15625852 .
- ^ Нишибаяси Х., Омма Т., Сато Р., Эстабрук Р.В., Окунуки К., Камен М.Д., Секузу И., ред. (1968). Строение и функции цитохромов . обзорная статья. Университетский парк Пресс. стр. 658–665.
- ^ Моттерлини Р., Форести Р. (март 2017 г.). «Биологическая передача сигналов угарным газом и молекулами, высвобождающими угарный газ» . Американский журнал физиологии. Клеточная физиология . 312 (3): C302–C313. doi : 10.1152/ajpcell.00360.2016 . ПМИД 28077358 . S2CID 21861993 .
- ^ Уилкинсон В.Дж., Кемп П.Дж. (июль 2011 г.). «Угарный газ: новый регулятор ионных каналов» . обзорная статья. Журнал физиологии . 589 (Часть 13): 3055–3062. дои : 10.1113/jphysicalol.2011.206706 . ПМК 3145923 . ПМИД 21521759 .
- ^ Коррейя М.А., Ортис де Монтеллано PR (2005). «Ингибирование ферментов цитохрома P450». Цитохром Р450 . обзорная статья. Бостон, Массачусетс: Спрингер. стр. 247–322. дои : 10.1007/0-387-27447-2_7 . ISBN 978-0-306-48324-0 .
- ^ Уилбур С., Уильямс М., Уильямс Р., Сциникариелло Ф., Клоцбах Дж.М., Даймонд Г.Л., Цитра М. (2012). «Влияние на здоровье» . Токсикологический профиль монооксида углерода . обзорная статья. Министерство здравоохранения и социальных служб США, Служба общественного здравоохранения, Агентство по регистрации токсичных веществ и заболеваний. ПМИД 23946966 .
Дальнейшее чтение
[ редактировать ]- Ким Х.Х., Чхве С. (август 2018 г.). «Терапевтические аспекты монооксида углерода при сердечно-сосудистых заболеваниях» . обзорная статья. Международный журнал молекулярных наук . 19 (8): 2381. doi : 10.3390/ijms19082381 . ПМК 6121498 . ПМИД 30104479 .
- Исмаилова А, Кутер Д., Боле Д.С., Батлер И.С. (2018). «Обзор потенциальных терапевтических применений CO-высвобождающих молекул» . обзорная статья. Биоинорганическая химия и ее приложения . 2018 : 8547364. doi : 10.1155/2018/8547364 . ПМК 6109489 . ПМИД 30158958 .
- Абейратна Н., Вашингтон К., Башур С., Ляо Ю. (октябрь 2017 г.). «Неметаллические молекулы, выделяющие угарный газ (CORM)». обзорная статья. Органическая и биомолекулярная химия . 15 (41): 8692–8699. дои : 10.1039/c7ob01674c . ПМИД 28948260 .
- Хоппер КП, Уолборн Дж (август 2019 г.). «Доставка окиси углерода с помощью галогенированных эфирных анестетиков». обзорная статья. Оксид азота . 89 : 93–95. дои : 10.1016/j.niox.2019.05.006 . ПМИД 31125687 . S2CID 164217698 .
- Уилсон Дж.Л., Джесси Х.Э., Пул Р.К., Дэвидж К.С. (май 2012 г.). «Антибактериальное действие угарного газа». обзорная статья. Современная фармацевтическая биотехнология . 13 (6): 760–768. дои : 10.2174/138920112800399329 . ПМИД 22201612 .
- Сланина Т., Шебей П. (июнь 2018 г.). «Фотокормы, активируемые видимым светом: рациональный дизайн органических молекул, выделяющих CO, поглощающих прозрачное для тканей окно» . обзорная статья. Фотохимические и фотобиологические науки . 17 (6): 692–710. дои : 10.1039/C8PP00096D . ПМИД 29796556 .