Декарбонилирование
В химии декарбонилирование — это тип органической реакции , которая включает потерю окиси углерода (CO). Часто это нежелательная реакция, поскольку она представляет собой деградацию . В химии карбонилов металлов декарбонилирование описывает процесс замещения CO , при котором лиганд заменяется другим лигандом.
Органическая химия
[ редактировать ]В отсутствие металлических катализаторов декарбонилирование (по сравнению с декарбоксилированием наблюдается редко ) в органической химии . Единственным исключением является декарбонилирование муравьиной кислоты :
- ЧАС СО ОН → СО + Н 2 О
Реакцию вызывает серная кислота , которая действует как катализатор и дегидратирующий агент. В ходе этой реакции муравьиная кислота иногда используется в качестве источника CO в лаборатории вместо баллонов с этим токсичным газом. [ 1 ] При сильном нагревании муравьиная кислота и некоторые ее производные могут подвергаться декарбонилированию даже без добавления катализатора. Например, диметилформамид ( (CH 3 ) 2 NC(O)H ) медленно разлагается с образованием диметиламина и монооксида углерода при нагревании до температуры кипения (154 °C). Некоторые производные муравьиной кислоты, например формилхлорид ( −COCl ), подвергаются спонтанному декарбонилированию при комнатной температуре (или ниже).
Реакции с участием оксалилхлорида (COCl) 2 (например, гидролиз , реакция с карбоновыми кислотами, окисление Сверна и т. д.) часто высвобождают как диоксид углерода, так и оксид углерода посредством процесса фрагментации.
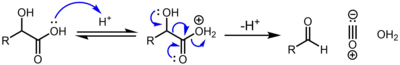
α-Оксикислоты , например ( молочная кислота и гликолевая кислота ), подвергаются декарбонилированию при обработке каталитической концентрированной серной кислотой по следующему механизму: [ 2 ]
Силакарбоновые кислоты ( R 3 SiCOOH ) подвергаются декарбонилированию при нагревании или обработке основанием и были исследованы как молекулы, генерирующие оксид углерода. [ 3 ] [ 4 ]
Декарбонилирование альдегидов
[ редактировать ]Обычное преобразование включает превращение альдегидов в алканы . [ 5 ]
- Р Ч Ч О → HR + СО
Декарбонилирование может катализироваться растворимыми металлокомплексами. [ 6 ] [ 5 ] Эти реакции протекают при посредничестве ацилгидридов металлов . Примером этого является реакция декарбонилирования Цуджи-Уилкинсона с использованием катализатора Уилкинсона . (Строго говоря, некаталитический вариант этой реакции приводит к образованию карбонильного комплекса родия, а не свободного монооксида углерода.) Эту реакцию обычно проводят в небольших масштабах в ходе полного синтеза сложного природного продукта, поскольку, хотя эта реакция очень эффективен при слегка повышенных температурах (например, 80 °C), когда используется стехиометрический родий, оборот катализатора посредством экструзии CO требует диссоциации очень стабильного карбонильного комплекса родия и температур, превышающих Требуется 200 °C. Это преобразование имеет значение в органическом синтезе , где декарбонилирование является редкой реакцией.
Декарбонилирование представляет интерес для превращений сахаров. [ 7 ] Кетоны и другие карбонилсодержащие функциональные группы более устойчивы к декарбонилированию, чем альдегиды.
Перициклические реакции
[ редактировать ]Некоторые циклические молекулы, содержащие кетон, подвергаются хелетропной реакции экструзии , в результате чего остаются новые углерод-углеродные π-связи в оставшейся структуре . Эта реакция может протекать самопроизвольно, как при синтезе гексафенилбензола . Циклопеноны и циклобутендионы можно превратить в алкины путем отщепления одной или двух молекул CO соответственно. [ 8 ]
Биохимия
[ редактировать ]Оксид углерода выделяется при распаде (катаболизме) гема под действием O 2 , НАДФН и фермент гемоксигеназа : [ 9 ]
- Гем b + 3 O 2 + 3/ 2 НАДФН + 3/ 2 H + → биливердин + Fe 2+ + СО + 3/2 БОЛЬШЕ + + 3H2O
Неорганический и металлоорганический синтез
[ редактировать ]Многие карбонилы металлов получают реакциями декарбонилирования. Лиганд CO в комплексе Васки возникает в результате декарбонилирования диметилформамида :
- IrCl 3 (H 2 O) 3 + 3 P(C 6 H 5 ) 3 + HCON(CH 3 ) 2 + C 6 H 5 NH 2 → IrCl(CO)[P(C 6 H 5 ) 3 ] 2 + [ (CH 3 ) 2 NH 2 ]Cl + OP(C 6 H 5 ) 3 + [C 6 H 5 NH 3 ]Cl + 2 H 2 O
Преобразование Fe(CO) 5 и Mo(CO) 6 и их многочисленные производные часто включают декарбонилирование. Здесь декарбонилирование сопровождает получение димера дикарбонила циклопентадиенилирона :
- 2 Fe(CO) 5 + C 10 H 12 → (n 5 −C 5 H 5 ) 2 Fe 2 (CO) 4 + 6 CO + H 2
Декарбонилирование можно вызвать фотохимически, а также с использованием таких реагентов, как триметиламина N -оксид :
- Me 3 NO + L + Fe(CO) 5 → Me 3 N + CO 2 + LFe(CO) 4
Ссылки
[ редактировать ]- ^ Кох, Х.; Хааф, В. (1973). «1-адамантанкарбоновая кислота» . Органические синтезы ; Сборник томов , т. 5, с. 20 .
- ^ Норман, Ричард Освальд Чендлер; Коксон, Джеймс Моррис (1993). Принципы органического синтеза (3-е изд.). Лондон: Blackie Academic & Professional. п. 709. ИСБН 0751401269 . ОСЛК 27813843 .
- ^ Брук, AG; Гилман, Генри (апрель 1955 г.). «Реакции элиминирования трифенилсиланкарбоновой кислоты и ее производных, катализируемые основаниями». Журнал Американского химического общества . 77 (8): 2322–2325. дои : 10.1021/ja01613a088 . ISSN 0002-7863 .
- ^ Фриис, Стиг Д.; Таанинг, Рольф Х.; Линдхардт, Андерс Т.; Скридструп, Троэлс (16 ноября 2011 г.). «Силакарбоновые кислоты как эффективные молекулы, высвобождающие оксид углерода: синтез и применение в реакциях карбонилирования, катализируемых палладием». Журнал Американского химического общества . 133 (45): 18114–18117. дои : 10.1021/ja208652n . ISSN 0002-7863 . ПМИД 22014278 .
- ^ Jump up to: а б Крейс, Майкл; Пальмелунд, Андерс; Банч, Леннарт; Мэдсен, Роберт (2006). «Общий и удобный метод катализируемого родием декарбонилирования альдегидов». Расширенный синтез и катализ . 348 (15): 2148–2154. дои : 10.1002/adsc.200600228 .
- ^ Хартвиг, Дж. Ф. Химия органопереходных металлов, от связывания к катализу; Университетские научные книги: Нью-Йорк, 2010.
- ^ Гейлен, Фрэнк, Массачусетс; Фом Штайн, Торстен; Энгендал, Бартель; Винтерле, Соня; Лиау, Марсель А.; Кланкермайер, Юрген; Лейтнер, Уолтер (2011). «Высокоселективное декарбонилирование 5-(гидроксиметил)фурфурола в присутствии сжатого углекислого газа». Международное издание «Прикладная химия» . 50 (30): 6831–6834. дои : 10.1002/anie.201007582 . ПМИД 21661080 .
- ^ Рубин, Ив; Ноблер, Кэролайн Б.; Дидерих, Франсуа (1990). «Предшественники цикло[ n ]углеродов: от 3,4-диалкинил-3-циклобутен-1,2-дионов и 3,4-диалкинил-3-циклобутен-1,2-диолов до циклобутенодегидроаннуленов и высших оксидов углерода» . Дж. Ам. хим. Соц . 112 (4): 1607–1617. дои : 10.1021/ja00160a047 .
- ^ Райтер, Стефан В.; Тиррелл, Рекс М. (2000). «Пути синтеза и деградации гема: роль в чувствительности к оксидантам». Свободнорадикальная биология и медицина . 28 (2): 289–309. дои : 10.1016/S0891-5849(99)00223-3 .