Ацетилацетонаты металлов
Ацетилацетонаты металлов представляют собой координационные комплексы, производные ацетилацетонат-аниона ( CH
3 КОЧКОХ −
3 ) и ионы металлов, обычно переходных металлов . Бидентатный ацетилацетонат лиганд часто обозначают сокращенно acac. Обычно оба атома кислорода связываются с металлом, образуя шестичленное хелатное кольцо. Простейшие комплексы имеют формулы M(acac) 3 и M(acac) 2 . смешанно-лигандные комплексы, например VO(acac) 2 Также многочисленны . Также были разработаны варианты ацетилацетоната с множеством заместителей вместо метила (RCOCHCOR ' − ). [1] Многие такие комплексы растворимы в органических растворителях , в отличие от родственных галогенидов металлов. Благодаря этим свойствам комплексы асак иногда используются в качестве предшественников катализаторов и реагентов. Приложения включают их использование в качестве «реагентов сдвига» ЯМР , катализаторов органического синтеза и предшественников промышленных катализаторов гидроформилирования . С
55Ч
77О −
2 в некоторых случаях также связывается с металлами через центральный атом углерода; этот тип связи более характерен для переходных металлов третьего ряда, таких как платина (II) и иридий (III).
Синтез
[ редактировать ]Обычный синтез включает обработку соли металла ацетилацетоном acacH: [2]
- М с + + z Hacac ⇌ M(acac) z + z H +
Добавление основания способствует удалению протона из ацетилацетона и сдвигает равновесие в пользу комплекса. Оба кислородных центра связываются с металлом, образуя шестичленное хелатное кольцо. В некоторых случаях хелатный эффект настолько силен, что для образования комплекса не требуется добавление основания. Некоторые комплексы получают метатезисом с использованием Tl (acac).
Структура и связь
[ редактировать ]В большинстве своих комплексов асас образует шестичленные хелатные кольца C 3 O 2 M. [3] Кольцо M(acac) плоское с плоскостью симметрии, делящей кольцо пополам.
Кольцо acacM обычно демонстрирует ароматический характер, что соответствует делокализованной связи в моноанионной части C 3 O 2 . В соответствии с этим сценарием в некоторых комплексах лиганд acac подвержен электрофильному замещению, сродни электрофильному ароматическому замещению (в этом уравнении Me = CH 3 ): [4]
- Co(O 2 C 3 Me 2 H) 3 + 3 NO 2 + → Co(O 2 C 3 Me 2 NO 2 ) 3 + 3 H +
С точки зрения счета электронов нейтральный бидентатный O,O-связанный acac-лиганд представляет собой «лиганд LX», т.е. комбинацию основания Льюиса (L) и псевдогалогенида (X).
Исключением из классического описания, представленного выше, является бис(пиридин)-аддукт ацетилацетоната хрома(II), обладающий невинными свойствами. 2- лиганд. [5]
Классификация по триаде
[ редактировать ]Титановая триада
[ редактировать ]Обработка TiCl 4 ацетилацетоном дает TiCl 2 (acac) 2 , октаэдрический комплекс красного цвета с C 2 симметрией :
- TiCl 4 + 2 Hacac → TiCl 2 (acac) 2 + 2 HCl
Эта реакция не требует основания. В атмосферных условиях дибромкомплекс легко гидролизуется (1 ч), тогда как дихлор- и дифторкомплексы гидролизуются трудно (1-3 сут). Комплекс TiCl 2 (acac) 2 является текучим в растворе, спектр ЯМР демонстрирует одиночный метильный резонанс при комнатной температуре. [6]
В отличие от Ti(IV), как Zr(IV), так и Hf(IV) связывают четыре бидентатных ацетилацетоната, что отражает больший радиус этих металлов. Ацетилацетонат гафния и ацетилацетонат циркония имеют квадратную антипризматическую структуру.
Из ацетилацетонатов титана(III) Ti(acac) 3 хорошо изучен . Это соединение синего цвета образуется из трихлорида титана и ацетилацетона. [3]
Ванадиевая триада
[ редактировать ]
Ацетилацетонат ванадила представляет собой комплекс синего цвета с формулой V(O)(acac) 2 . В этом комплексе присутствует ванадильная группа (IV), и известны многие родственные соединения. Молекула имеет квадратно-пирамидальную форму с идеализированной симметрией C 2v . Комплекс катализирует эпоксидирование аллильных спиртов пероксидами. Ацетилацетонат ванадия(III) представляет собой твердое вещество темно-коричневого цвета. Комплексы β-дикетоната ванадия используются в качестве прекатализаторов в промышленном производстве этилен-пропилен-диеновых эластомеров (ЭПДМ). Их часто оценивают для других применений, связанных с проточными окислительно-восстановительными батареями, диабетом и повышением активности инсулина, а также в качестве предшественников неорганических материалов при сердечно-сосудистых заболеваниях. [7]
Хромовая триада
[ редактировать ]Ацетилацетонат хрома(III) , Cr(acac) 3 , представляет собой типичный октаэдрический комплекс, содержащий три асац. − лиганды. Как и большинство подобных соединений, он хорошо растворим в неполярных органических растворителях. Этот конкретный комплекс, имеющий три неспаренных электрона, используется в качестве агента спиновой релаксации для повышения чувствительности в количественной ЯМР-спектроскопии углерода-13 . [8] Ацетилацетонат хрома (II) представляет собой высокочувствительное к кислороду соединение светло-коричневого цвета. Комплекс имеет квадратную плоскую структуру , слабо связанную со стопками в твердом состоянии. Он изоморфен Pd(acac) 2 и Cu(acac) 2 . [9] Mo(acac) 3 , фиолетовый, чувствительный к воздуху комплекс, получают метатезисом солей из гексахлормолибдата. [10] [11]
Марганцевая триада
[ редактировать ]
Mn(acac) 3 получен сопропорционированием соединения марганца(II) Mn(acac) 2 с перманганатом калия в присутствии дополнительного ацетилацетона. [12] Альтернативно прямая реакция ацетилацетона с перманганатом калия . [13] С точки зрения электронной структуры Mn(acac) 3 является высокоспиновым . Его искаженная октаэдрическая структура отражает геометрические искажения из-за эффекта Яна-Теллера . Две наиболее распространенные структуры этого комплекса включают одну с тетрагональным удлинением и одну с тетрагональным сжатием. Что касается удлинения, две связи Mn–O имеют длину 2,12 Å, а остальные четыре - 1,93 Å. При сжатии две связи Mn–O имеют длину 1,95 Å, а остальные четыре — 2,00 Å. Эффекты тетрагонального удлинения заметно более значительны, чем эффекты тетрагонального сжатия. [14]
В органической химии Mn(acac) 3 использовался в качестве одноэлектронного окислителя для связывания фенолов. [15]
Оценены скорости переноса электронов для Mn(acac)3. [16] -
Железная триада
[ редактировать ]Ацетилацетонат железа(III) , Fe(acac) 3 , представляет собой красный высокоспиновый комплекс, хорошо растворимый в органических растворителях. Это высокоспиновый комплекс с пятью неспаренными электронами. Иногда его исследовали в качестве предшественника катализатора. [17] Fe(acac) 3 частично разделился на Δ и Λ изомеры . [18] Комплекс железа Fe(acac) 2 является олигомерным.
Как и железо, Ru(III) образует стабильный трис(ацетилацетонат) . Восстановление этого производного Ru(III) в присутствии других лигандов приводит к образованию смешанно-лигандных комплексов, например Ru(acac) 2 (алкен) 2 . [19]
Кобальтовая триада
[ редактировать ]
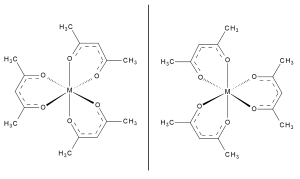
Трис(ацетилацетонато)кобальт(III) , Co(acac) 3 , представляет собой низкоспиновый диамагнитный комплекс. Как и другие соединения типа M(acac) 3 , этот комплекс является хиральным (имеет ненакладываемое зеркальное отображение). [18]
Синтез Co(acac) 3 предполагает использование окислителя, поскольку предшественники кобальта двухвалентны:
- 2 CoCO 3 + 6 Hacac + H 2 O 2 → 2 Co(acac) 3 + 4 H 2 O + 2 CO 2
Комплекс «Co(acac) 2 », как и комплекс никеля с аналогичной стехиометрией, обычно изолируется с двумя дополнительными лигандами, т.е. октаэдрическим Co(acac) 2 L 2 . Безводная форма существует в виде тетрамера [Co(acac) 2 ] 4 . Как и тримерный комплекс никеля, этот тетрамер проявляет ферромагнитные взаимодействия при низких температурах. [20]
Ir(acac) 3 и Rh(acac) 3 Известны . Известен второй изомер связи иридиевого комплекса, транс -Ir(acac) 2 ( CH (COMe) 2 )(H 2 O). Это производное с C -связью является предшественником гомогенных катализаторов активации C – H и связанных с ним химических процессов. [21] [22] [23] [24]
Двумя хорошо изученными ацетилацетонатами родия(I) и иридия(I) являются Rh(acac)(CO) 2 и Ir(acac)(CO) 2 . Эти комплексы плоскоквадратные, симметрии C 2v .
Никелевая триада
[ редактировать ]
Бис(ацетилацетонат) никеля(II) существует в виде триметаллического комплекса [Ni(acac) 2 ] 3 . Объемные бета-дикетонаты образуют красные мономерные плоско-квадратные комплексы. [25] Бис(ацетилацетонат) никеля(II) реагирует с водой с образованием октаэдра. [26] аддукт [Ni(acac) 2 (H 2 O) 2 ] , мелово-зеленое твердое вещество.
В отличие от сложного магнетизма и структуры Ni(acac) 2 , бис(ацетилацетонат) платины(II) и бис(ацетилацетонат) палладия(II) являются диамагнитными монометаллическими соединениями.
Медная триада
[ редактировать ]Cu(acac) 2 получают обработкой ацетилацетона водным раствором Cu(NH
3 ) 2+
4 . Он доступен коммерчески, катализирует реакции сочетания и переноса карбена.
В отличие от производного меди (II), ацетилацетонат меди (I) представляет собой чувствительный к воздуху олигомерный вид. Он используется для катализа присоединения Михаэля . [27]
Цинковая триада
[ редактировать ]Моноаквокомплекс Zn(acac) 2 H 2 O ( т. пл. 138–140 °С) пятикоординированный, имеет квадратно-пирамидальную структуру. [28] Комплекс находит некоторое применение в органическом синтезе . [29] Дегидратация этого вида дает гигроскопичное безводное производное (т.пл. 127°С). [30] Это более летучее производное использовалось в качестве предшественника пленок ZnO .
Ацетилацетонаты других элементов
[ редактировать ]Бесцветный ацетилацетонат алюминия (Al(acac) 3 ) по структуре аналогичен другим трис-комплексам, например [Fe(acac) 3 ]. Трисацетилацетонаты лантаноидов часто имеют координационные числа выше 8.
Варианты акка
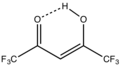
[ редактировать ]Многие варианты ацетилацетонатов хорошо разработаны. Гексафторацетилацетонаты и трифторацетилацетонаты образуют комплексы, которые часто структурно родственны обычным ацетилацетонатам, но являются более кислотными по Льюису и более летучими. Комплекс Eufod Eu 3 (OCC(CH 3 ) 3 CHCOC 3 F 7 ) . имеет сложный частично фторированный лиганд Этот комплекс представляет собой кислоту Льюиса, образующую аддукты с различными твердыми основаниями.
Один или оба кислородных центра в ацетилацетонате могут быть заменены группами RN, что приводит к образованию лигандов Nacac и Nacnac .
- Таутомеры и комплексообразование Накнака
- Реактив «ЯМР-сдвиг» Юфод
- Тетраацетилэтан , образующий биметаллические комплексы. [31]
- 2,4,6-гептантринон , двуядерный лиганд. [33]
С- связанные ацетилацетонаты
[ редактировать ]С
55Ч
77О −
2 в некоторых случаях также связывается с металлами через центральный атом углерода ( С3 ); этот тип связи более характерен для переходных металлов третьего ряда, таких как платина (II) и иридий (III). Комплексы Ir(acac) 3 и соответствующие аддукты с основанием Льюиса Ir(acac) 3 L (L = амин ) содержат один связанный с углеродом лиганд acac. ИК-спектры ацетилацетонатов с О -связью характеризуются относительно низкоэнергетическими полосами ν CO 1535 см-1. −1 , тогда как в ацетилацетонатах с углеродной связью карбонильное колебание происходит ближе к нормальному диапазону для кетона C=O, т.е. 1655 см-1. −1 .
Ссылки
[ редактировать ]- ^ Альбрехт, М.; Шмид, С.; Де Гроот, М.; Вайс, П.; Фрелих, Р. (2003). «Самосборка неполярного энантиомерно чистого металла-криптанда геликатного типа». хим. Комм. 2003 (20): 2526–2527. дои : 10.1039/b309026d . ПМИД 14594263 .
- ^ ЖК Мехротра; Р. Бора; Д. П. Гаур (1978). Металлические β-дикетоны и родственные производные . Академическая пресса. ISBN 0-12-488150-5 .
- ^ Jump up to: а б Арслан, Эврим; Лалансетт, Роджер А.; Бернал, Иван (2017). «Историческое и научное исследование свойств трис-ацетилацетонатов металлов (III)». Структурная химия . 28 : 201–212. дои : 10.1007/s11224-016-0864-0 . S2CID 99668641 .
- ^ Шалхуб, Джордж М. (1980). «Синтез, реакции и спектры Co(acac)3: эксперимент по общей химии». Журнал химического образования . 57 (7): 525. Бибкод : 1980ЖЧЭд..57..525С . дои : 10.1021/ed057p525 .
- ^ Винум, Мортен Готтольд; Фойгт, Лаура; Хансен, Стин Х.; Белл, Колби; Кларк, Кенша Мари; Ларсен, Рене Вугт; Педерсен, Каспер С. (2020). «Окислительно-восстановительная активность ацетилацетоната, активируемая лигандным полем» . Химическая наука . 11 (31): 8267–8272. дои : 10.1039/d0sc01836h . ПМК 8163028 . ПМИД 34094180 .
- ^ Уилки, Калифорния; Лин, Г.; Хаворт, DT (1979). « Цис- [дигалобис(2,4-пентаэдионато)титан(IV)] комплексы». Неорганические синтезы . Том. 19. С. 145–148. дои : 10.1002/9780470132500.ch33 . ISBN 978-0-470-13250-0 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ V. D. Makhaev; L. A. Petrova (2017). "Mechanochemical synthesis of vanadium(III) β-diketonates". Zhurnal Obshchei Khimii (Russian Journal of General Chemistry) . 87 (6): 1105–1109. doi : 10.1134/s1070363217060019 . S2CID 103887631 .
- ^ Кайтан, Эльза; Ремо, Джеральд С.; Тенайо, Ева; Акока, Серж (2007). «Точные и точные количественные 13 ЯМР С с сокращенным временем эксперимента». Talanta . 71 (3): 1016–1021. doi : 10.1016/j.talanta.2006.05.075 . PMID 19071407 .
- ^ Коттон, ФА; Райс, CE; Райс, GW (1977). «Кристаллическая и молекулярная структура бис(2,4-пентандионато)хрома». Неорг. Хим. Акта . 24 : 231–234. дои : 10.1016/S0020-1693(00)93880-5 .
- ^ Ларсон, Мелвин Л.; Мур, Фред В.; Уоллер, Джеймс; Брайант, Берл Э. (1966). «Трис(2,4-пентандионато)молибден (III)». Неорганические синтезы . Том. 8. стр. 153–156. дои : 10.1002/9780470132395.ch40 . ISBN 978-0-470-13167-1 .
- ^ Леднева А. Ю.; Артемкина, С.Б.; Пирязев Д.А.; Федоров, В.Е. (2015). «Структура и термические свойства молибденового комплекса Mo(acac) 3 ». Журнал структурной химии . 56 (5): 1021–1023. дои : 10.1134/S0022476615050315 .
- ^ Чарльз, Р.Г. (1963). «Ацетилацетонато марганца(III)». Неорганические синтезы Том 7 . Том. 7. С. 183–184. дои : 10.1002/9780470132388.ch49 . ISBN 978-0-470-13238-8 .
{{cite book}}:|journal=игнорируется ( помогите ) - ^ Джиролами, Г.; Раухфусс, Т.; Анжеличи, Р. Синтез и техника неорганической химии , 3-е изд.; Университетские научные книги: Саусалито, Калифорния, 1999; стр. 85-92. ISBN 0-935702-48-2
- ^ Коттон, Ф. Альберт ; Уилкинсон, Джеффри ; Мурильо, Карлос А.; Бохманн, Манфред (1999), Передовая неорганическая химия (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Снайдер, Б.Б. (2001). «Ацетилацетонат марганца (III)». В Пакетте, Л. (ред.). Энциклопедия реагентов для органического синтеза . Нью-Йорк, штат Нью-Йорк: Дж. Уайли и сыновья. дои : 10.1002/047084289X.rm022 . ISBN 0-471-93623-5 .
- ^ Фосетт, В.; Опалло, М. (1992). «Кинетические параметры гетерогенного переноса электрона к трис (ацетилацетонато) марганцу (III) и трис (ацетилацетонато) железу (III) в апротонных растворителях». Журнал электроаналитической химии . 331 (1–2): 815–830. дои : 10.1016/0022-0728(92)85008-Q .
- ^ Ричерт, SA; Цанг, ПКС; Сойер, Д.Т. (1989). «Лиганд-центрированные окислительно-восстановительные процессы для комплексов марганца, железа и кобальта, MnL 3 , FeL 3 и CoL 3 (L = ацетилацетонат, 8-хинолинат, пиколинат, 2,2' - бипиридил, 1,10-фенантролин) и для их тетракис(2,6-дихлорфенил)порфинатокомплексы [M(Por)]". Неорг. хим. 28 (12): 2471–2475. дои : 10.1021/ic00311a044 .
- ^ Jump up to: а б Леннартсон, Андерс (2011). «Оптическое разрешение и рацемизация [Fe(acac) 3 ]». Неорг. Хим. Акта . 365 : 451–453. дои : 10.1016/j.ica.2010.07.066 .
- ^ Беннетт, Массачусетс; Хит, Джорджия; Хоклесс, округ Колумбия; Ковачик, И.; Уиллис, AC (1998). «Алкеновые комплексы двухвалентного и трехвалентного рутения, стабилизированные хелатированием. Зависимость ориентации координированных алкенов от степени окисления металлов». Дж. Ам. хим. Соц. 120 (5): 932–941. дои : 10.1021/ja973282k .
- ^ Врещ, В.Д.; Х. Чжан, Ж.-Х. Ян; Филатов А.С.; Дикарев, Е.В. (2010). «Мономерный квадратно-планарный ацетилацетонат кобальта (II): тайна или ошибка?». Неорг. хим. 49 (18): 8430–8434. дои : 10.1021/ic100963r . ПМИД 20795642 .
- ^ Беннетт, Массачусетс; Митчелл, TRB (1976). «2,4-пентандионатокомплексы трехвалентного иридия с γ-углеродной связью». Неорг. хим. 15 (11): 2936–8. дои : 10.1021/ic50165a079 .
- ^ Бхалла, Г.; Оксгаард, Дж.; Годдард, Вашингтон; Периана, Рой А. (2005). «Гидровинилирование олефинов, катализируемое иридиевым комплексом посредством активации CH» (PDF) . Металлоорганические соединения . 24 (23): 5499–5502. дои : 10.1021/om050614i .
- ^ Вонг-Фой, АГ; Бхалла, Г.; Лю, XY; Периана, РА (2003). «Активация алканов C – H и катализ с помощью O-донорного лигированного иридиевого комплекса». Дж. Ам. хим. Соц. 125 (47): 14292–14293. дои : 10.1021/ja037849a . ПМИД 14624574 .
- ^ Тенн, Уильям Дж.; Янг, Кеннет Дж. Х.; Бхалла, Гаурав; Оксгаард, Йонас; Годдард, Уильям А.; Периана, Рой А. (2005). «Активация CH с помощью O-донорного иридий-метоксокомплекса» (PDF) . Дж. Ам. хим. Соц. 127 (41): 14172–14173. дои : 10.1021/ja051497l . ПМИД 16218597 .
- ^ Дёринг, А.; Годдард, Р.; Джолли, ПВ; Крюгер, К.; Поляков, В.Р. (2007). «Мономер-тримерная изомерия в 3-замещенных пентан-2,4-дионовых производных никеля (II)». Неорг. Хим . 36 (2): 177–183. дои : 10.1021/ic960441c .
- ^ Уильямс, Пол; Джонс, Энтони; Бикли, Джейми; Штайнер, Александр; Дэвис, Хиуэл; Лидхэм, Тимоти; Импи, Сьюзен; Гарсия, Джоанна; Аллен, Стивен; Ружье, Алин ; Блир, Александра (2 августа 2001 г.). «Синтез и кристаллические структуры диметиламиноэтанольных аддуктов ацетата Ni (ii) и ацетилацетоната Ni (ii). Прекурсоры для золь-гель-осаждения тонких пленок электрохромного оксида никеля». Журнал химии материалов . 11 (9). Королевское химическое общество : 2329–2334. дои : 10.1039/B103288G . (требуется подписка)
- ^ Пэриш, Э.Дж.; Ли, С. (2004). «Ацетилацетонат меди (I)». В Пакетте, Л. (ред.). Энциклопедия реагентов для органического синтеза . Нью-Йорк, штат Нью-Йорк: Дж. Уайли и сыновья. дои : 10.1002/047084289X.rc203 . ISBN 0-471-93623-5 .
- ^ Монтгомери, Х.; Лингафельтер, ЕС (1963). «Кристаллическая структура моноаквобисацетилацетонатоцинка». Акта Кристаллографика . 16 (8): 748–752. дои : 10.1107/S0365110X6300195X .
- ^ Барта, Н. (2004). «Бис(ацетилацетонат)цинк(II)». В Пакетте, Л. (ред.). Энциклопедия реагентов для органического синтеза . Нью-Йорк, штат Нью-Йорк: Дж. Уайли и сыновья. дои : 10.1002/047084289X.rb097 . ISBN 0-471-93623-5 .
- ^ Рудольф, Г.; Генри, MC (1967). «Бис(2,4-пентандионато)цинк (ацетилацетонат цинка)». Неорг. Синтез. 10 : 74–77. дои : 10.1002/9780470132418.ch14 .
- ^ Койва, Томохиро; Масуда, Юки; Шоно, Дзюмпей; Кавамото, Юджи; Хосино, Ёсимаса; Хашимото, Такеши; Натараджан, Каруппаннан; Симидзу, Кунио (2004). «Синтез, характеристика и подробная электрохимия биядерных комплексов рутения (III), связанных мостиком бисацетилацетонатом. Кристаллические и молекулярные структуры [{Ru (acac) 2 } 2 (tae)] (Acac = 2,4-пентандионат-ион, tae = 1) ,1,2,2-Тетраацетилэтанат Дианион)». Неорганическая химия . 43 (20): 6215–6223. дои : 10.1021/ic030216c . PMID 15446866 .
- ^ Базируется в Марино; Канева, Элизабетта; Тубаро, Кристина; Веронезе, Август Цезарь (2009). «Координационные свойства анионного лиганда (MeCO) 2 C(-)C(X)Me (X=O или NH) по отношению к центрам переходного металла (II)». Неорганика Химика Акта . 362 (8): 2551–2555. дои : 10.1016/j.ica.2008.11.017 .
- ^ Мурта, ДП; Линтведт, Ричард Л. (1970). «Хелаты бис(1,3,5-трикетонато)димеди(II). Ферромагнитный и антиферромагнитный обмен между ионами меди(II)». Неорганическая химия . 9 (6): 1532–1535. дои : 10.1021/ic50088a046 .



![Тетраацетилэтан, образующий биметаллические комплексы[31]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/4e/Ac4C2H2.svg/81px-Ac4C2H2.svg.png)
![Триацетилметан[32]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/31/Ac3CH.svg/120px-Ac3CH.svg.png)