Нитритный комплекс переходного металла
В металлоорганической химии комплексы переходных металлов с нитритом описывают семейства координационных комплексов, содержащих один или несколько нитритов ( −NO 2 ) лиганды . [2] Хотя синтетические производные представляют лишь научный интерес, комплексы металл-нитрит встречаются в ряде ферментов , участвующих в азотистом цикле . [3]
Структура и связь
[ редактировать ]
Режимы склеивания
[ редактировать ]три изомера связи Для нитритных лигандов характерны : O-связь, N-связь и бидентатная O,O-связь. Первые два изомера были охарактеризованы для системы пентаминкобальта(III), т.е. [(NH 3 ) 5 Co-NO 2 ] 2+ и [(NH3 ) 5Co − ONO] 2+ , называемые N-нитрито и О-нитрито соответственно. Эти две формы иногда называют нитро и нитрито. Эти изомеры могут взаимно превращаться в некоторые комплексы. [4]
Примером хелатирования нитрита является [Cu(bipy) 2 (O 2 N)]NO 3 – «bipy» представляет собой бидентатный лиганд 2,2'-бипиридил . Этот режим связи иногда описывается как κ 2О,О - НЕТ 2 .
Сосредоточив внимание на счете электронов в монометаллических комплексах, O-связь и N-связь рассматриваются как одноэлектронные псевдогалогениды («X-лиганд»). Бидентатная O,O-связь представляет собой «лиганд LX», аналогичный бидентатному карбоксилату.
Что касается теории HSAB , способ связи N более распространен для более мягких металлических центров. Бидентатные моды O и O,O представляют собой жесткие лиганды и обнаруживаются на кислых металлоцентрах Льюиса.
Кинетически выгодный изомер с О-связью [(NH3 ) 5Co − ONO] 2+ превращается в [(NH 3 ) 5 Co-NO 2 ] 2+ . В реакции с комплексами порфирина железа нитрит дает изомер с О-связью: Fe(porph)ONO . Добавление к этому комплексу донорных лигандов вызывает превращение в октаэдрический низкоспиновый изомер, который теперь представляет собой мягкую кислоту Льюиса. Нитрит изомеризуется до изомера с N-связью, Fe(porph)NO 2 (L) . [5]
Изомеризация [(NH3 ) 5Co − ONO] 2+ к [(NH 3 ) 5 Co-NO 2 ] 2+ протекает внутримолекулярно. [6]
Гомолептические комплексы
[ редактировать ]
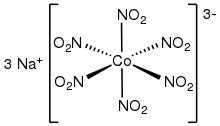
охарактеризовано несколько гомолептических (комплексов только с одним типом лиганда) комплексов Рентгеновской кристаллографией . Инвентаризация включает октаэдрические комплексы. [М(НО 2 ) 6 ] 3− , где M = Co ( кобальтинитрит натрия ) [7] [8] и Рх. Квадратно-плоские гомолептические комплексы известны также для Pt(II) и Pd(II). Калийные соли [М(НО 2 ) 4 ] 2− (M = Zn, Cd) представляют собой гомолептические комплексы с четырьмя O,O-бидентатными нитритными лигандами. [9]
Синтез нитритокомплексов
[ редактировать ]Традиционно нитритокомплексы металлов получают путем метатезиса солей или реакций замещения лиганда с использованием солей нитритов щелочных металлов, таких как нитрит натрия . При нейтральном pH нитрит существует преимущественно в виде аниона, а не азотистой кислоты. [10]
Нитрозильные комплексы металлов подвергаются щелочному гидролизу с образованием нитритных комплексов. Такая закономерность проявляется в поведении нитропруссида :
- [Fe(CN) 5 НЕТ] 2− + 2 ОН − → [Fe(CN) 5 NO 2 ] 4− + Н 2 О
Реакции нитритокомплексов
[ редактировать ]Некоторые анионные нитритокомплексы подвергаются дезоксигенации, вызванной кислотой, с образованием нитрозильного комплекса . [11]
- [L н MNO 2 ] − + Ч + → [Л н МНО] + + ОН −
В некоторых случаях реакция обратима. Таким образом, можно генерировать нитритокомплексы путем гидролиза электрофильных нитрозилов металлов.
Нитрокомплексы также катализируют окисление алкенов. [12]
Бионеорганическая химия
[ редактировать ]Нитритокомплексы металлов занимают видное место в азотном цикле , который описывает взаимоотношения и взаимопревращения аммиака до нитрата . Поскольку азот часто является ограничивающим питательным веществом, этот цикл важен. Сам нитрит не вступает в окислительно-восстановительные реакции, в отличие от его металлокомплексов. [13]
Окисление до нитрата
[ редактировать ]Молибденсодержащий фермент нитритоксидоредуктаза катализирует окисление нитрита в нитрат:
- НЕТ - 2 + Ч 2 О → НЕТ - 3 + 2 Ч +
Снижение
[ редактировать ]катализирует на основе гема Фермент нитритредуктаза превращение нитрита в аммиак. Цикл начинается с восстановления комплекса железа с нитритом до нитрозильного комплекса металла . [3]
Медьсодержащий фермент нитритредуктаза (CuNIR) катализирует одноэлектронное восстановление нитрита до оксида азота. Предлагаемый механизм предполагает протонирование κ 2О,О -NO 2 Комплекс -Cu(I). Это протонирование вызывает разрыв связи NO-O с образованием центра HO-Cu-ON, который содержит лиганд оксида азота, связанный O-связью с Cu (II) (изонитрозил ) .
Родственные соединения
[ редактировать ]- NH 4 [Co(NO 2 ) 4 (NH 3 ) 2 ] , «соль Эрдмана». [14]
Ссылки
[ редактировать ]- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Хитчман, Майкл А.; Роуботтом, Грэм Л. (1982). «Комплексы нитритов переходных металлов». Обзоры координационной химии . 42 : 55–132. дои : 10.1016/S0010-8545(00)80527-5 .
- ^ Jump up to: а б Тиммонс, Эй Джей; Саймс, доктор медицины (2015). «Преобразование оксидов азота с использованием координационных комплексов металл-лиганд» . Обзоры химического общества . 44 (19): 6708–6722. дои : 10.1039/C5CS00269A . ПМИД 26158348 .
- ^ Шаниэль, Доминик; Войке, Тео; Бернд, Норвид-Р.; Хаузер, Юрг; Кремер, Карл В.; Тодорова, Теодора; Делли, Бернард (2009). «Фотогенерация изомеров нитрозильной связи в октаэдрически координированных комплексах платины в красной спектральной области». Неорганическая химия . 48 (23): 11399–11406. дои : 10.1021/ic901392q . ПМИД 19863116 .
- ^ Форд, Питер К. (2010). «Реакции NO и нитрита с моделями гема и белками». Неорганическая химия . 49 (14): 6226–6239. дои : 10.1021/ic902073z . ПМИД 20666383 .
- ^ Джексон, В. Грегори; Лоуренс, Джеффри А.; Лэй, Питер А.; Сарджесон, Алан М. (1980). «Катализируемая основанием изомеризация нитрито-нитросвязи пентаамминных комплексов кобальта (III), родия (III) и иридия (III)». Неорганическая химия . 19 (4): 904–910. дои : 10.1021/ic50206a022 .
- ^ Бьянки, Р.; Гатти, К.; Адовазио, В.; Нарделли, М. (1996). «Теоретическое и экспериментальное (113 К) исследование электронной плотности гексанитрокобальтата (III) бис (тетраметиламмония) лития». Acta Crystallographica Раздел B: Структурная наука . 52 (3): 471–478. дои : 10.1107/S0108768195016879 .
- ^ Адовазио, В.; Лина, Ф.; Нарделли, М.; Пелицци, Г. (1994). «Гексанитрокобальтат (III) бис (тетраметилламмония) лития при 113 и 293 К». Журнал кристаллографии, раздел C: Связь с кристаллической структурой . 50 (6): 871–874. дои : 10.1107/S0108270193011588 .
- ^ Охба, С.; Мацумото, Ф.; Такадзава, Х.; Сайто, Ю. (1987). «Структуры дигидрата нитрита кадмия и тетранитрита дикалия кадмия». Acta Crystallographica Раздел C: Связь с кристаллической структурой . 43 (2): 191–194. дои : 10.1107/S0108270187096471 .
- ^ Харбулак, Эдвард П.; Альбинак, Марвин Дж. (1966). Цис-динитробис(этилендиамин)кобальт(III) Нитрит и нитрат . Неорганические синтезы. стр. 196–198. дои : 10.1002/9780470132395.ch51 . ISBN 9780470132395 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 449. ИСБН 978-0-08-037941-8 .
- ^ Фэрламб, Ян Дж.С. (2015). «Редокса-активные NO x- лиганды в процессах, опосредованных палладием». Angewandte Chemie, международное издание . 54 (36): 10415–10427. дои : 10.1002/anie.201411487 . ПМИД 26211412 .
- ^ Майя, Луиза Б.; Моура, Хосе Дж.Г. (2014). «Как биология обращается с нитритом» . Химические обзоры . 114 (10): 5273–5357. дои : 10.1021/cr400518y . ПМИД 24694090 .
- ^ Комияма, Ёшимичи (1957). «Структуры соли Эрдмана, NH 4 [Co(NH 3 ) 2 (NO 2 ) 4 ] и некоторых других родственных комплексов нитро-аммин-кобальт (III)». Бюллетень Химического общества Японии . 30 :13–21. дои : 10.1246/bcsj.30.13 .