Карбоксилатный комплекс переходного металла

Карбоксилатные комплексы переходных металлов представляют собой координационные комплексы с карбоксилатом (RCO 2 − ) лиганды . Учитывая разнообразие карбоновых кислот, запасы карбоксилатов металлов велики. Многие из них полезны с коммерческой точки зрения, и многие привлекли пристальное внимание ученых. Карбоксилаты проявляют множество способов координации, наиболее распространенными являются κ 1 - (О-монодентатный), κ 2 (O,O-двузубый) и мостик.
Ацетат и родственные монокарбоксилаты
[ редактировать ]Структура и связь
[ редактировать ]Карбоксилаты связываются с отдельными металлами одним или обоими атомами кислорода, соответствующее обозначение κ. 1 - и г-н 2 -. С точки зрения счета электронов κ 1 -карбоксилаты представляют собой лиганды «Х»-типа, т.е. псевдогалоидоподобные. κ 2 -карбоксилаты представляют собой «лиганды LX», т.е. напоминают комбинацию основания Льюиса (L) и псевдогалогенида (X). карбоксилаты классифицируются как жесткие лиганды HSAB В теории .
- Структуры некоторых ацетатов металлов
- Ацетат серебра
- Ацетат молибдена (II) , иллюстрирующий четверную связь Mo-Mo. [1]
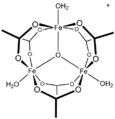
- [CoO(ацетат)] 4 , « Das cubane »
Для простых карбоксилатов показательными являются ацетатные комплексы. Большинство ацетатов переходных металлов представляют собой смешанно-лигандные комплексы. Одним из распространенных примеров является гидратированный ацетат никеля Ni(O 2 CCH 3 ) 2 (H 2 O) 4 , который характеризуется внутримолекулярными водородными связями между некоординированными атомами кислорода и протонами аква-лигандов . Стехиометрически простые комплексы часто являются мультиметаллическими. Одно семейство представляет собой основные ацетаты металлов стехиометрии [M 3 O(OAc) 6 (H 2 O) 3 ] п+ . [2]

Гомолептические комплексы
[ редактировать ]Гомолептические карбоксилатные комплексы обычно представляют собой координационные полимеры . Но существуют исключения.
- Молекулярный монокарбоксилат – ацетат серебра Ag 2 (OAc) 2 .
- Молекулярные диацетаты встречаются чаще. Некоторые диацетаты принимают структуру китайского фонаря . Хорошо изученные примеры включают тетраацетаты диметаллов (M 2 (OAc) 4 ), включая ацетат родия (II) , ацетат меди (II) , ацетат молибдена (II) и ацетат хрома (II) . Диацетат платины и диацетат палладия содержат ядра Pt 4 и Pd 3 , что еще раз иллюстрирует тенденцию ацетатных лигандов стабилизировать мультиметаллические структуры.
- К моноядерным трикарбоксилатам относятся производные 1-адамантанкарбоновой кислоты , имеющие формулу [M(O 2 CC 10 H 11 ) 3 ] − (М = Со, Ni, Zn). Карбоксилаты бидентатны. [4]
Синтез
[ редактировать ]Многие методы позволяют синтезировать карбоксилаты металлов. Из предварительно полученной карбоновой кислоты были продемонстрированы следующие пути: [5]
- кислотно-основные реакции: L n MOR' + RCO 2 H → L n MO 2 CR + R'OH
- протонолиз: L n Mалкил + RCO 2 H → L n MO 2 CR + алкан
- окислительное присоединение : L n M + RCO 2 H → L n (H)MO 2 CR
Из предварительно образовавшегося карбоксилата реакции метатезиса солей часто наблюдаются :
- L n MCl + RCO 2 Na → L n MO 2 CR + NaCl
Карбоксилаты металлов можно получить карбонизацией высокоосновных алкилов металлов:
- L н МР + СО 2 → L н МО 2 CR
Реакции
[ редактировать ]Распространенной реакцией карбоксилатов металлов является их замещение более основными лигандами. Ацетат является распространенной уходящей группой . Они особенно склонны к протонолизу, который широко используют для введения лигандов, замещающих карбоновую кислоту. Таким способом октахлордимолибдат получают из тетраацетата димолибдена :
- Mo 2 (O 2 CCH 3 ) 4 + 4 HCl + 4 KCl → K 4 [Mo 2 Cl 8 ] + 4 CH 3 CO 2 H
Предполагается, что ацетаты электрофильных металлов выполняют роль оснований в реакциях согласованного депротонирования металлирования . [6]
Попытки получить некоторые карбоксилатные комплексы, особенно электрофильных металлов, часто приводят к оксопроизводным. Примеры включают оксоацетаты Fe(III), Mn(III) и Cr(III). Пиролиз карбоксилатов металлов дает ангидриды кислот и оксиды металлов. Эта реакция объясняет образование основного ацетата цинка из безводного диацетата цинка .
В некоторых случаях монодентатные карбоксилаты подвергаются O-алкилированию с образованием сложных эфиров. Требуются сильные алкилирующие агенты.
Другие карбоксилаты
[ редактировать ]Многие карбоксилаты образуют комплексы с переходными металлами. Алкил- и простые арилкарбоксилаты ведут себя аналогично ацетатам. Трифторацетаты отличаются моноядерными комплексами, поскольку обычно они монодентатны, например [Zn(κ 2 -O 2 CCH 3 ) 2 (OH 2 ) 2 ] vs [Zn(κ 1 -O 2 CCF 3 ) 2 (OH 4 ) 2 ]. [7]
Приложения
[ редактировать ]Нафтенаты и этилгексаноаты металлов
[ редактировать ]Нафтеновые кислоты , смеси длинноцепочечных и циклических карбоновых кислот, извлеченные из нефти, образуют липофильные комплексы (часто называемые солями) с переходными металлами. Эти нафтенаты металлов имеют формулу M(нафтенат) 2 или M 3 O(нафтенат) 6 и имеют разнообразное применение. [8] [9] включая синтетические моющие средства , смазочные материалы , ингибиторы коррозии, присадки к топливу и смазочным маслам, консерванты для древесины , инсектициды , фунгициды , акарициды , смачивающие агенты , загустители и средства для сушки масла . Промышленно полезные нафтенаты включают нафтенаты алюминия, магния, кальция, бария, кобальта, меди, свинца, марганца, никеля, ванадия и цинка. [9] Показательным является использование нафтената кобальта для окисления тетрагидронафталина до гидропероксида. [10]

Подобно нафтеновой кислоте, 2-этилгексановая кислота образует липофильные комплексы, которые используются в органическом и промышленном химическом синтезе . Они действуют как катализаторы полимеризации , а также в окисления реакциях в качестве агентов, осушающих масло . [11] металлов Этилгексаноаты называются металлическими мылами. [12]
Аминополикарбоксилаты
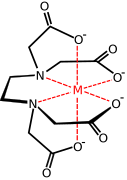
[ редактировать ]- металлокомплекс с ЭДТА анионом
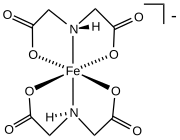
- Бис(иминодиацетат) железа
- Активный центр гемеритрина, O 2 -переносящего карбоксилата железа.
Коммерчески важное семейство карбоксилатов металлов происходит из аминополикарбоксилатов , например ЭДТА. 4- . С этими синтетическими хелатирующими агентами связаны аминокислоты , которые образуют большие семейства аминокислотных комплексов . Две аминокислоты, глутамат и аспартат, имеют карбоксилатные боковые цепи, которые действуют как лиганды железа в негемовых железосодержащих белках, таких как гемеритрин . [13]
Металлоорганические каркасы (МОФ)
[ редактировать ]Металлоорганические каркасы , пористые трехмерные координационные полимеры, часто происходят из кластеров карбоксилатов металлов. Эти кластеры, называемые вторичными связующими единицами (SBU), часто связаны сопряженными основаниями бензолди- и трикарбоновых кислот. [14]
Реагенты для органического синтеза
[ редактировать ]
Ацетат палладия (II) описывается как «один из наиболее широко используемых комплексов переходных металлов в органическом синтезе с участием металлов». Во многих реакциях сочетания используется этот реагент, который растворим в органических растворителях и содержит встроенное основание Бренстеда (ацетат). [15]
Диродий тетракис (трифторацетат) широко используется в качестве катализатора реакций с участием диазосоединений. [16]
Связанные темы
[ редактировать ]Ссылки
[ редактировать ]- ^ Бриньоль, Алисия Б.; Коттон, ФА (1972). «Соединения рения и молибдена, содержащие четверные связи». Неорганические синтезы . 13 : 81–89. дои : 10.1002/9780470132449.ch15 .
- ^ Каттерик, Джанет; Торнтон, Питер (1977). Структура и физические свойства полиядерных карбоксилатов . Достижения неорганической химии и радиохимии. Том. 20. стр. 291–362. дои : 10.1016/S0065-2792(08)60041-2 . ISBN 9780120236206 .
- ^ Чжан, Гао; Линь, Цзянь; Го, Дун Вэй; Яо, Ши Ян; Тянь, Юнь Ци (2010). «Полимеры бесконечной координации одно- и двумерных ацетатов кобальта». Журнал неорганической и общей химии . 636 (7): 1401–1404. дои : 10.1002/zaac.200900457 .
- ^ Фурсова Е. Ю.; Романенко Г.В.; Толстиков С.Е.; Овчаренко, В.И. (2019). «Моноядерные адамантан-1-карбоксилаты переходных металлов». Русский химический вестник : 1669–1674. дои : 10.1007/s11172-019-2610-4 . S2CID 203592748 .
- ^ Гарсиа-Родригес, Рауль; Хендрикс, Марк П.; Коссарт, Брэнди М.; Лю, Хайтао; Оуэн, Джонатан С. (2013). «Реакции конверсии предшественников нанокристаллов халькогенида кадмия». Химия материалов . 25 (8): 1233–1249. дои : 10.1021/см3035642 .
- ^ Акерманн, Лутц (9 марта 2011 г.). «Функционализация связи C-H, катализируемая карбоксилатом переходного металла: механизм и сфера применения» . Химические обзоры . 111 (3): 1315–1345. дои : 10.1021/cr100412j . ISSN 0009-2665 . ПМИД 21391562 .
- ^ Morozov, I. V.; Karpova, E. V.; Glazunova, T. Yu.; Boltalin, A. I.; Zakharov, M. A.; Tereshchenko, D. S.; Fedorova, A. A.; Troyanov, S. I. (2016). "Trifluoroacetate complexes of 3d elements: Specific features of syntheses and structures". Russian Journal of Coordination Chemistry . 42 (10): 647–661. doi : 10.1134/S107032841610002X .
- ^ М. Ландау. 1993. «Сиккативы и металлические мыла», в изд. Дж. Крошвица, Энциклопедия химической технологии Кирка-Отмера . Нью-Йорк: Джон Уайли и сыновья. Том. 8, стр. 432-445. два : 10.1002/0471238961.0418090512011404.a01
- ^ Jump up to: а б Нора, Анджело; Коенен, Гюнтер (2010). «Металлическое мыло». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a16_361.pub2 . ISBN 978-3-527-30385-4 .
- ^ Найт, HB; Сверн, Дэниел (1954). «Гидропероксид тетралина». Органические синтезы . 34 : 90. дои : 10.15227/orgsyn.034.0090 .
- ^ Раджу, Равиндер; Прасад, Капа (2012). «Синтетическое применение реагентов, производных 2-этилгексановой кислоты». Тетраэдр . 68 (5): 1341–1349. дои : 10.1016/j.tet.2011.10.078 .
- ^ Нора, Анджело; Щепанек, Альфред; Коенен, Гюнтер (2001). «Металлическое мыло». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a16_361 . ISBN 3527306730 .
- ^ Ясневский, Эндрю Дж.; Que, Лоуренс (2018). «Активация дикислорода негемовыми дижелезосодержащими ферментами: разнообразные аддукты дикислорода, высоковалентные промежуточные соединения и родственные модельные комплексы» . Химические обзоры . 118 (5): 2554–2592. doi : 10.1021/acs.chemrev.7b00457 . ПМК 5920527 . ПМИД 29400961 .
- ^ Траншмонтань, Дэвид Дж.; Мендоса-Кортес, Хосе Л.; о'Киф, Майкл; Яги, Омар М. (2009). «Вторичные строительные единицы, сетки и связи в химии металлоорганических каркасов» . Обзоры химического общества . 38 (5): 1257–1283. дои : 10.1039/b817735j . ПМИД 19384437 .
- ^ Греннберг, Хелена; Фут, Джонатан С.; Банвелл, Мартин Г.; Роман, Даниэла Сустак (2001). «Ацетат палладия(II)». Энциклопедия реагентов для органического синтеза . стр. 1–35. дои : 10.1002/047084289X.rp001.pub3 . ISBN 978-0-470-84289-8 .
- ^ Дойл, Майкл П.; Дэвис, Хью М.Л.; Мэннинг, Джеймс Р. (2006). «Дирродий (II) тетракис (трифторацетат)». эЭРОС . дои : 10.1002/047084289X.rd461.pub2 .


![[CoO(ацетат)]4, "Das cubane"](http://upload.wikimedia.org/wikipedia/commons/thumb/d/da/DasCubane.svg/120px-DasCubane.svg.png)