Выход из группы
В химии определяется уходящая группа ИЮПАК как атом или группа атомов , которые отделяются от основной или остаточной части субстрата во время реакции или элементарной стадии реакции. [1] Однако в обычном использовании этот термин часто ограничивается фрагментом, который уходит с парой электронов при гетеролитическом разрыве связи . [2] В этом случае уходящая группа является менее формальным, но более часто используемым синонимом термина нуклеофуг . В этом контексте уходящими группами обычно являются анионы или нейтральные соединения, исходящие от нейтральных или катионных субстратов соответственно, хотя в редких случаях катионы, уходящие от дикатионного субстрата. известны также [3]
Способность вида служить уходящей группой зависит от его способности стабилизировать дополнительную электронную плотность , возникающую в результате гетеролиза связи. Обычными анионными уходящими группами являются галогениды, такие как кл. − , Бр − и я − и сложные эфиры сульфонатов, такие как тозилат ( Цо − ), а вода ( H 2 O ), спирты ( R-OH ) и амины ( R 3 N ) представляют собой общие нейтральные уходящие группы.
В более широком определении ИЮПАК этот термин также включает группы, которые отделяются без электронной пары в результате гетеролитического расщепления (группы, специально известные как электрофуги ), такие как ЧАС + или SiR + 3 , которые обычно возникают в реакциях электрофильного ароматического замещения . [1] [4] Точно так же виды с высокой термодинамической стабильностью , такие как азот ( N 2 ) или углекислый газ ( CO 2 ) обычно действуют как уходящие группы в реакциях гомолитического разрыва связей радикальных частиц . Относительно редкий термин, который служит антонимом покидающей группы, - это входящий в группу , полученным из субстрата (т.е. вид, который реагирует и образует связь с субстратом или промежуточным продуктом ).
В этой статье нижеприведенные обсуждения в основном касаются ухода групп, действующих как нуклеофуг.

Возможность выхода из группы
[ редактировать ]Физическим проявлением способности выхода из группы является скорость, с которой происходит реакция. Хорошие уходящие группы дают быструю реакцию. Согласно теории переходного состояния это означает, что реакции с участием хороших уходящих групп имеют низкие активационные барьеры, что приводит к относительно стабильным переходным состояниям.
Понятие о способности уходящей группы полезно рассмотреть в случае первой стадии реакции S N 1/E1 с анионной уходящей группой (ионизация), имея в виду, что это понятие можно обобщить на все реакции, в которых участвуют уход из групп. Поскольку уходящая группа несет больший отрицательный заряд в переходном состоянии (и продуктах), чем в исходном материале, хорошая уходящая группа должна быть способна стабилизировать этот отрицательный заряд, т.е. образовывать стабильные анионы . Хорошей мерой стабильности аниона является p K a анионом кислоты, сопряженной с (p K aH ), и способность уходящей группы действительно обычно следует этой тенденции, при этом более низкое p K aH хорошо коррелирует с лучшей способностью уходящей группы.

Однако корреляция между p K aH и способностью покидать группу не идеальна. Способность уходящей группы представляет собой разницу в энергии между исходными материалами и переходным состоянием (Δ G ‡ ) и различия в способности покидать группу отражаются на изменении этой величины (ΔΔ G ‡ ). Однако pK aH ° представляет собой разницу в энергии между исходными материалами и продуктами (ΔG ) , причем различия в кислотности отражаются в изменениях этого количества (ΔΔG ° ). Возможность корреляции этих энергетических различий подтверждается постулатом Хаммонда и принципом Белла-Эванса-Полани . Также исходные материалы в этих случаях разные. В случае константы диссоциации кислоты «уходящая группа» связана с протоном в исходном материале, тогда как в случае способности уходящей группы уходящая группа связана с (обычно) углеродом. Именно с учетом этих важных предостережений следует считать, что p K aH отражает способность покидать группу. Тем не менее, обычно можно изучить константы диссоциации кислоты, чтобы качественно предсказать или рационализировать тенденции скорости или реакционной способности, связанные с изменением уходящей группы. В соответствии с этой картиной, сильные основания, такие как ОЙ − , ИЛИ 2 и NR - 2 имеют тенденцию образовывать плохие уходящие группы из-за своей неспособности стабилизировать отрицательный заряд.
| Выездные группы упорядочены примерно по мере уменьшения возможности выезда. [5] | |
|---|---|
| Р-Н + 2 | диазот |
| R-ИЛИ' + 2 | диалкиловый эфир |
| Р-ОСО 2 Р Ф | перфторалкилсульфонаты (например, трифлат ) |
| Р – Я | йода |
| Р–ОТ, Р–ОМ и т. д. | тозилаты , мезилаты и подобные сульфонаты |
| Р – Бр | бромид |
| R-OH + 2 , R'-OHR + | вода , спирты |
| R – Cl | хлористый |
| Р-ОНО 2 , R-OPO(ИЛИ') 2 | нитраты , фосфаты и другие неорганические эфиры |
| R-SR' + 2 | тиоэфир |
| R-NR' + 3 , Р-NH + 3 | амины , аммиак |
| Р – Ф | фторид |
| Р–ОКОР | карбоксилат |
| Рев | феноксиды |
| Р–ОН, Р–ОР | гидроксид , алкоксиды |
| Р – НР 2 | амиды |
| Р – Ч | гидрид |
| Р – Р' | аренид, алканид |
Что представляет собой разумную покидающую группу, зависит от контекста. S N 2 типичные синтетически полезные уходящие группы включают Для реакций кл. − , Бр − , я − , − ОЦ, − ОМ, − ОТф и Н 2 О. Субстраты, содержащие фосфатные и карбоксилатные уходящие группы, с большей вероятностью будут реагировать путем конкурентного присоединения-отщепления, в то время как сульфониевые и аммониевые соли обычно образуют илиды или, если это возможно, подвергаются отщеплению E2. Что касается приведенной выше таблицы, феноксиды ( − OAr ) представляют собой нижний предел того, что возможно в качестве уходящих групп S N 2 : очень сильные нуклеофилы, такие как Ф 2 П − или ЭтС − были использованы для деметилирования производных анизола путем замещения SN 2 по метильной группе. Гидроксиды, алкоксиды, амиды, гидриды и алкил-анионы не служат уходящими группами в реакциях S N 2 .
С другой стороны, когда коллапс анионных или дианионных тетраэдрических интермедиатов , высокая электронная плотность соседнего гетероатома облегчает изгнание уходящей группы. Так, при гидролизе эфиров и амидов в основных условиях в качестве уходящих групп обычно предлагают алкоксиды и амиды. По этой же причине E1cb нередки реакции с участием гидроксида в качестве уходящей группы (например, при альдольной конденсации ). Это крайне редкое явление для таких групп, как ЧАС − ( гидриды ), Р 3 С − ( алкиланионы , R = алкил или H), или С − (арильные анионы, Ar = арил) уходят с парой электронов из-за высокой энергии этих частиц. Реакция Чичибабина представляет собой пример гидрида в качестве уходящей группы, тогда как реакция Вольфа-Кишнера и реакция Халлера-Бауэра содержат нестабилизированные уходящие группы карбаниона.
Контекстуальные различия в способности покинуть группу
[ редактировать ]Важно отметить, что приведенный выше список является качественным и описывает тенденции . Способность группы уйти зависит от контекста. Например, в реакциях S N Ar скорость обычно увеличивается, когда уходящая группа представляет собой фторид по сравнению с другими галогенами. Этот эффект обусловлен тем фактом, что переходное состояние с наивысшей энергией в этом двухэтапном процессе присоединения-отщепления возникает на первом этапе, где большая способность фторида к акцептору электронов по сравнению с другими галогенидами стабилизирует развивающийся отрицательный заряд на ароматическом кольце. Выход уходящей группы происходит быстро из этого высокоэнергетического комплекса Мейзенгеймера , и, поскольку уход не участвует в стадии ограничения скорости, он не влияет на общую скорость реакции. Этот эффект является общим для устранения сопряженных оснований.
Даже когда уход уходящей группы участвует в стадии реакции, ограничивающей скорость, все равно могут существовать контекстуальные различия, которые могут изменить порядок способности покидать группу. При алкилировании по Фриделю-Крафтсу нормальный порядок уходящей группы галогена меняется на обратный, так что скорость реакции следует RF > RCl > RBr > RI. Этот эффект обусловлен их большей способностью образовывать комплекс с катализатором кислоты Льюиса , а фактическая удаляющаяся группа представляет собой «съеденный» комплекс между кислотой Льюиса и уходящей уходящей группой. [6] Эта ситуация в широком смысле определяется как активация выхода из группы .
Все еще могут существовать контекстуальные различия в способности уходящей группы в самой чистой форме, то есть когда на фактическую уходящую группу не влияют условия реакции (путем протонирования или комплексообразования с кислотой Льюиса), и уход уходящей группы происходит со скоростью, определяющей скорость реакции. шаг. В ситуации, когда другие переменные остаются постоянными (природа алкил-электрофила, растворителя и т. д.), смена нуклеофила может привести к изменению порядка реакционной способности уходящих групп. В приведенном ниже случае тозилат является лучшей уходящей группой, когда нуклеофилом является этоксид, но йодид и даже бромид становятся лучшими уходящими группами в случае тиолатного нуклеофила. [7]
| Выход из группы (X) | 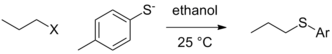 |  |
|---|---|---|
| кл. | 0.0074 | 0,0024 (при 40 °С) |
| Бр | 1 | 1 |
| я | 3.5 | 1.9 |
| ОТ | 0.44 | 3.6 |
Активация
[ редактировать ]обычно E1 и SN1 кислотой В реакциях бедная уходящая группа превращается в хорошую путем протонирования или комплексообразования с Льюиса . Таким образом, именно путем протонирования перед уходом молекула может формально потерять такие плохо уходящие группы, как гидроксид.
Тот же принцип действует и в реакции Фриделя-Крафтса . Здесь необходима сильная кислота Льюиса для образования либо карбокатиона из алкилгалогенида в реакции алкилирования Фриделя-Крафтса, либо иона ацилия из ацилгалогенида.

В подавляющем большинстве случаев реакции, включающие активацию уходящей группы, генерируют катион на отдельной стадии перед нуклеофильной атакой или элиминированием. Например, реакции SN 1 и E1 могут включать стадию активации, тогда как реакции SN 2 и E2 обычно этого не делают.
При исключении сопряженных оснований
[ редактировать ]Требование к хорошей уходящей группе ослабляется в реакциях отщепления сопряженных оснований. Эти реакции включают потерю уходящей группы в β-положении енолята, а также регенерацию карбонильной группы из тетраэдрического промежуточного соединения при нуклеофильном ацильном замещении. В принудительных условиях даже амиды могут подвергнуться основному гидролизу - процессу, который включает в себя изгнание крайне бедной уходящей группы R 2 N. − . Еще более драматично то, что декарбоксилирование бензоат-анионов может происходить при нагревании с медью или Cu 2 O, что приводит к потере арильного аниона. Этой реакции способствует тот факт, что уходящая группа, скорее всего, представляет собой соединение арилмеди, а не гораздо более основную соль щелочного металла.
Это резкое отклонение от обычных требований к уходящей группе происходит в основном в сфере образования двойной связи C=O, где образование очень прочной двойной связи C=O может вызвать неблагоприятные реакции. Требование к хорошей уходящей группе все еще ослаблено в случае образования связи C=C посредством механизмов E1cB, но из-за относительной слабости двойной связи C=C реакция все еще проявляет некоторую чувствительность к уходящей группе. Примечательно, что изменение идентичности уходящей группы (и готовности уйти) может изменить природу механизма реакций элиминации. При плохих уходящих группах предпочтение отдается механизму E1cB, но по мере изменения способности уходящей группы скорость реакции смещается от скорости, определяющей потерю уходящей группы из карбанионного промежуточного соединения B через TS BC. ‡ за счет наличия этапа депротонирования, определяющего скорость, через TS AB ‡ (без изображения) к согласованному устранению E2. В последней ситуации уходящая группа X стала достаточно хорошей, так что первое переходное состояние, соединяющее промежуточные соединения B и C, стало более низким по энергии, чем B , который больше не является стационарной точкой на поверхности потенциальной энергии реакции. Поскольку только одно переходное состояние соединяет исходный материал A и продукт C , реакция теперь согласована (хотя и очень асинхронна в изображенном случае) из-за увеличения способности X к уходящей группе.


«Супер» и «гипер» покидающие группы
[ редактировать ]Прототипом суперуходящей группы является трифлат , и этот термин стал обозначать любую уходящую группу с сопоставимыми способностями. Соединения, в которых потеря суперуходящей группы может привести к образованию стабильного карбокатиона, обычно очень реакционноспособны и нестабильны. Таким образом, наиболее часто встречающимися органическими трифлатами являются метилтрифлат и алкенил- или арилтрифлаты, все из которых не могут образовывать стабильные карбокатионы при ионизации, что делает их относительно стабильными. Отмечено, что стероидные алкилнонафлаты ( еще одна суперуходящая группа), образующиеся из спиртов и перфторбутансульфонилфторида, не поддаются выделению как таковые, а сразу образуют продукты либо отщепления , либо замещения фторидом , генерируемым реагентом. Смешанные ацил-трифторметансульфонилангидриды плавно подвергаются ацилированию по Фриделю-Крафтсу без катализатора. [8] в отличие от соответствующих ацилгалогенидов, для которых требуется сильная кислота Льюиса. Однако метилтрифлат не участвует в реакциях алкилирования Фриделя-Крафтса электронно-нейтральными ароматическими кольцами.
Помимо суперуходящих групп по реактивности лежат «гипер» уходящие группы. Среди них наиболее заметными являются λ 3 -йоданы , к которым относятся соли диарилйодония, и другие ионы галония . В одном исследовании было проведено количественное сравнение этих и других выезжающих групп. По отношению к хлориду (k отн = 1) реакционная способность возрастала в ряду бромид (k отн = 14), иодид (k отн = 91), тозилат (k отн = 3,7 × 10 4 ), трифлат (k отн = 1,4 × 10 8 ), тетрафторборат фенилиодония ( доктор философии + БФ − 4 , k отн = 1,2 × 10 14 ). Наряду с критерием того, что гиперуходящая группа является более сильной уходящей группой, чем трифлат, существует необходимость того, чтобы уходящая группа подверглась редукционному элиминированию. В случае ионов галония это включает восстановление трехвалентного галония до одновалентного галогенида в сочетании с высвобождением анионного фрагмента. Исключительную реакционную способность соединений гиперуходящих групп отчасти приписывают энтропийной выгоде расщепления одной молекулы на три.

Ионы диалкилгалония также были выделены и охарактеризованы по простым алкильным группам. Эти соединения, несмотря на их чрезвычайную реакционную способность по отношению к нуклеофилам, могут быть получены в чистом виде в твердом состоянии с очень слабонуклеофильными противоионами, такими как СбФ − 6 [9] [10] и CHB 11 Cl - 11 . [11] Сильно электрофильная природа этих соединений обусловлена их присоединением к чрезвычайно лабильным Уходящие группы R-X (R = алкил, X = Cl, Br, I) иллюстрируются их склонностью к алкилированию очень слабых нуклеофилов. Нагревание чистых образцов (СН 3 ) 2 Cl + [CHB 11 Cl 11 ] − при пониженном давлении приводило к метилированию очень плохо нуклеофильного карборан-аниона с одновременным вытеснением CH 3 Cl Уходящая группа . Соли гексафторантимоната диалкилгалония алкилируют избыток алкилгалогенидов с образованием продуктов обмена. Их сильно электрофильная природа, наряду с нестабильностью первичных карбокатионов, образующихся в результате ионизации их алкильных групп, указывает на их возможное участие в химии алкилирования Фриделя-Крафтса. [9] Порядок возрастания лабильности этих уходящих групп следующий: R-I < R-Br < R-Cl .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б «Уходящая группа» (PDF) . Золотая книга: уход из группы . ИЮПАК. 2009. doi : 10.1351/goldbook.L03493 . ISBN 978-0-9678550-9-7 .
- ^ Например, уходящие группы определяются таким образом в книге «Органическая химия: структура и функции» (8-е изд.) П. Воллхардта и Н. Шора (стр. 231).
- ^ Вайс, Роберт; Энгель, Стефан (февраль 1992 г.). «Электростатическая активация нуклеофуг: катионные уходящие группы» . Angewandte Chemie International Edition на английском языке . 31 (2): 216–217. дои : 10.1002/anie.199202161 . ISSN 0570-0833 .
- ^ «Золотая книга: электрофуга» (PDF) . ИЮПАК. Архивировано из оригинала (PDF) 7 ноября 2017 г. Проверено 10 июня 2017 г.
- ^ Смит, март. Продвинутая органическая химия 6-е изд. (501-502)
- ^ Браун, Герберт С.; Ганс Юнгк (1955). «Реакция бензола и толуола с бромистым метилом и иодидом в присутствии бромида алюминия; доказательства механизма замещения при метилировании ароматических соединений1,2». Журнал Американского химического общества . 1955, 77 (21): 5584–5589. дои : 10.1021/ja01626a039 . ISSN 0002-7863 .
- ^ Хоффманн, HMR (1965). «1252. Скорость смещения толуол-п-сульфоната относительно бромид-иона. Новый механистический критерий». Журнал Химического общества (возобновленное) . 1965 : 6753–6761. дои : 10.1039/JR9650006753 . ISSN 0368-1769 .
- ^ Мартинес, А. Гарсия; А. Эррера Фернандес; Д. Молеро Вилчес; МЛ Лаорден Гутьеррес; Л. Р. Субраманиан (1993). «Новый простой одноэтапный синтез производных изохинолина из замещенных фенилуксусных эфиров». Синлетт . 1993 (3): 229–230. дои : 10.1055/s-1993-22413 . ISSN 0936-5214 .
- ^ Перейти обратно: а б Джордж А. Ола ; Джон Р. ДеМембер (1969). «Химия Фриделя-Крафтса. IV. Ионы диалкилгалония и их возможная роль в реакциях Фриделя-Крафтса». Журнал Американского химического общества . 1969, 91 (8): 2113–2115. дои : 10.1021/ja01036a044 . ISSN 0002-7863 .
- ^ Ола, Джордж А.; Джон Р. ДеМембер (1970). «Химия Фриделя-Крафтса. V. Выделение, ядерный магнитный резонанс углерода-13 и лазерное рамановское спектроскопическое исследование фторантимонатов диметилгалония». Журнал Американского химического общества . 1970, 92 (3): 718–720. дои : 10.1021/ja00706a058 . ISSN 0002-7863 .
- ^ Стоянов Евгений С.; Стоянова Ирина Владимировна; Фук С. Тэм; Кристофер А. Рид (2010). «Ионы диалкилхлорония». Журнал Американского химического общества . 132 (12): 4062–4063. дои : 10.1021/ja100297b . ISSN 0002-7863 . ПМИД 20218556 . S2CID 207048412 .