Перфторбутансульфонилфторид

| |
| Имена | |
|---|---|
| Предпочтительное название ИЮПАК
1,1,2,2,3,3,4,4,4-нонафторбутан-1-сульфонилфторид | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| Сокращения | НфФ |
| ХимическийПаук | |
| Информационная карта ECHA | 100.006.175 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 4 Ж 10 О 2 С | |
| Молярная масса | 302.09 g/mol |
| Плотность | 1,682 г/мл [ 1 ] |
| Температура плавления | < -120 ° C (-184 ° F; 153 К) |
| Точка кипения | От 65 до 66 ° C (от 149 до 151 ° F; от 338 до 339 К) [ 2 ] |
| Родственные соединения | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Перфторбутансульфонилфторид (нонафторбутансульфонилфторид, NfF) представляет собой бесцветную летучую жидкость, несмешивающуюся с водой, но растворимую в обычных органических растворителях. Его получают электрохимическим фторированием сульфолана . NfF служит точкой входа для нонафторбутансульфонатов ( нонафлатов ), которые ценны в качестве электрофилов в палладием катализируемых реакциях перекрестного сочетания, . В качестве перфторалкилсульфонилирующего агента NfF обладает преимуществами более низкой стоимости и большей стабильности по сравнению с более часто используемым трифликовым ангидридом . Уходящая группа фторида амины легко заменяется нуклеофилами, такими как , феноксиды и еноляты , давая сульфонамиды, арилнонафлаты и алкенилнонафлаты соответственно. Однако он не подвергается воздействию воды (в которой он стабилен при pH <12). Гидролиз гидроксидом бария дает Ba(ONf) 2 , который при обработке серной кислотой дает перфторбутансульфоновую кислоту и нерастворимый сульфат бария .
Очистка
[ редактировать ]
Коммерчески доступный NfF загрязнен 6-10 моль % перфторсульфоланом, полученным при его производстве. Его легко удалить энергичным перемешиванием коммерческого материала с концентрированным водным раствором K 3 PO 4 и K 2 HPO 4 в молярном соотношении 1:1 в течение 96 часов. Эта обработка с последующим удалением водного слоя и перегонкой P 2 O 5 дает продукт, который содержит >99 мол.% NfF с почти количественным выходом. [ 3 ]
Синтез арил- и алкенилнонафлатов.
[ редактировать ]Как упоминалось выше, арил- и алкенил-нонафлаты полезны в качестве электрофилов в реакциях перекрестного сочетания, катализируемых палладием. Их реакционная способность обычно соответствует реакционной способности наиболее часто встречающихся трифлатных электрофилов, но нонафлаты менее склонны к гидролизу до кетонов (в случае алкенилсульфонатов) и фенолов (в случае арилсульфонатов). Их устойчивость к гидролизу делает нонафлаты превосходными электрофилами в соединениях Бухвальда-Хартвига, где эта побочная реакция может отрицательно влиять на выход желаемого продукта. [ 4 ]
Еноляты натрия β-кетоэфиров реагируют с 1,15 эквивалентами NfF с образованием соответствующих алкенилнонафлатов с высоким выходом. Этил-2-метилацетоацетат (R=R'=Me) этим методом дает геометрически чистый E-изомер. [ 5 ]
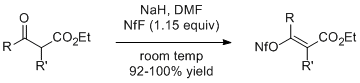
Простые альдегиды и кетоны реагируют с NfF в присутствии оснований, таких как DBU или фосфазены, с образованием алкенилнонафлатов с высокими выходами без образования дискретного енолята. Использование фосфазенового основания P 2 при температуре от -30 до -20°С дает менее замещенный алкенилнонафлат с несимметрично замещенными кетонами. [ 3 ] Подобные реакции с трифликовым ангидридом обычно требуют использования дорогого 2,6-ди- трет -бутилпиридина для достижения высоких выходов.
Реакция енолятов с NfF сильно зависит как от строения енолята, так и от его металлического противоиона. Еноляты лития метилкетонов дают смеси продуктов, полученных в результате электрофильной атаки на атомы O (ожидаемый) или C (неожиданный) енолята. Этот эффект особенно очевиден при использовании енолята лития пинаколона, который дает смесь 2:1, способствующую C-атаке. Более замещенные еноляты лития дают только продукты О-сульфонилирования с переменными выходами. [ 6 ]
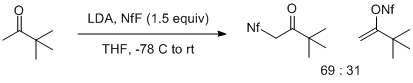
Эфиры триметилсилиланола реагируют с NfF в присутствии субстехиометрического источника фторида при температуре от 0 ° C до температуры окружающей среды с образованием алкенилнонафлатов с выходами от умеренных до хороших. высушенный фторид тетра -н -бутиламмония. В одном исследовании предпочтительным источником фторида был [ 6 ] но CsF использовался в сложных случаях с отличными результатами. [ 7 ]

Арилнонафлаты можно получить непосредственно из фенолов и NfF в присутствии таких оснований, как карбонат калия. [ 8 ] и Et 3 N [ 4 ] с близкими к количественным выходам. Более сильные основания, такие как NaH и BuLi. [ 9 ] также могут быть использованы, но они, как правило, дают несколько меньший выход.
Реакция со спиртами
[ редактировать ]Реакция NfF со спиртами подчеркивает лабильность алкилнонафлатов – в большинстве случаев конечным продуктом реакции является либо алкилфторид (из F − атака на промежуточный алкил нонафлат) или олефин (в результате удаления NfOH из промежуточного нонафлата). Недавно было обнаружено, что при реакции NfF со спиртами с образованием алкилнонафлата высвобождается F. - может быть использован для активации триметилсилил-связанных нуклеофилов in situ с получением нескольких дезокси-диверсифицированных продуктов. [ 10 ]
Синтез бис -нонафторбутансульфонимида (Nf 2 NH)
[ редактировать ]NfF реагирует с хлоридом аммония в присутствии триэтиламина в ацетонитриле с образованием триэтиламмониевой соли сверхкислотного бис -нонафторбутансульфонимида с выходом 97%. Соответствующую калиевую соль получают обработкой метанольного раствора триэтиламмониевой соли КОН . [ 11 ] Кислоту получают методом ионообменной хроматографии триэтиламмониевой соли с использованием Амберлита IR-100 в качестве неподвижной фазы и метанола в качестве элюента. [ 12 ] Фактическим веществом, полученным в последней процедуре, вероятно, является MeOH 2. + Нф 2 Н − .
Ссылки
[ редактировать ]- ^ «Перфтор-1-бутансульфонилфторид» . Проверено 22 июля 2012 г.
- ^ «1,1,2,2,3,3,4,4,4-нонафторбутан-1-сульфонилфторид» . Национальный институт стандартов и технологий . Проверено 22 июля 2012 г.
- ^ Jump up to: а б Фогель, Майкл АК; Кристиан Б.В. Старк; Илья Михайлович Ляпкало (2007). «Простой синтез алкенилнонафлатов из карбонильных соединений с использованием нонафторбутан-1-сульфонилфторида в сочетании с фосфазеновыми основаниями». Синлетт . 2007 (EFirst): 2907–2911. дои : 10.1055/s-2007-991084 . ISSN 0936-5214 .
- ^ Jump up to: а б Медоуз, Ребекка Э.; Саймон Вудворд (11 февраля 2008 г.). «Стерические эффекты при катализируемом палладием аминировании арилтрифлатов и нонафлатов первичными аминами PhCH (R) NH2 (R = H, Me)». Тетраэдр . 64 (7): 1218–1224. дои : 10.1016/j.tet.2007.11.074 . ISSN 0040-4020 .
- ^ Беллина, Фабио; Донателла Чиуччи; Ренцо Росси; Пьерджорджио Вергамини (12 февраля 1999 г.). «Синтез винил-нонафлатов, полученных из β-кетоэфиров, β-дикетонов или α-дикетонов, и их катализируемые палладием реакции кросс-сочетания с цинкорганическими галогенидами». Тетраэдр . 55 (7): 2103–2112. дои : 10.1016/S0040-4020(98)01221-6 . ISSN 0040-4020 .
- ^ Jump up to: а б Ляпкало Илья М.; Матиас Вебель; Ганс-Ульрих Райсиг (2002). «Целесообразное и стереоселективный синтез алкенилнонафлатов из эфиров силиленолов: оптимизация, область применения и ограничения». Европейский журнал органической химии . 2002 (6): 1015–1025. doi : 10.1002/1099-0690(200203)2002:6<1015::AID-EJOC1015>3.0.CO;2-K . ISSN 1099-0690 .
- ^ Брезе, Стефан (1999). «Синтез бис (енононафлатов) и их 4-экзо-триг-циклизаций с помощью внутримолекулярных реакций Хека». Синлетт . 1999 (10): 1654–1656. дои : 10.1055/с-1999-2892 . ISSN 0936-5214 .
- ^ Шекхар, Шашанк; Трэвис Б. Данн; Брайан Дж. Котекки; Донна К. Монтавон; Стивен С. Каллен (2011). «Общий метод катализируемых палладием реакций первичных сульфаниламидов с арилнонафлатами». Дж. Орг. Хим . 76 (11): 4552–4563. дои : 10.1021/jo200443u . ISSN 0022-3263 . ПМИД 21510695 .
- ^ Уэмура, Минору; Хидеки Ёримицу; Коитиро Осима (18 февраля 2008 г.). «Cp * Li в качестве основания: применение в катализируемой палладием реакции кросс-сочетания арил-X или алкенила-X (X = I, Br, OTf, ONf) с концевыми ацетиленами». Тетраэдр . 64 (8): 1829–1833. дои : 10.1016/j.tet.2007.11.095 . hdl : 2433/88969 . ISSN 0040-4020 .
- ^ Одо, Амаечи Шедрак; Киллер, Кортни; Ким, Бёнму (01 мая 2024 г.). «Прямая дезокси-диверсификация спиртов с помощью SuFEx» . Органические письма . 26 (18): 4013–4017. doi : 10.1021/acs.orglett.4c01016 . ISSN 1523-7060 .
- ^ Кек, сир Кианг; Илья Михайлович Ляпкало; Хан Винь Хюнь (27 марта 2006 г.). «Синтез и свойства бис(нонафторбутан-1-сульфонил)имидов N,N'-диалкилимидазолия: новое подсемейство ионных жидкостей». Тетраэдр . 62 (13): 3137–3145. дои : 10.1016/j.tet.2006.01.015 . ISSN 0040-4020 .
- ^ Хашми, А. Стивен К.; Тобиас Хенгст; Кристиан Лотшютц; Фрэнк Ромингер (2010). «Новые и легкодоступные азотные ациклические карбены золота (I): структура и применение в катализируемом золотом синтезе фенолов, а также гидратации алкинов». Расширенный синтез и катализ . 352 (8): 1315–1337. дои : 10.1002/adsc.201000126 . ISSN 1615-4169 .