Бис(ацетилацетонат) никеля(II)
| |

| |
| Имена | |
|---|---|
| Другие имена
Ni(acac) 2 , никель acac
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.019.887 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| C30H42Ni3OC30H42Ni3O12 | |
| Молярная масса | 770.734 g·mol −1 |
| Появление | темно-зеленый |
| Плотность | 1,455 г/см 3 |
| Температура плавления | 229,5 ° C (445,1 ° F; 502,6 К) (разлагается) |
| Н 2 О | |
| Опасности | |
| СГС Маркировка : | |
 
| |
| Опасность | |
| Х302 , Х317 , Х334 , Х350 | |
| P201 , P202 , P261 , P264 , P270 , P272 , P280 , P285 , P281 , P301+P312 , P302+P352 , P304+P341 , P308+P313 , P321 , P330 , P333+P313 , 42+П311 , П363 , П405 , P501 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
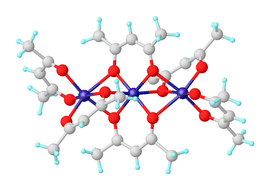
Бис(ацетилацетонат) никеля(II) представляет собой координационный комплекс формулы [Ni(acac) 2 ] 3 , где acac – анион C 5 H 7 O 2 . − получают в депротонирования ацетилацетона . результате Это темно-зеленое парамагнитное твердое вещество, растворимое в органических растворителях, таких как толуол . Он реагирует с водой с образованием сине-зеленого диакокомплекса Ni(acac) 2 (H 2 O) 2 . [1]
Структура и свойства
[ редактировать ]Безводный ацетилацетонат никеля(II) существует в виде молекул Ni 3 (acac) 6 . Три атома никеля расположены примерно коллинеарно, и каждая пара из них соединена двумя атомами кислорода μ 2 . Каждый атом никеля имеет тетрагонально искаженную октаэдрическую геометрию , вызванную разницей в длине связей Ni-O между мостиковыми и немостиковыми атомами кислорода. [2] Ni 3 (acac) 6 Молекулы почти центросимметричны , несмотря на нецентросимметричную точечную группу цис - Ni (acac) 2 «мономеров», что встречается редко. [3] Тримерная структура позволяет всем центрам никеля достичь октаэдрической координации. Тример образуется только в том случае, если происходит внутримолекулярное разделение кислородных центров между парами никелевых центров. Безводный комплекс обладает интересными магнитными свойствами . Примерно до 80 К он проявляет нормальный парамагнетизм с эффективным магнитным моментом 3,2 мкБ , что близко к только спиновому моменту, ожидаемому от ad. 8 ион с двумя неспаренными электронами. Эффективный момент возрастает до 4,1 мкБ при 4,3 К за счет ферромагнитных обменных взаимодействий с участием всех трех ионов никеля. [4]
При связывании с более объемными аналогами ацетилацетонатного лиганда стерические препятствия способствуют образованию мононикелевых производных. Такое поведение наблюдается для производного 3-метилацетилацетоната. [5]
дигидрат
[ редактировать ]
Как и в безводной форме, центры Ni(II) занимают октаэдрические координационные позиции. Координационную сферу обеспечивают два бидентатных ацетилацетонатных (acac) лиганда и два aquo-лиганда . Ni(acac) 2 (H 2 O) 2 существует в виде цис- и транс- изомеров . [6] Транс-изомеры наблюдаются также у Ni(acac) 2 ( пиридин-N-оксид ) 2 . [7] В транс-изомерах аксиальные связи Ni-O больше по длине (2,1000 Å), чем экваториальные связи Ni-O (2,0085 Å и 1,9961 Å). [8]

Синтез
[ редактировать ]Бис(2,4-пентандионато)никель(II) получают обработкой нитрата никеля ацетилацетоном в присутствии основания . Продукт представляет собой сине-зеленый диаквомплекс Ni(CH 3 COCHCOCH 3 ) 2 (H 2 O) 2 . [9]
- Ni(NO 3 ) 2 + 2 CH 3 COCH 2 COCH 3 + 2 H 2 O + 2 NaOH → Ni(CH 3 COCHCOCH 3 ) 2 (H 2 O) 2 + 2 NaNO 3
Этот комплекс можно обезвоживать с помощью ловушки Дина-Старка путем азеотропной перегонки : [9]
- 3 Ni(CH 3 COCHCOCH 3 ) 2 (H 2 O) 2 → [Ni(CH 3 COCHCOCH 3 ) 2 ] 3 + 6 H 2 O
При нагревании Ni(acac) 2 (H 2 O) 2 при 170–210 °С при пониженном давлении (0,2–0,4 мм рт. ст.) безводная форма сублимируется и вода удаляется. [3]
Реакции
[ редактировать ]Безводный комплекс реагирует с рядом оснований Льюиса с образованием мономерных аддуктов . [10] Показательной является реакция с тетраметилэтилендиамином (тмеда): [11]
- [Ni(CH 3 COCHCOCH 3 ) 2 ] 3 + 3 тмеда → 3 Ni(CH 3 COCHCOCH 3 ) 2 (тмеда)
Ni(acac) 2 (H 2 O) 2 быстро и с высоким выходом реагирует по метиновым положениям, образуя диамиды из изоцианатов. Связанные реакции происходят с диэтилазодикарбоксилатом и диметилацетилендикарбоксилатом :
- Ni(acac) 2 (H 2 O) 2 + 2 PhNCO → Ni(O 2 C 5 Me 2 C(O)NHPh) 2 + 2 H 2 O
Приложения
[ редактировать ]Безводный комплекс является предшественником катализаторов на основе никеля, таких как бис(циклооктадиен) никеля и тетраметилэтилендиамин(диметил)никель(II) . [12] [11]
acac) 2 ] 3 является предшественником для осаждения тонкой пленки NiO [Ni ( на проводящие стеклянные подложки с использованием золь-гель технологий. [10]

См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ ЖК Мехротра; Р. Бора; Д. П. Гаур (1978). Металлические β-дикетоны и родственные производные . Академическая пресса. ISBN 0124881505 .
- ^ Дж. Дж. Буллен, Р. Мейсон и П. Полинг (1961). «Октаэдрическая координация никеля в бисацетилацетоне никеля (II)». Природа . 189 (4761): 291–292. дои : 10.1038/189291a0 . S2CID 37394858 .
- ^ Jump up to: а б Дж. Дж. Буллен, Р. Мейсон и П. Полинг. (1965). «Кристалл и молекулярная структура бис (ацетилацетонато) никеля (II)». Неорганическая химия . 4 (4): 456–462. дои : 10.1021/ic50026a005 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 1157. ИСБН 978-0-08-037941-8 .
- ^ 1. А. Дёринг, Р. Годдард, П. В. Джолли, К. Крюгер, В. Р. Поляков, «Мономер-тримерная изомерия в 3-замещенных пентан-2,4-дионовых производных никеля (II)», Inorg. Химия 1997, 36, 177–183. два : 10.1021/ic960441c
- ^ М. Кудрат-Э-Захан, Ю. Нисида и Х. Сакияма (2010). «Идентификация цис/транс-изомеров комплексов бис(ацетилацетонато)никеля(II) в растворе на основе электронных спектров». Неорганическая химия Acta . 363 : 168–172. дои : 10.1016/j.ica.2009.09.011 .
- ^ Б.Н. Фиггис; М. А. Хитчман (2000). «Теория поля лигандов и ее применение».
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) - ^ О. Метин, Л.Т. Йылдирим и С. Озкар (2007). «Синтез, характеристика и кристаллическая структура бис (ацетилацетонато) диметанолникеля (II)». Неорганическая химия . 10 (9): 1121–1123. дои : 10.1016/j.inoche.2007.06.011 .
- ^ Jump up to: а б Виландт, JW; Рукербауэр, Д. (2010). Бис(1,5-циклооктадиен)никель(0) . Неорганические синтезы. Том. 35. с. 120. дои : 10.1002/9780470651568.ch6 .
- ^ Jump up to: а б Пол А. Уильямс; Энтони С. Джонс; Джейми Ф. Бикли; Александр Штайнер; Хиуэл О. Дэвис; Тимоти Дж. Лидэм; Сьюзан А. Импи; Джоан Гарсия; Стивен Аллен; Алин Ружье ; Александра Блир (2001). «Синтез и кристаллические структуры диметиламиноэтанольных аддуктов ацетата Ni (II) и ацетилацетоната Ni (II). Прекурсоры для золь-гель-осаждения тонких пленок электрохромного оксида никеля». Журнал химии материалов . 11 (9): 2329–2334. дои : 10.1039/b103288g .
- ^ Jump up to: а б Кашубе, Вильфрид; Пёршке, Клаус Р.; Вильке, Гюнтер (1988). «Тмеда-Никель-Комплекс». Журнал металлоорганической химии . 355 (1–3): 525–532. дои : 10.1016/0022-328X(88)89050-8 .
- ^ Гётткер-Шнетманн, Иниго; Мекинг, Стивен (2020). tmeda)Ni( CH3 ) 2 «Практический синтез изотопно-меченого ( 13 CH 3 ) 2 и нейтральные хелатно-никелевые метиловые комплексы». Organometallics . 39 (18): 3433–3440. doi : 10.1021/acs.organomet.0c00500 . S2CID 224930545 .
- ^ Шреста, Ружа; Дорн, Стефани CM; Вейкс, Дэниел Дж. (16 января 2013 г.). «Восстановительное конъюгатное присоединение к енонам, катализируемое никелем, через промежуточные аллилникелевые соединения» . Журнал Американского химического общества . 135 (2): 751–762. дои : 10.1021/ja309176h . ПМЦ 3547151 . ПМИД 23270480 .