Нитрат никеля(II)
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Нитрат никеля(II) | |
| Другие имена Нитрат никеля Нитрат никеля Азотная кислота, соль никеля(2+) | |
| Идентификаторы | |
| |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.032.774 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
| Число | 2725 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Ni( NO3 ) 2 | |
| Молярная масса | 182,703 г/моль (безводный) 290,79 г/моль (гексагидрат) |
| Появление | изумрудно-зеленое гигроскопичное твердое вещество |
| Запах | без запаха |
| Плотность | 2,05 г/см 3 (гексагидрат) |
| Температура плавления | 56,7 ° C (134,1 ° F; 329,8 К) (гексагидрат) |
| Точка кипения | 120–145 ° C (248–293 ° F; 393–418 К) (гексагидрат, разлагается до основного нитрата никеля) [1] |
| 243 (гексагидрат) г/100 мл (0 °C) [2] | |
| Растворимость | растворим в этаноле |
| +4300.0·10 −6 см 3 /моль (+6 H 2 O) | |
Показатель преломления ( n D ) | 1,422 (гексагидрат) |
| Структура | |
| моноклинный (гексагидрат) | |
| Опасности | |
| СГС Маркировка : | |
     | |
| Опасность | |
| H272 , H302 , H315 , H317 , H318 , H332 , H334 , H341 , H350 , H360 , H372 , H410 | |
| P201 , P202 , P210 , P220 , P221 , P260 , P261 , P264 , P270 , P271 , P272 , P273 , P280 , P281 , P285 , P301+P312 , P302+P352 , P304+P312 , П304+П340 , П304+П341 , P305+P351+P338 , P308+P313 , P310 , P312 , P314 , P321 , P330 , P332+P313 , P333+P313 , P342+P311 , P362 , P363 , P370+P378 , P391 , P405 , P501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Невоспламеняющийся |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 1620 мг/кг (перорально, крыса) |
| Паспорт безопасности (SDS) | Внешний паспорт безопасности материалов |
| Родственные соединения | |
Другие анионы | Сульфат никеля(II) Хлорид никеля(II) |
Другие катионы | Нитрат палладия(II) |
Родственные соединения | Нитрат кобальта(II) Нитрат меди(II) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Нитрат никеля представляет собой неорганическое соединение Ni(NO 3 ) 2 или любой его гидрат . В гексагидрате нитрат -анионы не связаны с никелем. Сообщалось также о других гидратах: Ni(NO 3 ) 2 . 9H 2 O, Ni(NO 3 ) 2 . 4H 2 O и Ni(NO 3 ) 2 . 2Н 2 О. [3]
Его получают реакцией оксида никеля с азотной кислотой:
- NiO + 2 HNO 3 + 5 H 2 O → Ni(NO 3 ) 2 . 6Н 2 О
Безводный нитрат никеля обычно не получают нагреванием гидратов. Скорее, он образуется в результате реакции гидратов с пятиокисью азота или карбонила никеля с четырехокисью азота : [3]
- Ni(CO) 4 + 2 N 2 O 4 → Ni(NO 3 ) 2 + 2 NO + 4 CO
Гидратированный нитрат часто используется в качестве предшественника нанесенных никелевых катализаторов. [3]
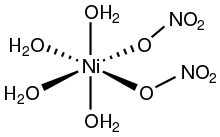
Структура
[ редактировать ]Соединения никеля(II) с кислородсодержащими лигандами часто имеют октаэдрическую координационную геометрию. Две полиморфные модификации тетрагидрата Ni(NO 3 ) 2 . 4H 2 O кристаллизовались. В одном монодентатные нитратные лиганды являются транс [4] в то время как в другом они цис. [5]
Реакции и использование
[ редактировать ]Нитрат никеля (II) в основном используется при гальванотипировании и гальванике металлического никеля.
В гетерогенном катализе нитрат никеля (II) используется для пропитки оксида алюминия . Пиролиз полученного материала дает формы никеля Ренея и никеля Урусибара . [6] В гомогенном катализе гексагидрат является предкатализатором реакций кросс-сочетания . [7]
Ссылки
[ редактировать ]- ^ Питч, ЭХЕ (1966). Справочник Гмелина по неорганической химии, никель, часть B 2 (на немецком языке) (8-е изд.). Вайнхайм/Бергстр.: Verlag Chemie GmbH. п. 509.
- ^ Справочник Перри по химии, 7-е изд.
- ^ Перейти обратно: а б с Ласселлес, Кейт; Морган, Линдси Г.; Николлс, Дэвид; Байерсманн, Детмар (2005). «Соединения никеля». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a17_235.pub2 . ISBN 3527306730 .
- ^ Моросин Б.; Хаседа, Т. (1979). «Кристаллическая структура β-формы Ni(NO 3 ) 2 . 4H 2 O". Acta Crystallographica Раздел B: Структурная кристаллография и кристаллохимия . 35 (12): 2856–2858. doi : 10.1107/S0567740879010827 .
- ^ Галлезот, П.; Вейгель, Д.; Преттр, М. (1967). «Структура нитрата тетрагидрата никеля» . Акта Кристаллографика . 22 (5): 699–705. Бибкод : 1967AcCry..22..699G . дои : 10.1107/S0365110X67001392 .
- ^ Сарко, Кристофер Р.; Димаре, Марчелло; Юс, Майкл; Алонсо, Франциско (2014). «Никелевые катализаторы (гетерогенные)». Энциклопедия реагентов для органического синтеза . стр. 1–8. дои : 10.1002/047084289X.rn011.pub2 . ISBN 978-0-470-84289-8 .
- ^ Сяо, Ю-Лань; Чжан, Синган (2017). «Гексагидрат нитрата никеля (II)». Энциклопедия реагентов для органического синтеза . стр. 1–3. дои : 10.1002/047084289X.rn02013 . ISBN 978-0-470-84289-8 .
