Нитрат кобальта(II)
 | |
| Имена | |
|---|---|
| Другие имена Нитрат кобальта Азотная кислота, соль кобальта(2+) | |
| Идентификаторы | |
| |
3D model ( JSmol ) | |
| КЭБ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.030.353 |
| Номер ЕС |
|
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 1477 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| Co(NO 3 ) 2 (H 2 O) 6 | |
| Молярная масса | 291,03 г/моль (гексагидрат) 182,943 г/моль (безводный) |
| Появление | бледно-красный порошок (безводный) красный кристаллический (гексагидрат) |
| Запах | без запаха |
| Плотность | 1,87 г/см 3 (гексагидрат) 2,49 г/см 3 (безводный) |
| Температура плавления | 100 ° C (212 ° F; 373 К) разлагается (безводный) 55 °С (гексагидрат) |
| Точка кипения | От 100 до 105 ° C (от 212 до 221 ° F; от 373 до 378 К) разлагается (безводный) [ нужна ссылка ] 74 °C, разлагается (гексагидрат) |
| безводный: [1] 84,03 г/100 мл (0 °С) 334,9 г/100 мл (90 °С) растворимый (безводный) | |
| Растворимость | растворим в спирте , ацетоне , этаноле , аммиаке (гексагидрате), метаноле 2,1 г/100 мл. |
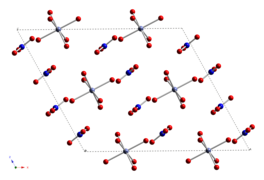
| Структура | |
| моноклинный (гексагидрат) | |
| Опасности | |
| СГС Маркировка : | |
  | |
| Опасность | |
| Х317 , Х334 , Х341 , Х350 , Х360 , Х410 | |
| P201 , P202 , P261 , P272 , P273 , P280 , P281 , P285 , P302+P352 , P304+P341 , P308+P313 , P321 , P333+P313 , P342+P311 , P363 , P391 , 05 , P501 | |
| NFPA 704 (огненный алмаз) | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 434 мг/кг; крыса, перорально (безводный) 691 мг/кг; крыса, перорально (гексагидрат) |
| Паспорт безопасности (SDS) | Паспорт безопасности нитрата кобальта (II) |
| Родственные соединения | |
Другие анионы | Сульфат кобальта(II) Хлорид кобальта(II) оксалат кобальта |
Другие катионы | Нитрат железа(III) Нитрат никеля(II) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Нитрат кобальта — неорганическое соединение формулы Co (NO 3 ) 2 . xH 2 O. Это кобальта (II) соль . Наиболее распространенной формой является гексагидрат Co(NO 3 ) 2 ·6H 2 O, который представляет собой красно-коричневую расплывающуюся соль, растворимую в воде и других полярных растворителях. [2]
Состав и структуры
[ редактировать ]Помимо безводного соединения Co(NO 3 ) 2 существует несколько гидратов нитрата кобальта(II). Эти гидраты имеют химическую формулу Co(NO 3 ) 2 · n H 2 O, где n = 0, 2, 4, 6.
Безводный нитрат кобальта (II) имеет трехмерную полимерную сетчатую структуру, в которой каждый атом кобальта (II) примерно октаэдрически координирован шестью атомами кислорода, каждый из которых принадлежит разному нитрат-иону. Каждый нитрат-ион координирует три кобальта. [3] Дигидрат представляет собой двумерный полимер с нитратными мостиками между центрами Co(II) и водородными связями, удерживающими слои вместе. [4] Тетрагидрат состоит из дискретных октаэдрических молекул [(H 2 O) 4 Co(NO 3 ) 2 ]. Гексагидрат лучше описать как нитрат гексааквакобальта(II), [Co(OH 2 ) 6 ][NO 3 ] 2 , поскольку он состоит из дискретных [Co(OH 2 ) 6 ] 2+ и [НЕТ 3 ] − ионы. [5] При температуре выше 55 °C гексагидрат превращается в тригидрат, а при более высоких температурах — в моногидрат. [2]
- Со(NO 3 ) 2
- Co(NO 3 ) 2 2H 2 O
- Со(NO 3 ) 2 4H 2 O
- Со(NO 3 ) 2 6H 2 O
Использование и реакции
[ редактировать ]Обычно его восстанавливают до металлического кобальта высокой чистоты. [2] Его можно абсорбировать на различных носителях катализаторов для использования в катализе Фишера-Тропша . [6] Его используют при приготовлении красителей и чернил. [7]
Нитрат кобальта(II) является распространенным исходным материалом для получения координационных комплексов, таких как кобалоксимы . [8] карбонаттетраамминкобальт(III), [9] и другие. [10]
Производство
[ редактировать ]Гексагидрат получают обработкой металлического кобальта или одного из его оксидов, гидроксидов или карбоната азотной кислотой :
- Co + 4 HNO 3 + 4 H 2 O → Co(H 2 O) 6 (NO 3 ) 2 + 2 NO 2
- CoO + 2 HNO 3 + 5 H 2 O → Co(H 2 O) 6 (NO 3 ) 2
- CoCO 3 + 2 HNO 3 + 5 H 2 O → Co(H 2 O) 6 (NO 3 ) 2 + CO 2
Ссылки
[ редактировать ]- ^ Справочник Перриса по химии, 7-е изд.
- ^ Перейти обратно: а б с Джон Даллас Дональдсон, Детмар Бейерсманн, «Кобальт и соединения кобальта» в Энциклопедии промышленной химии Ульмана, Wiley-VCH, Вайнхайм, 2005. два : 10.1002/14356007.a07_281.pub2
- ^ Тихомиров Г.А.; Знаменков, КО; Морозов, ИВ; Кемниц, Э.; Троянов, С.И. (2002). «Безводные нитраты и нитратометаллаты нитрозония марганца и кобальта, M(NO 3 ) 2 , NO[Mn(NO 3 ) 3 ] и (NO) 2 [Co(NO 3 ) 4 ]: синтез и кристаллическая структура» . З. аорган. аллг. хим. 628 (1): 269–273. doi : 10.1002/1521-3749(200201)628:1<269::AID-ZAAC269>3.0.CO;2-P .
- ^ Рибар, Б.; Милинский, Н.; Херак, Р.; Крстанович И.; Джурич, С. (1976). «Кристаллическая структура дигидрата нитрата кобальта, Co(NO 3 ) 2 ·2H 2 O». Zeitschrift für Kristallographie . 144 (1–6): 133–138. Бибкод : 1976ZK....144..133R . дои : 10.1524/zkri.1976.144.1-6.133 .
- ^ Прелесник, П.В.; Габела, Ф.; Рибар, Б.; Крстанович, И. (1973). «Нитрат гексааквакобальта(II)». Крист. Структура. Коммун . 2 (4): 581–583.
- ^ Эрнст Б., Либс С., Шометт П., Киннеманн А. Appl. Катал. А 186 (1-2): 145-168 1999 г.
- ^ Льюис, Ричард Дж. Старший (2002). Сокращенный химический словарь Хоули (14-е издание). Джон Уайли и сыновья. http://www.knovel.com/knovel2/Toc.jsp?BookID=704&VerticalID=0
- ^ Шрауцер, Г.Н. (1968). Комплексы бис(диметилглиоксимато)кобальта: («кобалоксимы») . Неорганические синтезы. стр. 61–70. дои : 10.1002/9780470132425.ch12 . ISBN 9780470132425 .
- ^ Шлезингер, Г. (1960). «Нитрат карбонатотетрамминкобальта(III)». Неорганические синтезы . 6 : 173–175. дои : 10.1002/9780470132371.ch55 . ISBN 9780470132371 .
- ^ Харгенс, Роберт Д.; Мин, Вунза; Хенни, Роберт С. (1973). «Бис(этилендиамин)сульфитокомплексы кобальта (III)». Неорганические синтезы . Неорганические синтезы. стр. 77–81. дои : 10.1002/9780470132456.ch15 . ISBN 9780470132456 .