Нитрат свинца(II)
 | |||
| |||
| Идентификаторы | |||
|---|---|---|---|
3D model ( JSmol ) | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.030.210 | ||
| Номер ЕС |
| ||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 1469 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| Pb(NO 3 ) 2 | |||
| Молярная масса | 331.2 g/mol | ||
| Появление | бесцветный или белый | ||
| Плотность | 4,53 г/см 3 | ||
| Температура плавления | 470 ° С (878 ° F; 743 К) [2] разлагается | ||
| 376,5 г/л (0 °С) 597 г/л (25°С) 1270 г/л (100°С) | |||
| −74·10 −6 см 3 /моль [1] | |||
Показатель преломления ( n D ) | 1.782 [2] | ||
| Термохимия | |||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | −451,9 кДж·моль −1 [1] | ||
| Опасности | |||
| СГС Маркировка : [4] | |||
    | |||
| Опасность | |||
| Х302 , Х317 , Х318 , Х332 , Х360 , Х373 , Х410 | |||
| P201 , P202 , P210 , P220 , P221 , P260 , P261 , P264 , P270 , P271 , P272 , P273 , P280 , P281 , P301+P312 , P302+P352 , P304+P312 , P304+P 340 , П305+П351+П338 , P308+P313 , P310 , P312 , P314 , P321 , P330 , P333+P313 , P363 , P370+P378 , P391 , P405 , P501 | |||
| NFPA 704 (огненный алмаз) | |||
| Летальная доза или концентрация (LD, LC): | |||
LD Lo ( самый низкий опубликованный ) | 500 мг/кг (морская свинка, перорально) [3] | ||
| Паспорт безопасности (SDS) | КМГС 1000 | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Нитрат свинца(II) — неорганическое соединение с химической формулой Pb ( NO 3 ) 2 . Обычно он представляет собой бесцветные кристаллы или белый порошок и, в отличие от большинства других солей свинца (II) , растворим в воде .
известный со времен средневековья под названием Plumbum Dulce Нитрат свинца (II), из металлического свинца или оксида свинца в азотной кислоте , производился в небольших масштабах для непосредственного использования при производстве других соединений свинца . В девятнадцатом веке нитрат свинца(II) начал коммерчески производиться в Европе и США. Исторически основное применение было в качестве сырья при производстве пигментов для красок , но такие краски были вытеснены менее токсичными красками на основе диоксида титана . Другие промышленные применения включали термостабилизацию нейлона и а также полиэфиров , в покрытиях фототермографической бумаги. Примерно с 2000 года нитрат свинца(II) начал использоваться для цианирования золота .
Нитрат свинца(II) токсичен , и с ним следует обращаться осторожно, чтобы не допустить вдыхания, проглатывания и контакта с кожей. Из-за его опасного характера ограниченное применение нитрата свинца (II) находится под постоянным вниманием.
История
[ редактировать ]Нитрат свинца был впервые идентифицирован в 1597 году алхимиком Андреасом Либавиусом , который из-за его вкуса назвал это вещество Plumbum Dulce , что означает «сладкий свинец». [5] Его производят в промышленных масштабах путем реакции металлического свинца с концентрированной азотной кислотой , в которой он мало растворим. [6] [7] Его производят в качестве сырья для изготовления таких пигментов, как хромовый желтый (хромат свинца (II), PbCrO 4 ) и хромовый оранжевый (основной хромат свинца (II), Pb 2 CrO 5 ) и неаполитанский желтый . Эти пигменты использовались для крашения и печати ситца и других тканей. [8] Его использовали в качестве окислителя в дымном порохе и вместе с азидом свинца в специальных взрывчатых веществах . [9]
Производство
[ редактировать ]Нитрат свинца получают реакцией оксида свинца(II) с концентрированной азотной кислотой: [10]
- PbO + 2 HNO 3 (концентрированный) → Pb(NO 3 ) 2 ↓ + H 2 O
Его можно также получить упариванием раствора, полученного при взаимодействии металлического свинца с разбавленной азотной кислотой . [11]
- Pb + 4 HNO 3 → Pb(NO 3 ) 2 + 2 NO 2 + 2 H 2 O
Растворы и кристаллы нитрата свинца(II) образуются при переработке свинцово- висмутовых отходов свинцовых заводов. [12]
Структура
[ редактировать ]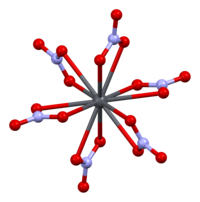

II ) установлена кристаллическая структура твердого нитрата свинца( Методом нейтронографии . [13] [14] Соединение кристаллизуется в кубической системе с атомами свинца в гранецентрированной кубической системе. Его пространственная группа — Pa3 Z=4 ( обозначение решетки Браве ), каждая сторона куба имеет длину 784 пикометра .
Черные точки представляют атомы свинца, белые точки — группы нитратов на 27 пикометров выше плоскости атомов свинца, а синие точки — группы нитратов на таком же расстоянии ниже этой плоскости. В этой конфигурации каждый атом свинца связан с двенадцатью атомами кислорода ( длина связи : 281 пм). Все связи N–O имеют одинаковую длину и составляют 127 пикометров. [15]
Исследовательский интерес к кристаллической структуре нитрата свинца(II) частично был основан на возможности свободного внутреннего вращения нитратных групп внутри кристаллической решетки при повышенных температурах, но это не осуществилось. [14]
Химические свойства и реакции
[ редактировать ]Графики недоступны по техническим причинам. Дополнительную информацию можно найти на Phabricator и на MediaWiki.org . |
Нитрат свинца разлагается при нагревании, это свойство использовалось в пиротехнике . [9] Он растворим в воде и разбавленной азотной кислоте.
Основные нитраты образуются при добавлении к раствору щелочи. Pb 2 (OH) 2 (NO 3 ) 2 является преобладающей разновидностью, образующейся при низких значениях pH. При более высоких значениях pH Pb 6 (OH) 5 (NO 3 ). образуется [17] Катион [Pb 6 O(OH) 6 ] 4+ необычно наличие оксидного иона внутри кластера из трех PbO 4 , имеющих общие грани. тетраэдров [18] Нет никаких доказательств образования гидроксида Pb(OH) 2 в водном растворе с pH ниже 12.
Растворы нитрата свинца можно использовать для образования координационных комплексов. Свинец(II) является жестким акцептором ; он образует более прочные комплексы с азота и кислорода электронодонорными лигандами . Например, объединение нитрата свинца и пентаэтиленгликоля (ЭО 5 ) в растворе ацетонитрила и метанола с последующим медленным испарением привело к образованию соединения [Pb(NO 3 ) 2 (ЭО 5 )]. [19] В кристаллической структуре этого соединения цепь ЭО 5 обернута вокруг иона свинца в экваториальной плоскости, аналогичной плоскости краун-эфира . Два бидентатных нитратных лиганда находятся в транс-конфигурации . Общее координационное число равно 10, при этом ион свинца имеет двуглавой квадратной антипризмы молекулярную геометрию .
Комплекс нитрата свинца с бидентатным N-донорным лигандом битиазола является биядерным. Кристаллическая структура показывает, что нитратная группа образует мостик между двумя атомами свинца. [20] Интересным аспектом комплексов этого типа является наличие физического разрыва в координационной сфере ; т.е. лиганды расположены несимметрично вокруг иона металла. Потенциально это связано с наличием неподеленной пары электронов свинца, которая также обнаруживается в комплексах свинца с имидазольным лигандом. [21]
Приложения
[ редактировать ]Нитрат свинца использовался в качестве термостабилизатора в нейлоне и полиэфирах, в качестве покрытия для фототермографической бумаги и в родентицидах . [10]
Нагревание нитрата свинца — удобный способ получения диоксида азота.
В процессе цианирования золота добавление раствора нитрата свинца(II) улучшает процесс выщелачивания . Требуются лишь ограниченные количества (от 10 до 100 миллиграммов нитрата свинца на килограмм золота). [22] [23]
В органической химии его можно использовать при получении изотиоцианатов из дитиокарбаматов . [24] его использовании в качестве поглотителя бромидов во время замещения S N 1 . Сообщалось о [25]
Безопасность
[ редактировать ]Нитрат свинца(II) токсичен, и его проглатывание может привести к острому отравлению свинцом, как и все растворимые соединения свинца. [26] Все неорганические соединения свинца классифицируются Международным агентством по изучению рака (МАИР) как вероятно канцерогенные для человека (Категория 2А). [27] Их связывают с раком почек и глиомой у экспериментальных животных, а также с раком почки, раком мозга и раком легких у людей, хотя исследования рабочих, подвергшихся воздействию свинца, часто осложняются одновременным воздействием мышьяка . [28] Известно, что свинец заменяет цинк в ряде ферментов , включая дегидратазу δ-аминолевулиновой кислоты (порфобилиногенсинтаза) в пути биосинтеза гема и пиримидин-5'-нуклеотидазу , важную для правильного метаболизма ДНК и, следовательно, может вызвать повреждение плода. [29]
Ссылки
[ редактировать ]- ^ Jump up to: а б CRC справочник по химии и физике: готовый справочник химических и физических данных . Уильям М. Хейнс, Дэвид Р. Лид, Томас Дж. Бруно (2016–2017, 97-е изд.). Бока-Ратон, Флорида. 2016. ISBN 978-1-4987-5428-6 . OCLC 930681942 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) CS1 maint: другие ( ссылка ) - ^ Jump up to: а б Патнаик, Прадьот (2003). Справочник неорганических химикатов . Нью-Йорк: МакГроу-Хилл. п. 475. ИСБН 0-07-049439-8 . OCLC 50252041 .
- ^ «Соединения свинца (как Pb)» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Свинцовая селитра» . pubchem.ncbi.nlm.nih.gov . Проверено 19 декабря 2021 г.
- ^ Либавиус, Андреас (1595). Алхимия Андрея Либавиуса Франкфурт: Джон Сауриус.
- ^ Чисхолм, Хью , изд. (1911). . Британская энциклопедия . Том. 16 (11-е изд.). Издательство Кембриджского университета. стр. 314–320.
- ^ Макгрегор, Джон (1847). Прогресс Америки к 1846 году . Лондон: ISBN Whittaker & Co. 0-665-51791-2 .
- ^ Партингтон, Джеймс Риддик (1950). Учебник неорганической химии . Макмиллан. п. 838.
- ^ Jump up to: а б Баркли, Дж. Б. (октябрь 1978 г.). «Нитрат свинца как окислитель черного пороха». Пиротехника . 4 . Пост-Фолс, Айдахо : Публикации Pyrotechnica: 16–18.
- ^ Jump up to: а б Гринвуд, Норман Н.; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд: Баттерворт-Хайнеманн. стр. 388 , 456. ISBN. 0-7506-3365-4 .
- ^ Отмер, Д.Ф. (1967). Энциклопедия химической технологии Кирка-Отмера . Том. 12 (От железа до марганца) (второе полностью переработанное издание). Нью-Йорк: Джон Уайли и сыновья . п. 272. ИСБН 0-471-02040-0 .
- ^ «Каталог продукции; другая продукция» . Тилли, Бельгия: Сидех. Архивировано из оригинала 1 июля 2007 г. Проверено 5 января 2008 г.
- ^ Гамильтон, WC (1957). «Нейтронно-кристаллографическое исследование нитрата свинца». Акта Кристаллогр. 10 (2): 103–107. дои : 10.1107/S0365110X57000304 .
- ^ Jump up to: а б Новотны, Х.; Г. Хегер (1986). «Уточнение структуры нитрата свинца». Акта Кристаллогр. С. 42 (2): 133–35. дои : 10.1107/S0108270186097032 .
- ^ Новотны, Х.; Хегер, Г. (15 февраля 1986 г.). «Cấu trúc của chì nitrat» . Acta Crystallographica Раздел C: Связь с кристаллической структурой . 42 (2): 133–135. дои : 10.1107/S0108270186097032 . Проверено 15 июля 2019 г.
- ^ Феррис, LM (1959). «Система Нитрат свинца — Азотная кислота — Вода». Журнал химических и инженерных данных . 5 (3): 242. doi : 10.1021/je60007a002 .
- ^ Поли, Дж.Л.; М. К. Тестерман (1954). «Основные соли нитрата свинца, образующиеся в водных средах». Журнал Американского химического общества . 76 (16): 4220–4222. дои : 10.1021/ja01645a062 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 . п. 395
- ^ Роджерс, Робин Д.; Эндрю Х. Бонд; Дебра М. Роден (1996). «Структурная химия поли(этиленгликоля). Комплексы нитрата свинца (II) и бромида свинца (II). Неорг. хим. 35 (24): 6964–6973. дои : 10.1021/ic960587b . PMID 11666874 .
- ^ Махджуб, Али Реза; Али Морсали (2001). «Димерный комплекс свинца(II) со смешанными анионами: синтез и структурная характеристика [Pb 2 (BTZ) 4 (NO 3 )(H 2 O)](ClO 4 ) 3 {BTZ = 4,4'-битиазол}» . Химические письма . 30 (12): 1234. doi : 10.1246/cl.2001.1234 .
- ^ Шуан-И Ван; Така-аки Окамура; Син-Мэй Оуян и Нориказу Уэяма (2002). 2 Сеть с тройным параллельным взаимопроникновением из триподального лиганда нанометрового размера и нитрата свинца (II)». Chem. Commun. (21): 2520–2521. doi : 10.1039/b207568g .
- ^ Хабаши, Фатхи (1998). «Последние достижения в золотометаллургии». Обзор инженерного факультета Центрального университета Венесуэлы . 13 (2): 43–54.
- ^ «Вспомогательные вещества при цианировании золота» . Разведка и добыча золота . Проверено 5 января 2008 г.
- ^ Дайнс, ФБ; Брюстер, RQ; Оландер, К.П. «Фенилизотиоцианат» . Органические синтезы ; Сборник томов , т. 1, с. 447 .
- ^ Рапопорт, Х.; Джеймисон, Т. (1998). «(S)-N-(9-фенилфлуорен-9-ил)аланин и (S)-диметил-N-(9-фенилфлуорен-9-ил)аспартат» . Органические синтезы ; Сборник томов , т. 9, с. 344 .
- ^ «Нитрат свинца, Карта химической безопасности 1000» . Международная организация труда , Международный информационный центр по безопасности и гигиене труда. Март 1999 года . Проверено 19 января 2008 г.
- ^ «Неорганические и органические соединения свинца» (PDF) . Монографии МАИР по оценке канцерогенных рисков для человека . Доп. 7. Международное агентство по исследованию рака : 239. 1987. Архивировано из оригинала (PDF) 6 марта 2008 г. Проверено 19 января 2008 г.
- ^ Всемирная организация здравоохранения, Международное агентство по исследованию рака (2006 г.). «Неорганические и органические соединения свинца» (PDF) . Монографии МАИР по оценке канцерогенных рисков для человека . 87 . Международное агентство по исследованию рака . ISBN 92-832-1287-8 . Архивировано из оригинала (PDF) 21 октября 2007 г. Проверено 1 января 2008 г.
- ^ Мохаммед-Брахим, Б.; Буше, JP; Лауверис, Р. (1985). «Активность пиримидин-5'-нуклеотидазы эритроцитов у рабочих, подвергшихся воздействию свинца, ртути или кадмия». Int Arch Occup Environ Health . 55 (3): 247–52. дои : 10.1007/BF00383757 . ПМИД 2987134 . S2CID 40092031 .
Внешние ссылки
[ редактировать ]- Вудбери, Уильям Д. (1982). "Вести" . Ежегодник минералов «Металлы и минералы» . Горное бюро : 515–42 . Проверено 18 января 2008 г.
- "Вести" . Карманный справочник NIOSH по химическим опасностям . Национальный институт безопасности и гигиены труда. Сентябрь 2005 г. NIOSH 2005-149 . Проверено 19 января 2008 г.
- «Информационный бюллетень о свинце и свинцовых соединениях» . Национальный реестр загрязнителей . Правительство Австралии, Департамент окружающей среды и водных ресурсов. Июль 2007. Архивировано из оригинала 11 января 2008 года . Проверено 19 января 2008 г.
- "Вести" . Здоровая домашняя обстановка, опасности для здоровья . Альянс США за здоровые дома. Архивировано из оригинала 20 февраля 2008 г. Проверено 19 января 2008 г.
- Паспорта безопасности материалов


![{\displaystyle {\ce {2 Pb(NO_3)_2->[\Delta]2PbO + 4NO_2 +O_2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/06f64696eaa883432008d7e6af4c5af9b60a6b85)