Нитрат олова(IV)
| |
| Имена | |
|---|---|
Другие имена
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.222.600 |
| Номер ЕС |
|
ПабХим CID
|
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| Sn(NO 3 ) 4 | |
| Молярная масса | 366.73 g/mol |
| Появление | Шелковистые кристаллы |
| Плотность | 2,65 г/см 3 |
| Температура плавления | 91 ° С (196 ° F; 364 К) |
| Точка кипения | 98 ° C (208 ° F; 371 К) (разлагается) |
| Реагирует | |
| Растворимость | Растворим в четыреххлористом углероде , хлороформе. |
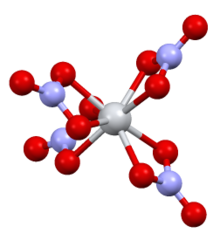
| Структура [3] | |
| Моноклиника | |
| П 2 1 / с | |
а = 7,80 Å, b = 13,85 Å, c = 10,23 Å
| |
| Опасности | |
| СГС Маркировка : | |
 
| |
| Опасность | |
| Х272 , Х314 | |
| П220 , П280 , П305+П351+П338 , П310 | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Нитрат олова(IV) представляет собой соль олова с азотной кислотой. Это летучее белое твердое вещество, сублимирующееся при 40 °C в вакууме. В отличие от других нитратов, он реагирует с водой с образованием диоксида азота.
Структура
[ редактировать ]Структурно он очень похож на нитрат титана (IV) , с единственным существенным отличием в том, что связь Sn-O (2,161 Å) немного длиннее, чем связь Ti-O (2,068 Å). [3]
Производство
[ редактировать ]Впервые он был подготовлен в 1960-х годах. Хлорид олова (IV) добавляли к пятиокисью азота при -78 ° C, в результате чего получали нитрат олова (IV) и хлорид нитрила : [4]
- SnCl 4 + 4 N 2 O 5 → Sn(NO 3 ) 4 + 4 NO 2 Cl
Попытки получить это соединение путем взаимодействия оксида олова (II) и азотной кислоты привели к образованию гидроксида нитрата олова (II). [5]
Реакции
[ редактировать ]Это соединение чувствительно к воде, гидролизуется на оксид олова(IV) и диоксид азота . Нитрат олова(IV) реагирует с ангидридом трифлоуксусной кислоты с образованием (NO 2 + ) 2 [Sn(OOCCF 3 ) 6 2− ] который представляет собой нитрониевую соль. С трифторуксусной кислотой образуется аналогичное соединение, сольватированное с трифторуксусной кислотой. [6]
Он также реагирует с уксусным ангидридом или уксусной кислотой с образованием ацетата олова (IV) и с оксидом азота с образованием оксинитрата олова (IV).
Реакция нитрата олова(IV) с трифенилфосфином и трифениларсином дает динитратотин(IV)бис(дифенилфосфонат) и динитратотин(IV)бис(дифениларсонат). [6]
Ссылки
[ редактировать ]- ^ «Нитрат олова(IV)» . Американские элементы . Проверено 16 февраля 2021 г.
- ^ «Нитрат олова(IV)» . Сигма-Олдрич . Проверено 16 февраля 2021 г.
- ^ Перейти обратно: а б компакт-диск Гарнер; Д. Саттон; СК Стенворк (1967). «Кристаллические структуры безводных нитратов и их комплексов. Часть IV. Нитрат олова(IV)». Журнал Химического общества A: Неорганическое, физическое, теоретическое : 1949–1954. дои : 10.1039/J19670001949 .
- ^ СиСи Эддисон; УБ Симпсон (1965). «Нитрат олова (IV): связь между структурой и реакционной способностью нитратов металлов». Журнал Химического общества : 598–602. дои : 10.1039/JR9650000598 .
- ^ Джей Ди Дональдсон; В. Мозер (1961). «Основной нитрат олова (II)». Журнал Химического общества (возобновлено) . 381 : 1996–2000. дои : 10.1039/JR9610001996 .
- ^ Перейти обратно: а б Харрисон, Филип Г.; Халил, Мутассим И.; Логан, Норман (январь 1978 г.). «Вклад в химию нитрата олова (IV)». Неорганика Химика Акта . 30 : 165–170. дои : 10.1016/S0020-1693(00)89031-3 .