Соединения свинца

Соединения свинца существуют со свинцом в двух основных степенях окисления: +2 и +4. Первое более распространено. свинца (IV) Неорганические соединения обычно являются сильными окислителями или существуют только в сильнокислых растворах. [1]



Химия
[ редактировать ]Различные окисленные формы свинца легко восстанавливаются до металла. Примером является нагревание PbO с мягкими органическими восстановителями, такими как глюкоза. Смесь оксида и сульфида, нагретая вместе, также образует металл. [2]
- 2 PbO + PbS → 3 Pb + SO 2
Металлический свинец подвергается воздействию (окисляется) воздухом лишь поверхностно, образуя тонкий слой оксида свинца, защищающий его от дальнейшего окисления. Металл не подвергается воздействию серной и соляной кислот. Он растворяется в азотной кислоте с выделением газообразного оксида азота с образованием растворенного Pb(NO 3 ) 2 .
- 3 Пб + 8 Н + + 8 НЕТ −
3 → 3 Пб 2+ + 6 НЕТ −
3 + 2 НО + 4 Н 2 О
При нагревании с нитратами щелочных металлов металлический свинец окисляется с образованием PbO (также известного как глет ), оставляя соответствующий щелочной нитрит . PbO представляет степень окисления свинца +2. Он растворим в азотной и уксусной кислотах, из растворов которых возможно осаждение галогенидов , сульфатов , хроматов , карбонатов (PbCO 3 ), основных карбонатов ( Pb
3 (О)
2 (КО
3 )
2 ) соли свинца. Сульфид растворов также можно осаждать из ацетатных . Все эти соли плохо растворяются в воде. Среди галогенидов йодид менее растворим, чем бромид, который, в свою очередь, менее растворим, чем хлорид. [3]
Оксид свинца (II) также растворим в щелочных металлов растворах гидроксидов с образованием соответствующей соли плюмбита . [2]
- PbO + 2 ОН − + H 2 O → Pb(OH) 2−
4
Хлорирование растворов плюмбита приводит к образованию степени окисления свинца +4.
- Свинец(ОН) 2−
4 + Cl 2 → PbO 2 + 2 Cl − + 2 Н 2 О
Диоксид свинца представляет степень окисления +4 и является мощным окислителем . Хлорид этой степени окисления образуется с трудом и легко разлагается на хлорид свинца (II) и газообразный хлор. Существование бромида и йодида свинца(IV) неизвестно. [3] Диоксид свинца растворяется в растворах гидроксидов щелочных металлов с образованием соответствующих плюбатов . [2]
- PbO 2 + 2 ОН − + 2 H 2 O → Pb(OH) 2−
6
У свинца также есть оксид со смешанными степенями окисления +2 и +4, свинцовый сурик ( Pb
33О
4 ), также известный как сурик .
Свинец легко образует эквимолярный сплав с металлическим натрием , который реагирует с алкилгалогенидами с образованием металлоорганических соединений свинца, таких как тетраэтилсвинец . [4]
Оксиды и сульфиды
[ редактировать ]Известны три оксида: , Pb3O4 ( и PbO суриком называемый « » ) PbO2 иногда . Первый имеет два аллотропа: α-PbO и β-PbO, оба со слоистой структурой и тетракоординированным свинцом. Альфа-аллотроп имеет красный цвет и имеет расстояние Pb – O 230 пм; бета-аллотроп имеет желтый цвет и имеет расстояние Pb – O 221 и 249 пм (из-за асимметрии). [5] Благодаря сходству оба аллотропа могут существовать в стандартных условиях (бета с небольшими (10 −5 относительные) примеси, такие как Si, Ge, Mo и др.). PbO реагирует с кислотами с образованием солей, а со щелочами с образованием плюмбитов, [Pb(OH) 3 ] − или [Pb(OH) 4 ] 2− . [6]
Диоксид можно получить, например, галогенизацией солей свинца(II). Альфа-аллотроп ромбоэдрический , а бета-аллотроп тетрагональный . [6] Оба аллотропа имеют черно-коричневый цвет и всегда содержат некоторое количество воды, удалить которую невозможно, так как при нагревании также происходит разложение (на PbO и Pb 3 O 4 ). Диоксид — мощный окислитель: он способен окислять соляную и серную кислоты. Он не реагирует с растворами щелочей, но реагирует с твердыми щелочами с образованием гидроксиплюмбатов или с основными оксидами с образованием плюмбатов. [6]
Реакция свинца с серой или сероводородом дает сульфид свинца. Твердое вещество имеет структуру, подобную NaCl (простую кубическую), которую оно сохраняет до температуры плавления 1114 ° C (2037 ° F). Если нагревание происходит в присутствии воздуха, соединения разлагаются с образованием монооксида и сульфата. [7] Соединения практически нерастворимы в воде, слабых кислотах, а раствор (NH 4 ) 2 S/(NH 4 ) 2 S 2 является ключевым для отделения свинца от элементов I-III аналитических групп, олова, мышьяка и сурьмы. Соединения растворяются в азотной и соляной кислотах с образованием элементарной серы и сероводорода соответственно. [7] При нагревании смеси монооксида и сульфида образуется металл. [2]
- 2 PbO + PbS → 3 Pb + SO 2 ↑
Галогениды и другие соли
[ редактировать ]При нагревании карбоната свинца с фтористым водородом образуется гидрофторид, который при плавлении разлагается на дифторид. Этот белый кристаллический порошок более растворим, чем дииодид, но хуже, чем дибромид и дихлорид. Координированных фторидов свинца не существует (кроме нестабильного PbF + катион). [8] Тетрафторид, желтый кристаллический порошок, нестабилен.
Остальные дигалогениды получаются при нагревании солей свинца(II) с галогенидами других металлов; Дигалогениды свинца выпадают в осадок с образованием белых ромбических кристаллов (дииодиды образуют желтые шестиугольные кристаллы). Их также можно получить прямой реакцией элементов при температуре, превышающей температуру плавления дигалогенидов. Их растворимость увеличивается с температурой; добавление большего количества галогенидов сначала снижает растворимость, но затем увеличивается из-за комплексообразования , при этом максимальное координационное число составляет 6. Комплексообразование зависит от числа галогенид-ионов, атомного номера щелочного металла, галогенид которого добавляется, температуры и ионной силы раствора. . [9] Тетрахлорид получают растворением диоксида в соляной кислоте; для предотвращения экзотермического разложения его хранят в концентрированной серной кислоте. Тетрабромида может не быть, а тетрайодида определенно не существует. [10] Также был приготовлен диастатид. [11]
Металл не подвергается воздействию серной и соляной кислот. Он растворяется в азотной кислоте с выделением газообразного оксида азота с образованием растворенного Pb(NO 3 ) 2 . [8] Это хорошо растворимое в воде твердое вещество; Таким образом, это ключ к получению осадков галогенидов , сульфатов , хроматов , карбонатов и основных карбонатов Pb 3 (OH) 2 (CO 3 ) 2 солей свинца. [3]
Хлоридные комплексы
[ редактировать ]
Свинец(II) образует ряд комплексов с хлоридом , образование которых изменяет химию коррозии свинца. Это будет иметь тенденцию ограничивать растворимость свинца в соленой среде.
| Pb 2+ + Cl − → PbCl + | К 1 = 12,59 |
| PbCl + + Cl − → PbCl 2 | К 2 = 14,45 |
| PbCl 2 + Cl − → PbCl − 3 |
К 3 = 0,398 |
| PbCl − 3 + кл − → PbCl 2− 4 |
К 4 = 0,0892 |
Органолвинец
[ редактировать ]Наиболее известными соединениями являются два простейших плюмбана производных : тетраметилсвинец (TML) и тетраэтилсвинец (TEL); однако их гомологи, а также гексаэтилдисвинец (HEDL) обладают меньшей стабильностью. Тетралкильные производные содержат свинец (IV); связи Pb–C ковалентны. Таким образом, они напоминают типичные органические соединения. [14]
Свинец легко образует эквимолярный сплав с металлическим натрием , который реагирует с алкилгалогенидами с образованием металлоорганических соединений свинца, таких как тетраэтилсвинец . [15] Энергии связей Pb–C в TML и TEL составляют всего 167 и 145 кДж/моль; таким образом, соединения разлагаются при нагревании, причем первые признаки состава TEL наблюдаются при 100 ° C (210 ° F). При пиролизе образуются элементарный свинец и алкильные радикалы; их взаимодействие вызывает синтез HEDL. [14] Они также разлагаются под воздействием солнечного света или ультрафиолетового излучения. [16] В присутствии хлора алкилы начинают замещаться хлоридами; R 2 PbCl 2 в присутствии HCl (побочный продукт предыдущей реакции) приводит к полной минерализации с образованием PbCl 2 . Реакция с бромом происходит по тому же принципу. [16]
Фазовые диаграммы растворимости
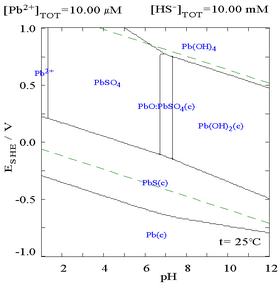
[ редактировать ]Сульфат свинца (II) плохо растворим, как видно на следующей диаграмме, показывающей добавление SO. 2−
4 к раствору, содержащему 0,1 М Pb 2+ . pH раствора 4,5, как и выше, Pb 2+ концентрация никогда не может достичь 0,1 М из-за образования Pb(OH) 2 . Обратите внимание, что Pb 2+ растворимость падает в 10 000 раз по сравнению с SO 2−
4 достигает 0,1 М.

|
|
| График, показывающий концентрацию растворенного Pb в водной среде 2+ как функция SO 2− 4 [12] |
Диаграмма содержания свинца в сульфатных средах [12] |
Добавление хлорида может снизить растворимость свинца, хотя в средах, богатых хлоридами (например, царской водке ), свинец может снова стать растворимым в виде анионных хлоркомплексов.

|
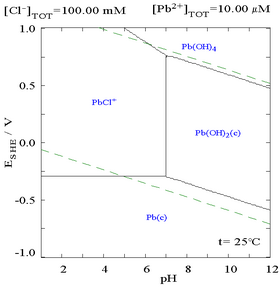
|
| Диаграмма, показывающая растворимость свинца в хлоридных средах. Концентрации свинца представлены на графике как функция общего количества присутствующих хлоридов. [12] | Диаграмма Пурбе для свинца в хлоридных (0,1 М) средах [12] |
Ссылки
[ редактировать ]- ^ Polyanskiy 1986 , pp. 14–15.
- ^ Перейти обратно: а б с д Полинг, Лайнус (1947). Общая химия . У. Х. Фриман. ISBN 978-0-486-65622-9 .
- ^ Перейти обратно: а б с Брэди, Джеймс Э.; Холум, Джон Р. (1996). Описательная химия элементов . Джон Уайли и сыновья. ISBN 978-0-471-13557-9 .
- ^ Виндхольц, Марта (1976). Индекс химических веществ и лекарств Merck, 9-е изд., монография 8393 . Мерк. ISBN 978-0-911910-26-1 .
- ^ Polyanskiy 1986 , p. 21.
- ^ Перейти обратно: а б с Polyanskiy 1986 , p. 22.
- ^ Перейти обратно: а б Polyanskiy 1986 , p. 28.
- ^ Перейти обратно: а б Polyanskiy 1986 , p. 32.
- ^ Polyanskiy 1986 , p. 33.
- ^ Polyanskiy 1986 , p. 34.
- ^ Цукерман, Джей-Джей; Хаген, AP (1989). Неорганические реакции и методы образования связей с галогенами . Джон Уайли и сыновья . п. 426. ИСБН 978-0-471-18656-4 .
- ^ Перейти обратно: а б с д и Пучдоменек, Игнаси (2004). База данных химического равновесия Hydra/Medusa и программное обеспечение для построения графиков . Королевский технологический институт KTH. Архивировано из оригинала 29 сентября 2007 г.
- ^ Уорд, Швейцария; Хлоусек, Дуглас А.; Филлипс, Томас А.; Лоу, Дональд Ф. (2000). Восстановление ударных берм на полигоне . ЦРК Пресс. ISBN 1566704626 .
- ^ Перейти обратно: а б Polyanskiy 1986 , p. 43.
- ^ Виндхольц, Марта (1976). Индекс химических веществ и лекарств Merck, 9-е изд., монография 8393 . Мерк. ISBN 0-911910-26-3 .
- ^ Перейти обратно: а б Polyanskiy 1986 , p. 44.
Библиография
[ редактировать ]- Polyanskiy, N. G. (1986). Fillipova, N. A (ed.). Аналитическая химия элементов: Свинец [ Аналитическая химия элементов: Свинец ] (на русском языке). Наука .