Соединения празеодима
Соединения празеодима представляют собой соединения, образованные лантанидом металлическим празеодимом (Pr). В этих соединениях празеодим обычно проявляет степень окисления +3 , например PrCl 3 , Pr(NO 3 ) 3 и Pr(CH 3 COO) 3 . соединения с празеодимом в степени окисления +2 и +4, а в отличие от других лантаноидов Однако известны также - в степени окисления +5.
Галогениды
[ редактировать ]
Металлический празеодим реагирует со всеми стабильными галогенами с образованием зеленых тригалогенидов: [ 1 ]
- 2 Пр(с) + 3 Ф 2 (г) → 2 ПрФ 3 (с)
- 2 Pr(т) + 3 Cl 2 (г) → 2 PrCl 3 (т)
- 2 Пр(т) + 3 Бр 2 (г) → 2 ПрБр 3 (с)
- 2 Пр(с) + 3 И 2 (г) → 2 ПрИ 3 (с)
Фторид празеодима(III) является наиболее стабильным фторидом празеодима. Его можно получить в результате реакции между нитратом празеодима (III) и фторидом натрия с образованием фторида празеодима (III) в виде зеленого кристаллического твердого вещества. [ 2 ] Хлорид празеодима(III) представляет собой светло-зеленое твердое вещество, которое можно получить обработкой металлического празеодима хлористым водородом . [ 3 ] [ 4 ] Обычно его очищают вакуумной сублимацией. [ 5 ] Это кислая среда Льюиса , классифицируемая как «жесткая» согласно концепции HSAB . Быстрое нагревание гидрата может вызвать небольшой гидролиз . [ 5 ] PrCl 3 образует стабильный кислотно-основной комплекс Льюиса K 2 PrCl 5 при реакции с хлоридом калия ; это соединение демонстрирует интересные оптические и магнитные свойства. [ 6 ]
Бромид празеодима(III) — единственный стабильный бромид празеодима. Он принимает структура UCl3 Кристаллическая . [ 7 ] Ионы празеодима имеют 9 координат и имеют трехгранную тригонально-призматическую геометрию . [ 8 ] Длины связей празеодим-бром составляют 3,05 Å и 3,13 Å. [ 9 ] Йодид празеодима (III) можно получить нагреванием празеодима, и йод в инертной атмосфере дает йодид празеодима (III), [ 10 ] или путем нагревания празеодима с йодидом ртути (II). [ 11 ] Он образует орторомбические кристаллы, которые гигроскопичны . [ 10 ] Кристаллизуется в PuBr 3. виде [ 11 ] [ 12 ] с пространственной группой Cmcm (№ 63) с a = 4,3281(6) Å, b = 14,003(6) Å и c = 9,988(3) Å. [ 13 ]
Тетрафторид PrF 4 также известен и получается путем взаимодействия смеси фторида натрия и фторида празеодима(III) с газообразным фтором с образованием Na 2 PrF 6 , после чего фторид натрия удаляется из реакционной смеси жидким фторидом водорода. . [ 8 ] бронзы Кроме того, празеодим образует дииодид ; как и дииодиды лантана, церия и гадолиния , это соединение электрида празеодима (III) . [ 8 ]
Оксиды
[ редактировать ]Празеодим может образовывать множество различных оксидов , хотя единственные оксиды, стабильные при комнатной температуре, — это Pr 2 O 3 , Pr 6 O 11 и PrO 2 . Оксид празеодима(III) представляет собой зеленый порошок, образующий шестиугольные кристаллы. [ 14 ] и кристаллизуется в структуре оксида марганца (III) или биксбиита . [ 15 ] Оксид празеодима(IV) можно получить кипячением Pr 6 O 11 в воде или уксусной кислоте : [ 16 ]
- Pr 6 O 11 + 3 H 2 O → 4 PrO 2 + 2 Pr(OH) 3
Оксид празеодима (III, IV) является наиболее стабильной формой оксидов празеодима при температуре и давлении окружающей среды . [ 17 ] Он растворим в воде [ 18 ] и имеет кубическую структуру флюорита . [ 19 ] Его можно получить твердофазными методами, такими как термолиз, метод расплавленных солей, прокаливание или осаждение . [ 19 ] [ 17 ] [ 20 ]
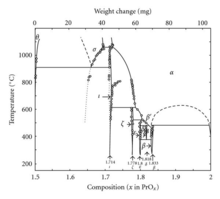
Помимо Pr 6 O 11 , празеодим образует также систему оксидов в разных фазах: [ 21 ]
| Ценить | Формула | Фаза | х в ПрО х | Средняя степень окисления Pr |
|---|---|---|---|---|
| 4 | Pr2OПр2О3 | я | 1.5 | 3 |
| 7 | Пр 7 О 12 | я | 1.714 | 3.428 |
| 9 | Пр 9 О 16 | г | 1.778 | 3.556 |
| 10 | Pr5OПр5О9 | е | 1.8 | 3.6 |
| 11 | Пр 11 О 20 | д | 1.818 | 3.636 |
| 12 | Пр 6 О 11 | б | 1.833 | 3.667 |
| ∞ | Про 2 | 2 | 4 |
Органопразеодимовые соединения
[ редактировать ]Органопразеодимовые соединения – это соединения, содержащие связь празеодим - углерод . Эти соединения очень похожи на соединения других лантаноидов , поскольку все они неспособны образовывать π-связи . Таким образом, они в основном ограничиваются в основном ионными циклопентадиенидами (изоструктурными с таковыми лантана) и простыми алкилами и арилами с σ-связью, некоторые из которых могут быть полимерными. [ 22 ] Координационная химия празеодима в основном аналогична большому электроположительному Pr. 3+ ион и, таким образом, во многом похож на таковые других ранних лантаноидов La 3+ , Этот 3+ и Нд 3+ . Например, подобно лантану, церию и неодиму, нитрат празеодима образует комплексы как 4:3, так и 1:1 с 18-краун-6 , тогда как средние лантаноиды от прометия до гадолиния могут образовывать только комплекс 4:3, а более поздние лантаноиды от тербия до лютеция не могут успешно координироваться со всеми лигандами. Такие комплексы празеодима имеют высокие, но неопределенные координационные числа и плохо определенную стереохимию, за исключением исключительно объемных лигандов, таких как трехкоординат [Pr{N(SiMe 3 ) 2 } 3 ]. Есть также несколько смешанных оксидов и фторидов с участием празеодима (IV), но он не имеет заметной координационной химии в этой степени окисления, как его сосед церий. [ 23 ] Однако недавно сообщалось о первом примере молекулярного комплекса празеодима (IV). [ 24 ] Как и другие лантанидорганические соединения, свойства органопразеодимовых соединений включают:
- Органопразеодимовые соединения очень чувствительны к воздуху и воде и пирофорны .
- 0 Химия в степени окисления гораздо более ограничена. Фактически, их электроположительная природа делает их металлоорганические соединения более вероятными ионными.
- Органопразеодимовые соединения не образуют стабильных карбонилов при комнатной температуре; Карбонильные соединения органопразеодима обнаружены только в аргоновых матрицах и разлагаются при нагревании до К. 40
σ-связанные комплексы
[ редактировать ]σ-связи металл-углерод встречаются в алкилах преодима, таких как [PrMe 6 ] 3− и Pr[CH(SiMe 3 ) 2 ] 3 .
π-связанные комплексы
[ редактировать ]Циклопентадиенильные комплексы известны празеодиму. Его можно получить по следующей схеме реакций:
- 3 Na[Cp] + PrCl 3 → Pr[Cp] 3 + 3 NaCl
Эти соединения имеют ограниченное применение и академический интерес. [ 25 ]
Приложения
[ редактировать ]Нитрид празеодима (III) используется в высококачественной электрической и полупроводниковой продукции, а также в качестве сырья для производства люминофора. Также он используется в качестве магнитного материала и материала для распыления. [ 26 ] Многие соединения празеодима, такие как оксалат празеодима (III) , используются для окраски некоторых стекол и эмалей. При смешивании с некоторыми другими материалами оксалат празеодима (III) окрашивает стекло в ярко-желтый цвет. [ 27 ]
Оксид празеодима (III, IV) имеет ряд потенциальных применений в химическом катализе и часто используется в сочетании с промотором, таким как натрий или золото, для улучшения его каталитических характеристик. Он имеет высокую диэлектрическую проницаемость около 30 и очень низкие токи утечки. [ 28 ] что также сделало его многообещающим материалом для многих потенциальных применений в наноустройствах и микроэлектронике . [ 20 ]
Фотографии соединений празеодима
[ редактировать ]-
Ацетат празеодима(III) (Pr(CH 3 COO) 3 )
-
Оксид празеодима(III) (Pr 2 O 3 )
-
Хлорид празеодима(III) (PrCl 3 )
-
Нитрат празеодима(III) (Pr(NO 3 ) 3 )
-
Октагидрат сульфата празеодима(III) (Pr 2 (SO 4 ) 3 ·8H 2 O)
-
Гидроксид празеодима(III) (Pr(OH) 3 )
-
Фосфат празеодима(III) (PrPO 4 )
Ссылки
[ редактировать ]- ^ «Химические реакции празеодима» . Веб-элементы . Проверено 9 июля 2016 г.
- ^ Линь Ма, Вэй-Сян Чен, И-Фань Чжэн, Цзе Чжао, Чжуде Сюй (май 2007 г.). «Гидротермальный синтез с помощью микроволнового излучения и характеристики полых наночастиц PrF3» . Материалы писем . 61 (13): 2765–2768. дои : 10.1016/j.matlet.2006.04.124 . Проверено 26 марта 2019 г.
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Дж. Цибинска, Дж. Сокольницкий, Дж. Легендзевич, Г. Мейер, Журнал сплавов и соединений , 341 , 115–123 (2002).
- ^ LF Druding, JD Corbett, «Низшие состояния окисления лантаноидов. Хлорид и йодид неодима (II), J. Am. хим. Соц. 83 , 2462 (1961); Дж. Д. Корбетт, преподобный Чим. Минерале 10 , 239 (1973) ,
- ^ Jump up to: а б FT Эдельманн, П. Поремба, в: Синтетические методы металлоорганической и неорганической химии , (WA Herrmann, ed.), Vol. 6, Георг Тиме Верлаг, Штутгарт, 1997 г.
- ^ Дж. Цибинска, Дж. Сокольницкий, Дж. Легендзевич, Г. Мейер, Журнал сплавов и соединений , 341 , 115–123 (2002).
- ^ Уэллс, А. Ф. (1984). Структурная неорганическая химия (5-е изд.). Издательство Оксфордского университета. п. 421. ИСБН 978-0-19-965763-6 .
- ^ Jump up to: а б с Гринвуд и Эрншоу, с. 1240–2
- ^ Шмид, Б.; Хельг, Б.; Фуррер, А. (1987). «Структура и кристаллические поля PrBr 3 и PrCl 3 : нейтронное исследование». Дж. Прил. Физ. 61 (8): 3426–3428. Бибкод : 1987JAP....61.3426S . дои : 10.1063/1.338741 .
- ^ Jump up to: а б Хейнс, Уильям М. (22 июня 2016 г.). CRC Справочник по химии и физике . ЦРК Пресс. стр. 2016–2652. ISBN 978-1-4987-5429-3 .
- ^ Jump up to: а б Эспри, LB; Кинан, ТК; Крузе, Ф.Х. (1964). «Приготовление и кристаллические данные для трииодидов лантаноидов и актинидов» . Неорг. хим. 3 (8): 1137–1141. дои : 10.1021/ic50018a015 .
- ^ Уэллс, А. Ф. (1984). Структурная неорганическая химия (5-е изд.). Издательство Оксфордского университета. п. 421. ИСБН 978-0-19-965763-6 .
- ^ Э. Варкентин, Х. Бернигхаузен (1979), «Кристаллическая структура дииодида празеодима (модификация V)», Журнал неорганической и общей химии (на немецком языке), том. 459, № 1, стр. 187–200, номер документа : 10.1002/zaac.19794590120.
- ^ Лиде, Дэвид Р. (1998), Справочник по химии и физике (87-е изд.), Бока-Ратон, Флорида: CRC Press, стр. 478, 523, ISBN 0-8493-0594-2
- ^ Домбровский, Ярек; Вебер, Эйке Р. (2004), Прогнозное моделирование обработки полупроводников , Springer, стр. 264, ISBN 978-3-540-20481-7 , получено 18 марта 2009 г.
- ^ Китайский : «Серия неорганической химии». Том 7. Редкоземельный элемент скандий. 1.3.4 Соединения со степенью окисления P 193 ~ 195.
- ^ Jump up to: а б Зинатлоо-Аджабшир, Сахар; Салавати-Ниасари, Масуд (2015). «Новый синтез наноструктур оксида празеодима с помощью поли(этиленгликоля) простым способом осаждения». Керамика Интернешнл . 41 (1): 567–575. doi : 10.1016/j.ceramint.2014.08.105 .
- ^ «Оксид празеодима (Pr6O11)» . www.reade.com . Проверено 15 марта 2018 г.
- ^ Jump up to: а б Матович, Бранко; Пантич, Елена; Прекайски, Мария; Станкович, Надежда; Буцевац, Душан; Минович, Тамара; Чебела, Мария (2013). «Синтез и характеристика нанопорошков Pr6O11». Керамика Интернешнл . 39 (3): 3151–3155. doi : 10.1016/j.ceramint.2012.09.098 .
- ^ Jump up to: а б Шамши Хасан, М., Шахир Ахтар, М., Шим, КБ. и др. Морфологические и электрохимические свойства кристаллических наностержней оксида празеодима. Nanoscale Res Lett 5, 735 (2010). https://doi.org/10.1007/s11671-010-9547-8
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 643–4. ISBN 978-0-08-037941-8 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 1248–9. ISBN 978-0-08-037941-8 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 1244–8. ISBN 978-0-08-037941-8 .
- ^ Уиллауэр, Арканзас; Палумбо, Коннектикут; Фадаи-Тирани, Ф.; Живкович И.; Дуэр, И.; Марон, Л.; Маццанти, М. (2020). «Доступ к степени окисления +IV в молекулярных комплексах празеодима» . Журнал Американского химического общества . 142 (12): 489–493. дои : 10.1021/jacs.0c01204 . ПМИД 32134644 . S2CID 212564931 .
- ^ Джей Джей Цукерман (17 сентября 2009 г.). Неорганические реакции и методы. Образование связей с элементами IVB группы (C, Si, Ge, Sn, Pb) . Джон Уайли и сыновья. ISBN 978-0-470-14547-0 . Проверено 28 июля 2013 г.
- ^ «Порошок нитрида празеодима (ПрН)» . Стэнфордские продвинутые материалы . Проверено 18 июня 2021 г.
- ^ «Оксалат празеодима 99–99,999% от Metall Rare Earth Limited» . metall.com.cn . Проверено 17 июня 2021 г.
- ^ Остен Х.Дж., Лю Дж.П., П. Гавожевски, Э. Бугель, Заумсейл П: Технический дайджест IEDM 653. 2000.






