Соединения технеция
Соединения технеция — это химические соединения, содержащие химический элемент технеций . Технеций может образовывать несколько степеней окисления, но часто образуется в степенях окисления +4 и +7. Поскольку технеций радиоактивен, соединения технеция на Земле встречаются крайне редко.
Пертехнетат и производные
[ редактировать ]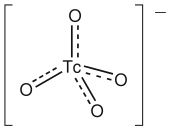
Наиболее распространенной и легкодоступной формой технеция является пертехнетат натрия Na[TcO 4 ]. Большая часть этого материала образуется в результате радиоактивного распада [ 99 МоО 4 ] 2− : [ 1 ] [ 2 ]
- [ 99 МоО 4 ] 2− → [ 99 м ТсО 4 ] − + и −
Пертехнетат (тетроксидотехнетат) TcO −
4 ведет себя аналогично перхлорату, оба из которых тетраэдрические . В отличие от перманганата ( MnO −
4 ), это лишь слабый окислитель .
Родственным пертехнетату является гептоксид технеция . Это бледно-желтое летучее твердое вещество образуется в результате окисления металла Tc и родственных ему предшественников:
- 4 Тс + 7 О 2 → 2 Тс 2 О 7
Это молекулярный оксид металла, аналог гептоксида марганца . Он имеет центросимметричную структуру с двумя типами связей Tc-O с длиной связи 167 и 184 мкм. [ 3 ]
Гептоксид технеция гидролизуется до пертехнетата и пертехнетовой кислоты в зависимости от pH: [ 4 ] [ 5 ]
- Тс 2 О 7 + 2 ОН − → 2 ТсО 4 − + Н 2 О
- Tc 2 O 7 + H 2 O → 2 HTcO 4
HTcO 4 – сильная кислота. В концентрированной серной кислоте [TcO 4 ] − превращается в октаэдрическую форму TcO 3 (OH)(H 2 O) 2 , сопряженное основание гипотетического триаквокомплекса [ TcO 3 (H 2 O) 3 ] + . [ 6 ]
Другие производные халькогенидов
[ редактировать ]Технеций образует диоксид , [ 7 ] дисульфид , диселенид и дителлурид . Неопределенный Tc 2 S 7 образуется при пертехнетата сероводородом обработке . Термически разлагается на дисульфид и элементарную серу. [ 8 ] Аналогичным образом диоксид можно получить восстановлением Tc 2 O 7 .
В отличие от рения, для технеция триоксид выделен не был. Однако TcO 3 был идентифицирован в газовой фазе с помощью масс-спектрометрии . [ 9 ]
Простые гидридные и галогенидные комплексы
[ редактировать ]Технеций образует простой комплекс TcH. 2−
9 . Калийная соль изоструктурна ReH . 2−
9 . [ 10 ]

Известны следующие бинарные (содержащие всего два элемента) галогениды технеция: TcF 6 , TcF 5 , TcCl 4 , TcBr 4 , TcBr 3 , α-TcCl 3 , β-TcCl 3 , TcI 3 , α-TcCl 2 и β-. ТсСl 2 . Степени окисления варьируются от Tc(VI) до Tc(II). Галогениды технеция имеют различные типы структуры, такие как молекулярные октаэдрические комплексы, вытянутые цепи, слоистые листы и металлические кластеры, расположенные в трехмерной сетке. [ 11 ] [ 12 ] Эти соединения производятся путем объединения металла и галогена или менее прямыми реакциями.
TcCl 4 получают хлорированием металлического Tc или Tc 2 O 7. при нагревании TcCl 4 дает соответствующие хлориды Tc(III) и Tc(II). [ 12 ]
- TcCl 4 → α-TcCl 3 + 1/2 Cl 2
- TcCl 3 → β-TcCl 2 + 1/2 Cl 2
Структура TcCl 4 состоит из бесконечных зигзагообразных цепочек октаэдров TcCl 6, имеющих общие ребра . Он изоморфен тетрахлоридам переходных металлов циркония , гафния и платины . [ 12 ]

Существуют две полиморфные модификации трихлорида технеция : α- и β-TcCl 3 . Полиморф α также обозначается как Tc 3 Cl 9 . Он принимает конфациальную биооктаэдрическую структуру . [ 13 ] Его получают обработкой хлорацетата Tc 2 (O 2 CCH 3 ) 4 Cl 2 HCl. Как и Re 3 Cl 9 , структура α-полиморфа состоит из треугольников с короткими ММ-расстояниями. β-TcCl 3 имеет октаэдрические центры Tc, которые организованы парами, как это видно также для трихлорида молибдена . TcBr 3 не принимает структуру ни одной трихлоридной фазы. Вместо этого он имеет структуру трибромида молибдена , состоящую из цепочек конфациальных октаэдров с чередующимися короткими и длинными контактами Tc—Tc. TcI 3 имеет ту же структуру, что и высокотемпературная фаза TiI 3 , и представляет собой цепочки конфациальных октаэдров с равными контактами Tc—Tc. [ 12 ]
Известно несколько анионных галогенидов технеция. Бинарные тетрагалогениды можно преобразовать в гексагалогениды [TcX 6 ] 2− (X = F, Cl, Br, I), которые принимают октаэдрическую молекулярную геометрию . [ 14 ] Более восстановленные галогениды образуют анионные кластеры со связями Tc–Tc. Аналогичная ситуация и для родственных элементов Mo, W, Re. Эти кластеры имеют ядерность Tc 4 , Tc 6 , Tc 8 и Tc 13 . Более стабильные кластеры Tc 6 и Tc 8 имеют форму призмы, в которой вертикальные пары атомов Tc соединены тройными связями, а плоские атомы - одинарными. Каждый атом технеция образует шесть связей, а оставшиеся валентные электроны могут быть насыщены одним аксиальным и двумя мостиковыми атомами галогена лиганда, такими как хлор или бром . [ 15 ]
Простые карбидные комплексы
[ редактировать ]Технеций при реакции с графитом образует простые углеродные внедренные фазы с низким содержанием углерода до 17 ат.% С. [ 16 ] или термолизом органических пертехнетатов. [ 17 ] Tc считается последним d-элементом, имеющим небольшое, но заметное сродство к углероду. [ 18 ]
Координационные и металлоорганические комплексы
[ редактировать ]
Технеций образует разнообразные координационные комплексы с органическими лигандами. Многие из них были хорошо исследованы из-за их значимости для ядерной медицины . [ 19 ]
Технеций образует разнообразные соединения со связями Tc–C, т. е. технецийорганические комплексы. Выдающимися представителями этого класса являются комплексы с CO, ареном и циклопентадиенильными лигандами. [ 20 ] Бинарный карбонил Tc 2 (CO) 10 представляет собой белое летучее твердое вещество. [ 21 ] В этой молекуле два атома технеция связаны друг с другом; каждый атом окружен октаэдрами из пяти карбонильных лигандов. Длина связи между атомами технеция 303 пм, [ 22 ] [ 23 ] значительно больше, чем расстояние между двумя атомами металлического технеция (272 пм). Подобные карбонилы образуются родственными технецию марганцем и рением. [ 24 ] Интерес к технецийорганическим соединениям обусловлен также применением их в ядерной медицине . [ 20 ] Технеций также образует аквакарбонильные комплексы, одним из которых является [Tc(CO) 3 (H 2 O) 3 ] + , что необычно по сравнению с карбонилами других металлов. [ 20 ]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Швохау 2000 , стр. 127–136.
- ^ Мур, PW (апрель 1984 г.). «Технеций-99 в генераторных системах» (PDF) . Журнал ядерной медицины . 25 (4): 499–502. ПМИД 6100549 . Проверено 11 мая 2012 г.
- ^ Кребс, Б. (1969). «Оксид технеция (VII), оксид переходного металла с молекулярной структурой в твердом состоянии». Прикладная химия . 81 (9): 328–329. дои : 10.1002/anie.19690810905 .
- ^ Швохау 2000 , с. 127.
- ^ Херрелл, AY; Бьюзи, Р.Х.; Гейер, К.Х. (1977). Оксид технеция (VII) в неорганическом синтезе . Том. XVII. стр. 155–158. ISBN 978-0-07-044327-3 .
- ^ Пуано Ф; Век ПФ; Герман К; Марук А; Киракосян Г; Люкенс В; Рего БД; и др. (2010). «Вид семивалентного технеция в серной кислоте: структурные и спектроскопические исследования» (PDF) . Транзакции Далтона . 39 (37): 8616–8619. дои : 10.1039/C0DT00695E . ПМИД 20730190 . S2CID 9419843 .
- ^ Швохау 2000 , с. 108.
- ^ Швохау 2000 , стр. 112–113.
- ^ Гибсон, Джон К. (1993). «Высокотемпературные оксидные и гидроксидные пары технеция». Радиохимика Акта . 60 (2–3): 121–126. дои : 10.1524/ract.1993.60.23.121 . S2CID 99795348 .
- ^ Швохау 2000 , с. 146.
- ^ Джонстон, EV (май 2014 г.). Бинарные галогениды технеция (Диссертация). Университет Невады, Лас-Вегас. doi : 10.34917/5836118 – через диссертации, диссертации, профессиональные статьи и основные положения UNLV.
- ^ Jump up to: а б с д Пуано, Фредерик; Джонстон, Эрик В.; Червински, Кеннет Р.; Саттельбергер, Альфред П. (2014). «Последние достижения в химии галогенидов технеция». Отчеты о химических исследованиях . 47 (2): 624–632. дои : 10.1021/ar400225b . ПМИД 24393028 .
- ^ Пуано, Фредерик; Джонстон, Эрик В.; Век, Филипп Ф.; Ким, Ынджа; Форстер, Пол М.; Скотт, Брайан Л.; Саттельбергер, Альфред П.; Червински, Кеннет Р. (2010). «Синтез и структура трихлорида технеция». Журнал Американского химического общества . 132 (45): 15864–5. дои : 10.1021/ja105730e . ПМИД 20977207 .
- ^ Швохау, К. (2000). Технеций: химия и радиофармацевтические применения . Вайнхайм, Германия: Wiley-VCH. ISBN 978-3-527-29496-1 .
- ^ немецкий, КЭ; Крючков, С.В. (2002). «Полиядерные кластеры галогенидов технеция» . Российский журнал неорганической химии . 47 (4): 578–583. Архивировано из оригинала 22 декабря 2015 г.
- ^ German, K. E.; Peretrukhin, V. F.; Gedgovd, K. N.; Grigoriev, M. S.; Tarasov, A. V.; Plekhanov, Yu V.; Maslennikov, A. G.; Bulatov, G. S.; Tarasov, V. P.; Lecomte, M. (2005). "Tc Carbide and New Orthorhombic Tc Metal Phase" . Journal of Nuclear and Radiochemical Sciences . 6 (3): 211–214. doi : 10.14494/jnrs2000.6.3_211 .
- ^ Кузнецов Виталий Владимирович; Герман Константин Евгеньевич; Наговицына Ольга А.; Филатова Елена Александровна; Волков Михаил А.; Ситанская Анастасия Владимировна; Пшеничкина Татьяна В. (31 октября 2023 г.). «Путь к стабилизации нанотехнеция в аморфной углеродной матрице: препаративные методы, данные XAFS и электрохимические исследования» . Неорганическая химия . doi : 10.1021/acs.inorgchem.3c03001 . ISSN 0020-1669 .
- ^ Ван, Цингао; Герман Константин Евгеньевич; Оганов Артем Р.; Донг, Хуафэн; Фея, Олег Д.; Зубавичус Я.В.; Мурзин, В. Ю (08 февраля 2016 г.). «Объяснение стабильности карбидов переходных металлов – и почему TcC не существует» . РСК Прогресс . 6 (20): 16197–16202. дои : 10.1039/C5RA24656C . ISSN 2046-2069 .
- ^ Бартоломя, Марк Д.; Луи, Аника С.; Вэллиант, Джон Ф.; Зубиета, Джон (2010). «Радиофармацевтические препараты, полученные из технеция и галлия: сравнение и сопоставление химического состава двух важных радиометаллов для эпохи молекулярной визуализации». Химические обзоры . 110 (5): 2903–20. дои : 10.1021/cr1000755 . ПМИД 20415476 .
- ^ Jump up to: а б с Альберто, Роджер (2010). «Металлоорганические радиофармпрепараты». Медицинская металлоорганическая химия . Темы металлоорганической химии. Том. 32. С. 219–246. дои : 10.1007/978-3-642-13185-1_9 . ISBN 978-3-642-13184-4 .
- ^ Хилман, Дж. К.; Хаггинс, ДК; Каес, HD (1961). «Карбонил технеция». Журнал Американского химического общества . 83 (13): 2953–2954. дои : 10.1021/ja01474a038 .
- ^ Бейли, МФ; Даль, Лоуренс Ф. (1965). «Кристаллическая структура декакарбонила дитехнеция». Неорганическая химия . 4 (8): 1140–1145. дои : 10.1021/ic50030a011 .
- ^ Уоллах, Д. (1962). «Элементарная ячейка и пространственная группа карбонила технеция, Tc2 (CO) 10». Акта Кристаллографика . 15 (10): 1058. дои : 10.1107/S0365110X62002789 .
- ^ Швохау 2000 , стр. 286, 328.