нонахлорид трирения
| Имена | |
|---|---|
| Название ИЮПАК
Хлорид рения(III)
| |
| Другие имена
трихлорид рения
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| Информационная карта ECHA | 100.033.610 |
| Номер ЕС |
|
ПабХим CID
|
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| ReCl 3 | |
| Молярная масса | 292.57 g/mol |
| Появление | красное кристаллическое нелетучее твердое вещество |
| Плотность | 4800 кг/м 3 |
| Температура плавления | Н/Д |
| Точка кипения | 500 ° C (932 ° F, 773 К) (разлагается) |
| гидролизуется с образованием Re 2 O 3 . хH2O H. | |
| Структура | |
| Ромбоэдрический , hR72 | |
| R-3m, No. 166 | |
| ( тримерное твердое вещество и в растворе) ( димер уксусной кислоты) | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности
|
Коррозионный ( С ) |
| Паспорт безопасности (SDS) | Внешний паспорт безопасности материалов |
| Родственные соединения | |
Другие анионы
|
Трибромид рения трийодид рения |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Нонахлорид трирения представляет собой соединение с формулой ReCl 3 , иногда также обозначаемое Re 3 Cl 9 . Это темно-красное гигроскопичное твердое вещество, нерастворимое в обычных растворителях. Это соединение играет важную роль в истории неорганической химии как ранний пример кластерного соединения со связями металл-металл. [ 1 ] Его используют в качестве исходного материала для синтеза других комплексов рения.
Структура и физические свойства
[ редактировать ]Как показали данные рентгеноструктурного анализа, нонахлорид трирения состоит из субъединиц Re 3 Cl 12 , имеющих три хлоридных мостика с соседними кластерами. Взаимосвязанная сеть кластеров образует листы. Вокруг каждого Re-центра расположены семь лигандов, четыре мостиковых хлорида, один концевой хлорид и две связи Re-Re. [ 2 ]
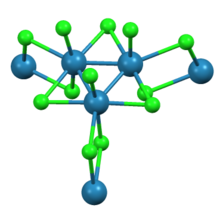
Гидрат является молекулярным с формулой Re 3 Cl 9 (H 2 O) 3 . [ 3 ]
Теплоту окисления оценивают по уравнению:
- 1/3 Re 3 Cl 9 + 4 ОН − + 2 ОСl − → РеО 4 − + 2 Н 2 О + 5Cl −
Энтальпия этого процесса составляет 190,7 ± 0,2 ккал/моль. [ 2 ]
Препарат и реакции
[ редактировать ]Соединение было обнаружено в 1932 году. [ 4 ] Нонахлорид трирения эффективно получают термическим разложением пентахлорида рения или гексахлоррениевой(IV) кислоты: [ 5 ]
- 3 ReCl 5 → Re 3 Cl 9 + 3 Cl 2
Если образец сублимируют в вакууме при температуре 500 °C, полученный материал сравнительно нереакционноспособен. Частично гидратированный материал, такой как Re 3 Cl 9 (H 2 O) 4 [ 6 ] может быть более полезным синтетически. Другие методы синтеза включают рения сульфурилхлоридом . обработку Иногда этот процесс проводят с добавлением хлорида алюминия . [ 2 ] Его также получают нагреванием Re 2 (O 2 CCH 3 ) 4 Cl 2 под HCl:
- 3/2 Re 2 (O 2 CCH 3 ) 4 Cl 2 + 6 HCl → Re 3 Cl 9 + 6 HO 2 CCH 3
Реакция три- и пентахлоридов дает тетрахлорид рения :
- 3 ReCl 5 + Re 3 Cl 9 → 6 ReCl 4
Ссылки
[ редактировать ]- ^ Коттон, ФА; Уолтон, Р.А. «Множественные связи между атомами металлов», Оксфорд (Оксфорд): 1993. ISBN 0-19-855649-7 .
- ^ Jump up to: а б с Колтон, Р. Химия рения и технеция. 965.
- ^ Ирмлер, Манфред; Мейер, Герд (1987). «Трихлорид рения, ReCl 3 и его 5/3-гидратный синтез, кристаллическая структура и термическое расширение». Журнал неорганической и общей химии . 552 (9): 81–89. дои : 10.1002/zaac.19875520908 .
- ^ Гейлнанн, В.; Рис, ФРВ; Бильц. В. : Нахр. Гес. Висс. Геттинген, 1932, 579.
- ^ Линкольн, Р.; Уилкинсон, Г. (1980). «Трирения нонахлорид». Неорг. Синтез. 20:44 . дои : 10.1002/9780470132517.ch12 . ISBN 978-0-470-13251-7 .
- ^ Ирмлер, Манфред; Мейер, Герд (1987). «Трихлорид рения, ReCl 3 и его 5/3-гидратный синтез, кристаллическая структура и термическое расширение». Журнал неорганической и общей химии . 552 (9): 81–89. дои : 10.1002/zaac.19875520908 .