Платина(IV) хлорид
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Платина тетрахлорид | |
| Другие имена Платина(IV) хлорид | |
| Идентификаторы | |
3D model ( JSmol ) |
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.033.300 |
| Номер ЕС |
|
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| PtCl 4 | |
| Молярная масса | 336.89 g/mol |
| Появление | коричнево-красный порошок |
| Плотность | 4,303 г/см 3 (безводный) 2,43 г/см 3 (пентагидрат) |
| Температура плавления | 370 ° C (698 ° F, 643 К) (разлагается) |
| 58,7 г/100 мл (безводный) очень растворим (пентагидрат) | |
| Растворимость | безводный растворим в ацетоне слабо растворим в этаноле нерастворим в эфире пентагидрат растворим в спирте , эфире |
| −93.0·10 −6 см 3 /моль | |
| Структура | |
| Квадратный плоский | |
| Опасности | |
| СГС Маркировка : [1] | |
    | |
| Опасность | |
| Х290 , Х301 , Х314 , Х317 , Х334 | |
| P234 , P260 , P261 , P264 , P270 , P272 , P280 , P285 , P301+P310 , P301+P330+P331 , P302+P352 , P303+P361+P353 , P304+P340 , P304+P341 , П305+П351+П338 , P310 , P321 , P330 , P333+P313 , P342+P311 , P363 , P390 , P404 , P405 , P501 | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 276 мг/кг (крыса, перорально) |
| Родственные соединения | |
Другие анионы | Бромид платины(IV) Фторид платины(IV) Сульфид платины(IV) |
Другие катионы | Хлорид иридия(IV) |
Родственные соединения | Платина(II) хлорид Фторид платины(VI) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Хлорид платины(IV) — неорганическое соединение платины 4 и хлора формулой PtCl с брутто - . Это коричневое твердое вещество содержит платину в степени окисления 4+.
Структура
[ редактировать ]Типично для Pt(IV), металлические центры принимают октаэдрическую координационную геометрию {PtCl 6 }. Такая геометрия достигается за счет образования полимера, в котором половина хлоридных лигандов образует мостик между платиновыми центрами. Из-за своей полимерной структуры PtCl 4 растворяется только при разрыве хлоридных мостиковых лигандов . Таким образом, добавление HCl дает H 2 PtCl 6 . оснований Льюиса Аддукты Pt(IV) типа цис-PtCl 4 L 2 известны, но большинство из них получают окислением производных Pt(II). [2]
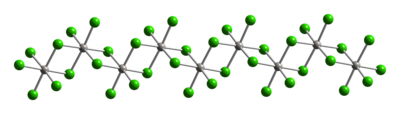 |
| Часть цепи (PtCl 4 ) ∞ кристаллической структуры хлорида платины(IV) |
Образование и реакции
[ редактировать ]PtCl 4 встречается главным образом при обращении с платинохлористоводородной кислотой , получаемой растворением металлической Pt в царской водке . Нагревание H 2 PtCl 6 до 220 °C дает нечистый PtCl 4 : [3]
- H 2 PtCl 6 → PtCl 4 + 2 HCl
Более чистый продукт можно получить путем нагревания в газообразном хлоре при температуре 250 °C. [4]
При удалении избытка кислот PtCl 4 кристаллизуется из водных растворов в крупные красные кристаллы пентагидрата PtCl 4 ·5(H 2 O), [5] который можно обезвоживать нагреванием примерно до 300°С в токе сухого хлора. Пентагидрат стабилен и используется в качестве коммерческой формы PtCl 4 .
Обработка PtCl 4 водным основанием дает [Pt(OH) 6 ] 2− ион. Под действием метиловых реактивов Гриньяра с последующим частичным гидролизом PtCl 4 превращается в кубический кластер [Pt(CH 3 ) 3 (OH)] 4 . [6] При нагревании PtCl 4 выделяется хлор с образованием PtCl 2 :
- PtCl 4 → PtCl 2 + Cl 2
более тяжелые галогениды PtBr 4 и PtI 4 Известны также .
Ссылки
[ редактировать ]- Коттон, Ю.А. Химия драгоценных металлов , Чепмен и Холл (Лондон): 1997. ISBN 0-7514-0413-6 .
- ^ «Тетрахлорид платины» . pubchem.ncbi.nlm.nih.gov . Проверено 27 декабря 2021 г.
- ^ М. Ф. Пилброу (1972). «Кристаллическая структура тетрахлорида платины». Журнал Химического общества, Химические коммуникации (5): 270–271. дои : 10.1039/C39720000270 .
- ^ А.Е. Швейцер; Г.Т. Керр (1978). «Термическое разложение платинохлористоводородной кислоты». Неорганическая химия . 17 (8): 2326–2327. дои : 10.1021/ic50186a067 .
- ^ Справочник по препаративной неорганической химии. 1 (3-е, исправленное изд.). Штутгарт: Энке. 1975. с. 1709. ISBN 978-3-432-02328-1 .
- ^ Джордж Сэмюэл Ньют (1920). Учебник неорганической химии . Лонгманс, Грин и компания. п. 694.
- ^ Гринвуд, Нью-Йорк; и Эрншоу, А. (1997). Химия элементов (2-е изд.), Оксфорд: Баттерворт-Хайнеманн. ISBN 0-7506-3365-4 .