Хлорид меди(II)
 | |
 Безводный | |
 Дигидрат | |
| Имена | |
|---|---|
| Название ИЮПАК Хлорид меди(II) | |
| Другие имена Хлорид меди | |
| Идентификаторы | |
| |
3D model ( JSmol ) |
|
| 8128168 | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Лекарственный Банк | |
| Информационная карта ECHA | 100.028.373 |
| Номер ЕС |
|
| 9300 | |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ |
|
| Число | 2802 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| CuCl 2 | |
| Молярная масса | 134,45 г/моль (безводный) 170,48 г/моль (дигидрат) |
| Появление | желто-коричневое твердое вещество (безводное) сине-зеленое твердое вещество (дигидрат) |
| Запах | без запаха |
| Плотность | 3,386 г/см 3 (безводный) 2,51 г/см 3 (дигидрат) |
| Температура плавления | 630 ° C (1166 ° F, 903 К) (экстраполировано) 100 °C (обезвоживание дигидрата) |
| Точка кипения | 993 ° C (1819 ° F; 1266 К) (безводный, разлагается) |
| 70,6 г/(100 мл) (0 °С) 75,7 г/(100 мл) (25 °С) 107,9 г/(100 мл) (100 °С) | |
| Растворимость | метанол: 68 г/(100 мл) (15 °С)
|
| +1080·10 −6 см 3 /моль | |
| Структура [1] [2] | |
| моноклинная (β = 121°) (безводная) орторомбический (дигидрат) | |
| С2/м (безводный) Pbmn (дигидрат) | |
а = 6,85 Å (безводный) 7,41 Å (дигидрат), b = 3,30 Å (безводный) 8,09 Å (дигидрат), c = 6,70 Å (безводный) 3,75 Å (дигидрат) | |
| Октаэдрический | |
| Опасности | |
| СГС Маркировка : | |
    | |
| Опасность | |
| Х301 , Х302 , Х312 , Х315 , Х318 , Х319 , Х335 , Х410 , Х411 | |
| P261 , P264 , P270 , P271 , P273 , P280 , P301+P310 , P301+P312 , P302+P352 , P304+P340 , P305+P351+P338 , P310 , P312 , P321 , P322 , П332 0 , +П313 , П337+ П313 , П362 , П363 , П391 , П403+П233 , П405 , П501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Невоспламеняющийся |
| NIOSH (пределы воздействия на здоровье в США): | |
МЕХ (Допускается) | СВВ 1 мг/м 3 (туз С) [3] |
РЕЛ (рекомендуется) | СВВ 1 мг/м 3 (туз С) [3] |
IDLH (Непосредственная опасность) | СВВ 100 мг/м 3 (туз С) [3] |
| Паспорт безопасности (SDS) | Фишер Сайентифик |
| Родственные соединения | |
Другие анионы | Фторид меди(II) Бромид меди(II) |
Другие катионы | Хлорид меди(I) Хлорид серебра Хлорид золота(III) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Хлорид меди(II) , также известный как хлорид меди , представляет собой неорганическое соединение с химической формулой Cu Cl 2 . Моноклинная дигидрата желтовато-коричневая безводная форма медленно поглощает влагу с образованием орторомбического сине-зеленого . CuCl 2 ·2H 2 O , с двумя молекулами гидратной воды . Его производят в промышленных масштабах для использования в качестве сокатализатора в процессе Вакера .
И безводная, и дигидратная формы встречаются в природе в виде редких минералов толбацита и эриохальцита соответственно.
Структура
[ редактировать ]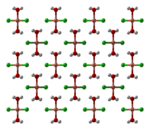
Безводный хлорид меди(II) имеет искаженную структуру йодида кадмия . В этой структуре медные центры имеют октаэдрическую форму . Большинство соединений меди(II) демонстрируют искажения идеализированной октаэдрической геометрии из-за эффекта Яна-Теллера , который в данном случае описывает локализацию одного d-электрона на молекулярной орбитали , которая является сильно разрыхляющей по отношению к паре хлоридных лигандов. В CuCl 2 ·2H 2 O медь снова принимает сильно искаженную октаэдрическую геометрию, центры Cu(II) окружены двумя водными лигандами и четырьмя хлоридными лигандами, которые асимметрично соединяются с другими центрами Cu. [4] [5]
Хлорид меди(II) парамагнитен . Представляющий исторический интерес, CuCl 2 ·2H 2 O был использован в первых электронного парамагнитного резонанса измерениях Евгением Завойским в 1944 году. [6] [7]
Свойства и реакции
[ редактировать ]Водные растворы, приготовленные из хлорида меди(II), содержат ряд комплексов меди(II) в зависимости от концентрации , температуры и присутствия дополнительных хлорид-ионов . К этим видам относится синяя окраска [Си(Н 2 О) 6 ] 2+ и желтый или красный цвет галогенидных комплексов формулы [CuCl 2+ х ] х - . [5]
Гидролиз
[ редактировать ]При обработке растворов хлорида меди(II) основанием происходит выпадение гидроксида меди (II) : [8]
- CuCl 2 + 2 NaOH → Cu(OH) 2 + 2 NaCl
Частичный гидролиз дает тригидроксид дихлорида меди . Cu 2 (OH) 3 Cl — популярный фунгицид. [8] Если водный раствор хлорида меди(II) оставить на воздухе и не стабилизировать небольшим количеством кислоты, он склонен к небольшому гидролизу. [5]
Редокс и разложение
[ редактировать ]Хлорид меди(II) — мягкий окислитель . Он начинает разлагаться на хлорид меди (I) и газообразный хлор примерно при 400 ° C (752 ° F) и полностью разлагается при температуре около 1000 ° C (1830 ° F): [8] [9] [10] [11]
- 2 CuCl 2 → 2 CuCl + Cl 2
Сообщаемая температура плавления хлорида меди (II) 498 ° C (928 ° F) представляет собой расплав смеси хлорида меди (I) и хлорида меди (II). Истинную температуру плавления 630 ° C (1166 ° F) можно экстраполировать, используя температуры плавления смесей CuCl и CuCl 2 . [12] [13] Хлорид меди(II) реагирует с несколькими металлами с образованием металлической меди или хлорида меди(I) (CuCl) при окислении другого металла. Чтобы превратить хлорид меди(II) в хлорид меди(I), может быть удобно восстановить водный раствор диоксидом серы в качестве восстановителя : [8]
- 2 CuCl 2 + SO 2 + 2 H 2 O → 2 CuCl + 2 HCl + H 2 SO 4
Координационные комплексы
[ редактировать ]CuCl 2 реагирует с HCl или другими источниками хлоридов с образованием комплексных ионов: красный [CuCl 3 ] − (содержится в трихлорокупрате калия (II) K[CuCl 3 ] ) (на самом деле это димер , [Cu 2 Cl 6 ] 2− , пара тетраэдров, имеющих общее ребро), а зеленый или желтый [СuCl 4 ] 2− (содержится в тетрахлорокупрате(II) калия К 2 [CuCl 4 ] ). [5] [14] [15]
- CuCl 2 + Cl − ⇌ [ CuCl3 ] −
- CuCl 2 + 2 Cl − ⇌ [ CuCl4 ] 2−
Некоторые из этих комплексов можно кристаллизовать из водного раствора, и они имеют самую разнообразную структуру. [14]
Хлорид меди(II) также образует множество координационных комплексов с такими лигандами , как аммиак , пиридин и оксид трифенилфосфина : [8] [5] [16]
- CuCl 2 + 2 C 5 H 5 N → [CuCl 2 (C 5 H 5 N) 2 ] (тетрагональный)
- CuCl 2 + 2 (C 6 H 5 ) 3 P=O → [CuCl 2 ((C 6 H 5 ) 3 P=O) 2 ] (тетраэдрический)
Однако «мягкие» лиганды, такие как фосфины (например, трифенилфосфин ), йодид и цианид , а также некоторые третичные амины, вызывают восстановление с образованием комплексов меди (I). [5]
Подготовка
[ редактировать ]Хлорид меди(II) получают в промышленных масштабах действием хлорирования меди. Медь при красном калении (300-400°C) соединяется непосредственно с газообразным хлором, образуя (расплавленный) хлорид меди(II). Реакция очень экзотермична . [8] [15]
- Cu(s) + Cl 2 (г) → CuCl 2 (ж)
Раствор хлорида меди(II) в промышленных масштабах получают добавлением газообразного хлора к циркулирующей смеси соляной кислоты и меди. Из этого раствора выпариванием можно получить дигидрат. [8] [10]
Хотя металлическая медь сама по себе не может быть окислена соляной кислотой, медьсодержащие основания, такие как гидроксид, оксид или карбонат меди (II), могут вступать в реакцию с образованием CuCl 2 в кислотно-основной реакции , которую впоследствии можно нагреть выше 100 °C (212 °F) для получения безводного производного. [8] [10]
После приготовления раствор CuCl 2 можно очистить кристаллизацией . В стандартном методе раствор смешивается с горячей разбавленной соляной кислотой и вызывает образование кристаллов путем охлаждения в хлориде кальция ( CaCl 2 ) ледяная баня. [17] [18]
Существуют косвенные и редко используемые способы использования ионов меди в растворе с образованием хлорида меди(II). Электролиз водного раствора хлорида натрия с помощью медных электродов дает (помимо прочего) сине-зеленую пену , которую можно собрать и превратить в гидрат. Хотя обычно этого не делают из-за выбросов токсичного газообразного хлора и преобладания более общего хлорщелочного процесса , электролиз преобразует металлическую медь в ионы меди в растворе, образуя соединение. Действительно, любой раствор ионов меди можно смешать с соляной кислотой и превратить в хлорид меди, удалив любые другие ионы. [19]
Использование
[ редактировать ]Сокатализатор в процессе Вакера
[ редактировать ]Основное промышленное применение хлорида меди (II) — в качестве сокатализатора с хлоридом палладия (II) в процессе Вакера . В этом процессе этен (этилен) преобразуется в этаналь (ацетальдегид) с использованием воды и воздуха. В ходе реакции PdCl 2 восстанавливается до , Pd а CuCl 2 служит для его повторного окисления до PdCl 2 . Затем воздух может окислить полученный CuCl обратно до CuCl 2 , завершая цикл. [20]
- C 2 H 4 + PdCl 2 + H 2 O → CH 3 CHO + Pd + 2 HCl
- Pd + 2 CuCl 2 → 2 CuCl + PdCl 2
- 4 CuCl + 4 HCl + O 2 → 4 CuCl 2 + 2 H 2 O
Общий процесс таков: [20]
- 2 С 2 Н 4 + О 2 → 2 СН 3 СНО
В органическом синтезе
[ редактировать ]Хлорид меди(II) имеет ряд узкоспециализированных применений в синтезе органических соединений . [17] Влияет на хлорирование ароматических углеводородов — часто его проводят в присутствии оксида алюминия . Способен хлорировать положение карбонильных альфа - соединений: [20] [21]
Эта реакция проводится в полярном растворителе, таком как диметилформамид , часто в присутствии хлорида лития , который ускоряет реакцию. [20]
CuCl 2 в присутствии кислорода может также окислять фенолы . Основной продукт может быть направлен на получение либо хинона , либо связанного продукта окислительной димеризации. Последний процесс обеспечивает высокопроизводительный путь получения 1,1-бинафтол : [22]
Такие соединения являются промежуточными продуктами синтеза BINAP и его производных. [20]
Дигидрат хлорида меди(II) способствует гидролизу ацетонидов , т.е. снятию защиты с целью регенерации диолов. [23] или аминоспирты , как в этом примере (где TBDPS = трет -бутилдифенилсилил ): [24]
CuCl 2 также катализирует свободнорадикальное присоединение сульфонилхлоридов к алкенам ; альфа-хлорсульфон может затем подвергаться элиминированию основанием с образованием винилсульфона . [20]
Катализатор в производстве хлора
[ редактировать ]Хлорид меди(II) используется в качестве катализатора в различных процессах получения хлора путем оксихлорирования . Процесс Дикона протекает при температуре от 400 до 450 ° C в присутствии хлорида меди: [8]
- 4 HCl + O 2 → 2 Cl 2 + 2 H 2 O
Хлорид меди(II) катализирует хлорирование при производстве винилхлорида и дихлорметана . [8]
Хлорид меди (II) используется в медно-хлорном цикле , где он реагирует с паром с образованием дихлорида оксида меди (II) и хлористого водорода, а затем извлекается в цикле в результате электролиза хлорида меди (I). [11]
Нишевое использование
[ редактировать ]Хлорид меди(II) используется в пиротехнике как сине-зеленый краситель. При испытании пламенем хлориды меди, как и все соединения меди, излучают зелено-синий свет. [25]
В картах индикаторов влажности (HIC) на рынке можно найти HIC от коричневого до лазурного цвета (основа хлорида меди (II)), не содержащие кобальта. [26] В 1998 году Европейское Сообщество классифицировало предметы, содержащие хлорид кобальта(II) в количестве от 0,01 до 1% по весу , как T (токсичные) с соответствующей R-фразой R49 (может вызвать рак при вдыхании). В связи с этим были разработаны новые безкобальтовые индикаторные карты влажности, содержащие медь. [27]
Хлорид меди(II) используется в качестве протравы в текстильной промышленности, нефти подсластителя , консерванта для древесины и очистителя воды . [8] [28]
Естественное явление
[ редактировать ]
Хлорид меди (II) встречается в природе в виде очень редкого безводного минерала толбацита и дигидрата эриохальцита. [29] Оба встречаются возле фумарол и в некоторых медных рудниках. [30] [31] [32] Смешанные оксигидроксид-хлориды типа атакамита ( Cu 2 (OH) 3 Cl ) более распространены, возникают среди зон окисления медных рудных пластов в засушливом климате. [33]
Безопасность и биологическое воздействие
[ редактировать ]Хлорид меди(II) может быть токсичным. ниже 1,3 ppm допускает в питьевой воде только концентрацию ионов меди Агентство по охране окружающей среды США . [34] Всасывание хлорида меди приводит к головной боли, диарее, падению артериального давления и лихорадке. Проглатывание больших количеств может вызвать отравление медью , расстройства ЦНС и гемолиз . [35] [36]
Было продемонстрировано, что хлорид меди (II) вызывает хромосомные аберрации и митотического нарушения цикла в клетках A. cepa (лук). [37] Такие клеточные нарушения приводят к генотоксичности . Хлорид меди (II) также изучался как вредный загрязнитель окружающей среды. Часто присутствуя в воде, пригодной для орошения, он может отрицательно влиять на воду и почвенные микробы. [38] В частности, было обнаружено, что денитрифицирующие бактерии очень чувствительны к присутствию хлорида меди(II). Установлено, что в концентрации 0,95 мг/л хлорид меди(II) вызывает 50%-ное ингибирование (IC50) метаболической активности денитрифицирующих микробов. [39]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ А. Ф. Уэллс (1947). «Кристаллическая структура безводного хлорида меди и стереохимия атома меди». Журнал Химического общества : 1670–1675. дои : 10.1039/JR9470001670 .
- ^ Сидней Браунштейн; Нам Фонг Хан; Эрик Гейб; Ивон ЛеПейдж (1989). «Переопределение кристаллической структуры дигидрата хлорида меди». Журнал кристаллографии . 189 (1): 13–15. Бибкод : 1989ЗК....189...13Б . дои : 10.1524/zkri.1989.189.1-2.13 .
- ^ Jump up to: а б с Карманный справочник NIOSH по химическим опасностям. «#0150» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Уэллс, А. Ф. (1984). Структурная неорганическая химия . Оксфорд: Кларендон Пресс. п. 253. ИСБН 0-19-855370-6 .
- ^ Jump up to: а б с д и ж Гринвуд, Н.Н. и Эрншоу, А. (1997). Химия элементов (2-е изд.), Оксфорд: Баттерворт-Хайнеманн. п. 1183–1185 гг. ISBN 0-7506-3365-4 .
- ^ Петр Балаж (2008). Механохимия в нанонауке и горнодобывающей промышленности . Спрингер. п. 167. ИСБН 978-3-540-74854-0 .
- ^ Карло Корвая (2009). Электронный парамагнитный резонанс: инструментарий практикующего врача . Джон Уайли и сыновья. п. 3. ISBN 978-0-470-25882-8 .
- ^ Jump up to: а б с д и ж г час я дж к Чжан, Дж.; Ричардсон, HW (2016). «Медные соединения». Энциклопедия промышленной химии Ульмана . стр. 1–31. дои : 10.1002/14356007.a07_567.pub2 . ISBN 978-3-527-30673-2 .
- ^ Шуйлян Чжоу; Шаобо Шен; Далонг Чжао; Чжитао Чжан; Шию Ян (2017). «Испарение и разложение эвтектик хлорида меди и хлорида натрия». Журнал термического анализа и калориметрии . 129 (3): 1445–1452. дои : 10.1007/s10973-017-6360-y . S2CID 99924382 .
- ^ Jump up to: а б с Ричардсон, HW (2003). «Медные соединения». Энциклопедия химической технологии Кирка-Отмера . дои : 10.1002/0471238961.0315161618090308.a01.pub2 . ISBN 0471238961 .
- ^ Jump up to: а б З. Ван; Г. Марин; Г. Ф. Натерер; КС Габриэль (2015). «Термодинамика и кинетика термического разложения хлорида меди в реакции его гидролиза» (PDF) . Журнал термического анализа и калориметрии . 119 (2): 815–823. дои : 10.1007/s10973-014-3929-6 . S2CID 93668361 .
- ^ Вильгельм Бильц; Вернер Фишер (1927). «Вклад в систематическую теорию взаимоотношений. XLIII. О системе медно-/меднохлоридной системы». Журнал неорганической и общей химии (на немецком языке). 166 (1): 290–298. дои : 10.1002/zaac.19271660126 .
- ^ А. Г. Мэсси; Н. Р. Томпсон; БФГ Джонсон (1973). Химия меди, серебра и золота . Эльзевир Наука. п. 42. ИСБН 9780080188607 .
- ^ Jump up to: а б Найда С. Гилл; Ф. Б. Тейлор (1967). Тетрагалокомплексы диположительных металлов первого переходного ряда . Неорганические синтезы. Том. 9. стр. 136–142. дои : 10.1002/9780470132401.ch37 . ISBN 978-0-470-13240-1 .
- ^ Jump up to: а б Х. Уэйн Ричардсон (1997). Справочник по соединениям меди и их применению . ЦРК Пресс. стр. 24–68. ISBN 9781482277463 .
- ^ В. Либус; С.К. Хоффманн; М. Ключковский; Х. Твардовская (1980). «Равновесия растворов хлорида меди (II) в пиридине и смесях пиридин-разбавитель». Неорганическая химия . 19 (6): 1625–1632. дои : 10.1021/ic50208a039 .
- ^ Jump up to: а б С.Х. Берц, Э.Х. Фэйрчайлд, в Справочнике реагентов для органического синтеза, том 1: Реагенты, вспомогательные вещества и катализаторы для образования CC-связей , (РМ Коутс, SE Дания, ред.), стр. 220–223, Уайли, Нью-Йорк, 1738 г. .
- ^ ВЛФ Армарего; Кристина Ли Линь Чай (22 мая 2009 г.). Очистка лабораторных химикатов ( отрывок из Google Books ) (6-е изд.). Баттерворт-Хайнеманн. п. 461. ИСБН 978-1-85617-567-8 .
- ^ Дж. Джи; У.К. Купер (1990). «Электрохимическое получение порошка закиси меди: Часть I. Основная электрохимия». Журнал прикладной электрохимии . 20 (5): 818–825. дои : 10.1007/BF01094312 . S2CID 95677720 .
- ^ Jump up to: а б с д и ж Николас Д. П. Косфорд; Полин Пей Ли; Тьерри Оллевье (2015). «Хлорид меди(II)». Энциклопедия реагентов для органического синтеза : 1–8. дои : 10.1002/047084289X.rc214.pub3 . ISBN 9780470842898 .
- ^ CE Кастро; Э. Дж. Гоган; Округ Колумбия Оусли (1965). «Галогениды меди». Журнал органической химии . 30 (2): 587. doi : 10.1021/jo01013a069 .
- ^ Дж. Брусси; JLG Гроенендейк; Дж. М. Коппеле; ACA Янсен (1985). «О механизме образования s(-)-(1,1'-бинафталин)-2,2'-диола через комплексы меди(II)амина». Тетраэдр . 41 (16): 3313. doi : 10.1016/S0040-4020(01)96682-7 .
- ^ Чандрасекхар, М.; Кусум Л. Чандра; Винод К. Сингх (2003). «Полный синтез (+)-боронолида, (+)-деацетилборонолида и (+)-дидеацетилборонолида». Журнал органической химии . 68 (10): 4039–4045. дои : 10.1021/jo0269058 . ПМИД 12737588 .
- ^ Кришна, Палакодеты Радха; Г. Даякер (2007). «Стереоселективный полный синтез (-)-андрахцинидина по протоколу перекрестного метатезиса олефинов». Буквы тетраэдра . 48 (41). Эльзевир: 7279–7282. дои : 10.1016/j.tetlet.2007.08.053 .
- ^ Кларк, Джим (август 2018 г.). «Испытания пламенем» . chemguide.co.uk . Архивировано из оригинала 27 ноября 2020 года . Проверено 10 января 2021 г.
- ^ США 20150300958 A1 , Эван Кун Лун Юдзи Хадзиме, «Регулируемые колориметрические индикаторы влажности», опубликовано в 2015 г.
- ^ «Дихлорид кобальта» . Европейское химическое агентство . ЭХА . Проверено 30 мая 2023 г.
- ^ Б. Х. Патель (2011). «11 – Красители натуральные». В Кларке, М. (ред.). Справочник по текстильному и промышленному крашению . Издательство Вудхед. стр. 412–413. ISBN 9781845696955 . Проверено 2 июня 2023 г.
- ^ Марлен К. Моррис, Ховард Ф. Макмерди, Элоиза Х. Эванс, Борис Парецкин, Гарри С. Паркер и Николас К. Панагиотопулос (1981) Гидрат хлорида меди (эриохальцит) , в Стандартных порошковых рентгенограммах Национального бюро Стандарты, Монография 25, раздел 18; страница 33.
- ^ «Толбачит» . Mindat.org . Проверено 24 августа 2023 г.
- ^ «Эриохальцит» . Mindat.org . Проверено 24 августа 2023 г.
- ^ «Новый список минералов IMA» . Университет Триеста . Международная минералогическая ассоциация . Проверено 24 августа 2023 г.
- ^ «Атакамит» . Mindat.org . Проверено 30 мая 2023 г.
- ^ «Национальные правила первичной питьевой воды» . Агентство по охране окружающей среды . 30 ноября 2015 года . Проверено 29 мая 2023 г.
- ^ «Медь: краткий обзор медицинской информации» (PDF) . Информационный бюллетень по окружающей среде . Департамент экологических служб Нью-Гэмпшира. 2005. ARD-EHP-9. Архивировано из оригинала (PDF) 20 января 2017 года.
- ^ «Паспорт безопасности» . Сигма Олдрич . Проверено 30 июня 2023 г.
- ^ Макар, Тугче Калефетоглу (2020). «Ресвератрол уменьшает физиологическую, биохимическую, цитогенетическую и анатомическую токсичность, вызванную воздействием хлорида меди (II) в Allium cepa L». Наука об окружающей среде и исследования загрязнения . 27 (1): 657–667. дои : 10.1007/s11356-019-06920-2 . ПМИД 31808086 . S2CID 208649491 .
- ^ Шияб, Сафван (2018). «Фитоаккумуляция меди из поливной воды и ее влияние на внутреннюю структуру салата» . Сельское хозяйство . 8 (2): 29. doi : 10.3390/aggricultural8020029 .
- ^ Очоа-Эррера, Валерия (2011). «Токсичность ионов меди (II) для микроорганизмов в системах биологической очистки сточных вод» . Наука об общей окружающей среде . 412 (1): 380–385. Бибкод : 2011ScTEn.412..380O . doi : 10.1016/j.scitotenv.2011.09.072 . ПМИД 22030247 .
Дальнейшее чтение
[ редактировать ]- Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- Лиде, Дэвид Р. (1990). CRC справочник по химии и физике: готовый справочник химических и физических данных . Бока-Ратон: CRC Press. ISBN 0-8493-0471-7 .
- Индекс Merck , 7-е издание, Merck & Co, Рэуэй, Нью-Джерси, США, 1960 г.
- Д. Николлс, Комплексы и переходные элементы первого ряда , Macmillan Press, Лондон, 1973.
- А.Ф. Уэллс, « Структурная неорганическая химия» , 5-е изд., Oxford University Press, Оксфорд, Великобритания, 1984.
- Дж. Марч, Передовая органическая химия , 4-е изд., с. 723, Уайли, Нью-Йорк, 1992 год.
- Реагенты Fieser & Fieser для органического синтеза, том 5, стр. 158, Wiley, Нью-Йорк, 1975.
- Д. У. Смит (1976). «Хлорокупраты(II)». Обзоры координационной химии . 21 (2–3): 93–158. дои : 10.1016/S0010-8545(00)80445-2 .



