Карбонат меди(II)
 | |
| Имена | |
|---|---|
| Название ИЮПАК Карбонат меди(II) | |
| Другие имена Карбонат меди, нейтральный карбонат меди | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.013.338 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| CuCO 3 | |
| Молярная масса | 123.5549 |
| Появление | зеленый или синий порошок [1] |
| нерастворим в воде [ нужны разъяснения ] | |
Произведение растворимости ( K sp ) | 10 −11.45 ± 0.10 и 25 °С. [2] [3] [4] |
| Структура | |
| Пока-С 2 с (7) [1] | |
а = 6,092 Å, b = 4,493 Å, c = 7,030 Å α = 90°, β = 101,34°°, γ = 90° | |
| 5 [1] | |
| Опасности | |
| точка возгорания | Невоспламеняющийся |
| Родственные соединения | |
Другие анионы | Сульфат меди(II) |
Другие катионы | Карбонат никеля(II) Цинк карбонат |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Карбонат меди(II) или карбонат меди (II) представляет собой химическое соединение формулы CuCO.
3 . При температуре окружающей среды представляет собой ионное твердое вещество ( соль ), состоящее из меди (II) катионов Cu. 2+
и карбонат- анионы CO 2−
3 .
Это соединение встречается редко, поскольку его трудно приготовить. [2] и легко реагирует с водной влагой из воздуха. Термины «карбонат меди», «карбонат меди (II)» и «карбонат меди» почти всегда относятся (даже в текстах по химии) к основному карбонату меди карбоната меди (II) (или гидроксиду , например Cu ).
2 ( ОН ) 2 СО
3 (который встречается в природе в виде минерала малахита ) или Cu
3 ( ОН ) 2 ( СО
3 ) 2 ( азурит ). По этой причине квалификатор нейтральный может использоваться вместо слова «базовый» для обозначения конкретно CuCO.
3 .
Подготовка
[ редактировать ]Реакции, в которых можно ожидать образования CuCO
3 , например, растворы для смешивания сульфата меди(II) CuSO
4 и карбонат натрия в условиях окружающей среды дают вместо этого основной карбонат и CO.
2 , из-за большого сродства Cu 2+
ион для гидроксид- аниона HO −
. [5]
Термическое разложение основного карбоната при атмосферном давлении приводит к образованию оксида меди (II), а не карбоната.
В 1960 году CWFT Писториус заявил о синтезе путем нагревания основного карбоната меди при 180 ° C в атмосфере углекислого газа (450 атм ) и воды (50 атм) в течение 36 часов. Основную часть продукции составлял хорошо кристаллизованный малахит Cu.
22
3 ( OH ) 2 , но также был получен небольшой выход ромбоэдрического вещества, заявленного как CuCO.
3 . [6] Однако этот синтез, видимо, не был воспроизведен. [2]
О надежном синтезе настоящего карбоната меди (II) впервые сообщили в 1973 году Хартмут Эрхардт и др. Соединение получено в виде серого порошка путем нагревания основного карбоната меди в атмосфере углекислого газа (полученного при разложении оксалата серебра Ag
2 С
22О
4 ) при 500 °С и 2 ГПа ( 20 000 атм). Установлено, что соединение имеет моноклинную структуру. [7]
Химические и физические свойства
[ редактировать ]Стабильность сухого CuCO
3 критически зависит от парциального давления углекислого газа (p CO 2 ). Он стабилен в течение нескольких месяцев в сухом воздухе, но медленно разлагается на CuO и CO.
2 , если р СО 2 меньше 0,11 атм. [3]
В присутствии воды или влажного воздуха при температуре 25 °C CuCO
3 стабилен только при p CO 2 выше 4,57 атмосфер и pH примерно от 4 до 8. [8] Ниже этого парциального давления он реагирует с водой с образованием основного карбоната ( азурита , Cu
3 ( КО
3 ) 2 ( ОН ) 2 ). [3]
- 3 CuCO
3 + Ч
2 О → С
3 (КО
3 )
2 (О)
2 + СО
2
В сильноосновных растворах комплексный анион Cu(CO
3 ) 2−
2 . Вместо этого формируется [3]
Произведение растворимости истинного карбоната меди (II) было измерено Рейтерером и другими как pK so = 11,45 ± 0,10 при 25 ° C. [2] [3] [4]
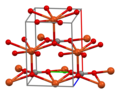
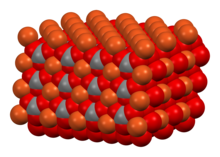
Структура
[ редактировать ]В кристаллической структуре CuCO 3 медь имеет искаженную квадратно-пирамидальную координационную среду с координационным числом 5. Каждый карбонатный ион связан с 5 медными центрами. [1]
- Элементарная ячейка CuCO 3
- Среда координации меди
- Карбонатная координационная среда
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д Х. Зайдель, Х. Эрхардт, К. Вишванатан, В. Йоханнес (1974): «Представление, структура и свойства карбоната меди (II)». З. неорг. Общая химия, том 410, страницы 138-148. два : 10.1002/zaac.19744100207
- ^ Перейти обратно: а б с д Рольф Грауэр (1999) « Продукты растворимости карбонатов M (II). Архивировано 1 ноября 2018 г. в Wayback Machine ». Технический отчет НТБ-99-03, НАГРА – Национальный кооператив по захоронению радиоактивных отходов; страницы 8, 14 и 17. Перевод У. Бернера.
- ^ Перейти обратно: а б с д и Ф. Райтерер, В. Йоханнес, Х. Гамсьегер (1981): «Полумикроопределение констант растворимости: карбонат меди (II) и карбонат железа (II)». Микрохим. Acta, том 1981, стр. 63. два : 10.1007/BF01198705
- ^ Перейти обратно: а б Ф. Рейтерер (1980): «Константы растворимости и свободные энтальпии образования нейтральных карбонатов переходных металлов». Диссертация, Montanuniversität Leoben.
- ^ Ахмад, Заки (2006). Принципы коррозионной техники и борьбы с коррозией . Оксфорд: Баттерворт-Хайнеманн. стр. 120–270. ISBN 9780750659246 .
- ^ CWFT Писториус (1960): «Синтез при высоком давлении и постоянные решетки нормального карбоната меди». Experientia, том XVI, стр. 447-448. дои : 10.1007/BF02171142
- ^ Хартмут Эрхардт, Вильгельм Йоханнес и Хинрих Зайдель (1973): «Синтез карбоната меди (II) под высоким давлением», Z. Naturforsch., том 28b, выпуск 9-10, стр. 682. дои : 10.1515/znb-1973-9-1021
- ^ Х. Гамсьегер и В. Прейс (1999): «Содержание меди в синтетическом карбонате меди». Письмо Дж. Чему. Образование., том 76, вып. 10, стр. 1339. два : 10.1021/ed076p1339.1