Царская водка
 | |
| Имена | |
|---|---|
| Название ИЮПАК Тригидрохлорид азотной кислоты | |
Другие имена
| |
| Идентификаторы | |
3D model ( JSmol ) | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
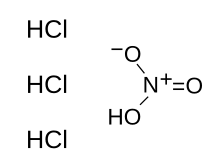
| HNO 3 + 3 HCl | |
| Появление | Дымящаяся жидкость. Свежеприготовленная царская водка бесцветна, но за считанные секунды становится желтой, оранжевой или красной. |
| Плотность | 1,01–1,21 г/см 3 |
| Температура плавления | -42 ° C (-44 ° F; 231 К) |
| Точка кипения | 108 ° С (226 ° F; 381 К) |
| смешивается | |
| Давление пара | 21 мбар |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |


Царская водка ( / ˈ r eɪ ɡ i ə , ˈ r iː dʒ i ə / ; от лат . «царственная вода» или «королевская вода») — смесь азотной , и соляной кислот оптимально в молярном соотношении 1: 3. [б] Царская водка — дымящая жидкость. Свежеприготовленная царская водка бесцветна, но в течение нескольких секунд становится желтой, оранжевой или красной из-за образования нитрозилхлорида и диоксида азота . назвали его так Алхимики потому, что он может растворять благородные металлы, такие как золото и платина , но не все металлы.
Подготовка и разложение
[ редактировать ]При смешивании концентрированной соляной кислоты и концентрированной азотной кислоты происходят химические реакции. В результате этих реакций образуются летучие продукты — нитрозилхлорид и газообразный хлор :
- HNO 3 + 3 HCl → NOCl + Cl 2 + 2 H 2 O
о чем свидетельствует дымящая природа и характерный желтый цвет царской водки. По мере того, как летучие продукты выходят из раствора, царская водка теряет свою эффективность. Нитрозилхлорид (NOCl) может далее разлагаться на оксид азота (NO) и элементарный хлор ( кл 2 ):
- 2 NOCl → 2 NO + Cl 2
Эта диссоциация ограничена равновесием. Следовательно, в дымах над царской водкой помимо нитрозилхлорида и хлора содержится еще и оксид азота (NO). Поскольку оксид азота легко вступает в реакцию с кислородом воздуха , образующиеся газы также содержат диоксид азота . NO 2 (красный дым):
- 2 НО + О 2 → 2 НО 2
Приложения
[ редактировать ]Царская водка в основном используется для производства золотохлористоводородной кислоты , электролита в процессе Вольвилля высочайшей чистоты (99,999%) для аффинажа золота .
Царская водка также используется при травлении и в определенных аналитических процедурах . Его также используют в некоторых лабораториях для очистки стеклянной посуды от органических соединений и металлических частиц. предпочтительнее более традиционной ванны с хромовой кислотой Этот метод для очистки ЯМР-трубок , поскольку не может оставаться никаких следов парамагнитного хрома , портящих спектры. [1] Хотя ванны с хромовой кислотой не рекомендуются из-за высокой токсичности хрома и возможности взрыва, царская водка сама по себе очень агрессивна и стала причиной нескольких взрывов из-за неправильного обращения. [2]
Поскольку ее компоненты быстро реагируют, что приводит к ее разложению , царская водка быстро теряет свою эффективность (но остается сильной кислотой), поэтому ее компоненты обычно смешивают только непосредственно перед использованием.
Химия
[ редактировать ]Растворение золота
[ редактировать ]
Царская водка растворяет золото , хотя ни одна из входящих в нее кислот не способна сделать это сама по себе. Азотная кислота является мощным окислителем, который растворяет очень небольшое количество золота, образуя ионы золота (III) ( В 3+ ). Соляная кислота обеспечивает готовый запас ионов хлорида ( кл. − ), которые реагируют с ионами золота с образованием анионов тетрахлораурата(III) ( [AuCl 4 ] − ), также в растворе. Реакция с соляной кислотой является равновесной реакцией, способствующей образованию анионов тетрахлораурата(III). Это приводит к удалению ионов золота из раствора и позволяет осуществить дальнейшее окисление золота. Золото растворяется, образуя золотохлористоводородную кислоту . Кроме того, золото может растворяться хлором, присутствующим в царской водке. Соответствующие уравнения :
- Ау + 3 ХНО
3 + 4 HCl [AuCl
4 ] −
+ 3 НЕТ
2 + Ч
33О +
+ 2 ч.
22О
или
- Ау + ХНО
3 + 4 HCl [AuCl
4 ] −
+ НЕТ + Ч
33О +
+ Ч
2О .
Твердую тетрахлорзолотокислоту можно выделить путем выпаривания избытка царской водки и разложения остаточной азотной кислоты путем многократного нагревания раствора с добавлением соляной кислоты. На этом этапе снижается содержание азотной кислоты (см. разложение царской водки ). Если требуется элементарное золото, его можно селективно восстановить с помощью восстановителей, таких как диоксид серы , гидразин , щавелевая кислота и т. д. [3] Уравнение восстановления окисленного золота ( В 3+ ) диоксидом серы ( SO 2 ) заключается в следующем:
- 2 [AuCl 4 ] − (водн.) + 3 SO 2 (г) + 6 H 2 O(l) → 2 Au(s) + 12 H + (водный раствор) + 3 SO 2− 4 (водный раствор) + 8 Cl − (вода)
Растворение платины
[ редактировать ]Аналогичные уравнения можно записать и для платины . Как и в случае с золотом, реакцию окисления можно записать, указав в качестве продукта оксида азота либо оксид азота, либо диоксид азота:
- Pt(s) + 4 NO - 3 (вод) + 8 H + (водн.) → Pt 4+ (водн.) + 4 NO 2 (г) + 4 H 2 O(л)
- 3 Pt(т) + 4 NO - 3 (водн.) + 16 H + (водный) → 3 Пт 4+ (водн.) + 4 NO(г) + 8 H 2 O(л)
Окисленный ион платины затем реагирует с ионами хлорида, в результате чего образуется хлороплатинат-ион:
- Пт 4+ (водный раствор) + 6 Cl − (водн.) → [PtCl 6 ] 2− (вода)
Экспериментальные данные показывают, что реакция платины с царской водкой протекает значительно сложнее. В результате первоначальных реакций образуется смесь платинохлористоводородной кислоты ( H 2 [PtCl 4 ] ) и нитрозоплатинхлорид ( [NO] 2 [PtCl 4 ] ). Хлорид нитрозоплатины представляет собой твердый продукт. Если желательно полное растворение платины, необходимо провести повторные экстракции остаточных твердых веществ концентрированной соляной кислотой:
- 2 Pt(т.в.) + 2 HNO 3 (водн.) + 8 HCl(водн.) → [NO] 2 [PtCl 4 ](т.в.) + H 2 [PtCl 4 ](водн.) + 4 H 2 O(ж)
и
- [NO] 2 [PtCl 4 ](т.в.) + 2 HCl(водн.) ⇌ H 2 [PtCl 4 ](водн.) + 2 NOCl(г)
Платинохлористоводородную кислоту можно окислить до платинохлористоводородной кислоты, насытив раствор молекулярным хлором ( Cl 2 ) при нагревании:
- H 2 [PtCl 4 ](водн.) + Cl 2 (г) → H 2 [PtCl 6 ](водн.)
Растворение твердых частиц платины в царской водке было способом открытия самых плотных металлов, иридия и осмия , оба из которых обнаружены в платиновых рудах и не растворяются в царской водке, а собираются в виде нерастворимого металлического порошка (элементарных Ir, Os) на поверхности воды. основание судна.
(через четыре дня).
Осаждение растворенной платины
[ редактировать ]На практике, когда металлы платиновой группы очищают путем растворения в царской водке, золото (обычно связанное с МПГ) осаждается обработкой хлоридом железа (II) . Платина в фильтрате в виде гексахлорплатината(IV) превращается в гексахлорплатинат аммония добавлением хлорида аммония . Эта соль аммония крайне нерастворима, и ее можно отфильтровать. Воспламенение (сильный нагрев) превращает его в металлическую платину: [4]
- 3 [NH 4 ] 2 [PtCl 6 ] → 3 Pt + 2 N 2 + 2 [NH 4 ]Cl + 16 HCl
Неосажденный гексахлорплатинат(IV) восстанавливают элементарным цинком , и аналогичный метод подходит для мелкомасштабного восстановления платины из лабораторных остатков. [5]
Реакция с оловом
[ редактировать ]Царская водка реагирует с оловом с образованием хлорида олова(IV) , содержащего олово в высшей степени окисления:
- 4 HCl + 2 HNO 3 + Sn → SnCl 4 + NO 2 + NO + 3 H 2 O
Реакция с другими веществами
[ редактировать ]Он может реагировать с пиритом железа с образованием хлорида железа (III) :
- FeS 2 + 5 HNO 3 + 3 HCl → FeCl 3 + 2 H 2 SO 4 + 5 NO + 2 H 2 O
История
[ редактировать ]Царская водка впервые появилась в книге «Об открытии истины» псевдо-Гебера (около г. 1300 ), который создал ее путем добавления нашатырного спирта ( хлорида аммония ) к азотной кислоте. [6] [д] Приготовление царской водки путем непосредственного смешивания соляной кислоты с азотной стало возможным только после открытия в конце шестнадцатого века процесса получения свободной соляной кислоты. [8]

На третьем ключе Василия Валентина ( около 1600 г. ) изображен дракон на переднем плане и лиса, поедающая петуха, на заднем плане. Петух символизирует золото (из-за его ассоциации с восходом солнца и ассоциации солнца с золотом), а лиса представляет царскую водку. Повторяющееся растворение, нагревание и повторное растворение (петух, поедающий лису, поедает петуха) приводит к накоплению газообразного хлора в колбе. Затем золото кристаллизуется в форме хлорида золота (III) , красные кристаллы которого Василий назвал «розой наших мастеров» и «кровью красного дракона». [9] О реакции не сообщалось в химической литературе до 1895 года. [10]
Антуан Лавуазье назвал царскую водку нитросоляной кислотой в 1789 году. [11]
Когда Германия вторглась в Данию во время Второй мировой войны, венгерский химик Джордж де Хевеши растворил золотые Нобелевские премии немецких физиков Макса фон Лауэ (1914 г.) и Джеймса Франка (1925 г.) в царской водке, чтобы не допустить их конфискации нацистами. Правительство Германии запретило немцам принимать или сохранять какие-либо Нобелевские премии после того, как заключенный в тюрьму борец за мир Карл фон Осецкий получил Нобелевскую премию мира в 1935 году. Де Хевеши поместил полученный раствор на полку в своей лаборатории в Институте Нильса Бора . Впоследствии нацисты проигнорировали его, считая, что в банке (одной из сотен, стоящих на полках) содержатся обычные химические вещества. После войны де Хевеши вернулся, нашел нетронутый раствор и выделил золото из кислоты. Золото было возвращено Шведской королевской академии наук и Нобелевскому фонду. Они отлили медали заново и снова вручили их Лауэ и Франку. [12] [13]
См. также
[ редактировать ]- Зеленая смерть – агрессивный раствор, используемый для проверки устойчивости металлов к коррозии.
- Раствор пираньи - смесь окисляющей кислоты, содержащая серную кислоту и перекись водорода, иногда также используемую для чистки стеклянной посуды.
Примечания
[ редактировать ]- ^ Информация в информационном окне относится к мольному соотношению азотной кислоты и соляной кислоты 1:3 .
- ^ Относительные концентрации двух кислот в воде различаются; значения могут составлять 65% мас./об. для азотной кислоты и 35% мас./об. для соляной кислоты – то есть фактические значения Массовое соотношение HNO 3 :HCl составляет менее 1:2.
- ↑ платиновая советская памятная монета . Если быть точным,
- ↑ Однако Ахмад Й. Аль-Хасан (2005) утверждал, что исламские тексты, датированные периодом до 13 века, включая работы Джабира ибн Хайяна и Абу Бакра ар-Рази , на самом деле содержали подробные описания царской водки . [7]
Ссылки
[ редактировать ]- ^ Хоффман, Р. (10 марта 2005 г.) Как сделать образец ЯМР , Еврейский университет . По состоянию на 31 октября 2006 г.
- ^ Американская ассоциация промышленной гигиены , Инциденты, связанные с безопасностью в лабораториях: взрывы . По состоянию на 8 сентября 2010 г.
- ^ Реннер, Герман; Шламп, Гюнтер; Холлманн, Дитер; Люшоу, Ганс Мартин; Тьюс, Питер; Рото, Джозеф; Дерманн, Клаус; Кнедлер, Альфонс; и др. «Золото, золотые сплавы и соединения золота». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a12_499 . ISBN 978-3527306732 .
- ^ Хант, LB; Левер, FM (1969). «Платиновые металлы: обзор производственных ресурсов для промышленного использования» (PDF) . Обзор платиновых металлов . 13 (4): 126–138. дои : 10.1595/003214069X134126138 .
- ^ Кауфман, Джордж Б.; Тетер, Ларри А.; Рода, Ричард Н. (1963). Восстановление платины из лабораторных остатков . Неорганические синтезы. Том. 7. С. 232–236. дои : 10.1002/9780470132388.ch61 . ISBN 978-0-470-13238-8 .
- ^ Карпенко Владимир; Норрис, Джон А. (2002). «Купорос в истории химии» . Химический список . 96 (12): 997–1005. п. 1002. Как отмечают Карпенко и Норрис, неопределенная датировка корпуса псевдо-Гебера (который, вероятно, был написан более чем одним автором) делает датировку царской водки столь же неопределенной.
- ^ Ахмад Ю. Аль-Хасан, Культурные контакты в построении универсальной цивилизации: вклад ислама , опубликовано Исследовательским центром исламской истории, искусства и культуры ОИК в 2005 году и доступно в Интернете по адресу «История науки и технологий в исламе».
- ^ Мультауф, Роберт П. (1966). Истоки химии . Лондон: Олдборн. п. 208, примечание 29; ср. п. 142, примечание 79.
- ^ Принсипи, Лоуренс М. (2013). Тайны алхимии . Чикаго: Издательство Чикагского университета. ISBN 978-0-226-68295-2 . стр. 149-153.
- ^ Роуз, Томас Кирк (1895). «Диссоциация хлорида золота» . Журнал Химического общества . 67 : 881–904. дои : 10.1039/CT8956700881 . См. Принсипи 2013 , с. 152.
- ^ Лавуазье, Антуан (1790). Элементы химии. в новом систематическом порядке, содержащем все современные открытия . Эдинбург: Уильям Крич. п. 116. ИСБН 978-0-486-64624-4 . .
- ^ «Приключения в радиоизотопных исследованиях» , Джордж Хевеси.
- ^ Биргитта Леммель (2006). «Медали Нобелевской премии и медаль премии по экономике» . Нобелевский фонд.
Внешние ссылки
[ редактировать ]- Химия оживает! Царская Аква
- Царская водка в Периодической таблице видео (Ноттингемский университет)
- Демонстрация растворения золотой монеты в кислоте (царской водке)







