Перренат аммония

| |

| |
| Имена | |
|---|---|
| Другие имена
перренат аммония,
Перренат аммония(VII) | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.033.690 |
| Номер ЕС |
|
ПабХим CID
|
|
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| NH 4 ReO 4 | |
| Молярная масса | 268.2359 g/mol |
| Плотность | 3,97 г/см 3 , твердый |
| Температура плавления | 200°C (разлагается) [1] |
| 2,8 г/100 мл (0 °С), 6,2 г/100 мл (20 °С), 12,0 г/100 мл (40 °С), 20,7 г/100 мл (60 °С), 32,3 г/100 мл ( 80 °С), 39,1 г/100 мл (90 °С) | |
| Структура | |
| шеелит | |
| Н/Д | |
| Опасности | |
| точка возгорания | Невоспламеняющийся |
| Родственные соединения | |
Другие анионы
|
Перманганат аммония ; пертехнетат аммония |
Другие катионы
|
перренат натрия ; перреновая кислота |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Перренат аммония (APR) — аммониевая соль перреновой кислоты NH 4 ReO 4 . Это наиболее распространенная форма торговли рением . Это белая соль; растворим в этаноле и воде и слабо растворим в NH 4 Cl. [2] Впервые он был описан вскоре после открытия рения. [3]
Структура
[ редактировать ]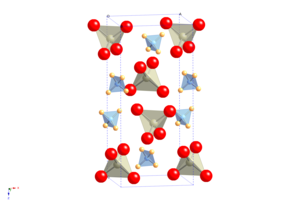
Кристаллическая структура APR напоминает структуру шеелита , атомарный катион заменен аммонием. Пертехнетат 4 (NH TcO 4 ) , периодат (NH 4 IO 4 ), тетрахлорталлат (NH 4 TlCl 4 ) и тетрахлориндат (NH 4 InCl 4 ) следуют этому мотиву. [4] Он претерпевает переход молекулярного ориентационного упорядочения при охлаждении без изменения пространственной группы, но с сильно анизотропным изменением формы элементарной ячейки , что приводит к необычному свойству наличия положительного коэффициента Re ЯКР при температуре и давлении . [5] APR не дает гидратов. [2]
Подготовка
[ редактировать ]Перренат аммония можно получить практически из всех распространенных источников рения. Металл, оксиды и сульфиды можно окислить азотной кислотой , а полученный раствор обработать водным раствором аммиака. Альтернативно водный раствор Re 2 O 7 можно обработать аммиаком с последующей кристаллизацией. [6] [7]
Реакции
[ редактировать ]Перренат аммония является слабым окислителем. Медленно реагирует с соляной кислотой: [2]
- NH 4 ReO 4 + 6 HCl → NH 4 [ReCl 4 O] + Cl 2 ↑ + 3H 2 O.
Восстанавливается до металлического Re при нагревании в водороде : [1]
- 2 NH 4 ReO 4 + 7 H 2 → 2 Re + 8 H 2 O + 2 NH 3
Перренат аммония разлагается до летучих Re 2 O 7 начиная с 250 °C. При нагревании в закрытой трубке при температуре 500 °С разлагается до диоксида рения : [1]
- 2NH 4 ReO 4 → 2ReO 2 + N 2 + 4 H 2 O
Ион аммония можно заменить некоторыми концентрированными нитратами, например нитратом калия, нитратом серебра и т. д.: [2]
- NH 4 ReO 4 + KNO 3 → KReO 4 ↓ + NH 4 NO 3
Его можно восстановить до нонагидридорената натрием в этаноле: [2]
- NH 4 ReO 4 + 18Na + 13C 2 H 5 OH → Na 2 [ReH 9 ] + 13NaC 2 H 5 O + 3NaOH + NH 3 •H 2 O.
Ссылки
[ редактировать ]- ^ Jump up to: а б с Георг Брауэр (1954), Перренат аммония , Фердинанд Энке Верлаг, с. 1108
- ^ Jump up to: а б с д и Lidin, R. (2007). Неорганическая химия в реакциях [ Inorganic chemistry in reactions ] (in Russian) (2nd ed.). Moscow: Drofa. p. 332. ISBN 978-5-358-01303-2 .
- ^ Ноддак, Дж.; Ноддак, В. (1929). «Кислородные соединения рения». Журнал неорганической и общей химии (на немецком языке). 181 (6): 1–37. Стартовый код : 1929NW.....17...93N . дои : 10.1002/zaac.19291810102 .
- ^ И.П. Суэйнсон и Р.Дж.К. Браун (1997). «Уточнение структуры перрената аммония с использованием псевдоспиновой модели ориентации ионов аммония». Акта Кристаллографика . Б53 (1): 76–81. Бибкод : 1997AcCrB..53...76S . дои : 10.1107/S0108768196011160 .
- ^ Р.Дж.К. Браун и С.Л. Сигел (1977). " 187 Ре, 14 Н и 2 Ядерные квадрупольные связи H в NH 4 ReO 4 : Доказательства возможного фазового перехода». Журнал химической физики . 67 (7): 3163–7. Бибкод : 1977JChPh..67.3163B . doi : 10.1063/1.435229 .
- ^ О. Глемсер «Перренат аммония» в Справочнике по препаративной неорганической химии , 2-е изд. Под редакцией Г. Брауэра, Academic Press, 1963, Нью-Йорк. том. 1. п. 1476–85 .
- ^ Ричард Дж. Томпсон (1966). «Перренат аммония». Неорганические синтезы . Неорганические синтезы . Том. 8. стр. 171–173. дои : 10.1002/9780470132395.ch44 . ISBN 9780470132395 .
- Вм. Т. Смит, С. Хармон Лонг (1948). «Соли перреновой кислоты. I. Щелочные металлы и аммоний». Журнал Американского химического общества . 70 (1): 354–356. дои : 10.1021/ja01181a110 .