Бериллий
 | |||||||||||||||||||||||||||||||
| Бериллий | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | / bə ˈ r ɪ l i ə m / | ||||||||||||||||||||||||||||||
| Появление | бело-серый металлик | ||||||||||||||||||||||||||||||
| Стандартный атомный вес А р °(Бе) | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Бериллий в таблице Менделеева | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Атомный номер ( Z ) | 4 | ||||||||||||||||||||||||||||||
| Группа | группа 2 (щелочноземельные металлы) | ||||||||||||||||||||||||||||||
| Период | период 2 | ||||||||||||||||||||||||||||||
| Блокировать | S-блок | ||||||||||||||||||||||||||||||
| Электронная конфигурация | [ Он ] 2с 2 | ||||||||||||||||||||||||||||||
| Электроны на оболочку | 2, 2 | ||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||
| Фаза в СТП | твердый | ||||||||||||||||||||||||||||||
| Температура плавления | 1560 К (1287 °С, 2349 °F) | ||||||||||||||||||||||||||||||
| Точка кипения | 2742 К (2469 °С, 4476 °F) | ||||||||||||||||||||||||||||||
| Плотность (при 20°С) | 1,845 г/см 3 [ 3 ] | ||||||||||||||||||||||||||||||
| в жидком состоянии (при температуре плавления ) | 1,690 г/см 3 | ||||||||||||||||||||||||||||||
| Критическая точка | 5205 К, МПа (экстраполировано) | ||||||||||||||||||||||||||||||
| Теплота плавления | 12,2 кДж/моль | ||||||||||||||||||||||||||||||
| Теплота испарения | 292 кДж/моль | ||||||||||||||||||||||||||||||
| Молярная теплоемкость | 16,443 Дж/(моль К) | ||||||||||||||||||||||||||||||
Давление пара
| |||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||
| Стадии окисления | 0, [ 4 ] +1, [ 5 ] +2 ( амфотерный оксид) | ||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,57. | ||||||||||||||||||||||||||||||
| Энергии ионизации |
| ||||||||||||||||||||||||||||||
| Атомный радиус | эмпирический: 112 вечера | ||||||||||||||||||||||||||||||
| Ковалентный радиус | 96±15 часов | ||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 153 вечера | ||||||||||||||||||||||||||||||
| Другие объекты недвижимости | |||||||||||||||||||||||||||||||
| Естественное явление | первобытный | ||||||||||||||||||||||||||||||
| Кристаллическая структура | гексагональная плотноупакованная (ГПУ) ( hP2 ) | ||||||||||||||||||||||||||||||
| Константы решетки | а = 228,60 вечера c = 358,42 вечера (при 20 ° C) [ 3 ] | ||||||||||||||||||||||||||||||
| Тепловое расширение | 10.98 × 10 −6 /К (при 20 °С) [ 3 ] [ а ] | ||||||||||||||||||||||||||||||
| Теплопроводность | 200 Вт/(м⋅К) | ||||||||||||||||||||||||||||||
| Электрическое сопротивление | 36 нОм⋅м (при 20 °C) | ||||||||||||||||||||||||||||||
| Магнитный заказ | диамагнитный | ||||||||||||||||||||||||||||||
| Молярная магнитная восприимчивость | −9.0 × 10 −6 см 3 /моль [ 6 ] | ||||||||||||||||||||||||||||||
| Модуль Юнга | 287 ГПа | ||||||||||||||||||||||||||||||
| Модуль сдвига | 132 ГПа | ||||||||||||||||||||||||||||||
| Объемный модуль | 130 ГПа | ||||||||||||||||||||||||||||||
| Скорость звука тонкого стержня | 12890 м/с (при комнатной температуре ) [ 7 ] | ||||||||||||||||||||||||||||||
| коэффициент Пуассона | 0.032 | ||||||||||||||||||||||||||||||
| Твердость по шкале Мооса | 6.0 | ||||||||||||||||||||||||||||||
| Твердость по Виккерсу | 1670 МПа | ||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 590–1320 МПа | ||||||||||||||||||||||||||||||
| Номер CAS | 7440-41-7 | ||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||
| Открытие | Луи Николя Воклен (1798) | ||||||||||||||||||||||||||||||
| Первая изоляция | Фридрих Вёлер и Антуан Бюсси (1828) | ||||||||||||||||||||||||||||||
| Изотопы бериллия | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
Бериллий — химический элемент ; имеет символ Be и атомный номер 4. Это стально-серый, твердый, прочный, легкий и хрупкий щелочноземельный металл . Это двухвалентный элемент, который встречается в природе только в сочетании с другими элементами с образованием минералов. Драгоценные камни с высоким содержанием бериллия включают берилл ( аквамарин , изумруд , красный берилл ) и хризоберилл . Это относительно редкий элемент во Вселенной , обычно образующийся в результате расщепления более крупных атомных ядер, столкнувшихся с космическими лучами . В ядрах звезд бериллий обедняется, поскольку он превращается в более тяжелые элементы. Бериллий составляет около 0,0004 процента массы земной коры. Ежегодный объем производства бериллия в мире, составляющий 220 тонн, обычно производится путем экстракции из минерала берилла . Это сложный процесс, поскольку бериллий прочно связывается с кислородом .
В конструкционных применениях сочетание высокой жесткости на изгиб , термической стабильности , теплопроводности и низкой плотности (в 1,85 раза выше, чем у воды) делает металлический бериллий желательным аэрокосмическим материалом для компонентов самолетов, ракет , космических кораблей и спутников . [ 9 ] Из-за своей низкой плотности и атомной массы бериллий относительно прозрачен для рентгеновских лучей и других форм ионизирующего излучения ; следовательно, это наиболее распространенный материал окон для рентгеновского оборудования и компонентов детекторов частиц . [ 9 ] При добавлении в качестве легирующего элемента к алюминию , меди (особенно сплаву бериллия с медью ), железу или никелю бериллий улучшает многие физические свойства. [ 9 ] Например, инструменты и компоненты из -бериллиевых сплавов прочны тверды и медно и не создают искр при ударе о стальную поверхность. На воздухе поверхность бериллия при комнатной температуре легко окисляется с образованием пассивационного слоя толщиной 1–10 нм, защищающего его от дальнейшего окисления и коррозии. [ 10 ] Металл окисляется в объеме (за пределами пассивационного слоя) при нагревании выше 500 ° C (932 ° F). [ 11 ] и блестяще горит при нагревании примерно до 2500 ° C (4530 ° F). [ 12 ]
Коммерческое использование бериллия требует постоянного использования соответствующего оборудования для борьбы с пылью и промышленного контроля из-за токсичности вдыхаемой бериллийсодержащей пыли, которая может вызвать у некоторых людей хроническое опасное для жизни аллергическое заболевание - бериллиоз . [ 13 ] Бериллиоз вызывает пневмонию и другие сопутствующие респираторные заболевания.
Характеристики
[ редактировать ]Физические свойства
[ редактировать ]стального цвета Бериллий представляет собой твердый металл , хрупкий при комнатной температуре и имеющий плотноупакованную гексагональную кристаллическую структуру . [ 9 ] Он обладает исключительной жесткостью ( модуль Юнга 287 ГПа) и температурой плавления 1287 °C. Модуль упругости бериллия примерно на 35% больше, чем у стали. Сочетание этого модуля и относительно низкой плотности приводит к необычайно высокой скорости звукопроводимости в бериллии — около 12,9 км/с в условиях окружающей среды . Другими важными свойствами являются высокая удельная теплоемкость ( 1925 Дж·кг −1 ·К −1 ) и теплопроводность ( 216 Вт·м −1 ·К −1 ), которые делают бериллий металлом с лучшими характеристиками рассеивания тепла на единицу веса. В сочетании с относительно низким коэффициентом линейного теплового расширения (11,4×10 −6 К −1 ), эти характеристики обеспечивают уникальную стабильность в условиях термической нагрузки. [ 14 ]
Ядерные свойства
[ редактировать ]Встречающийся в природе бериллий, за исключением небольшого загрязнения космогенными радиоизотопами , представляет собой изотопно чистый бериллий-9, имеющий ядерный спин 3/2 . Бериллий имеет большое сечение рассеяния нейтронов высоких энергий, около 6 барнов для энергий выше примерно 10 кэВ. Следовательно, он работает как отражатель нейтронов и замедлитель нейтронов , эффективно замедляя нейтроны до диапазона тепловой энергии ниже 0,03 эВ, где полное сечение как минимум на порядок ниже; точное значение сильно зависит от чистоты и размера кристаллитов материала.
Единственный первичный изотоп бериллия 9 Be также подвергается нейтронной реакции (n,2n) с энергией нейтронов около 1,9 МэВ, в результате чего образуется 8 Be , который почти сразу распадается на две альфа-частицы. Таким образом, для нейтронов высоких энергий бериллий является умножителем нейтронов, выделяя больше нейтронов, чем поглощая. Эта ядерная реакция: [ 15 ]
- 9
4 Будь
+ п → 2 4
2 Он
+ 2 н
Нейтроны высвобождаются при ядер столкновении бериллия с энергичными альфа-частицами. [ 14 ] производя ядерную реакцию
- 9
4 Будь
+ 4
2 Он
→ 12
6 С
+ н
где 4
2 Он
является альфа-частицей и 12
6 С
представляет собой ядро углерода-12 . [ 15 ]
Бериллий также выделяет нейтроны при бомбардировке гамма-лучами. Таким образом, природный бериллий, бомбардируемый альфа- или гамма-излучением подходящего радиоизотопа, является ключевым компонентом большинства ядерных реакций источников нейтронов с использованием радиоизотопов для лабораторного производства свободных нейтронов.
Небольшие количества трития выделяются при 9
4 Будь
ядра поглощают нейтроны низкой энергии в трехступенчатой ядерной реакции
- 9
4 Будь
+ н → 4
2 Он
+ 6
2 Он
, 6
2 Он
→ 6
3 Ли
+ б − , 6
3 Ли
+ н → 4
2 Он
+ 3
1 час
6
2 Он
имеет период полураспада всего 0,8 секунды, β − представляет собой электрон, а 6
3 Ли
имеет высокое сечение поглощения нейтронов. Тритий является вызывающим озабоченность радиоизотопом в потоках отходов ядерных реакторов. [ 16 ]
Оптические свойства
[ редактировать ]Как металл, бериллий прозрачен или полупрозрачен для большинства длин волн рентгеновских лучей и гамма-лучей , что делает его полезным для выходных окон рентгеновских трубок и других подобных устройств. [ 17 ]
Изотопы и нуклеосинтез
[ редактировать ]В звездах создаются как стабильные, так и нестабильные изотопы бериллия, но радиоизотопы сохраняются недолго. Считается, что большая часть стабильного бериллия во Вселенной изначально образовалась в межзвездной среде, когда космические лучи вызвали деление более тяжелых элементов, обнаруженных в межзвездном газе и пыли. [ 18 ] Первичный бериллий содержит только один стабильный изотоп: 9 Be и, следовательно, бериллий является единственным среди всех стабильных элементов с четным атомным номером моноизотопным и мононуклидным элементом .

Радиоактивный космогенный 10 Be образуется в атмосфере Земли в результате лучами расщепления кислорода космическими . [ 19 ] 10 Be накапливается на поверхности почвы , где его относительно длительный период полураспада (1,36 миллиона лет) обеспечивает длительное время пребывания перед распадом до бора -10. Таким образом, 10 Be и его дочерние продукты используются для изучения естественной эрозии почвы , почвообразования и развития латеритных почв , а также в качестве показателя для измерения изменений солнечной активности и возраста ледяных кернов . [ 20 ] Производство 10 Be обратно пропорционален солнечной активности, поскольку усиление солнечного ветра в периоды высокой солнечной активности уменьшает поток галактических космических лучей , достигающих Земли. [ 19 ] Ядерные взрывы также образуют 10 Быть за счет реакции быстрых нейтронов с 13 C в углекислом газе в воздухе. Это один из показателей прошлой активности на полигонах ядерного оружия . [ 21 ] Изотоп 7 Be (период полураспада 53 дня) также космогенен и демонстрирует обилие атмосферы, связанное с солнечными пятнами, как и 10 Быть.
8 Be имеет очень короткий период полураспада около 8 × 10. −17 Это способствует его значительной космологической роли, поскольку элементы тяжелее бериллия не могли быть произведены в результате ядерного синтеза во время Большого взрыва . [ 22 ] Это связано с отсутствием достаточного времени во время фазы нуклеосинтеза Большого взрыва для производства углерода путем слияния 4 Ядра He и очень низкие концентрации доступного бериллия-8. Британский астроном сэр Фред Хойл впервые показал, что энергетические уровни 8 Будь и 12 C позволяет производить углерод с помощью так называемого процесса тройного альфа в звездах, питаемых гелием, где доступно больше времени нуклеосинтеза. Этот процесс позволяет производить углерод в звездах, но не в результате Большого взрыва. Созданный звездами углерод (основа углеродной жизни ), таким образом, является компонентом элементов газа и пыли, выбрасываемых звездами AGB и сверхновыми (см. Также нуклеосинтез Большого взрыва ), а также созданием всех других элементов с помощью атомных числа больше, чем у углерода. [ 23 ]
2s-электроны бериллия могут способствовать образованию химической связи. Поэтому, когда 7 Be распадается путем захвата L-электронов , забирая электроны со своих атомных орбиталей , которые могут участвовать в связывании. Это делает скорость его распада в измеримой степени зависимой от химического окружения – редкое явление при ядерном распаде. [ 24 ]
Самый короткоживущий известный изотоп бериллия — 16 Be, который распадается за счет нейтронного излучения с периодом полураспада 6,5 × 10 −22 с . [ 25 ] Экзотические изотопы 11 Будь и 14 Известно, что он обладает ядерным ореолом . [ 26 ] Это явление можно понимать как ядро 11 Будь и 14 У Be соответственно 1 и 4 нейтрона, вращающихся по орбитам существенно за пределами классической фермиевской модели ядра «капля воды».
возникновение
[ редактировать ]

На Солнце концентрация составляет 0,1 части на миллиард (ppb). бериллия [ 27 ] Бериллий имеет концентрацию от 2 до 6 частей на миллион (ppm) в земной коре и является 47-м по распространенности элементом. [ 28 ] [ 29 ] Наибольшая концентрация его в почвах составляет 6 ppm. [ 29 ] Следовые количества 9 Встречаются в атмосфере Земли. [ 29 ] Концентрация бериллия в морской воде составляет 0,2–0,6 частей на триллион . [ 29 ] [ 30 ] Однако в речной воде бериллий более распространен с концентрацией 0,1 частей на миллиард. [ 31 ]
Бериллий содержится более чем в 100 минералах. [ 32 ] но большинство из них необычны или редки. Наиболее распространенные бериллийсодержащие минералы включают: бертрандит (Be 4 Si 2 O 7 (OH) 2 ), берилл (Al 2 Be 3 Si 6 O 18 ), хризоберилл (Al 2 BeO 4 ) и фенакит (Be 2 SiO 4 ). Драгоценными формами берилла являются аквамарин , красный берилл и изумруд . [ 14 ] [ 33 ] [ 34 ] Зеленый цвет бериллов ювелирного качества обусловлен различным содержанием хрома (около 2% для изумруда). [ 35 ]
Две основные руды бериллия, берилл и бертрандит, находятся в Аргентине, Бразилии, Индии, Мадагаскаре, России и США. [ 35 ] Общие мировые запасы бериллиевой руды превышают 400 000 тонн. [ 35 ]
Производство
[ редактировать ]Извлечение бериллия из его соединений — сложный процесс из-за его высокого сродства к кислороду при повышенных температурах и способности восстанавливать воду при удалении оксидной пленки. В настоящее время США, Китай и Казахстан являются единственными тремя странами, занимающимися добычей бериллия в промышленных масштабах. [ 36 ] Казахстан производит бериллий из концентрата, накопленного до распада Советского Союза примерно в 1991 году. К середине 2010-х годов этот ресурс был практически исчерпан. [ 37 ]
Производство бериллия в России было остановлено в 1997 году, его планируется возобновить в 2020-х годах. [ 38 ] [ 39 ]
Бериллий чаще всего извлекается из минерала берилла , который либо спекается с использованием экстрагента, либо плавится в растворимую смесь. Процесс спекания включает смешивание берилла с фторосиликатом натрия и содой при температуре 770 ° C (1420 ° F) с образованием фторбериллата натрия , оксида алюминия и диоксида кремния . [ 9 ] Гидроксид бериллия осаждают из раствора фторбериллата натрия и гидроксида натрия в воде. Добыча бериллия методом расплава включает измельчение берилла в порошок и нагревание его до 1650 °C (3000 °F). [ 9 ] Расплав быстро охлаждают водой, а затем повторно нагревают до 250–300 °C (от 482 до 572 °F) в концентрированной серной кислоте , в основном с получением сульфата бериллия и сульфата алюминия . [ 9 ] Затем водный аммиак используется для удаления алюминия и серы, оставляя гидроксид бериллия.
Гидроксид бериллия, полученный методом агломерации или расплава, затем преобразуется во фторид бериллия или хлорид бериллия . Для образования фторида водный фторид аммония добавляют к гидроксиду бериллия с образованием осадка тетрафторбериллата аммония, который нагревают до 1000 ° C (1830 ° F) с образованием фторида бериллия. [ 9 ] Нагревание фторида до 900 °C (1650 °F) с магнием образует мелкодисперсный бериллий, а дополнительный нагрев до 1300 °C (2370 °F) создает компактный металл. [ 9 ] При нагревании гидроксида бериллия образуется оксид, который при соединении с углеродом и хлором становится хлоридом бериллия. электролиз расплавленного хлорида бериллия. Затем для получения металла используют [ 9 ]
Химические свойства
[ редактировать ]Бериллий имеет высокую электроотрицательность по сравнению с другими элементами 2 группы; таким образом, связи C-Be поляризованы менее сильно, чем другие CM. II облигации, [ 40 ] хотя присоединенный углерод все еще несет отрицательный дипольный момент .
Атом бериллия имеет электронную конфигурацию [He] 2s 2 . Преобладающая степень окисления бериллия +2; атом бериллия потерял оба своих валентных электрона. Комплексы низших степеней окисления бериллия чрезвычайно редки. Например, сообщалось о соединениях бис (карбена), которые, как предполагается, содержат бериллий в состояниях окисления 0 и +1, хотя эти утверждения оказались противоречивыми. [ 41 ] [ 42 ] Описан устойчивый комплекс со связью Be-Be, формально характеризующий бериллий в степени окисления +1. [ 43 ] Химическое поведение бериллия во многом обусловлено его малым атомным и ионным радиусом. Таким образом, он имеет очень высокие потенциалы ионизации и сильную поляризацию, когда он связан с другими атомами, поэтому все его соединения являются ковалентными . Его химический состав имеет сходство с химическим составом алюминия, что является примером диагонального взаимодействия .
При комнатной температуре на поверхности бериллия образуется оксидный пассивирующий слой толщиной 1–10 нм, который предотвращает дальнейшие реакции с воздухом, за исключением постепенного утолщения оксида примерно до 25 нм. При нагреве выше примерно 500 °C окисление в объеме металла происходит вдоль границ зерен. [ 11 ] Когда металл воспламеняется на воздухе при нагревании выше температуры плавления оксида около 2500 °C, бериллий ярко горит. [ 12 ] образуя смесь оксида бериллия и нитрида бериллия . Бериллий легко растворяется в неокисляющих кислотах , таких как HCl и разбавленная H 2 SO 4 , но не в азотной кислоте или воде, поскольку при этом образуется оксид. Это поведение похоже на поведение алюминия. Бериллий растворяется также в растворах щелочей. [ 9 ] [ 44 ]
Бинарные соединения бериллия(II) полимерны в твердом состоянии. BeF 2 имеет структуру, подобную кремнезему разделенными по вершинам , с тетраэдрами BeF 4, . BeCl 2 и BeBr 2 имеют цепочечную структуру с тетраэдрами, разделенными по краям. Оксид бериллия BeO представляет собой белое тугоплавкое твердое вещество, имеющее кристаллическую структуру вюрцита и теплопроводность, такую же высокую, как у некоторых металлов. BeO амфотерен . бериллия сульфид , селенид и теллурид Известны , имеющие структуру цинковой обманки . [ 45 ] Нитрид бериллия Be 3 N 2 представляет собой тугоплавкое соединение, легко гидролизующееся. азид бериллия BeN 6 Известен , а фосфид бериллия Be 3 P 2 имеет структуру, аналогичную Be 3 N 2 . ряд боридов Известен бериллия, таких как Be 5 B, Be 4 B, Be 2 B, BeB 2 , BeB 6 и BeB 12 . Карбид бериллия Be 2 C — тугоплавкое соединение кирпично-красного цвета, которое вступает в реакцию с водой с образованием метана . [ 45 ] бериллия не Силицид обнаружен. [ 44 ]
Галогениды BeX 2 (X = F, Cl, Br, I) имеют линейное мономерное молекулярное строение в газовой фазе. [ 44 ] Комплексы галогенидов образуются с одним или несколькими лигандами, отдающими в общей сложности две пары электронов. Такие соединения подчиняются правилу октетов . Другие 4-координационные комплексы, такие как акваион [Be(H 2 O) 4 ] 2+ также подчиняются правилу октетов.
Водные растворы
[ редактировать ]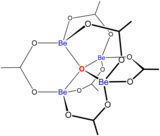
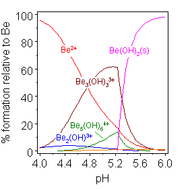
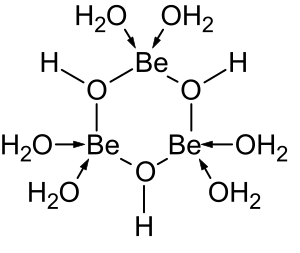
Растворы солей бериллия, таких как сульфат бериллия и нитрат бериллия , являются кислыми из-за гидролиза [Be(H 2 O) 4 ] 2+ ион. Концентрация первого продукта гидролиза, [Be(H 2 O) 3 (OH)] + , составляет менее 1% от концентрации бериллия. Наиболее стабильным продуктом гидролиза является тримерный ион [Be 3 (OH) 3 (H 2 O) 6 ] 3+ . Гидроксид бериллия Be(OH) 2 нерастворим в воде при pH 5 и более. Следовательно, соединения бериллия обычно нерастворимы при биологическом pH. Из-за этого вдыхание человеком пыли металлического бериллия приводит к развитию смертельного состояния бериллиоза . Be(OH) 2 растворяется в сильнощелочных растворах . [ 46 ]
Бериллий(II) образует мало комплексов с монодентатными лигандами, поскольку молекулы воды в аква-ионе [Be(H 2 O) 4 ] 2+ очень прочно связаны с ионом бериллия. Заметным исключением является ряд водорастворимых комплексов с фторид -ионом: [ 47 ]
Бериллий (II) образует множество комплексов с бидентатными лигандами, содержащими атомы донора кислорода. [ 46 ] Вид [Be 3 O(H 2 PO 4 ) 6 ] 2- примечателен наличием в центре трехкоординационного оксид-иона. Основной ацетат бериллия Be 4 O(OAc) 6 имеет оксидный ион, окруженный тетраэдром атомов бериллия.
С органическими лигандами, такими как малонат -ион, кислота депротонирует при образовании комплекса. Донорными атомами являются два атома кислорода. Образование комплекса конкурирует с реакцией гидролиза ионов металлов, также образуются смешанные комплексы как с анионом, так и с гидроксид-ионом. Например, известны производные циклического тримера, в которых бидентатный лиганд заменяет одну или несколько пар молекул воды. [ 48 ]
Алифатические гидроксикарбоновые кислоты, такие как гликолевая кислота, образуют в растворе довольно слабые монодентатные комплексы, в которых гидроксильная группа остается неповрежденной. В твердом состоянии гидроксильная группа может депротонироваться: гексамер, , был изолирован давно. [ 48 ] [ 49 ] Ароматические гидроксилиганды (т.е. фенолы ) образуют относительно прочные комплексы. Например, log K 1 и log K 2 , были зарегистрированы значения для комплексов с тироном равные 12,2 и 9,3 . [ 48 ] [ 50 ]
Бериллий обычно имеет довольно плохое сродство к амминным лигандам. [ 48 ] [ 51 ] Лиганды, такие как ЭДТА, ведут себя как дикарбоновые кислоты. [ нужна ссылка ] Существует много ранних сообщений о комплексах с аминокислотами, но, к сожалению, они ненадежны, поскольку на момент публикации не были понятны сопутствующие реакции гидролиза. Значения log β ок. Сообщается о 6-7 случаях. Степень образования невелика из-за конкуренции с реакциями гидролиза. [ 48 ] [ 51 ]
Органическая химия
[ редактировать ]Бериллийорганическая химия ограничена академическими исследованиями из-за стоимости и токсичности бериллия, производных бериллия и реагентов, необходимых для введения бериллия, таких как хлорид бериллия . Известно, что металлоорганические соединения бериллия обладают высокой реакционной способностью. [ 52 ] Примерами известных бериллийорганических соединений являются динеопентилбериллий , [ 53 ] бериллоцен (Cp 2 Be), [ 54 ] [ 55 ] [ 56 ] [ 57 ] диаллилбериллий (по реакции обмена диэтилбериллия на триаллилбор), [ 58 ] бис(1,3-триметилсилилаллил)бериллий, [ 59 ] Будь(мес) 2 , [ 52 ] и (комплекс бериллия(I)) дибериллоцен . [ 43 ] Лиганды также могут быть арилами. [ 60 ] и алкинилы. [ 61 ]
История
[ редактировать ]Минерал берилл , содержащий бериллий, использовался, по крайней мере, со времен династии Птолемеев в Египте. [ 62 ] В первом веке нашей эры римский натуралист Плиний Старший упомянул в своей энциклопедии « Естественная история» , что берилл и изумруд («смарагдус») похожи. [ 63 ] Папирус Graecus Holmiensis , написанный в третьем или четвертом веке нашей эры, содержит заметки о том, как приготовить искусственный изумруд и берилл. [ 63 ]

Ранние анализы изумрудов и бериллов, проведенные Мартином Генрихом Клапротом , Торберном Улофом Бергманом , Францем Карлом Ахардом и Иоганном Якобом Биндхаймом, всегда давали схожие элементы, что приводило к ошибочному выводу, что оба вещества представляют собой алюмосиликаты . [ 64 ] Минералог Рене Жюст Аюи обнаружил, что оба кристалла геометрически идентичны, и попросил химика Луи-Николя Воклена провести химический анализ. [ 62 ]
В статье 1798 года, прочитанной в Институте Франции , Воклен сообщил, что он нашел новую «землю», растворив гидроксид алюминия из изумруда и берилла в дополнительной щелочи . [ 65 ] Редакторы журнала Annales de Chimie et de Physique назвали новую землю «глюцином» из-за сладкого вкуса некоторых ее соединений. [ 66 ] Клапрот предпочел название «бериллина» из-за того, что иттрий также образует сладкие соли. [ 67 ] [ 68 ] Название «бериллий» впервые было использовано Вёлером в 1828 году. [ 69 ]

Фридрих Вёлер [ 70 ] и Антуан Бюсси [ 71 ] независимо выделил бериллий в 1828 году химической реакцией металлического калия с хлоридом бериллия следующим образом:
- BeCl 2 + 2 К → 2 KCl + Be
Используя спиртовку, Вёлер нагрел чередующиеся слои хлорида бериллия и калия в платиновом тигле с проволочной заглушкой. Вышеуказанная реакция произошла немедленно и привела к тому, что тигель нагрелся добела. Охладив и промыв полученный серо-черный порошок, он увидел, что он состоит из мелких частиц с темным металлическим блеском. [ 72 ] Высокореактивный калий был получен электролизом его соединений — процессом, открытым 21 годом ранее. Химический метод с использованием калия давал лишь мелкие зерна бериллия, из которых невозможно было отлить или отковать слиток металла.
В результате прямого электролиза расплавленной смеси фторида бериллия и фторида натрия , проведенного Полем Лебо в 1898 году, были получены первые чистые (от 99,5 до 99,8%) образцы бериллия. [ 72 ] Однако промышленное производство началось только после Первой мировой войны. Первоначальное промышленное участие включало дочерние компании и ученых, связанных с Union Carbide and Carbon Corporation в Кливленде, штат Огайо, и Siemens & Halske AG в Берлине. В США процессом руководил Хью С. Купер, директор компании Kemet Laboratories. В Германии первый коммерчески успешный процесс производства бериллия был разработан в 1921 году Альфредом Штоком и Гансом Гольдшмидтом . [ 73 ]
Образец бериллия подвергся бомбардировке альфа-лучами распада радия в ходе эксперимента Джеймса Чедвика 1932 года , который открыл существование нейтрона . [ 35 ] Этот же метод используется в одном классе лабораторных источников нейтронов на основе радиоизотопов , которые производят 30 нейтронов на каждый миллион α-частиц. [ 28 ]
Производство бериллия резко возросло во время Второй мировой войны из-за растущего спроса на твердые сплавы бериллия и меди и люминофоры для люминесцентных ламп . В большинстве ранних люминесцентных ламп использовался ортосиликат цинка с различным содержанием бериллия, излучающий зеленоватый свет. магния Небольшие добавки вольфрамата улучшили синюю часть спектра и позволили получить приемлемый белый свет. Люминофоры на основе галофосфатов заменили люминофоры на основе бериллия после того, как бериллий оказался токсичным. [ 74 ]
Электролиз смеси фторида бериллия и фторида натрия использовался для выделения бериллия в 19 веке. Высокая температура плавления металла делает этот процесс более энергозатратным, чем соответствующие процессы, используемые для щелочных металлов . В начале 20 века производство бериллия путем термического разложения йодида бериллия было исследовано после успеха аналогичного процесса производства циркония , но этот процесс оказался неэкономичным для массового производства. [ 75 ]
Чистый металлический бериллий стал доступен только в 1957 году, хотя гораздо раньше он использовался в качестве легирующего металла для упрочнения меди. [ 35 ] Бериллий можно получить путем восстановления соединений бериллия, таких как хлорид бериллия, металлическим калием или натрием. В настоящее время большая часть бериллия производится восстановлением фторида бериллия магнием . [ 76 ] Цена на американском рынке слитков бериллия, отлитого в вакууме, в 2001 году составляла около 338 долларов за фунт (745 долларов за килограмм). [ 77 ]
В период с 1998 по 2008 год мировое производство бериллия снизилось с 343 до примерно 200 тонн . Затем к 2018 году он увеличился до 230 метрических тонн, из которых 170 тонн поступило из США. [ 78 ] [ 79 ]
Этимология
[ редактировать ]Бериллий получил свое название в честь полудрагоценного минерала берилла , из которого он был впервые выделен. [ 80 ] [ 81 ] [ 82 ]
Приложения
[ редактировать ]Радиационные окна
[ редактировать ]

Из-за его низкого атомного номера и очень низкого поглощения рентгеновских лучей старейшим и до сих пор одним из наиболее важных применений бериллия является изготовление радиационных окон для рентгеновских трубок . [ 35 ] К чистоте и чистоте бериллия предъявляются высокие требования, чтобы избежать появления артефактов на рентгеновских изображениях. Тонкая бериллиевая фольга используется в качестве радиационных окон для детекторов рентгеновского излучения, а ее чрезвычайно низкое поглощение сводит к минимуму эффекты нагрева, вызываемые высокоинтенсивными рентгеновскими лучами низкой энергии, типичными для синхротронного излучения. Вакуумонепроницаемые окна и пучковые трубки для радиационных экспериментов на синхротронах изготавливаются исключительно из бериллия. В научных установках для различных исследований рентгеновской эмиссии (например, энергодисперсионной рентгеновской спектроскопии ) держатель образца обычно изготавливается из бериллия, поскольку испускаемые им рентгеновские лучи имеют гораздо меньшую энергию (≈100 эВ), чем рентгеновские лучи от большинства изученные материалы. [ 14 ]
Низкий атомный номер также делает бериллий относительно прозрачным для энергичных частиц . Поэтому он используется для построения лучевой трубы вокруг области столкновения в установках физики элементарных частиц , таких как все четыре эксперимента с основными детекторами на Большом адронном коллайдере ( ALICE , ATLAS , CMS , LHCb ), [ 83 ] Тэватрон и SLAC . Низкая плотность бериллия позволяет продуктам столкновения достигать окружающих детекторов без значительного взаимодействия, его жесткость позволяет создавать мощный вакуум внутри трубы для минимизации взаимодействия с газами, его термическая стабильность позволяет ему правильно работать при температурах всего в несколько градусов. выше абсолютного нуля , и его диамагнитная природа не позволяет ему мешать сложным мультипольным магнитным системам, используемым для управления и фокусировки частиц пучков . [ 84 ]
Механические приложения
[ редактировать ]Благодаря своей жесткости, легкому весу и стабильности размеров в широком диапазоне температур металлический бериллий используется для изготовления легких конструкционных компонентов в оборонной и аэрокосмической промышленности, в высокоскоростных самолетах , управляемых ракетах , космических кораблях и спутниках , включая космический телескоп Джеймса Уэбба. . В нескольких ракетах на жидком топливе использовались сопла из чистого бериллия. [ 85 ] [ 86 ] Порошок бериллия сам по себе изучался как ракетное топливо , но его применение так и не было реализовано. [ 35 ] экстремального класса Небольшое количество велосипедных рам было построено из бериллия. [ 87 ] С 1998 по 2000 год команда McLaren Формулы-1 использовала Mercedes-Benz двигатели с поршнями из бериллий-алюминиевого сплава . [ 88 ] Использование бериллиевых компонентов двигателя было запрещено после протеста Scuderia Ferrari . [ 89 ]
При смешивании около 2,0% бериллия с медью образуется сплав, называемый бериллиевой медью , который в шесть раз прочнее меди в отдельности. [ 90 ] Сплавы бериллия используются во многих областях применения благодаря сочетанию эластичности, высокой электропроводности и теплопроводности , высокой прочности и твердости , немагнитных свойств, а также хорошей к коррозии и стойкости усталости . [ 35 ] [ 9 ] Эти области применения включают в себя искробезопасные инструменты, которые используются рядом с горючими газами ( бериллий-никель ) в пружинах и мембранах (бериллий-никель и бериллий-железо ), используемых в хирургических инструментах и высокотемпературных устройствах. [ 35 ] [ 9 ] Всего лишь 50 частей на миллион бериллия, легированного жидким магнием, приводит к значительному увеличению стойкости к окислению и снижению воспламеняемости. [ 9 ]

Высокая упругая жесткость бериллия привела к его широкому использованию в точном приборостроении, например, в инерциальных системах наведения и в опорных механизмах оптических систем. [ 14 ] Сплавы бериллия и меди также применялись в качестве отвердителя в « пистолетах Джейсона », которыми снимали краску с корпусов кораблей. [ 91 ]
В системах усиления звука скорость распространения звука напрямую влияет на резонансную частоту усилителя , тем самым влияя на диапазон слышимых высокочастотных звуков. Бериллий выделяется исключительно высокой скоростью распространения звука по сравнению с другими металлами. [ 92 ] Это уникальное свойство позволяет бериллию достигать более высоких резонансных частот, что делает его идеальным материалом для использования в качестве диафрагмы в высококачественных громкоговорителях. [ 93 ]
Бериллий также использовался для изготовления кантилеверов в высокопроизводительных иглах картриджей фонографов, где его чрезвычайная жесткость и низкая плотность позволили уменьшить отслеживающий вес до 1 грамма, сохраняя при этом отслеживание высокочастотных отрывков с минимальными искажениями. [ 94 ]
Ранее бериллий широко применялся в тормозах военных самолетов из-за его твердости, высокой температуры плавления и исключительной способности рассеивать тепло . Экологические соображения привели к замене другими материалами. [ 14 ]
Чтобы снизить затраты, бериллий можно легировать значительным количеством алюминия , в результате чего получается сплав AlBeMet (торговое название). Эта смесь дешевле чистого бериллия, но при этом сохраняет многие полезные свойства.
Зеркала
[ редактировать ]бериллиевые зеркала Особый интерес представляют . Зеркала большой площади, часто с сотовой опорной конструкцией , используются, например, в метеорологических спутниках , где малый вес и долговременная стабильность размеров имеют решающее значение. Бериллиевые зеркала меньшего размера используются в оптических системах наведения и системах управления огнем немецкого производства Leopard 1 и Leopard 2 , например, в основных боевых танках . В этих системах требуется очень быстрое перемещение зеркала, что опять-таки диктует малую массу и высокую жесткость. Обычно бериллиевое зеркало покрыто твердым химическим никелевым покрытием , которое легче полировать до более высокого оптического качества, чем бериллий. Однако в некоторых случаях бериллиевую заготовку полируют без какого-либо покрытия. Это особенно применимо к криогенным операциям, где несоответствие температурного расширения может привести к короблению покрытия. [ 14 ]
Космический телескоп Джеймса Уэбба имеет 18 шестиугольных бериллиевых секций зеркал, каждое из которых покрыто тонким слоем золота. [ 95 ] Поскольку JWST будет работать при температуре 33 К, зеркало изготовлено из позолоченного бериллия, который способен выдерживать экстремальные холода лучше, чем стекло. Бериллий сжимается и деформируется меньше, чем стекло, и остается более однородным – при таких температурах. [ 96 ] По той же причине оптика космического телескопа «Спитцер» полностью изготовлена из металлического бериллия. [ 97 ]
Магнитные приложения
[ редактировать ]
Бериллий немагнитен. Поэтому инструменты, изготовленные из материалов на основе бериллия, используются военно-морскими или военными группами по обезвреживанию боеприпасов или вблизи них для работы на морских минах , поскольку эти мины обычно имеют магнитные взрыватели . [ 99 ] Они также встречаются в ремонтных и строительных материалах рядом с аппаратами магнитно-резонансной томографии (МРТ) из-за генерируемых сильных магнитных полей. [ 100 ] В области радиосвязи и мощных (обычно военных) радаров ручные инструменты из бериллия используются для настройки сильномагнитных клистронов , магнетронов , ламп бегущей волны и т. д., которые используются для генерации высоких уровней микроволновой мощности в передатчиках. . [ нужна ссылка ]
Ядерные применения
[ редактировать ]Тонкие пластины или фольга из бериллия иногда используются в конструкциях ядерного оружия в качестве самого внешнего слоя плутониевых ям на начальных стадиях термоядерных бомб , расположенных вокруг делящегося материала. Эти слои бериллия являются хорошими «толкателями» для взрыва плутония -239 и хорошими отражателями нейтронов , как и в ядерных реакторах с бериллиевым замедлителем . [ 101 ]
Бериллий также широко используется в некоторых источниках нейтронов в лабораторных устройствах, в которых требуется относительно мало нейтронов (вместо использования ядерного реактора или от ускорителя частиц с питанием генератора нейтронов ). Для этой цели мишень из бериллия-9 бомбардируется энергичными альфа-частицами радиоизотопа, такого как полоний -210, радий -226, плутоний -238 или америций -241. В ходе происходящей ядерной реакции ядро бериллия преобразуется в углерод-12 и испускается один свободный нейтрон, движущийся примерно в том же направлении, в котором двигалась альфа-частица. Такие альфа-распадом источники нейтронов бериллия, управляемые , называемые «ежовыми» нейтронными инициаторами, использовались в некоторых ранних атомных бомбах . [ 101 ] Источники нейтронов, в которых бериллий бомбардируется гамма-лучами радиоизотопа гамма-распада , также используются для производства лабораторных нейтронов. [ 102 ]

Бериллий также используется при производстве топлива для реакторов CANDU . Топливные элементы имеют небольшие придатки, которые припаиваются к оболочке твэла методом индукционной пайки с использованием бериллия в качестве припоя. Подушки подшипников припаяны для предотвращения контакта топливного пучка с содержащей его напорной трубкой, а также межэлементные проставки для предотвращения контакта элементов с элементами.
Бериллий также используется в Торус» Объединенной европейской исследовательской лаборатории ядерного синтеза « и будет использоваться в более совершенном ИТЭР для подготовки компонентов, контактирующих с плазмой. [ 103 ] Бериллий также был предложен в качестве оболочки материала ядерных топливных стержней из-за его хорошего сочетания механических, химических и ядерных свойств. [ 14 ] Фторид бериллия является одной из составляющих солей эвтектической смеси солей FLiBe , которая используется в качестве растворителя, замедлителя и теплоносителя во многих гипотетических конструкциях реакторов с расплавленными солями , включая реактор с жидким фторидом тория (LFTR). [ 104 ]
Акустика
[ редактировать ]Малый вес и высокая жесткость бериллия делают его полезным в качестве материала для высокочастотных динамиков . Поскольку бериллий дорог (во много раз дороже титана ), его трудно поддавать форме из-за его хрупкости и он токсичен при неправильном обращении, бериллиевые твитеры используются только в домах высокого класса. [ 105 ] [ 106 ] [ 107 ] профессиональное аудио и приложения для громкой связи . [ 108 ] [ 109 ] Некоторые высококачественные продукты обманным путем утверждаются как изготовленные из этого материала. [ 110 ]
В некоторых высококачественных картриджах для фонографов использовались бериллиевые кантилеверы для улучшения отслеживания за счет уменьшения массы. [ 111 ]
Электронный
[ редактировать ]Бериллий является p-типа легирующей примесью в полупроводниках соединений III-V . Он широко используется в таких материалах, как GaAs , AlGaAs , InGaAs и InAlAs, выращенных методом молекулярно-лучевой эпитаксии (МЛЭ). [ 112 ] Лист бериллия, прокатанный поперечно, является отличной структурной опорой для печатных плат в технологии поверхностного монтажа . В критически важных электронных приложениях бериллий является одновременно структурной опорой и теплоотводом . Для применения также требуется коэффициент теплового расширения , хорошо соответствующий подложкам из оксида алюминия и стекла полиимидного . оксид бериллия-бериллия Композитный « E-Materials » был специально разработан для этих электронных приложений и имеет дополнительное преимущество, заключающееся в том, что коэффициент теплового расширения может быть адаптирован для соответствия различным материалам подложки. [ 14 ]
Оксид бериллия полезен во многих случаях, когда требуется сочетание свойств электрического изолятора и превосходного проводника тепла, высокой прочности и твердости, а также очень высокой температуры плавления. Оксид бериллия часто используется в качестве изоляционной опорной пластины в транзисторах радиочастотных мощных передатчиков для телекоммуникаций. Оксид бериллия также изучается на предмет использования для увеличения теплопроводности таблеток из диоксида урана ядерного топлива . [ 113 ] Соединения бериллия использовались в люминесцентных осветительных трубках, но это использование было прекращено из-за заболевания бериллиоза , развившегося у рабочих, производивших лампы. [ 114 ]
Здравоохранение
[ редактировать ]Бериллий входит в состав ряда стоматологических сплавов . [ 115 ] [ 116 ]
Токсичность и безопасность
[ редактировать ]| Опасности | |
|---|---|
| СГС Маркировка : [ 117 ] | |
 
| |
| Опасность | |
| Х301 , Х315 , Х317 , Х319 , Х330 , Х335 , Х350и , Х372 | |
| P201 , P202 , P280 , P302 , P304 , P305+P351+P338 , P310 , P340 , P352 | |
| NFPA 704 (огненный алмаз) | |
Биологические эффекты
[ редактировать ]В среднем человеческом организме содержится около 35 микрограммов бериллия, и это количество не считается вредным. [ 118 ] Бериллий химически подобен магнию и поэтому может вытеснять его из ферментов , что приводит к их сбоям. [ 118 ] Потому что будь 2+ Это высокозаряженный и небольшой ион, он может легко проникать во многие ткани и клетки, где специфически поражает ядра клеток, ингибируя многие ферменты, в том числе те, которые используются для синтеза ДНК. Его токсичность усугубляется тем фактом, что у организма нет средств для контроля уровня бериллия, и, попав в организм, бериллий не может быть удален. [ 119 ]
Вдыхание
[ редактировать ]Хроническая бериллиевая болезнь (ХББ), или бериллиоз , — легочное и системное гранулематозное заболевание, вызываемое вдыханием пыли или паров, загрязненных бериллием; К этому недугу могут привести либо большие количества в течение короткого времени, либо небольшие количества в течение длительного времени. Для развития симптомов заболевания может потребоваться до пяти лет; около трети пациентов с ним умирают, а выжившие остаются инвалидами. [ 118 ] Международное агентство по изучению рака (IARC) относит бериллий и его соединения к канцерогенам первой категории . [ 120 ]
Профессиональное воздействие
[ редактировать ]В США Управление по охране труда (OSHA) установило допустимый предел воздействия (PEL) для бериллия и его соединений на уровне 0,2 мкг/м. 3 как средневзвешенное по времени время (TWA) за 8 часов и 2,0 мкг/м 3 как предел кратковременного воздействия в течение периода отбора проб в 15 минут. Национальный институт охраны труда (NIOSH) установил рекомендуемого предела воздействия (REL) 0,5 мкг/м. верхний предел 3 . Значение IDLH ( непосредственно опасно для жизни и здоровья) составляет 4 мг/м. 3 . [ 121 ] Токсичность бериллия находится на одном уровне с другими токсичными металлоидами/металлами, такими как мышьяк и ртуть . [ 122 ] [ 123 ]
Воздействие бериллия на рабочем месте может привести к сенсибилизированной иммунной реакции и со временем к развитию бериллиоза. [ 124 ] Национальный институт охраны труда (NIOSH) в США исследует эти эффекты в сотрудничестве с крупным производителем бериллиевой продукции. NIOSH также проводит генетические исследования сенсибилизации и КБД, независимо от этого сотрудничества. [ 124 ]
Острая бериллиевая болезнь в форме химического пневмонита впервые была зарегистрирована в Европе в 1933 году и в США в 1943 году. Исследование показало, что около 5% рабочих заводов по производству люминесцентных ламп в 1949 году в США страдали заболеваниями легких, связанными с бериллием. . [ 125 ] Хронический бериллиоз напоминает саркоидоз во многом , и дифференциальный диагноз часто затруднен. Он убил некоторых первых исследователей ядерного оружия, таких как Герберт Л. Андерсон . [ 126 ]
Бериллий можно найти в угольных шлаках. Когда шлак используется в качестве абразивного агента для удаления краски и ржавчины с твердых поверхностей, бериллий может попасть в воздух и стать источником воздействия. [ 127 ]
Хотя использование соединений бериллия в люминесцентных осветительных трубках было прекращено в 1949 году, потенциал воздействия бериллия существует в атомной и аэрокосмической промышленности, при очистке металлического бериллия и плавке бериллийсодержащих сплавов, при производстве электронных устройств, и при обращении с другими бериллийсодержащими материалами. [ 128 ]
Обнаружение
[ редактировать ]Ранние исследователи предприняли весьма опасную практику определения бериллия и его различных соединений по сладкому вкусу. Современный тест на содержание бериллия в воздухе и на поверхностях был разработан и опубликован в качестве международного добровольного консенсусного стандарта ASTM D7202. В процедуре используется разбавленный бифторид аммония для обнаружения растворения и флуоресценции бериллия, связанного с сульфонированным гидроксибензохинолином, что обеспечивает до 100 раз более чувствительное обнаружение, чем рекомендуемый предел концентрации бериллия на рабочем месте. Флуоресценция увеличивается с увеличением концентрации бериллия. Новая процедура была успешно протестирована на различных поверхностях и эффективна для растворения и обнаружения тугоплавкого оксида бериллия и кремнистого бериллия в минимальных концентрациях (ASTM D7458). [ 129 ] [ 130 ] Руководство NIOSH по аналитическим методам содержит методы измерения профессионального воздействия бериллия. [ 131 ]
Примечания
[ редактировать ]- ^ Тепловое расширение анизотропно : параметры (при 20 ° C) для каждой оси кристалла составляют α a = 12,03 × 10. −6 /К, α с = 8,88 × 10 −6 /K, а α среднее = α V /3 = 10,98 × 10. −6 /К.
Ссылки
[ редактировать ]- ^ «Стандартные атомные массы: бериллий» . ЦИАВ . 2013.
- ^ Прохаска, Томас; Ирргехер, Йоханна; Бенефилд, Жаклин; Бёлке, Джон К.; Чессон, Лесли А.; Коплен, Тайлер Б.; Дин, Типинг; Данн, Филип Дж. Х.; Грёнинг, Манфред; Холден, Норман Э.; Мейер, Харро Эй Джей (4 мая 2022 г.). «Стандартные атомные веса элементов 2021 (Технический отчет ИЮПАК)» . Чистая и прикладная химия . дои : 10.1515/pac-2019-0603 . ISSN 1365-3075 .
- ^ Перейти обратно: а б с Арбластер, Джон В. (2018). Некоторые значения кристаллографических свойств элементов . Парк материалов, Огайо: ASM International. ISBN 978-1-62708-155-9 .
- ^ Be(0) наблюдался; видеть «Обнаружен комплекс бериллия (0)» . Химия Европы . 13 июня 2016 г.
- ^ «Бериллий: данные о соединениях гидрида бериллия (I)» (PDF) . bernath.uwaterloo.ca . Проверено 10 декабря 2007 г.
- ^ Уэст, Роберт (1984). CRC, Справочник по химии и физике . Бока-Ратон, Флорида: Издательство компании Chemical Rubber Company. стр. E110. ISBN 0-8493-0464-4 .
- ^ Хейнс, Уильям М., изд. (2011). Справочник CRC по химии и физике (92-е изд.). Бока-Ратон, Флорида: CRC Press . п. 14.48. ISBN 1-4398-5511-0 .
- ^ Кондев, ФГ; Ван, М.; Хуанг, WJ; Наими, С.; Ауди, Г. (2021). «Оценка ядерных свойств NUBASE2020» (PDF) . Китайская физика C . 45 (3): 030001. doi : 10.1088/1674-1137/abddae .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н Якубке, Ганс Дитер; Йешкейт, Ганс, ред. (1994). Краткая энциклопедия химии . пер. обр. Иглсон, Мэри. Берлин: Вальтер де Грюйтер.
- ^ Гувер, Марк Д.; Касторина, Брайан Т.; Финч, Грегори Л.; Ротенберг, Саймон Дж. (октябрь 1989 г.). «Определение толщины оксидного слоя на частицах металлического бериллия» . Журнал Американской ассоциации промышленной гигиены . 50 (10): 550–553. дои : 10.1080/15298668991375146 . ISSN 0002-8894 . ПМИД 2801503 .
- ^ Перейти обратно: а б Томастик, К.; Вернер, В.; Стори, Х. (2005). «Окисление бериллия — сканирующее оже-исследование» . Нукл. Слияние . 45 (9): 1061. Бибкод : 2005NucFu..45.1061T . дои : 10.1088/0029-5515/45/9/005 . S2CID 111381179 .
- ^ Перейти обратно: а б Мачек, Андрей; Маккензи Семпл, Дж. (1969). «Экспериментальные скорости горения и механизмы горения одиночных частиц бериллия» . Симпозиум (международный) по горению . 12 (1): 71–81. дои : 10.1016/S0082-0784(69)80393-0 .
- ^ Пухта, Ральф (2011). «Более яркий бериллий» . Природная химия . 3 (5): 416. Бибкод : 2011НатЧ...3..416П . дои : 10.1038/nchem.1033 . ПМИД 21505503 .
- ^ Перейти обратно: а б с д и ж г час я Беренс, В. (2003). «11 Бериллий». В Бейсс, П. (ред.). Ландольт-Бёрнштайн – Передовые материалы и технологии VIII группы: данные порошковой металлургии. Огнеупорные, твердые и интерметаллические материалы . Ландольт-Бёрнштайн - Группа VIII Передовые материалы и технологии. Том. 2А1. Берлин: Шпрингер. стр. 667–677. дои : 10.1007/10689123_36 . ISBN 978-3-540-42942-5 .
- ^ Перейти обратно: а б Хауснер, Генри Х. (1965). «Ядерные свойства» . Бериллий, его металлургия и свойства . Издательство Калифорнийского университета. п. 239. Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ Томберлин, Т.А. (15 ноября 2004 г.). «Бериллий – уникальный материал для ядерных применений» (PDF) . Национальная лаборатория Айдахо . Национальная инженерно-экологическая лаборатория Айдахо. Архивировано из оригинала (PDF) 22 декабря 2015 года.
- ^ «О бериллии» . Министерство энергетики США. Архивировано из оригинала 22 декабря 2021 года . Проверено 22 декабря 2021 г.
- ^ Экспонг, Г. (1992). Физика: 1981–1990 гг . Всемирная научная. стр. 172 и далее. ISBN 978-981-02-0729-8 . Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ Перейти обратно: а б Эмсли 2001 , с. 56.
- ^ «Бериллий: изотопы и гидрология» . Университет Аризоны, Тусон. Архивировано из оригинала 26 мая 2013 года . Проверено 10 апреля 2011 г.
- ^ Уайтхед, Н.; Эндо, С; Танака, К; Такацудзи, Т; Хоши, М; Фукутани, С; Дитчберн, Родригес; Зондерван, А. (февраль 2008 г.). «Предварительное исследование по использованию (10)Be в судебно-радиоэкологии мест ядерных взрывов». Журнал радиоактивности окружающей среды . 99 (2): 260–70. дои : 10.1016/j.jenvrad.2007.07.016 . ПМИД 17904707 .
- ^ Бойд, Р.Н.; Каджино, Т. (1989). «Может ли Бе-9 стать проверкой космологических теорий?». Астрофизический журнал . 336 : Л55. Бибкод : 1989ApJ...336L..55B . дои : 10.1086/185360 .
- ^ Арнетт, Дэвид (1996). Сверхновые и нуклеосинтез . Издательство Принстонского университета. п. 223. ИСБН 978-0-691-01147-9 . Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ Джонсон, Билл (1993). «Как изменить скорость ядерного распада» . Калифорнийский университет, Риверсайд. Архивировано из оригинала 29 июня 2013 года . Проверено 30 марта 2008 г.
- ^ Хаммонд, CR "Элементы" в Лиде, Д.Р., изд. (2005). Справочник CRC по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5 .
- ^ Хансен, П.Г.; Дженсен, А.С.; Джонсон, Б. (1995). «Ядерные ореолы» . Ежегодный обзор ядерной науки и науки о элементарных частицах . 45 (45): 591–634. Бибкод : 1995ARNPS..45..591H . дои : 10.1146/annurev.ns.45.120195.003111 .
- ^ «Изобилие на солнце» . Марк Винтер, Университет Шеффилда и WebElements Ltd, Великобритания . ВебЭлементы. Архивировано из оригинала 27 августа 2011 года . Проверено 6 августа 2011 г.
- ^ Перейти обратно: а б О'Нил, Мэридейл Дж.; Хекельман, Патрисия Э.; Роман, Чери Б., ред. (2006). Индекс Merck: Энциклопедия химических веществ, лекарств и биологических препаратов (14-е изд.). Станция Уайтхаус, Нью-Джерси, США: Merck Research Laboratories, Merck & Co., Inc. ISBN 978-0-911910-00-1 .
- ^ Перейти обратно: а б с д Эмсли 2001 , с. 59.
- ^ «Изобилие в океанах» . Марк Винтер, Университет Шеффилда и WebElements Ltd, Великобритания . ВебЭлементы. Архивировано из оригинала 5 августа 2011 года . Проверено 6 августа 2011 г.
- ^ «Изобилие в речной воде» . Марк Винтер, Университет Шеффилда и WebElements Ltd, Великобритания . ВебЭлементы. Архивировано из оригинала 4 августа 2011 года . Проверено 6 августа 2011 г.
- ^ «Поиск минералов по химии» . www.mindat.org . Архивировано из оригинала 6 августа 2021 года . Проверено 30 октября 2021 г.
- ^ Уолш, Кеннет А. (2009). «Источники бериллия» . Химия и обработка бериллия . АСМ Интернешнл. стр. 20–26. ISBN 978-0-87170-721-5 . Архивировано из оригинала 13 мая 2016 года . Проверено 5 января 2016 г.
- ^ Филипп Саби (5 марта 2006 г.). «Распределение крупных месторождений» . В Джессике Эльзи Когель; Никхил К. Триведи; Джеймс М. Баркер; Стэнли Т. Круковски (ред.). Промышленные минералы и горные породы: товары, рынки и использование . стр. 265–269. ISBN 978-0-87335-233-8 . Проверено 5 января 2016 г.
- ^ Перейти обратно: а б с д и ж г час я Эмсли 2001 , с. 58.
- ^ «Источники бериллия» . Корпорация Материон. Архивировано из оригинала 24 декабря 2016 года . Проверено 23 декабря 2016 г.
- ^ «Бериллим» . Архивировано 3 июля 2021 года в Wayback Machine в Ежегоднике минералов за 2016 год . Геологическая служба США (сентябрь 2018 г.).
- ^ Уральский производитель изумрудов планирует выпускать стратегический металл бериллий Archived 11 October 2021 at the Wayback Machine . TASS.ru (15 May 2019)
- ^ «Россия возобновляет производство бериллия спустя 20 лет» . Евразийский бизнес-брифинг. 20 февраля 2015 года. Архивировано из оригинала 31 июля 2017 года . Проверено 22 февраля 2018 г.
- ^ Монтеро-Кампильо, М. Мерсед; Мо, Отилия; Яньес, Мануэль; Алькорта, Ибон; Эльгеро, Хосе (1 января 2019 г.), ван Элдик, Руди; Пухта, Ральф (ред.), «Глава третья - Бериллиевая связь» , «Достижения в неорганической химии» , «Вычислительная химия», том. 73, Академик Пресс, с. 73–121, doi : 10.1016/bs.adioch.2018.10.003 , S2CID 140062833 , получено 26 октября 2022 г.
- ^ Эроусмит, Мерл; Брауншвейг, Хольгер; Челик, Мехмет Али; Деллерманн, Тереза; Дьюхерст, Райан Д.; Юинг, Уильям К.; Хаммонд, Кай; Крамер, Томас; Крумменахер, Иво (2016). «Нейтральные нульвалентные s-блок-комплексы с прочными кратными связями». Природная химия . 8 (9): 890–894. Бибкод : 2016НатЧ...8..890А . дои : 10.1038/nchem.2542 . ПМИД 27334631 .
- ^ Гимферрер, Марти; ДЕЙНЕС, Сержи; ТЫ, Ева; Йылдыз, Джем Б.; КОРРАЛ, Инес; Яна, Анукул; САЛЬВАДОР, Педро; Андрада, Диего М. (7 июня 2022 г.). «Статус окисления в малоценных соединениях бериллия и магния» . Химическая наука . 13 (22): 6583–6591. дои : 10.1039/D2SC01401G . ISSN 2041-6539 . ПМЦ 9172369 . ПМИД 35756523 .
- ^ Перейти обратно: а б Боронски, Йозеф Т.; Крамптон, Агамемнон Э.; Уэльс, Льюис Л.; Олдридж, Саймон (16 июня 2023 г.). «Дибериллоцен, стабильное соединение Be (I) со связью Be – Be» . Наука . 380 (6650): 1147–1149. Бибкод : 2023Sci...380.1147B . дои : 10.1126/science.adh4419 . ISSN 0036-8075 . ПМИД 37319227 . S2CID 259166086 .
- ^ Перейти обратно: а б с Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Перейти обратно: а б Виберг, Эгон; Холлеман, Арнольд Фредерик (2001). Неорганическая химия . Эльзевир. ISBN 978-0-12-352651-9 .
- ^ Перейти обратно: а б Альдерги, Люсия; Ганс, Питер; Мидоллини, Стефано; Вакка, Альберто (2000). Сайкс, АГ; Коули, Алан Х. (ред.). «Химия водных растворов бериллия». Достижения неорганической химии . 50 . Сан-Диего: Academic Press: 109–172. дои : 10.1016/S0898-8838(00)50003-8 . ISBN 978-0-12-023650-3 .
- ^ Белл, Н.А. (1972). Достижения неорганической химии и радиохимии . Том. 14. Нью-Йорк: Академик Пресс. стр. 256–277. дои : 10.1016/S0065-2792(08)60008-4 . ISBN 978-0-12-023614-5 .
- ^ Перейти обратно: а б с д и Кумбергер, Отто; Шмидбаур, Хуберт (декабрь 1993 г.). «Почему бериллий так токсичен?» . Химия в наше время (на немецком языке). 27 (6): 310–316. дои : 10.1002/ciuz.19930270611 . ISSN 0009-2851 .
- ^ Розенхайм, Артур; Леманн, Фриц (1924). «О внутрикомплексных берилатах». Анна Либиха. Хим . 440 : 153–166. дои : 10.1002/jlac.19244400115 .
- ^ Шмидт, М.; Бауэр, А.; Шир, А.; Шмидтбауэр, Х (1997). «Хелирование бериллия дикарбоновыми кислотами в водном растворе». Неорганическая химия . 53б (10): 2040–2043 гг. дои : 10.1021/ic961410k . ПМИД 11669821 .
- ^ Перейти обратно: а б Медерос, А.; Домингес, С.; Чинея, Э.; Брито, Ф.; Миддолини, С.; Вакка, А. (1997). «Последние аспекты координационной химии очень токсичного катиона бериллия (II): поиск изолирующих агентов». Бол. Соц. Чил. Ким . 42 : 281.
- ^ Перейти обратно: а б Наглав Д.; Бюхнер, MR; Бендт, Г.; Краус, Ф.; Шульц, С. (2016). «С проторенных дорог - Путеводитель по химии бериллия для путешествующих автостопом». Энджью. хим. Межд. Эд . 55 (36): 10562–10576. дои : 10.1002/anie.201601809 . ПМИД 27364901 .
- ^ Коутс, GE; Фрэнсис, БР (1971). «Получение безосновных алкилов бериллия из триалкилборанов. Динеопентилбериллий, бис((триметилсилил)метил)бериллий и гидрид этилбериллия». Журнал Химического общества A: Неорганическое, физическое, теоретическое : 1308. doi : 10.1039/J19710001308 .
- ^ Фишер, Эрнст Отто; Хофманн, Герман П. (1959). «Об ароматических комплексах металлов, XXV. Дициклопентадиенилбериллий». Химические отчеты . 92 (2): 482. doi : 10.1002/cber.19590920233 .
- ^ Ньюджент, КВ; Битти, Дж. К.; Хэмбли, ТВ; Сноу, MR (1984). «Точная низкотемпературная кристаллическая структура бис (циклопентадиенил) бериллия». Австралийский химический журнал . 37 (8): 1601. doi : 10.1071/CH9841601 . S2CID 94408686 .
- ^ Альменнинген, А.; Хааланд, Арне; Луштик, Януш (1979). «Молекулярная структура бериллоцена (C 5 H 5 ) 2 Be. Повторное исследование методом газовой дифракции электронов». Журнал металлоорганической химии . 170 (3): 271. doi : 10.1016/S0022-328X(00)92065-5 .
- ^ Вонг, CH; Ли, Тайвань; Чао, Кей Джей; Ли, С. (1972). «Кристаллическая структура бис (циклопентадиенил) бериллия при -120 ° C». Acta Crystallographica Раздел B. 28 (6): 1662. Бибкод : 1972AcCrB..28.1662W . дои : 10.1107/S0567740872004820 .
- ^ Виганд, Г.; Тиле, К.-Х. (1974). «Вклад в существование соединений аллилбериллия и аллилалюминия». Журнал неорганической и общей химии (на немецком языке). 405 : 101-108. дои : 10.1002/zaac.19744050111 .
- ^ Чмели, Стивен С.; Хануса, Тимоти П.; Бреннессел, Уильям В. (2010). «Бис(1,3-триметилсилилаллил)бериллий». Angewandte Chemie, международное издание . 49 (34): 5870–5874. дои : 10.1002/anie.201001866 . ПМИД 20575128 .
- ^ Руландт-Зенге, Карин; Бартлетт, Рут А.; Олмстед, Мэрилин М.; Пауэр, Филип П. (1993). «Синтез и структурная характеристика соединений бериллия [Be(2,4,6-Me 3 C 6 H 2 ) 2 (OEt 2 )], [Be{O(2,4,6-трет-Bu 3 C 6 H 2 )} 2 (OEt 2 )], и [Be{S(2,4,6-трет-Bu 3 C 6 H 2 )} 2 (THF)]⋅PhMe и определение структуры [BeCl 2 (OEt 2 ) 2 ]». Неорганическая химия . 32 (9): 1724–1728. дои : 10.1021/ic00061a031 .
- ^ Моросин Б.; Ховатсон, Дж. (1971). «Кристаллическая структура димерного метил-1-пропинилбериллийтриметиламина». Журнал металлоорганической химии . 29 : 7–14. дои : 10.1016/S0022-328X(00)87485-9 .
- ^ Перейти обратно: а б Уикс 1968 , с. 535.
- ^ Перейти обратно: а б Уикс 1968 , с. 536.
- ^ Уикс 1968 , с. 537.
- ^ Воклен, Луи-Николя (1798). «Аквамарин, или Берилл; и открытие новой земли в этом камне» [Аквамарин или берилл; и открытие новой земли в этом камне]. Анналы химии . 26 : 155–169. Архивировано из оригинала 27 апреля 2016 года . Проверено 5 января 2016 г.
- ^ В сноске на странице 169. Архивировано 23 июня 2016 года в Wayback Machine (Воклен, 1798 г.) редакторы пишут: «(1) Наиболее характерным свойством этой земли, подтвержденным последними экспериментами нашего коллеги, является образование соли со сладким вкусом, мы предлагаем назвать ее глюцином , от γλυκυς, сладкий , γλυκύ, сладкое вино , γλυκαιτω, делать сладким ... Примечание редакции ». ((1) Наиболее характерным свойством этой земли, подтвержденным недавними опытами нашего коллеги [Воклена], является образование солей со сладким вкусом, мы предлагаем называть ее глюцином от γλυκυς, сладкое , γλυκύ, сладкое вино , γλυκαιτω. , чтобы сделать сладкое ... Примечание редакции .)
- ^ Клапрот, Мартин Генрих, Вклад в химические знания минеральных веществ, том. 3, (Берлин, (Германия): Генрих Август Роттманн, 1802 г.), страницы 78–79. Архивировано 26 апреля 2016 г. в Wayback Machine : «Как и Воклен, новая земля, которую он открыл в берилле и изумруде, добавила сладкие средние соли из-за их свойств. Форма, имя Гликин , милая земля, он, вероятно, не ожидал, что вскоре после этого будет найдена другая земля, которая могла бы претендовать на это имя с совершенно равными правами, чтобы ее не смешивали с итровой землей. Может быть, было бы целесообразно откажитесь от этого названия «Глицин» и замените его на «Бериловая земля» ( Beryllina ); изменение названия уже было рекомендовано профессором Линком, поскольку уже существует род растений «Глицин ». (Когда Воклен дал – из-за его свойства образовывать сладкие соли – название глицин , сладкоземля , на новой земле, найденной им в берилле и смарагде, он, конечно, не ожидал, что вскоре после этого будет найдена другая земля, которая с совершенно равным правом могла бы претендовать на это имя. Поэтому, во избежание смешения его с иттриземлем, возможно, было бы целесообразно отказаться от этого названия глицин и заменить его бериллземельем ( бериллином ); изменение названия было также рекомендовано профессором Линком, и по той причине, что уже существует род растений Glycine .)
- ^ Уикс 1968 , с. 538.
- ^ Вёлер, Ф. (1828). «О бериллии и иттрии» . Анналы физики и химии . 13 (89): 577–582. Бибкод : 1828АнП....89..577Вт . дои : 10.1002/andp.18280890805 . Архивировано из оригинала 26 апреля 2016 года . Проверено 5 января 2016 г.
- ^ Вёлер, Фридрих (1828). «О бериллии и иттрии» . Анналы физики и химии . 89 (8): 577–582. Бибкод : 1828АнП....89..577Вт . дои : 10.1002/andp.18280890805 . Архивировано из оригинала 27 мая 2016 года . Проверено 5 января 2016 г.
- ^ Бюсси, Антуан (1828). «С работы он взялся на глюцинии» . Журнал медицинской химии (4): 456–457. Архивировано из оригинала 22 мая 2016 года . Проверено 5 января 2016 г.
- ^ Перейти обратно: а б Уикс 1968 , с. 539.
- ^ Бойя, Иоганн (27 августа 2016 г.). От сырья к стратегическим сплавам. Случай международной бериллиевой промышленности (1919–1939) . 1-й Всемирный конгресс по истории бизнеса, Берген, Норвегия. дои : 10.13140/rg.2.2.35545.11363 . Архивировано из оригинала 30 октября 2021 года . Проверено 30 октября 2021 г.
- ^ Кейн, Раймонд; Селл, Хайнц (2001). «Обзор ранних неорганических фосфоров» . Революция в лампах: хроника 50-летнего прогресса . Фэрмонт Пресс. п. 98. ИСБН 978-0-88173-378-5 . Архивировано из оригинала 7 мая 2016 года . Проверено 5 января 2016 г.
- ^ Бабу, РС; Гупта, СК (1988). «Добыча бериллия – Обзор». Обзор переработки полезных ископаемых и добывающей металлургии . 4 : 39–94. дои : 10.1080/08827508808952633 .
- ^ Хаммонд, ЧР (2003). «Элементы». Справочник CRC по химии и физике (84-е изд.). Бока-Ратон, Флорида: CRC Press. стр. 4–5. ISBN 978-0-8493-0595-5 . Архивировано из оригинала 13 марта 2020 года . Проверено 18 июля 2019 г.
- ^ «Статистика и информация по бериллию» . Геологическая служба США. Архивировано из оригинала 16 сентября 2008 года . Проверено 18 сентября 2008 г.
- ^ «Товарная сводка: Бериллий» (PDF) . Геологическая служба США. Архивировано (PDF) из оригинала 1 июня 2010 года . Проверено 16 мая 2010 г.
- ^ «Товарный обзор 2000 г.: Бериллий» (PDF) . Геологическая служба США. Архивировано (PDF) из оригинала 16 июля 2010 года . Проверено 16 мая 2010 г.
- ^ «Этимология онлайн» . Архивировано из оригинала 30 октября 2020 года . Проверено 30 октября 2021 г.
- ^ «Британская энциклопедия» . Архивировано из оригинала 23 октября 2021 года . Проверено 30 октября 2021 г.
- ^ «Элементарная материя» . Архивировано из оригинала 29 ноября 2020 года . Проверено 30 октября 2021 г.
- ^ Венесс, Р.; Рамос, Д.; Лепель, П.; Росси, А.; Шнайдер, Г.; Бланшар, С. «Монтаж и ввод в эксплуатацию вакуумных систем для детекторов частиц БАК» (PDF) . ЦЕРН. Архивировано (PDF) из оригинала 14 ноября 2011 года . Проверено 13 января 2012 г.
- ^ Виман, Х; Бизер, Ф.; Кляйнфельдер, С.; Матис, ХС; Невский П.; Рай, Г.; Смирнов Н. (2001). «Новый внутренний вершинный детектор для STAR» (PDF) . Ядерные приборы и методы в физических исследованиях . Секция А. 473 (1–2): 205. Бибкод : 2001NIMPA.473..205W . дои : 10.1016/S0168-9002(01)01149-4 . S2CID 39909027 . Архивировано (PDF) из оригинала 17 октября 2020 г. Проверено 30 октября 2021 г.
- ^ Дэвис, Джозеф Р. (1998). «Бериллий» . Справочник по металлам . АСМ Интернешнл. стр. 690–691. ISBN 978-0-87170-654-6 . Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ Шварц, Мел М. (2002). Энциклопедия материалов, деталей и отделки . ЦРК Пресс. п. 62. ИСБН 978-1-56676-661-6 . Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ «Музей искусства и технологий горных велосипедов: американское производство велосипедов» . Архивировано из оригинала 20 июля 2011 года . Проверено 26 сентября 2011 г.
- ^ Уорд, Уэйн. «Алюминий-Бериллий» . Рет-Монитор. Архивировано из оригинала 1 августа 2010 года . Проверено 18 июля 2012 г.
- ^ Коллантайн, Кейт (8 февраля 2007 г.). «Запрещено! – Бериллий» . Архивировано из оригинала 21 июля 2012 года . Проверено 18 июля 2012 г.
- ^ Геллер, Элизабет, изд. (2004). Краткая энциклопедия химии . Нью-Йорк: МакГроу-Хилл. ISBN 978-0-07-143953-4 .
- ^ «Силы обороны сталкиваются с риском воздействия редких токсичных металлов» . Сидней Морнинг Геральд . 1 февраля 2005 г. Архивировано из оригинала 30 декабря 2007 г. Проверено 8 августа 2009 г.
- ^ Спецификации материалов реактора (Отчет). Окриджская национальная лаборатория. 1958. с. 227 . Проверено 14 июля 2024 г.
- ^ «6 распространенных применений бериллия» . Тугоплавкие металлы . 28 апреля 2020 г. Проверено 14 июля 2024 г.
- ^ Руководство пользователя Shure V15VxMR, страница 2
- ^ «Космический телескоп Уэбба перепишет космическую историю. Если он сработает» . Журнал Кванта. 3 декабря 2021 года. Архивировано из оригинала 5 декабря 2021 года . Проверено 5 декабря 2021 г.
- ^ Гарднер, Джонатан П. (2007). «Космический телескоп Джеймса Уэбба» (PDF) . Proceedings of Science : 5. Bibcode : 2007mru..confE...5G . дои : 10.22323/1.052.0005 . S2CID 261976160 . Архивировано (PDF) из оригинала 4 июня 2016 года . Проверено 15 января 2009 г.
- ^ Вернер, МВт; Руллиг, ТЛ; Лоу, Ф.Дж.; Рике, Г.Х.; Рике, М.; Хоффманн, ВФ; Янг, Э.; Хоук, младший; и др. (2004). «Миссия космического телескопа Спитцер». Приложение к астрофизическому журналу . 154 (1): 1–9. arXiv : astro-ph/0406223 . Бибкод : 2004ApJS..154....1W . дои : 10.1086/422992 . S2CID 119379934 .
- ^ Грей, Теодор . Гироскопическая сфера. Пример элемента бериллий. Архивировано 14 апреля 2021 года в Wayback Machine . periodtable.com
- ^ Койола, Кеннет; Лурье, Уильям (9 августа 1961 г.). «Выбор маломагнитных сплавов для инструментов ЭОД» . Завод по производству военно-морского оружия в Вашингтоне. Архивировано из оригинала 23 августа 2011 года . Проверено 28 февраля 2010 г.
- ^ Дорш, Джерри А. и Дорш, Сьюзан Э. (2007). Понимание анестезиологического оборудования . Липпинкотт Уильямс и Уилкинс. п. 891. ИСБН 978-0-7817-7603-5 . Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ Перейти обратно: а б Барнаби, Фрэнк (1993). Как распространяется ядерное оружие . Рутледж. п. 35. ISBN 978-0-415-07674-6 . Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ Бирн, Дж. Нейтроны, ядра и материя , Dover Publications, Минеола, Нью-Йорк, 2011, ISBN 0-486-48238-3 , стр. 32–33.
- ^ Кларк, REH; Райтер, Д. (2005). Исследования ядерного синтеза . Спрингер. п. 15. ISBN 978-3-540-23038-0 . Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ Петти, Д.; Смолик Г.; Симпсон, М.; Шарп, Дж.; Андерл, Р.; Фукада, С.; Хатано, Ю.; Хара, М.; и др. (2006). «Исследование расплавленной соли ЮПИТЕР-II Flibe: обновленная информация об экспериментах по тритию, мобилизации и окислительно-восстановительной химии» . Термоядерная инженерия и дизайн . 81 (8–14): 1439. Бибкод : 2006FusED..81.1439P . дои : 10.1016/j.fusengdes.2005.08.101 . ОСТИ 911741 . Архивировано из оригинала 26 апреля 2021 года . Проверено 30 октября 2021 г.
- ^ «Scan Speak предлагает высокочастотные динамики OEM-производителям и домашним мастерам» (PDF) . Сканировать «Говори». Май 2010 г. Архивировано из оригинала (PDF) 3 марта 2016 г.
- ^ Джонсон, Джон Э. младший (12 ноября 2007 г.). «Полочные колонки Usher Be-718 с бериллиевыми твитерами» . Архивировано из оригинала 13 июня 2011 года . Проверено 18 сентября 2008 г.
- ^ «Студийный монитор Exposé E8B» . КРК Системс. Архивировано из оригинала 10 апреля 2011 года . Проверено 12 февраля 2009 г.
- ^ «Использование бериллия в профессиональных аудиоколонках Focal» . Архивировано из оригинала 31 декабря 2012 года.
- ^ «VUE Audio объявляет об использовании громкоговорителей Be in Pro Audio» . ВУЭ Аудиотехника . Архивировано из оригинала 10 мая 2012 года . Проверено 21 мая 2012 г.
- ^ Свилар, Марк (8 января 2004 г.). «Анализ купола и диффузора динамика из «бериллия», полученных из Китая» . Архивировано из оригинала 17 мая 2013 года . Проверено 13 февраля 2009 г.
- ^ «Руководство пользователя Shure V15 VXmR» (PDF) . Архивировано из оригинала (PDF) 10 января 2017 года . Проверено 31 мая 2017 г.
- ^ Диль, Роланд (2000). Мощные диодные лазеры . Спрингер. п. 104. ИСБН 978-3-540-66693-6 . Архивировано из оригинала 27 июля 2020 года . Проверено 30 октября 2021 г.
- ^ «Инженеры Purdue создают более безопасное и эффективное ядерное топливо, моделируют его характеристики» . Университет Пердью. 27 сентября 2005 г. Архивировано из оригинала 27 мая 2012 г. Проверено 18 сентября 2008 г.
- ^ Бреслин Эй Джей (1966). «Глава 3. Воздействие и характер заболеваний в бериллиевой промышленности». В Стокинджере, HE (ред.). Бериллий: аспекты промышленной гигиены . Академик Пресс, Нью-Йорк. стр. 30–33. ISBN 978-0-12-671850-8 .
- ^ Информационный бюллетень OSHA об опасностях HIB 02-04-19 (ред. 05-14-02) Предотвращение неблагоприятных последствий для здоровья от воздействия бериллия в стоматологических лабораториях
- ^ Эльшахави, В.; Ватанабэ, И. (2014). «Биосовместимость стоматологических сплавов, применяемых в несъемном протезировании зубов» . Танта Стоматологический журнал . 11 (2): 150–159. дои : 10.1016/j.tdj.2014.07.005 .
- ^ «Бериллий 265063» . Сигма-Олдрич. 24 июля 2021 года. Архивировано из оригинала 11 апреля 2021 года . Проверено 21 декабря 2021 г.
- ^ Перейти обратно: а б с Эмсли 2001 , с. 57.
- ^ Венугопал, Б. (14 марта 2013 г.). Физиологические и химические основы токсичности металлов . Спрингер. стр. 167–8. ISBN 978-1-4684-2952-7 .
- ^ «Бериллий и соединения бериллия» . Монография МАИР . Том. 58. Международное агентство по изучению рака. 1993. Архивировано из оригинала 26 мая 2024 года . Проверено 18 сентября 2008 г.
- ^ Карманный справочник NIOSH по химическим опасностям. «#0054» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ «CDC - Карманный справочник NIOSH по химическим опасностям - Мышьяк (неорганические соединения, такие как As)» . Архивировано из оригинала 11 мая 2017 года . Проверено 30 октября 2021 г.
- ^ Карманный справочник NIOSH по химическим опасностям - Соединения ртути . Национальный институт охраны труда и здоровья (NIOSH). Архивировано 7 мая 2021 года в Wayback Machine.
- ^ Перейти обратно: а б «CDC – Исследования бериллия – Тема безопасности и гигиены труда NIOSH» . www.cdc.gov . Архивировано из оригинала 8 марта 2013 года . Проверено 30 января 2017 г.
- ^ Эмсли 2001 , с. 5.
- ^ «Фотография ученых из Чикаго, 1946 год» . Управление по связям с общественностью Аргоннской национальной лаборатории. 19 июня 2006 г. Архивировано из оригинала 11 декабря 2008 г. Проверено 18 сентября 2008 г.
- ↑ Рабочие судостроения Ньюпорт-Ньюс сталкиваются со скрытым токсином. Архивировано 13 января 2014 г. в Wayback Machine , Daily Press (Вирджиния) , Майкл Уэллс Шапиро, 31 августа 2013 г.
- ^ Международная программа по химической безопасности (1990 г.). «Бериллий: КРИТЕРИИ ЗДОРОВЬЯ ОКРУЖАЮЩЕЙ СРЕДЫ 106» . Всемирная организация здравоохранения. Архивировано из оригинала 9 июня 2011 года . Проверено 10 апреля 2011 г.
- ^ «ASTM D7458-08» . Американское общество испытаний и материалов. Архивировано из оригинала 12 июля 2010 года . Проверено 8 августа 2009 г.
- ^ Миноуг, ЕМ; Элер, Д.С.; Баррелл, АК; Макклески, ТМ; Тейлор, Т.П. (2005). «Разработка нового флуоресцентного метода обнаружения бериллия на поверхностях». Журнал ASTM International . 2 (9): 13168. дои : 10.1520/JAI13168 .
- ^ «CDC – Публикации и продукты NIOSH – Руководство NIOSH по аналитическим методам (2003–154) – Альфа-список B» . www.cdc.gov . Архивировано из оригинала 16 декабря 2016 года . Проверено 30 января 2017 г.
Цитируемые источники
[ редактировать ]- Эмсли, Джон (2001). Строительные блоки природы: Путеводитель по элементам от А до Я. Оксфорд, Англия, Великобритания: Издательство Оксфордского университета. ISBN 978-0-19-850340-8 .
- Маккей, Кеннет Малкольм; Маккей, Розмари Энн; Хендерсон, В. (2002). Введение в современную неорганическую химию (6-е изд.). ЦРК Пресс. ISBN 978-0-7487-6420-4 .
- Уикс, Мэри Эльвира ; Лечестер, Генри М. (1968). Открытие элементов . Истон, Пенсильвания: Журнал химического образования. LCCCN 68-15217.
Дальнейшее чтение
[ редактировать ]- Ньюман Л.С. (2003). «Бериллий». Новости химии и техники . 81 (36): 38. doi : 10.1021/cen-v081n036.p038 .
- Мроз М.М., Балкиссун Р. и Ньюман Л.С. «Бериллий». В: Бингэм Э., Корссен Б., Пауэлл С. (ред.) Токсикология Пэтти , пятое издание. Нью-Йорк: Джон Вили и сыновья, 2001, 177–220.
- Уолш, К.А., Химия и переработка бериллия . Видаль, Э.Э. и др. Ред. 2009, Парк материалов, Огайо: ASM International.
- Тестирование пролиферации бериллиевых лимфоцитов (BeLPT). Спецификация Министерства энергетики США 1142–2001. Вашингтон, округ Колумбия: Министерство энергетики США, 2001.
- 2007, Эрик Шерри, Таблица Менделеева: ее история и значение, Oxford University Press, Нью-Йорк, ISBN 978-0-19-530573-9
Внешние ссылки
[ редактировать ]- Тематические исследования ATSDR в экологической медицине: токсичность бериллия США Министерство здравоохранения и социальных служб
- Это элементарно – Бериллий
- Паспорт безопасности : ESPI Металлы
- Бериллий в Периодической таблице видео (Ноттингемский университет)
- Национальный институт охраны труда и здоровья - Бериллиевая страница
- Национальная дополнительная программа скрининга (ассоциированные университеты Ок-Риджа)
- Историческая цена бериллия в США

![{\displaystyle {\ce {[Be(H2O)4]^{2}+{}+{\mathit {n}}\,F^{-}<=>Be[(H2O)_{2\!- {\mathit {n}}}F_{\mathit {n}}]^{2\!-{\mathit {n}}}{}+{\mathit {n}}\,H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9b4cabb9c4f8dd2cd76b67ae2b7338b0df72eab6)
![{\displaystyle {\ce {H2A + [Be(H2O)4]^2+ <=> [BeA(H2O)2] + 2H+ + 2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7cfee182a6f6d66479ed4ea44f318b60bc531733)
![{\displaystyle {\ce {H2A + [BeA(H2O)2] <=> [BeA2]^2- + 2H+ + 2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4e584fca5d0eed9a46d5cdcb9b3540ff77d40af2)
![{\displaystyle {\ce {Na_4[Be_6(OCH_2(O)O)_6]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb11d9d4fdbfc6972b29c3f0da2932c7af31f59a)
