Энергия ионизации
Эта статья нуждается в дополнительных цитатах для проверки . ( сентябрь 2020 г. ) |

В физике и химии электрона энергия ионизации ( ИЕ ) — это минимальная энергия, необходимая для удаления наиболее слабо связанного изолированного газообразного атома , положительного иона или молекулы . [1] Первая энергия ионизации количественно выражается как
- X(г) + энергия ⟶ X + (г) + е −
где X — любой атом или молекула, X + - это образовавшийся ион, когда исходный атом был лишен одного электрона, а e − – оторванный электрон. [2] Энергия ионизации положительна для нейтральных атомов, а это означает, что ионизация является эндотермическим процессом . Грубо говоря, чем ближе крайние электроны к ядру атома , тем выше энергия ионизации атома.
В физике энергия ионизации обычно выражается в электронвольтах (эВ) или джоулях (Дж). В химии это выражается как энергия ионизации моля атомов или молекул, обычно в килоджоулях на моль (кДж/моль) или килокалориях на моль (ккал/моль). [3]
Сравнение энергий ионизации атомов в таблице Менделеева обнаруживает две периодические тенденции , которые следуют правилам кулоновского притяжения : [4]
- Энергия ионизации обычно увеличивается слева направо в течение заданного периода (то есть строки).
- Энергия ионизации обычно уменьшается сверху вниз в данной группе (то есть столбце).
Последняя тенденция возникает из-за того, что внешняя электронная оболочка становится все дальше от ядра, с добавлением одной внутренней оболочки в каждом ряду по мере движения вниз по столбцу.
n -я энергия ионизации относится к количеству энергии, необходимой для удаления наиболее слабо связанного электрона из частиц, имеющих положительный заряд ( n - 1). Например, первые три энергии ионизации определяются следующим образом:
- 1-я энергия ионизации — это энергия, обеспечивающая реакцию X ⟶ X + + и −
- 2-я энергия ионизации — это энергия, обеспечивающая реакцию X + ⟶ Х 2+ + и −
- Третья энергия ионизации — это энергия, обеспечивающая реакцию X 2+ ⟶ Х 3+ + и −
Наиболее заметные факторы, определяющие энергию ионизации, включают:
- Электронная конфигурация: это объясняет IE большинства элементов, поскольку все их химические и физические характеристики можно определить, просто определив их соответствующую электронную конфигурацию.
- Заряд ядра: если заряд ядра ( атомный номер ) больше, электроны крепче удерживаются ядром и, следовательно, энергия ионизации будет больше (что приводит к упомянутой тенденции 1 в течение заданного периода).
- Количество электронных оболочек : если размер атома больше из-за наличия большего количества оболочек, электроны менее прочно удерживаются ядром, и энергия ионизации будет меньше.
- Эффективный ядерный заряд ( Z eff ): если величина электронного экранирования и проникновения больше, электроны менее прочно удерживаются ядром, Z eff электрона и энергия ионизации меньше. [5]
- Стабильность: атом, имеющий более стабильную электронную конфигурацию, имеет меньшую тенденцию терять электроны и, следовательно, имеет более высокую энергию ионизации.
Незначительные влияния включают в себя:
- Релятивистские эффекты : они влияют на более тяжелые элементы (особенно те, атомный номер которых превышает 70), поскольку их электроны приближаются к скорости света. Поэтому они имеют меньшие атомные радиусы и более высокие энергии ионизации.
- Сокращение лантаноидов и актинидов (и сокращение скандидов ): сжатие элементов влияет на энергию ионизации, поскольку суммарный заряд ядра ощущается сильнее.
- Энергии электронных пар : полузаполненные подоболочки обычно приводят к более высоким энергиям ионизации.
Термин «потенциал ионизации» является более старым и устаревшим термином. [6] по энергии ионизации, [7] потому что самый старый метод измерения энергии ионизации был основан на ионизации образца и ускорении удаленного электрона с помощью электростатического потенциала .
Определение энергий ионизации [ править ]

Энергия ионизации атомов, обозначаемая E i , измеряется [8] найдя минимальную энергию квантов света ( фотонов ) или электронов, ускоренных до известной энергии, которая выбьет наименее связанные атомные электроны. Измерение проводится в газовой фазе на одиночных атомах. Хотя только благородные газы встречаются в виде одноатомных газов , другие газы могут быть разделены на отдельные атомы. [9] Кроме того, многие твердые элементы можно нагревать и испарять до отдельных атомов. Одноатомный пар содержится в предварительно откачанной трубке с двумя параллельными электродами, подключенными к источнику напряжения. Ионизирующее возбуждение вводится через стенки трубки или создается внутри.
При использовании ультрафиолетового света длина волны смещается в ультрафиолетовый диапазон. При определенной длине волны (λ) и частоте света (ν=c/λ, где c — скорость света) кванты света, энергия которых пропорциональна частоте, будут иметь достаточно высокую энергию, чтобы выбить наименее связанные электроны. . Эти электроны будут притягиваться к положительному электроду, а положительные ионы, оставшиеся после фотоионизации, притягиваться к отрицательно заряженному электроду. Эти электроны и ионы создадут ток через трубку. Энергией ионизации будет энергия фотонов hν i ( h — постоянная Планка ), вызвавших резкий рост тока: E i = hν i .
Когда для ионизации атомов используются высокоскоростные электроны, они создаются электронной пушкой внутри аналогичной вакуумной трубки. Энергией электронного пучка можно управлять с помощью ускоряющих напряжений. Энергия этих электронов, вызывающая резкое начало тока ионов и освободившихся электронов через трубку, будет соответствовать энергии ионизации атомов.
: ценности тенденции и Атомы
Как правило, ( N +1)-я энергия ионизации конкретного элемента больше, чем N -я энергия ионизации (можно также отметить, что энергия ионизации аниона обычно меньше, чем у катионов и нейтрального атома того же элемента). ). Когда следующая энергия ионизации включает удаление электрона из той же электронной оболочки, увеличение энергии ионизации происходит в первую очередь из-за увеличения чистого заряда иона, из которого удаляется электрон. Электроны, отделенные от более сильно заряженных ионов, испытывают большие силы электростатического притяжения; таким образом, их удаление требует больше энергии. Кроме того, когда следующая энергия ионизации включает удаление электрона из нижней электронной оболочки, сильно уменьшенное расстояние между ядром и электроном также увеличивает как электростатическую силу, так и расстояние, на котором эту силу необходимо преодолеть, чтобы удалить электрон. Оба эти фактора еще больше увеличивают энергию ионизации.
Некоторые значения элементов третьего периода приведены в следующей таблице:
| Элемент | Первый | Второй | Третий | Четвертый | Пятый | Шестой | Седьмой |
|---|---|---|---|---|---|---|---|
| Уже | 496 | 4,560 | |||||
| мг | 738 | 1,450 | 7,730 | ||||
| Ал | 577 | 1,816 | 2,881 | 11,600 | |||
| И | 786 | 1,577 | 3,228 | 4,354 | 16,100 | ||
| П | 1,060 | 1,890 | 2,905 | 4,950 | 6,270 | 21,200 | |
| С | 1,000 | 2,295 | 3,375 | 4,565 | 6,950 | 8,490 | 27,107 |
| кл. | 1,256 | 2,260 | 3,850 | 5,160 | 6,560 | 9,360 | 11,000 |
| С | 1,520 | 2,665 | 3,945 | 5,770 | 7,230 | 8,780 | 12,000 |
Большие скачки последовательных молярных энергий ионизации происходят при прохождении конфигураций благородного газа . Например, как видно из таблицы выше, первые две молярные энергии ионизации магния (отрыв двух 3s-электронов от атома магния) намного меньше, чем третья, что требует отрыва 2p-электрона от неоновой конфигурации. мг 2+ . Этот 2p-электрон находится гораздо ближе к ядру, чем удаленные ранее 3s-электроны.

Энергия ионизации также является периодической тенденцией в таблице Менделеева. Двигаясь слева направо в пределах периода или вверх внутри группы , первая энергия ионизации обычно увеличивается. [10] за исключением таких, как алюминий и сера, указанные в таблице выше. По мере увеличения ядерного заряда ядра по периоду увеличивается электростатическое притяжение между электронами и протонами, следовательно, атомный радиус уменьшается, и электронное облако приближается к ядру. [11] потому что электроны, особенно самый крайний, удерживаются крепче более высоким эффективным зарядом ядра.
При движении вниз внутри данной группы электроны удерживаются в оболочках с более высокой энергией и более высоким главным квантовым числом n, расположенным дальше от ядра и, следовательно, более слабо связанными, так что энергия ионизации уменьшается. Эффективный заряд ядра увеличивается очень медленно, так что его влияние перевешивается увеличением n. [12]
в ионизации Исключения энергиях
Возможно, этот раздел содержит оригинальные исследования . ( декабрь 2022 г. ) |
Есть исключения из общей тенденции роста энергии ионизации в течение определенного периода. Например, значение уменьшается от бериллия (
4 Будь
: 9,3 эВ) в бор (
5 Б
: 8,3 эВ) и из азота (
7 Н
: 14,5 эВ) до кислорода (
8 О
: 13,6 эВ). Эти провалы можно объяснить с точки зрения электронных конфигураций. [13]

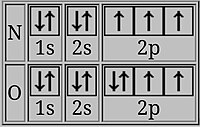
Последний электрон бора находится на 2p-орбитали, плотность электронов которой в среднем дальше от ядра, чем у 2s-электронов на той же оболочке. Затем 2s-электроны в некоторой степени экранируют 2p-электрон от ядра, и легче удалить 2p-электрон из бора, чем удалить 2s-электрон из бериллия, что приводит к более низкой энергии ионизации B. [2]
В кислороде последний электрон делит дважды занятую p-орбиталь с электроном противоположного спина . Два электрона на одной и той же орбитали в среднем находятся ближе друг к другу, чем два электрона на разных орбиталях, поэтому они более эффективно защищают друг друга от ядра , и один электрон легче удалить, что приводит к более низкой энергии ионизации. [2] [14]
Более того, после каждого элемента благородного газа энергия ионизации резко падает. Это происходит потому, что внешнему электрону в щелочных металлах требуется гораздо меньше энергии для удаления из атома, чем внутренним оболочкам. Это также приводит к низким значениям электроотрицательности щелочных металлов. [15] [16] [17]
Тенденции и исключения обобщены в следующих подразделах:
Энергия ионизации уменьшается, когда [ править ]
- Переход к новому периоду: щелочной металл легко теряет один электрон, оставляя конфигурацию октета или псевдоблагородного газа , поэтому эти элементы имеют лишь небольшие значения для IE.
- Переход от s-блока к p-блоку: p-орбиталь легче теряет электрон. Примером является переход от бериллия к бору с электронной конфигурацией 1s. 2 2 с 2 2р 1 . Электроны 2s защищают электрон 2p с более высокой энергией от ядра, что облегчает его удаление. Это также происходит при переходе от магния к алюминию . [19]
- Занятие p-подоболочки своим первым электроном со спином, противоположным остальным электронам: например, в азоте (
7 Н
: 14,5 эВ) до кислорода (
8 О
: 13,6 эВ), а также фосфор (
15 П
: 10,48 эВ) в серу (
16 С
: 10,36 эВ). Причина этого в том, что кислород, сера и селен имеют падающую энергию ионизации из-за эффектов экранирования. [20] Однако это прекращается, начиная с теллура , где экранирование слишком мало, чтобы вызвать провал. - Переход от d-блока к p-блоку: как и в случае с цинком (
30 Зн
: 9,4 эВ) в галлий (
31 млрд лет
: 6,0 эВ) - Особый случай: уменьшение от опережения (
82 Пб
: 7,42 эВ) в висмут (
83 Би
: 7,29 эВ). Это нельзя объяснить размером (разница минимальна: ковалентный радиус свинца составляет 146 пм , тогда как у висмута — 148 пм). [21] ). Это происходит из-за спин-орбитального расщепления оболочки 6p (свинец удаляет электрон со стабилизированного уровня 6p 1/2 , а висмут — с дестабилизированного уровня 6p 3/2 ). Прогнозируемые энергии ионизации показывают гораздо большее уменьшение от флеровия к московию , на одну строку дальше в периодической таблице, и с гораздо большими спин-орбитальными эффектами. - Особый случай: уменьшение радия (
88 Ра
: 5,27 эВ) в актиний (
89 Ак
: 5,17 эВ), что представляет собой переход с s-орбитали на ад-орбиталь. Однако аналогичный переход с бария (
56 Нет
: 5,2 эВ) в лантан (
57 Ла
: 5,6 эВ) не показывает изменения в сторону понижения. - Париж (
71 Лу
) и лоуренсий (
103 лр
) оба имеют энергию ионизации ниже, чем предыдущие элементы. В обоих случаях последний добавленный электрон начинает новую подоболочку : 5d для Lu с электронной конфигурацией [Xe] 4f. 14 5д 1 6 с 2 , и 7p для Lr с конфигурацией [Rn] 5f 4 7 с 2 7р 1 . Эти провалы в энергиях ионизации лютеция и особенно лоуренция показывают, что именно эти элементы принадлежат к d-блоку, а не лантану и актинию. [22]
Энергия ионизации увеличивается, когда [ править ]
- Достижение благородных газовых элементов группы 18: это происходит из-за их полных электронных подоболочек, [23] так что этим элементам требуется большое количество энергии для удаления одного электрона.
- Группа 12: Элементы здесь цинк (
30 Зн
: 9,4 эВ), кадмий (
48 компакт-дисков
: 9,0 эВ) и ртуть (
80 рт. ст.
: 10,4 эВ) все фиксируют внезапное повышение значений IE по сравнению с предыдущими элементами: медью (
29 меди
: 7,7 эВ), серебро (
47 Аг
: 7,6 эВ) и золото (
79 Ау
: 9,2 эВ) соответственно. Для ртути можно экстраполировать, что релятивистская стабилизация 6s-электронов увеличивает энергию ионизации в дополнение к плохой защите 4f-электронами, которая увеличивает эффективный заряд ядра на внешних валентных электронах. Кроме того, электронные конфигурации с закрытыми подоболочками: [Ar] 3d 10 4 с 2 , [Кр] 4д 10 5 с 2 и [Xe] 4f 14 5д 10 6 с 2 обеспечить повышенную стабильность. - Особый случай: переход от родия (
45 резус
: 7,5 эВ) в палладий (
46 ПД
: 8,3 эВ). В отличие от других элементов 10-й группы, палладий имеет более высокую энергию ионизации, чем предыдущий атом, из-за своей электронной конфигурации. В отличие от никелевого [Ar] 3d 8 4 с 2 и платиновый [Xe] 4f 14 5д 9 6 с 1 электронная конфигурация палладия: [Kr] 4d 10 5 с 0 (хотя правило Маделунга предсказывает [Kr] 4d 8 5 с 2 ). Наконец, ( более низкий IE серебра
47 Аг
: 7,6 эВ) еще больше подчеркивает высокую ценность палладия; единственный добавленный s-электрон удаляется с более низкой энергией ионизации, чем у палладия, [24] что подчеркивает высокий IE палладия (как показано в приведенной выше линейной таблице значений IE) - ИЭ гадолиния (
64 Гд
: 6,15 эВ) несколько выше, чем оба предыдущих (
62 см
: 5,64 эВ), (
63 евро
: 5,67 эВ) и следующие элементы (
65 Тб
: 5,86 эВ), (
66 Ди
: 5,94 эВ). Эта аномалия связана с тем, что валентная d-подоболочка гадолиния заимствует 1 электрон у валентной f-подоболочки. Теперь валентной подоболочкой является d-подоболочка, и из-за плохой экранировки положительного заряда ядра электронами f-подоболочки электрон валентной d-подоболочки испытывает большее притяжение к ядру, поэтому увеличивается энергия, необходимая для удалить (крайний) валентный электрон. - Переходим к элементам d-блока: элементы Sc с 3d 1 электронная конфигурация имеет более высокий IP (
21 СБН
: 6,56 эВ), чем предыдущий элемент (
20 Калифорния
: 6,11 эВ), в отличие от уменьшения при переходе к элементам s-блока и p-блока. 4s- и 3d-электроны обладают одинаковой экранирующей способностью: 3d-орбиталь образует часть оболочки n=3, среднее положение которой ближе к ядру, чем 4s-орбиталь и оболочка n=4, но электроны на s-орбиталях испытывают большее проникновение в ядро. ядром, чем электроны на d-орбиталях. Таким образом, взаимное экранирование 3d- и 4s-электронов слабое, а эффективный заряд ядра, действующий на ионизованный электрон, относительно велик. Иттрий (
3939 лет
) аналогично имеет более высокий IP (6,22 эВ), чем
38 лет
: 5,69 эВ. - Переходим к элементам f-блока; Элементы (
57 Ла
: 5,18 эВ) и (
89 Ак
: 5,17 эВ) имеют лишь немного более низкие значения IP, чем их предыдущие элементы (
56 Нет
: 5,21 эВ) и (
88 Ра
: 5,18 эВ), хотя их атомы являются аномалиями в том смысле, что они добавляют d-электрон, а не f-электрон. Как видно на приведенном выше графике энергий ионизации, резкий рост значений IE от (
55 Cs
: 3,89 эВ) до (
56 Нет
: 5,21 эВ) сопровождается небольшим увеличением (с некоторыми флуктуациями) по мере перехода f-блока от
56 Нет
к
70 лет
. Это происходит из-за лантаноидного сжатия (для лантаноидов). [25] [26] [27] Это уменьшение ионного радиуса связано с увеличением энергии ионизации, которая в свою очередь увеличивается, поскольку эти два свойства коррелируют друг с другом . [10] Что касается элементов d-блока, электроны добавляются во внутреннюю оболочку, поэтому новые оболочки не образуются. Форма добавленных орбиталей не позволяет им проникнуть в ядро, поэтому занимающие их электроны имеют меньшую экранирующую способность.
энергии ионизации в Аномалии группах
Значения энергии ионизации имеют тенденцию уменьшаться при переходе к более тяжелым элементам внутри группы. [13] поскольку экранирование обеспечивается большим количеством электронов и в целом валентные оболочки испытывают меньшее притяжение со стороны ядра, что объясняется большим ковалентным радиусом, который увеличивается при движении вниз по группе. [28] Тем не менее, это не всегда так. Как одно исключение, в группе 10 палладий (
46 ПД
: 8,34 эВ) имеет более высокую энергию ионизации, чем никель (
28 Ни
: 7,64 эВ), в отличие от общего снижения элементов из технеция.
43 Тк
к ксенону
54 транспортных средства
. Такие аномалии кратко описаны ниже:
- Группа 1:
- Энергия ионизации водорода очень высока (13,59844 эВ) по сравнению с щелочными металлами. Это связано с его единственным электроном (и, следовательно, очень маленьким электронным облаком ), который находится близко к ядру. Аналогичным образом, поскольку нет других электронов, которые могли бы вызвать экранирование, этот единственный электрон испытывает полный суммарный положительный заряд ядра. [29]
- Энергия ионизации франция выше, чем у предшествующего щелочного металла цезия . Это связано с малыми ионными радиусами его (и радия) из-за релятивистских эффектов. Из-за их большой массы и размера это означает, что его электроны движутся с чрезвычайно высокими скоростями, в результате чего электроны приближаются к ядру, чем ожидалось, и, следовательно, их труднее удалить (более высокий IE). [30]
- Группа 2: Энергия ионизации радия выше, чем у предшествующего ему щелочноземельного металла бария , такого как франций, что также обусловлено релятивистскими эффектами. Электроны, особенно 1s-электроны, испытывают очень высокие эффективные ядерные заряды . Чтобы избежать падения в ядро, 1s-электроны должны двигаться с очень высокими скоростями, из-за чего специальные релятивистские поправки существенно превышают приблизительные классические импульсы. По принципу неопределенности это вызывает релятивистское сжатие 1s-орбитали (и других орбиталей с электронной плотностью, близкой к ядру, особенно ns- и np-орбиталей). Следовательно, это вызывает каскад электронных изменений, который в конечном итоге приводит к сжатию внешних электронных оболочек и приближению к ядру.
- Группа 4:
- гафния Близкое сходство в ИЭ с цирконием . Последствия сокращения лантаноидов все еще можно ощутить после появления лантаноидов . [26] Его можно увидеть через меньший атомный радиус первого (что противоречит наблюдаемой периодической тенденции. Архивировано 11 октября 2018 г. на Wayback Machine ) в 159 часов вечера. [31] ( эмпирическое значение ), которое отличается от последнего в 155 ч. [32] [33] Это, в свою очередь, приводит к увеличению энергии ионизации на 18 кДж/моль. −1 .
- IE титана меньше, чем у гафния и циркония. Энергия ионизации гафния аналогична энергии ионизации циркония из-за сжатия лантаноидов. Однако остается неясным, почему энергия ионизации циркония выше, чем у предыдущих элементов; мы не можем приписать это атомному радиусу, поскольку у циркония и гафния он выше на 15 часов. [34] Мы также не можем ссылаться на конденсированную энергию ионизации, поскольку она более или менее одинакова ([Ar] 3d 2 4 с 2 для титана, тогда как [Kr] 4d 2 5 с 2 для циркония). Кроме того, не существует ни наполовину заполненных, ни полностью заполненных орбиталей, которые мы могли бы сравнивать. электронную конфигурацию циркония Следовательно, мы можем использовать только полную , которая равна 1s. 2 2 с 2 2р 6 3 с 2 3р 6 3d 10 4 с 2 4р 6 4д 2 5 с 2 . [35] Наличие полного подуровня 3d-блока равносильно более высокой эффективности экранирования по сравнению с элементами 4d-блока (которые состоят всего из двух электронов). [а]
- Группа 5: подобно группе 4, ниобий и тантал аналогичны друг другу из-за их электронной конфигурации и сокращения лантаноидов, влияющего на последний элемент. [36] Фактически, их значительное увеличение IE по сравнению с передовым элементом в группе, ванадием , можно объяснить наличием у них полных d-блоков электронов в дополнение к их электронной конфигурации. Еще одна интригующая идея — наполовину заполненная 5s-орбиталь ниобия; за счет отталкивания и обменной энергии (иными словами, «затрат» на помещение электрона на низкоэнергетический подуровень для его полного заполнения вместо помещения электрона на высокоэнергетический) преодоление энергетической щели между s- и d- (или f) блокируют электроны, ЕС не следует правилу Маделунга.
- Группа 6: как и ее предшественники группы 4 и 5, группа 6 также фиксирует высокие значения при движении вниз. Вольфрам снова похож на молибден из-за своей электронной конфигурации. [37] Точно так же его также приписывают полной 3d-орбитали в ее электронной конфигурации. Другая причина - наполовину заполненная 4d-орбиталь молибдена из-за энергии электронных пар, нарушающей принцип ауфбау.
- Группы 7–12 элементов 6-го периода ( рений , осмий , иридий , платина , золото и ртуть ): все эти элементы имеют чрезвычайно высокие энергии ионизации по сравнению с элементами, предшествующими им в соответствующих группах. Суть этого связана с влиянием лантанидного сжатия на постлантаниды, помимо релятивистской стабилизации 6s-орбитали.
- Группа 13:
- IE галлия выше, чем у алюминия. Это опять же связано с тем, что d-орбитали в дополнение к скандидному сжатию обеспечивают слабую защиту, и, следовательно, эффективные ядерные заряды увеличиваются.
- ИЭ таллия из-за плохой защиты 4f-электронов. [5] Помимо сжатия лантаноидов, это приводит к увеличению его IE по сравнению с его предшественником индием .
- Группа 14: ( Необычно высокая энергия ионизации свинца
82 Пб
: 7,42 эВ), подобно таллию группы 13, является результатом полных подоболочек 5d и 4f. Сокращение лантаноидов и неэффективное экранирование ядра 4f-электронами приводят к несколько большей энергии ионизации свинца, чем олова (
50 секунд
: 7,34 эВ). [38] [5]
водорода Модель Бора для атома
Энергия ионизации атома водорода ( ) можно оценить в модели Бора , [39] который предсказывает, что уровень атомной энергии имеет энергию
R H — константа Ридберга для атома водорода. Для водорода в основном состоянии и так что энергия атома до ионизации просто
После ионизации энергия равна нулю для неподвижного электрона, бесконечно удаленного от протона, так что энергия ионизации равна
- . Это согласуется с экспериментальным значением для атома водорода.
- механическое объяснение Квантово
Этот раздел нуждается в расширении : добавление дополнительных формул расчета энергий ионизации. Вы можете помочь, добавив к нему . ( сентябрь 2020 г. ) |
Согласно более полной теории квантовой механики , расположение электрона лучше всего описывается как распределение вероятностей внутри электронного облака , т.е. атомной орбитали . [40] [41] Энергию можно вычислить путем интегрирования по этому облаку. Базовым математическим представлением облака является волновая функция , построенная на основе определителей Слейтера, состоящих из молекулярных спиновых орбиталей. [42] Они связаны принципом исключения Паули с антисимметризованными продуктами атомных или молекулярных орбиталей .
Существует два основных способа расчета энергии ионизации. В общем, расчет N- й энергии ионизации требует расчета энергий и электронные системы. Точно вычислить эти энергии невозможно, за исключением простейших систем (т.е. водорода и водородоподобных элементов), прежде всего из-за трудностей интегрирования членов электронной корреляции . [43] Поэтому регулярно используются методы аппроксимации, причем разные методы различаются по сложности (времени расчета) и точности по сравнению с эмпирическими данными. Эта проблема стала хорошо изученной и регулярно решается в вычислительной химии . Второй способ расчета энергий ионизации в основном используется на самом низком уровне приближения, где энергия ионизации определяется теоремой Купманса , которая включает высшую занятую молекулярную орбиталь или « ВЗМО » и самую низкую незанятую молекулярную орбиталь или « НСМО ». и утверждает, что энергия ионизации атома или молекулы равна отрицательному значению энергии орбитали, с которой вылетает электрон. [44] Это означает, что энергия ионизации равна отрицательной энергии ВЗМО, которую в формальном уравнении можно записать как: [45]
: энергия вертикальной и ионизации адиабатической Молекулы

Ионизация молекул часто приводит к изменению геометрии молекул , при этом определяются два типа (первой) энергии ионизации — адиабатическая и вертикальная . [46]
Адиабатическая энергия ионизации [ править ]
Адиабатическая нейтральной частицы (уровень v" = энергия ионизации молекулы — это минимальное количество энергии, необходимое для отрыва электрона от нейтральной молекулы, т. е. разница между энергией основного колебательного состояния 0) и энергии положительного ион (v' = 0). Конкретная равновесная геометрия каждого вида не влияет на это значение.
Энергия вертикальной ионизации [ править ]
Из-за возможных изменений в геометрии молекулы, которые могут возникнуть в результате ионизации, могут существовать дополнительные переходы между основным колебательным состоянием нейтрального вещества и колебательно- возбужденными состояниями положительного иона. Другими словами, ионизация сопровождается колебательным возбуждением . Интенсивность таких переходов объясняется принципом Франка-Кондона , который предсказывает, что наиболее вероятный и интенсивный переход соответствует колебательно-возбужденному состоянию положительного иона, имеющему ту же геометрию, что и нейтральная молекула. Этот переход называется «вертикальной» энергией ионизации, поскольку на диаграмме потенциальной энергии он представлен полностью вертикальной линией (см. Рисунок).
Для двухатомной молекулы геометрия определяется длиной одинарной связи . Удаление электрона со связывающей молекулярной орбитали ослабляет связь и увеличивает ее длину. На рисунке 1 нижняя кривая потенциальной энергии предназначена для нейтральной молекулы, а верхняя поверхность — для положительного иона. Обе кривые отображают потенциальную энергию как функцию длины связи. Горизонтальные линии соответствуют колебательным уровням и связанным с ними колебательным волновым функциям . Поскольку ион имеет более слабую связь, он будет иметь большую длину связи. Этот эффект представлен сдвигом минимума кривой потенциальной энергии вправо от нейтрального вещества. Адиабатическая ионизация — это диагональный переход в основное колебательное состояние иона. Вертикальная ионизация может включать колебательное возбуждение ионного состояния и, следовательно, требует большей энергии.
Во многих случаях энергия адиабатической ионизации часто является более интересной физической величиной, поскольку она описывает разницу в энергии между двумя поверхностями потенциальной энергии. Однако из-за экспериментальных ограничений энергию адиабатической ионизации часто трудно определить, тогда как энергию вертикального отрыва легко определить и измерить.
Аналоги энергии ионизации другим системам [ править ]
Хотя термин «энергия ионизации» в основном используется только для атомных, катионных или молекулярных частиц в газовой фазе, существует ряд аналогичных величин, которые учитывают количество энергии, необходимое для удаления электрона из других физических систем.
Энергия связи электрона [ править ]
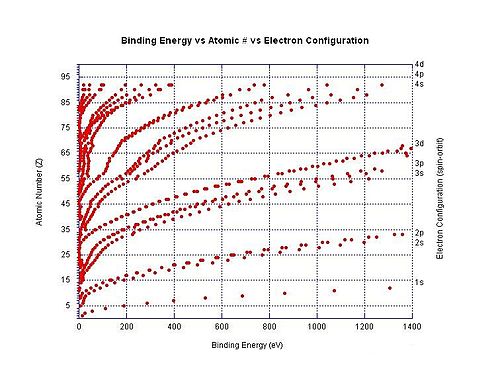
электрона Энергия связи — это общий термин, обозначающий минимальную энергию, необходимую для удаления электрона из определенной электронной оболочки атома или иона, поскольку эти отрицательно заряженные электроны удерживаются на месте электростатическим притяжением положительно заряженного ядра. [47] Например, энергия связи электрона для отрыва электрона 3p 3/2 от иона хлорида представляет собой минимальное количество энергии, необходимое для отрыва электрона от атома хлора, когда он имеет заряд -1. В этом конкретном примере энергия связи электрона имеет ту же величину, что и сродство к электрону нейтрального атома хлора. В другом примере энергия связи электрона относится к минимальному количеству энергии, необходимой для удаления электрона из дикарбоксилат-дианиона. − О 2 С(СН 2 ) 8 СО −
2 .
На графике справа показана энергия связи электронов в разных оболочках нейтральных атомов. Энергия ионизации — это самая низкая энергия связи для конкретного атома (хотя не все они показаны на графике).
Твердые поверхности: рабочая функция [ править ]
Работа выхода - это минимальное количество энергии, необходимое для удаления электрона с твердой поверхности, где работа выхода W для данной поверхности определяется разностью [48]
где − e — заряд электрона , φ — электростатический потенциал в вакууме вблизи поверхности, а EF — уровень Ферми ( электрохимический потенциал электронов) внутри материала.
Примечание [ править ]
- ^ Тем не менее, необходимы дальнейшие исследования, чтобы подтвердить этот простой вывод.
См. также [ править ]
- Уравнение Ридберга — расчет, позволяющий определить энергии ионизации водорода и водородоподобных элементов. Это более подробно описано на этом сайте.
- Сродство к электрону — тесно связанная концепция, описывающая энергию, высвобождаемую при присоединении электрона к нейтральному атому или молекуле.
- Энергия решетки — мера энергии, выделяющейся при объединении ионов в соединение.
- Электроотрицательность — это число, имеющее некоторое сходство с энергией ионизации.
- Теорема Купманса относительно предсказанных энергий ионизации в Хартри – Фока . теории
- Дивольфрам тетра(hpp) имеет самую низкую зарегистрированную энергию ионизации среди стабильных химических соединений .
- Энергия диссоциации связи , мера прочности химической связи, рассчитанная путем расщепления путем гомолиза с образованием двух радикальных фрагментов A и B и последующей оценки изменения энтальпии.
- Энергия связи — средняя мера прочности химической связи, рассчитываемая через количество тепла, необходимое для разрыва всех химических связей на отдельные атомы.
Ссылки [ править ]
- ^ «Периодические тенденции» . Химия LibreTexts . 02.10.2013 . Проверено 13 сентября 2020 г.
- ↑ Перейти обратно: Перейти обратно: а б с Мисслер, Гэри Л.; Тарр, Дональд А. (1999). Неорганическая химия (2-е изд.). Прентис Холл. п. 41. ИСБН 0-13-841891-8 .
- ^ «Энергия ионизации» . Химвики . Калифорнийский университет в Дэвисе. 2013-10-02.
- ^ «Глава 9: Квантовая механика» . факультет.chem.queesu.ca . 15 января 2018 года. Архивировано из оригинала 24 июля 2020 года . Проверено 31 октября 2020 г.
- ↑ Перейти обратно: Перейти обратно: а б с д Ланг, Питер Ф.; Смит, Барри К. (август 2003 г.). «Энергия ионизации атомов и атомарных ионов». Журнал химического образования . 80 (8): 938. Бибкод : 2003ЖЧЭд..80..938Л . дои : 10.1021/ed080p938 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Потенциал ионизации ». дои : 10.1351/goldbook.I03208
- ^ Коттон, Ф. Альберт ; Уилкинсон, Джеффри (1988). Продвинутая неорганическая химия (5-е изд.). Джон Уайли. п. 1381. ИСБН 0-471-84997-9 .
- ^ Махан, Брюс Х. (1962). «Энергия ионизации» . Химический колледж Калифорнийского университета в Беркли . Проверено 13 сентября 2020 г.
- ^ «Одноатомный газ — обзор | Темы ScienceDirect» . www.sciencedirect.com . Проверено 8 января 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б Стоун, Е.Г. (19 декабря 2020 г.). «Атомная структура: периодические тенденции» . Кафедра химии. chem.tamu.edu . 400 Bizzell St, Колледж-Стейшн, Техас 77843, Техас, США: Техасский университет A&M. Архивировано из оригинала 11 октября 2018 года . Проверено 19 декабря 2020 г.
{{cite web}}: CS1 maint: местоположение ( ссылка ) - ^ «Аномальные тенденции в энергии ионизации» . Обмен стеками химии . Проверено 20 сентября 2020 г.
- ^ Петруччи, Ральф Х.; Харвуд, Уильям С.; Херринг, Ф. Джеффри (2002). Общая химия (8-е изд.). Прентис Холл. п. 370. ИСБН 0-13-014329-4 .
- ↑ Перейти обратно: Перейти обратно: а б Грандинетти, Филип Дж. (8 сентября 2019 г.). «Тенденции в области ионизационной энергетики | Grandinetti Group» . www.grandinetti.org . Проверено 13 сентября 2020 г.
- ^ Кент, г-н «Первая энергия ионизации» . kentchemistry.com . Кент Химия . Проверено 6 декабря 2020 г.
...Присоединение второго электрона к уже занятой орбитали вызывает отталкивание между электронами, поэтому его легче удалить. поэтому наблюдается провал энергии ионизации.
- ^ «Группа ИА» . chemed.chem.purdue.edu . Проверено 20 сентября 2020 г.
- ^ «Щелочные металлы» . гиперфизика.phy-astr.gsu.edu . Проверено 13 сентября 2020 г.
- ^ «Щелочные металлы | Введение в химию» . Courses.lumenlearning.com . Проверено 13 сентября 2020 г.
- ^ «Химические элементы, перечисленные по энергии ионизации» . lenntech.com . Леннтек Б.В. 2018 . Проверено 6 декабря 2020 г.
Элементы таблицы Менделеева, отсортированные по энергии ионизации, щелкните имя любого элемента, чтобы получить дополнительную информацию о химических свойствах, данных об окружающей среде или влиянии на здоровье. Этот список содержит 118 химических элементов.
- ^ Будро, штат Калифорния (13 августа 2020 г.) [26 июля 2006 г.]. «Части таблицы Менделеева» . Кафедра химии и биохимии. angelo.edu/faculty/kboudrea/ . 2601 W. Avenue N, Сан-Анджело, Техас 76909, Техас: Государственный университет Анджело . Получено 19 декабря 2020 г. - через angelo.edu.
{{cite web}}: CS1 maint: местоположение ( ссылка ) - ^ «18.10: Элементы группы 6А» . Химия LibreTexts . 02 июля 2014 г. Проверено 20 сентября 2020 г.
- ^ «Ковалентный радиус всех элементов таблицы Менделеева» . periodtable.com . Проверено 13 сентября 2020 г.
- ^ Дженсен, ВБ (2015). «Некоторые комментарии о положении Лоуренсия в периодической таблице» (PDF) . Архивировано из оригинала (PDF) 23 декабря 2015 года . Проверено 20 сентября 2015 г.
- ^ Сингх, Джасвиндер (1999). «Инертные газы» . Стерлинговый физический словарь . Стерлинг Паблишерс Пвт. ООО с. 122. ИСБН 978-81-7359-124-2 .
- ^ «Ванадий, ниобий и тантал». Химия элементов . 1997. стр. 976–1001. дои : 10.1016/B978-0-7506-3365-9.50028-6 . ISBN 978-0-7506-3365-9 .
- ^ Хаускрофт, CE; Шарп, AG (1 ноября 1993 г.). Неорганическая химия (электронная книга). Том. 3 (15-е изд.). Швейцария: Пирсон Прентис-Холл. стр. 536, 649, 743. doi : 10.1021/ed070pA304.1 . ISBN 978-0-273-74275-3 . Архивировано из оригинала 14 апреля 2021 года . Проверено 14 декабря 2020 г.
{{cite book}}: CS1 maint: bot: исходный статус URL неизвестен ( ссылка ) - ↑ Перейти обратно: Перейти обратно: а б Коттон, Ф. Альберт ; Уилкинсон, Джеффри (1988), Передовая неорганическая химия (5-е изд.), Нью-Йорк: Wiley-Interscience, стр. 776, 955, ISBN. 0-471-84997-9
- ^ Билло, Э.Дж. (1985). «Современная неорганическая химия (Джолли, Уильям Л.)» . Журнал химического образования . 62 (4): А137. Бибкод : 1985JChEd..62..137B . дои : 10.1021/ed062pA137.1 .
- ^ «Закономерности и тенденции в таблице Менделеева — Периодичность — Высшее химическое издание» . BBC Bitesize . Проверено 20 сентября 2020 г.
- ^ «Энергии ионизации» . Химия LibreTexts . 03.10.2013 . Проверено 20 сентября 2020 г.
- ^ «Элементы IYPT 2019 087: Франций: не самый реактивный элемент группы 1» . Сложные проценты . 06.11.2019 . Проверено 20 сентября 2020 г.
- ^ «Гафний» . gordonengland.co.uk . Гордон Англия. 2020 . Проверено 7 декабря 2020 г.
...Атомный радиус 159 пм...
- ^ «Цирконий (Элемент) – Атомный радиус» . pubchem.ncbi.nlm.nih.gov . ПабХим . Проверено 8 декабря 2020 г.
155 вечера (Эмпирический)
- ^ Слейтер, Дж. К. (15 ноября 1964 г.). «Атомные радиусы в кристаллах». Журнал химической физики . 41 (10): 3199–3204. Бибкод : 1964ЖЧФ..41.3199С . дои : 10.1063/1.1725697 .
- ^ «Таблица Менделеева WebElements » Титан » радиусы атомов и ионов» . www.webelements.com . Проверено 20 сентября 2020 г.
- ^ Страка, Дж. «Периодическая таблица элементов: цирконий - электронная конфигурация» . www.tabulka.cz . Проверено 20 сентября 2020 г.
- ^ «Тантал | химический элемент» . Британская энциклопедия . Проверено 20 сентября 2020 г.
- ^ Лангард, Сверре (2015). «Хром, молибден и вольфрам». Токсикология Пэтти . дои : 10.1002/0471435139.tox038 . ISBN 978-0-471-12547-1 .
- ^ «Элементы группы 14» . Химический Нексус . 2015-12-02 . Проверено 13 сентября 2020 г.
- ^ Бор, Н. (июль 1913 г.). «I. О строении атомов и молекул» . Лондонский, Эдинбургский и Дублинский философский журнал и научный журнал . 26 (151): 1–25. дои : 10.1080/14786441308634955 .
- ^ «Орбитали, электронные облака, вероятности и энергии» . chem.libretexts.org . Химическая вики Калифорнийского университета в Дэвисе. 23 мая 2019 года . Проверено 2 ноября 2020 г.
- ^ «Квантовые числа и орбитали. Квантово-механическая модель атома» . Ханская академия . Проверено 2 ноября 2020 г.
- ^ Левин 1991 , с. 315: «В приближении Хартри-Фока волновая функция атома (или молекулы) представляет собой определитель Слейтера или линейную комбинацию нескольких определителей Слейтера»
- ^ Левин 1991 , стр. 290–291.
- ^ Левин 1991 , с. 475.
- ^ «Справочная информация по энергии ионизации» . shodor.org . Образовательный фонд Шодор, Inc., 2000 г. Проверено 15 ноября 2020 г.
... Второй метод называется «Теория Купмана». Этот метод включает в себя HOMO.
- ^ «Разница между энергией вертикальной ионизации и энергией адиабатической ионизации» . База данных компьютерных химических сравнений и эталонных тестов . Национальный институт стандартов и технологий .
- ^ Мерфи, Эндрю; Вонг, Моника (2019). «Энергия связи электрона» . Radiopaedia.org . Радиопедия . Проверено 7 декабря 2020 г.
Энергия связи электрона – это минимальная энергия, необходимая для отрыва электрона от атома.
- ^ Киттель, Чарльз (1 января 1996 г.) [1953]. «6». В Зайнабе, Р.; Ду, Д.; Таннер, БК; Чемберс, Р.Г. (ред.). Введение в физику твердого тела . Том. 7. Нью-Йорк, США: John Wiley & Sons, Inc. (опубликовано в 1995 г.). стр. 18–19. Бибкод : 1969Natur.224..983C . дои : 10.1063/1.3061720 . ISBN 978-0-471-11181-8 . ЛЦН 95-018445 . OCLC 263625446 . S2CID 121571376 . Архивировано из оригинала 28 сентября 2021 года . Проверено 18 декабря 2020 г.
{{cite book}}:|journal=игнорируется ( справка ) CS1 maint: bot: исходный статус URL неизвестен ( ссылка ) [ нужна страница ]
Источники [ править ]
- Левин, Ира Н. (1991). Квантовая химия . Прентис Холл. ISBN 978-0-205-12770-2 .