Периодические тенденции
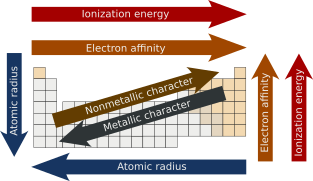
В химии сгруппированных периодические тенденции представляют собой определенные закономерности, которые присутствуют в периодической таблице и иллюстрируют различные аспекты определенных элементов, по периодам и/или группам . Они были открыты русским химиком Дмитрием Менделеевым в 1863 году. Основные периодические тенденции включают атомный радиус , энергию ионизации , сродство к электрону , электроотрицательность , валентность и металлический характер . Эти тенденции существуют из-за схожих электронных конфигураций элементов внутри соответствующих групп или периодов; они отражают периодическую природу элементов. Эти тенденции дают качественную оценку свойств каждого элемента. [1] [2]
Краткое изложение тенденций [ править ]
| Периодическое свойство | За период | Вниз по группе |
|---|---|---|
| Атомный радиус | Уменьшается | Увеличивает |
| Энергия ионизации | Увеличивает | Уменьшается |
| Сродство к электрону | ||
| Электроотрицательность | ||
| Валентность | Постоянный | |
| Неметаллический характер | Уменьшается | |
| Металлический персонаж | Уменьшается | Увеличивает |
| Ядерный заряд | Увеличивает |
Атомный радиус [ править ]
Атомный радиус — это расстояние от атомного ядра до крайней электронной орбитали в атоме . В общем, атомный радиус уменьшается по мере движения слева направо в периоде и увеличивается , когда мы спускаемся по группе . Это происходит потому, что в периоды валентные электроны находятся в одной и той же внешней оболочке . Атомный номер увеличивается за тот же период при движении слева направо, что, в свою очередь, увеличивает эффективный заряд ядра . Увеличение сил притяжения уменьшает атомный радиус элементов . Когда мы двигаемся вниз по группе, радиус атома увеличивается за счет добавления новой оболочки. [3] [4]
Энергия ионизации [ править ]
Энергия ионизации — это минимальное количество энергии , которое должен поглотить электрон в газообразном атоме или ионе , чтобы выйти из-под влияния притягивающей силы ядра . Его еще называют потенциалом ионизации. Первая энергия ионизации — это количество энергии, необходимое для отрыва первого электрона от нейтрального атома . Энергия, необходимая для отрыва второго электрона от нейтрального атома, называется второй энергией ионизации и так далее. [5]
В тренде, при движении слева направо по периоду современной таблицы Менделеева , энергия ионизации увеличивается по мере увеличения заряда ядра и уменьшения размера атома . Уменьшение размера атома приводит к более мощной силе притяжения между электронами и ядром. Однако предположим, что кто-то движется вниз в группе . В этом случае энергия ионизации уменьшается по мере увеличения размера атома из-за добавления валентной оболочки , тем самым уменьшая притяжение ядра к электронам. [6] [7]
Сродство к электрону [ править ]
Энергия , выделяющаяся при электрона присоединении к нейтральному газообразному атому с образованием аниона, называется сродством к электрону. [8] В соответствии с тенденцией, по мере продвижения слева направо в течение периода , сродство к электрону будет увеличиваться по мере увеличения заряда ядра и уменьшения размера атома, что приводит к более мощной силе притяжения ядра и добавленного электрона. Однако предположим, что кто-то движется вниз в группе . В этом случае сродство к электрону будет уменьшаться по мере увеличения размера атома из-за добавления валентной оболочки , тем самым уменьшая притяжение ядра к электронам. Хотя может показаться, что фтор должен иметь наибольшее сродство к электрону, его небольшой размер вызывает достаточное отталкивание между электронами, в результате чего хлор имеет самое высокое сродство к электрону в семействе галогенов . [9]
Электроотрицательность [ править ]
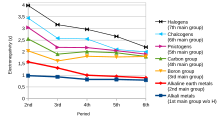
Склонность атома в молекуле притягивать к себе общую пару электронов называется электроотрицательностью. Это безразмерное свойство , поскольку это всего лишь тенденция. [10] Наиболее часто используемая шкала для измерения электроотрицательности была разработана Лайнусом Полингом . шкала была названа шкалой Полинга В его честь . Согласно этой шкале, фтор является наиболее электроотрицательным элементом, а цезий — наименее электроотрицательным элементом . [11]
В тренде, при движении слева направо по периоду в современной таблице Менделеева , электроотрицательность увеличивается по мере увеличения заряда ядра и уменьшения размера атома . Однако, если кто-то движется вниз в группе , электроотрицательность уменьшается по мере увеличения размера атома из-за добавления валентной оболочки , тем самым уменьшая притяжение атома к электронам. [12]
Однако в группе XIII ( семейство боров ) электроотрицательность сначала уменьшается от бора к алюминию , а затем увеличивается по группе. Это связано с тем, что размер атома увеличивается по мере продвижения вниз по группе, но в то же время эффективный заряд ядра увеличивается из-за плохой экранировки внутренних d- и f-электронов. В результате сила притяжения ядра для электронов увеличивается и, следовательно, электроотрицательность увеличивается от алюминия к таллию . [13] [14]
Валентность [ править ]
Валентность элемента — это количество электронов должен потерять или приобрести, , которое атом чтобы получить стабильную электронную конфигурацию . Проще говоря, это мера комбинационной способности элемента образовывать химические соединения . Электроны, находящиеся во внешней оболочке , обычно известны как валентные электроны ; количество валентных электронов определяет валентность атома. [15] [16]
По тренду при движении слева направо по периоду число валентных электронов элементов увеличивается и колеблется от одного до восьми. Но валентность элементов сначала возрастает от 1 до 4, а затем снижается до 0 по мере достижения благородных газов . Однако по мере продвижения вниз по группе число валентных электронов обычно не меняется. Следовательно, во многих случаях элементы определенной группы имеют одинаковую валентность . Однако эта периодическая тенденция не всегда соблюдается для более тяжелых элементов, особенно для f-блока и переходных металлов . Эти элементы обладают переменной валентностью , поскольку у этих элементов есть d-орбиталь в качестве предпоследней орбитали и s-орбиталь в качестве самой внешней орбитали. Энергии этих (n-1)d и ns-орбиталей (например, 4d и 5s) относительно близки. [17] [18]
Металлические и неметаллические свойства [ править ]
Металлические свойства обычно увеличиваются по группам , поскольку уменьшение притяжения между ядрами и внешними электронами приводит к тому, что эти электроны становятся более слабо связанными и, таким образом, способны проводить тепло и электричество . В течение каждого периода , слева направо, возрастающее притяжение между ядрами и внешними электронами приводит к уменьшению металлического характера . Напротив, неметаллический характер уменьшается по группам и увеличивается по периодам. [19] [20]
См. также [ править ]
Ссылки [ править ]
- ^ Периодическая таблица I. Структура и связь. Том. 181. 2019. doi : 10.1007/978-3-030-40025-5 . ISBN 978-3-030-40024-8 . S2CID 211038510 .
- ^ Шробильген, Гэри Дж. (2019), Мингос, Д. Майкл П. (ред.), «Химия на краю таблицы Менделеева: важность периодических тенденций для открытия благородных газов и разработки благородных газов». Химия» , Периодическая таблица I: историческое развитие и основные характеристики , структура и связь, Cham: Springer International Publishing, стр. 157–196, doi : 10.1007/430_2019_49 , ISBN 978-3-030-40025-5 , S2CID 213379908 , получено 2 июля 2022 г.
- ^ «атомный и ионный радиус» . www.chemguide.co.uk . Проверено 30 июня 2022 г.
- ^ Хаггинс, Морис Л. (1 апреля 1922 г.). «Атомные радиусы. I» . Физический обзор . 19 (4): 346–353. дои : 10.1103/PhysRev.19.346 .
- ^ «7.4: Энергия ионизации» . Химия LibreTexts . 18 ноября 2014 г. Проверено 2 июля 2022 г.
- ^ «Тенденция в области энергии ионизации | Тенденции науки» . sciencetrends.com . 18 мая 2018 г. Проверено 2 июля 2022 г.
- ^ Заде, Дариуш Х. (26 июля 2019 г.). «Атомные оболочки по энергиям ионизации» . Журнал молекулярного моделирования . 25 (8): 251. doi : 10.1007/s00894-019-4112-6 . ISSN 0948-5023 . ПМИД 31346734 . S2CID 198913558 .
- ^ Гуч, Ян В., изд. (2007), «Сродство к электрону» , Энциклопедический словарь полимеров , Нью-Йорк, Нью-Йорк: Springer, стр. 350, номер домена : 10.1007/978-0-387-30160-0_4245 , ISBN 978-0-387-30160-0 , получено 2 июля 2022 г.
- ^ «Тенденция сродства к электрону | Тенденции науки» . sciencetrends.com . 14 мая 2018 г. Проверено 2 июля 2022 г.
- ^ Химия (ИЮПАК), Международный союз теоретической и прикладной химии. «ИЮПАК – электроотрицательность (Е01990)» . goldbook.iupac.org . дои : 10.1351/goldbook.e01990 . Проверено 30 июня 2022 г.
- ^ Бикмор, Барри Р.; Уандер, Мэтью К.Ф. (2018), «Электронегативность» , в Уайте, Уильям М. (редактор), Энциклопедия геохимии: всеобъемлющий справочный источник по химии Земли , Cham: Springer International Publishing, стр. 442–444, дои : 10.1007/978-3-319-39312-4_222 , ISBN 978-3-319-39312-4 , получено 30 июня 2022 г.
- ^ Маллай, Джон (1987), Сен, Кали Дас; Йоргенсен, К.К. (ред.), «Оценка атомной и групповой электроотрицательности» , «Электроотрицательность » , «Структура и связь», том. 66, Берлин/Гейдельберг: Springer-Verlag, стр. 1–25, doi : 10.1007/bfb0029834 , ISBN. 978-3-540-17740-1 , получено 30 июня 2022 г.
- ^ «21.1: Элементы группы 13» . Либретексты . 26 ноября 2013 г. Проверено 30 июня 2022 г.
- ^ Франц, Дэниел; Иноуэ, Сигэёси (2016). «Достижения в разработке комплексов, содержащих халькогенную кратную связь 13-элементной группы» . Транзакции Далтона . 45 (23): 9385–9397. дои : 10.1039/C6DT01413E . ISSN 1477-9226 . ПМИД 27216700 .
- ^ Манучер-Данаи, Мохсен, изд. (2009), «валентность» , Словарь драгоценных камней и геммологии , Берлин, Гейдельберг: Springer, с. 899, номер домена : 10.1007/978-3-540-72816-0_22746 , ISBN 978-3-540-72816-0 , получено 2 июля 2022 г.
- ^ Вор, Ганс-Вернер, изд. (2016), «Валенци» , Энциклопедия иммунотоксикологии , Берлин, Гейдельберг: Springer, с. 947, номер домена : 10.1007/978-3-642-54596-2_201542 , ISBN 978-3-642-54596-2 , получено 2 июля 2022 г.
- ^ Валентность . Гейдельбергская научная библиотека. 1978. doi : 10.1007/978-1-4612-6262-6 . ISBN 978-0-387-90268-5 .
- ^ О'Дуайер, МФ; Кент, Дж. Э.; Браун, РД (1978), О'Дуайер, МФ; Кент, Дж. Э.; Браун, Р.Д. (ред.), «Многоэлектронные атомы» , Валенси , Нью-Йорк, Нью-Йорк: Springer, стр. 59–86, doi : 10.1007/978-1-4612-6262-6_4 , ISBN 978-1-4612-6262-6 , получено 2 июля 2022 г.
- ^ Доу, Мюррей С.; Фойлс, Стивен М.; Баскес, Майкл И. (1 марта 1993 г.). «Метод встроенного атома: обзор теории и приложений» . Отчеты по материаловедению . 9 (7): 251–310. дои : 10.1016/0920-2307(93)90001-У . ISSN 0920-2307 .
- ^ «C9.1 – Периодические тенденции» . ПОМОЩЬ IGCSE . 05.03.2018 . Проверено 2 июля 2022 г.