Фаза (материя)
| Часть серии о |
| Химия |
|---|
 |
|
В физических науках фаза — это область материала, которая химически однородна, физически различима и (часто) механически разделима. В системе, состоящей из льда и воды в стеклянной банке, кубики льда являются одной фазой, вода — второй фазой, а влажный воздух — третьей фазой над льдом и водой. Стекло банки – это еще один отдельный этап. (См. состояние вещества § Стекло .)
Точнее, фаза — это область пространства ( термодинамическая система ), в которой все физические свойства материала по существу однородны. [1] [2] : 86 [3] : 3 Примеры физических свойств включают плотность , показатель преломления , намагниченность и химический состав.
Термин « фаза» иногда используется как синоним состояния вещества , но может существовать несколько несмешивающихся фаз одного и того же состояния вещества (например, когда нефть и вода разделяются на отдельные фазы, причем обе находятся в жидком состоянии). Его также иногда используют для обозначения состояний равновесия, показанных на фазовой диаграмме , описанных в терминах переменных состояния, таких как давление и температура, и разграниченных фазовыми границами . (Фазовые границы относятся к изменениям в организации материи, включая, например, тонкие изменения в твердом состоянии от одной кристаллической структуры к другой, а также к изменениям состояний, например, между твердым и жидким.) Эти два использования несоизмеримы с формальное определение, данное выше, и предполагаемое значение должны частично определяться контекстом, в котором используется этот термин.

Типы фаз [ править ]
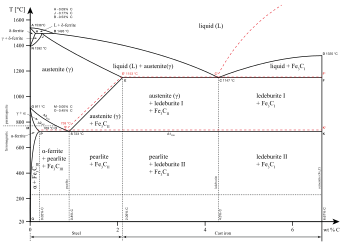
Различные фазы могут быть описаны как различные состояния вещества, такие как газ , жидкость , твердое тело , плазма или конденсат Бозе-Эйнштейна . Полезные мезофазы между твердым и жидким образуют другие состояния вещества.
Различные фазы могут также существовать внутри данного состояния материи. Как показано на диаграмме для сплавов железа, существует несколько фаз как в твердом, так и в жидком состоянии. Фазы также можно различать по растворимости : полярные (гидрофильные) или неполярные (гидрофобные). Смесь воды (полярная жидкость) и масла (неполярная жидкость) самопроизвольно разделится на две фазы. Вода имеет очень низкую растворимость (нерастворима) в масле, а масло имеет низкую растворимость в воде. Растворимость – это максимальное количество растворенного вещества, которое может раствориться в растворителе до того, как растворенное вещество перестанет растворяться и останется в отдельной фазе. Смесь может разделиться на более чем две жидкие фазы, и концепция разделения фаз распространяется и на твердые вещества, т. е. твердые вещества могут образовывать твердые растворы или кристаллизоваться в отдельные кристаллические фазы. Взаиморастворимые пары металлов могут образовывать сплавы , тогда как взаимно нерастворимые пары металлов не могут образовывать сплавы.
до восьми несмешивающихся жидких фаз . Было обнаружено [а] Взаимно несмешивающиеся жидкие фазы образуются из воды (водная фаза), гидрофобных органических растворителей, перфторуглеродов ( фтористая фаза ), силиконов, ряда различных металлов, а также из расплавленного фосфора. Не все органические растворители полностью смешиваются, например, смесь этиленгликоля и толуола может разделиться на две отдельные органические фазы. [б]
Фазы не требуют макроскопического самопроизвольного разделения. Эмульсии и коллоиды являются примерами несмешивающихся комбинаций фазовых пар, которые физически не разделяются.
Фазовое равновесие [ править ]
При достижении равновесия многие композиции образуют однородную однофазную фазу, но в зависимости от температуры и давления даже одно вещество может разделиться на две или более отдельные фазы. Внутри каждой фазы свойства одинаковы, но между двумя фазами свойства различаются.
Вода в закрытой банке с воздушным пространством над ней образует двухфазную систему. Большая часть воды находится в жидкой фазе, где она удерживается за счет взаимного притяжения молекул воды. Даже в состоянии равновесия молекулы постоянно находятся в движении, и время от времени молекула в жидкой фазе набирает достаточно кинетической энергии, чтобы оторваться от жидкой фазы и перейти в газовую фазу. Аналогично, время от времени молекула пара сталкивается с поверхностью жидкости и конденсируется в жидкость. В равновесии процессы испарения и конденсации точно уравновешиваются, и нет чистого изменения объема любой фазы.
При комнатной температуре и давлении сосуд с водой достигает равновесия, когда влажность воздуха над водой составляет около 3%. Этот процент увеличивается с повышением температуры. При 100 °C и атмосферном давлении равновесие не достигается до тех пор, пока воздух не будет на 100% состоять из воды. Если жидкость нагреть чуть выше 100 °С, переход из жидкости в газ произойдет не только на поверхности, но и во всем объеме жидкости: вода закипит.
Количество фаз [ править ]
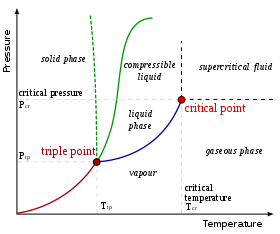
Для данного состава возможны только определенные фазы при данной температуре и давлении. Количество и тип образующихся фаз трудно предсказать, и обычно они определяются экспериментальным путем. Результаты таких экспериментов можно отобразить в виде фазовых диаграмм .
Показанная здесь фазовая диаграмма предназначена для однокомпонентной системы. В этой простой системе возможные фазы зависят только от давления и температуры . Маркировка показывает точки, где две или более фазы могут сосуществовать в равновесии. При температурах и давлениях, далеких от маркировки, в равновесии будет только одна фаза.
На схеме синяя линия, обозначающая границу между жидкостью и газом, не продолжается бесконечно, а заканчивается в точке, называемой критической точкой . По мере того как температура и давление приближаются к критической точке, свойства жидкости и газа становятся все более схожими. В критической точке жидкость и газ становятся неразличимы. Выше критической точки больше нет отдельных жидких и газовых фаз: есть только общая жидкая фаза, называемая сверхкритической жидкостью . В воде критическая точка возникает при температуре около 647 К (374 °C или 705 °F) и 22,064 МПа .
Необычной особенностью диаграммы состояния воды является то, что фазовая линия твердого тела и жидкости (показана пунктирной зеленой линией) имеет отрицательный наклон. Для большинства веществ наклон положителен, о чем свидетельствует темно-зеленая линия. Эта необычная особенность воды связана с тем, что лед имеет меньшую плотность, чем жидкая вода. Увеличение давления переводит воду в фазу с более высокой плотностью, что вызывает таяние.
Другой интересной, хотя и не необычной особенностью фазовой диаграммы является точка, где линия фазы твердое тело-жидкость пересекается с линией фазы жидкость-газ. Пересечение называется тройной точкой . В тройной точке все три фазы могут сосуществовать.
Экспериментально фазовые линии относительно легко нанести на карту из-за взаимозависимости температуры и давления, которая возникает при образовании нескольких фаз. Правило фаз Гиббса предполагает, что различные фазы полностью определяются этими переменными. Рассмотрим испытательный аппарат, состоящий из закрытого и хорошо изолированного цилиндра, снабженного поршнем. Контролируя температуру и давление, систему можно привести в любую точку фазовой диаграммы. Из точки в области стабильности твердого тела (левая часть диаграммы) повышение температуры системы приведет ее в область, где жидкость или газ являются равновесной фазой (в зависимости от давления). Если поршень медленно опустить, система проследит кривую увеличения температуры и давления в газовой области фазовой диаграммы. В момент, когда газ начинает конденсироваться в жидкость, направление кривой температуры и давления резко изменится и будет следовать вдоль фазовой линии, пока вся вода не сконденсируется.
Межфазные явления [ править ]
Между двумя фазами, находящимися в равновесии, существует узкая область, свойства которой не совпадают со свойствами ни одной из фаз. Хотя эта область может быть очень тонкой, она может иметь значительные и легко наблюдаемые эффекты, например, вызывать у жидкости поверхностное натяжение . В смесях некоторые компоненты могут преимущественно перемещаться к границе раздела фаз . С точки зрения моделирования, описания или понимания поведения конкретной системы может оказаться эффективным рассматривать межфазную область как отдельную фазу.
Кристаллические фазы [ править ]
Один и тот же материал может иметь несколько различных твердых состояний, способных образовывать отдельные фазы. Вода является хорошо известным примером такого материала. Например, водяной лед обычно имеет шестиугольную форму льда I h , но может также существовать в виде кубического льда I c , ромбоэдрического льда II и многих других форм. Полиморфизм – это способность твердого тела существовать более чем в одной кристаллической форме. Для чистых химических элементов полиморфизм известен как аллотропия . Например, алмаз , графит и фуллерены — это разные аллотропы углерода .
Фазовые переходы [ править ]
Когда вещество претерпевает фазовый переход (переход из одного состояния вещества в другое), оно обычно либо поглощает, либо выделяет энергию. Например, когда вода испаряется, увеличение кинетической энергии по мере того, как испаряющиеся молекулы покидают силы притяжения жидкости, отражается на понижении температуры. Энергия, необходимая для осуществления фазового перехода, берется из внутренней тепловой энергии воды, которая охлаждает жидкость до более низкой температуры; следовательно, испарение полезно для охлаждения. См. Энтальпия испарения . Обратный процесс – конденсация – приводит к выделению тепла. Тепловая энергия, или энтальпия, связанная с переходом из твердого состояния в жидкость, представляет собой энтальпию плавления , а энергия, связанная с переходом из твердого состояния в газ, — это энтальпия сублимации .
из равновесия выхода Фазы
В то время как фазы материи традиционно определяются для систем, находящихся в тепловом равновесии, работа над квантовыми локализованными системами многих тел (MBL) обеспечила основу для определения фаз, находящихся вне равновесия. Фазы MBL никогда не достигают теплового равновесия и могут допускать новые формы порядка, запрещенные в равновесии благодаря явлению, известному как квантовый порядок, защищенный локализацией. Переходы между различными фазами MBL, а также между MBL и термализующимися фазами представляют собой новые динамические фазовые переходы, свойства которых являются активной областью исследований.
Примечания [ править ]
- ^ Одна из таких систем, сверху: минеральное масло , силиконовое масло , вода , анилин , перфтор(диметилциклогексан) , белый фосфор , галлий и ртуть . Система остается неопределенно разделенной при 45 ° C , когда галлий и фосфор находятся в расплавленном состоянии. От Райхардт, К. (2006). Растворители и эффекты растворителей в органической химии . Вайли-ВЧ . стр. 9–10. ISBN 978-3-527-60567-5 .
- ^ Это явление можно использовать для переработки катализатора при винилировании Хека . Видеть Бханаге, БМ; и др. (1998). «Сравнение активности и селективности различных комплексных катализаторов металл-ТППТС в реакциях этиленгликоль-толуолового двухфазного винилирования Хека иодбензола». Буквы тетраэдра . 39 (51): 9509–9512. дои : 10.1016/S0040-4039(98)02225-4 .
Ссылки [ править ]
- ^ Моделл, Майкл; Роберт С. Рид (1974). Термодинамика и ее приложения . Энглвуд Клиффс, Нью-Джерси: Прентис-Холл. ISBN 978-0-13-914861-3 .
- ^ Энрико Ферми (2012). Термодинамика . Курьерская компания. ISBN 978-0-486-13485-7 .
- ^ Клемент Джон Адкинс (1983). Равновесная термодинамика . Издательство Кембриджского университета. ISBN 978-0-521-27456-2 .
Внешние ссылки [ править ]
- Французские физики нашли раствор, обратимо затвердевающий при повышении температуры — α- циклодекстрин , вода и 4-метилпиридин
